














Preview text:
LOGO HÓA LÝ I
TS. Nguyễn Thị Tuyết Mai
Bộ môn Hóa lý, Viện Kỹ thuật Hóa học
Trường Đại học Bách Khoa Hà Nội
Email: mai.nguyenthituyet1@hust.edu.vn 1
Chương 3. SỰ CHUYỂN PHA TRONG HÓA LÝ I
HỆ 1 CHẤT NGUYÊN CHẤT
1. Sự chuyển pha loại một
2. Ảnh hưởng của áp suất đến nhiệt độ chuyển pha
Phương trình Clausius Clapeyron I
3. Ảnh hưởng của nhiệt độ đến áp suất hơi bão hòa
Phương trình Clausius Clapeyron II
4. Giản đồ pha hệ một chất nguyên chất
TS. Nguyễn Thị Tuyết Mai 2 Hóa Lý, ĐHBKHN
Câu hỏi thảo luận
1. Tại sao khi nấu ăn trên núi thức ăn lâu chín hơn so với khi
nấu ở vùng đồng bằng ?
2. Tại sao nấu trong nồi áp suất thì đồ ăn nhanh chín hơn ?
3. Làm cách nào để sấy khô vật chất (đường, muối, thức ăn,
trái cây, tinh dầu…) mà không làm nóng chảy/phân hủy chúng ? 3
1. Sự chuyển pha loại 1 HÓA LÝ I
CHƯƠNG 4. CB PHA HỆ 1 CHẤT NGUYÊN CHẤT V CP Chuyển pha loại 1
(thường gặp: nóng chảy,
kết tinh, ngưng tụ, bay hơi) Chuyển pha loại 2
(KL thông thường →chất
siêu dẫn ở nhiệt độ thấp
Fe thuận từ → Fe nghịch từ) Nhiệt độ
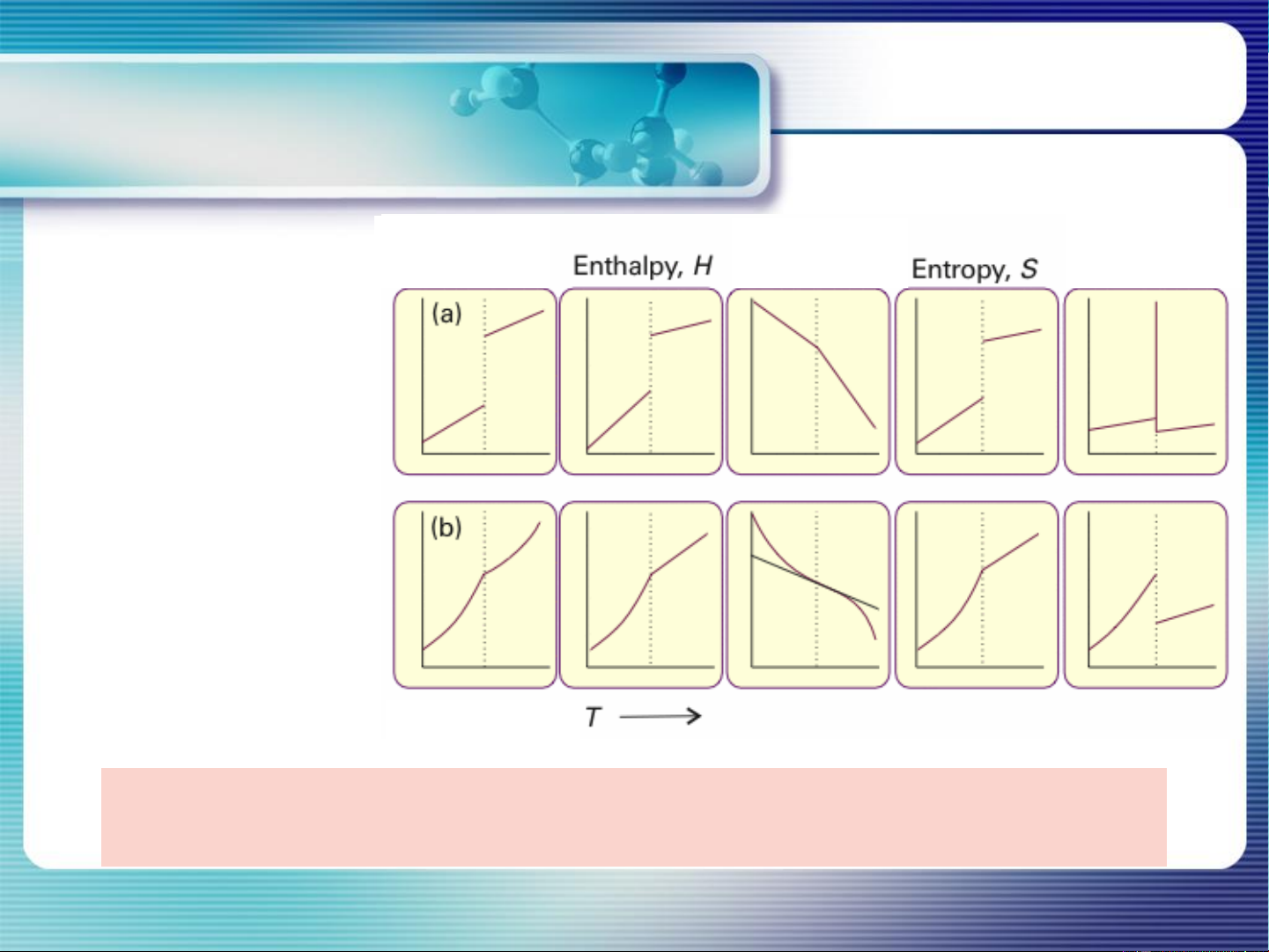
Chuyển pha loại 1: thay đổi nhảy vọt các thông số nhiệt động
TS. Nguyễn Thị Tuyết Mai 4 Hóa Lý, ĐHBKHN
1. Sự chuyển pha loại 1 HÓA LÝ I
CHƯƠNG 4. CB PHA HỆ 1 CHẤT NGUYÊN CHẤT Hệ 1 chất nguyên chất:
• Khí/lỏng: 1 pha (trừ He lỏng)
• Rắn: có thể có nhiều pha (số pha = số dạng thù hình)
• Sự chuyển pha: chuyển đổi giữa các trạng thái tập hợp
thay đổi đột ngột những tính chất của hệ (khối lượng riêng,
nhiệt dung, thể tích, hiệu ứng nhiệt…)
• Cân bằng pha trong hệ 1 chất nguyên chất: cân bằng giữa
các trạng thái tập hợp của chất đó 5
TS. Nguyễn Thị Tuyết Mai Hóa Lý, ĐHBKHN
1. Sự chuyển pha loại 1 HÓA LÝ I
CHƯƠNG 4. CB PHA HỆ 1 CHẤT NGUYÊN CHẤT
Áp dụng quy tắc pha Gibbs: Bậc tự do C = k - f + 2 C = 3 - f C 0 f 3
số pha lớn nhất có thể cùng tồn tại ở trạng thái cân bằng: 3 6
TS. Nguyễn Thị Tuyết Mai Hóa Lý, ĐHBKHN
1. Sự chuyển pha loại 1 HÓA LÝ I
CHƯƠNG 4. CB PHA HỆ 1 CHẤT NGUYÊN CHẤT C = 3 - f f = 1 C = 2
Hệ 1 pha, P và T có thể thay đổi tùy ý (trong một giới hạn xác định) mà hệ
vẫn tồn tại ở dạng 1 pha. f = 2 C = 1
Hệ 2 pha, nhất biến, khi 1 thông số thay đổi thì thông số còn lại phải thay đổi theo: T = f(P) hoặc P = f(T) f = 3 C = 0
Chỉ tồn tại cân bằng của 3 pha trong 1 điều kiện bên ngoài hoàn toàn xác định (P và T =const)
TS. Nguyễn Thị Tuyết Mai 7 Hóa Lý, ĐHBKHN
2. Ảnh hưởng của áp suất tới HÓA LÝ I
nhiệt độ chuyển pha
CHƯƠNG 4. CB PHA HỆ 1 CHẤT NGUYÊN CHẤT
A () ↔ A () f = 2 c = 1 T = f(P)
Điều kiện cân bằng pha ở T=const và P=const: =
Chất nguyên chất: = G G = G
Khi có thay đổi P → P + dP thì T → T + dT
Hệ thiết lập CB mới: G + dG = G + dG
Mà G = G dG = dG
TS. Nguyễn Thị Tuyết Mai 8 Hóa Lý, ĐHBKHN
2. Ảnh hưởng của áp suất tới HÓA LÝ I
nhiệt độ chuyển pha
CHƯƠNG 4. CB PHA HỆ 1 CHẤT NGUYÊN CHẤT Phương trình T (K); V (L/mol);
Clausius – Clapeyron I (atm.L/mol)
TS. Nguyễn Thị Tuyết Mai 9 Hóa Lý, ĐHBKHN
2. Ảnh hưởng của áp suất tới HÓA LÝ I
nhiệt độ chuyển pha
CHƯƠNG 4. CB PHA HỆ 1 CHẤT NGUYÊN CHẤT
Quá trình sôi (hóa hơi): dT V=(V 0 h – Vl)>0; hh>0
P tăng Ts tăng dP
Quá trình nóng chảy: dT V=(V 0 l - Vr)>0; nc>0
P tăng Tnc tăng dP
Riêng trường hợp nước: V= (V dT
l - Vr)<0; nc>0
0 P tăng Tnc giảm dP T (K); V (L/mol); (atm.L/mol)
TS. Nguyễn Thị Tuyết Mai 10 Hóa Lý, ĐHBKHN
2. Ảnh hưởng của áp suất tới HÓA LÝ I
nhiệt độ chuyển pha
CHƯƠNG 4. CB PHA HỆ 1 CHẤT NGUYÊN CHẤT Ví dụ: d (phenol,l) = 1,056 g/ml d (phenol,r) = 1,072 g/ml nc (phenol) = 104,35 J/g Tnc,1atm = 41 oC
Tính nhiệt độ nóng chảy của phenol ở 500 atm. (1 J = 0,00987 atm.L) Đs: Tnc,500atm = 43 oC
TS. Nguyễn Thị Tuyết Mai 11 Hóa Lý, ĐHBKHN
3. Ảnh hưởng của nhiệt độ tới HÓA LÝ I
áp suất hơi bão hòa
CHƯƠNG 4. CB PHA HỆ 1 CHẤT NGUYÊN CHẤT
▪Áp suất hơi bão hòa ?
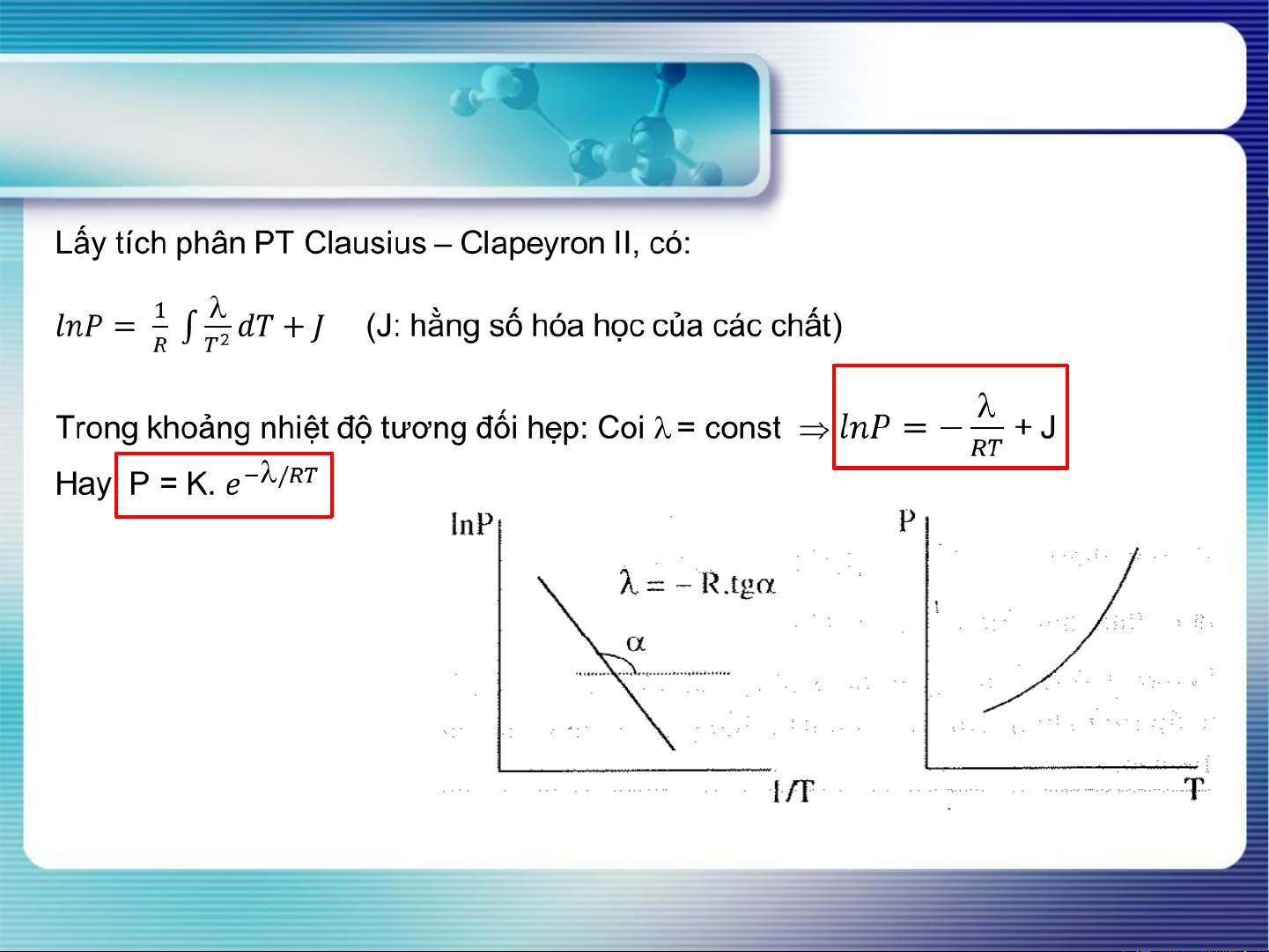
Phương trình Clausius – Clapeyron II
(mô tả ảnh hưởng của nhiệt độ đến ASHBH)
TS. Nguyễn Thị Tuyết Mai 12 Hóa Lý, ĐHBKHN
3. Ảnh hưởng của nhiệt độ tới HÓA LÝ I
áp suất hơi bão hòa
CHƯƠNG 4. CB PHA HỆ 1 CHẤT NGUYÊN CHẤT
Ví dụ: bài thí nghiệm “Áp suất hơi bão hòa”
TS. Nguyễn Thị Tuyết Mai 13 Hóa Lý, ĐHBKHN
3. Ảnh hưởng của nhiệt độ tới HÓA LÝ I
áp suất hơi bão hòa
CHƯƠNG 4. CB PHA HỆ 1 CHẤT NGUYÊN CHẤT
Tính toán gần đúng các thông số nhiệt động (P, Ts, …) VD: Tính T của s
nước ở 2 atm biết nhiệt hóa hơi là 538,1 cal/g ĐS: Ts,2atm = 120,9 oC
TS. Nguyễn Thị Tuyết Mai 14 Hóa Lý, ĐHBKHN PHYSICAL CHEMISTRY I
3. Ảnh hưởng của nhiệt độ tới
PHASE EQUILIBRIUM OF PURE SUBSTANCES
áp suất hơi bão hòa Bài tập:
Axeton có áp suất hơi bão hòa ở các nhiệt độ 306 K
và 320 K lần lượt là 346 mmHg và 556 mmHg. Hãy
xác định nhiệt hóa hơi và nhiệt độ sôi của axeton.
(Coi nhiệt hóa hơi là hằng số).
ĐS : Ts = 326 K = 56 oC
TS. Nguyễn Thị Tuyết Mai 15 Hóa Lý, ĐHBKHN
4. Giản đồ pha hệ 1 chất nguyên chất HÓA LÝ I
CHƯƠNG 4. CB PHA HỆ 1 CHẤT NGUYÊN CHẤT
Giản đồ pha bao gồm: - Các điểm - Các đường - Các mặt - Các vùng
TS. Nguyễn Thị Tuyết Mai 16 Hóa Lý, ĐHBKHN
4. Giản đồ pha hệ 1 chất nguyên chất HÓA LÝ I
CHƯƠNG 4. CB PHA HỆ 1 CHẤT NGUYÊN CHẤT
Điểm sôi – nhiệt độ sôi:
Chất lỏng được làm nóng trong 1 bình hở, khi áp suất hơi trên bề mặt
chất lỏng = áp suất ngoài → hiện tượng sôi
Nhiệt độ tại đó gọi là nhiệt độ sôi (Ts)
Pbh = Pngoài = 1 atm → nhiệt độ sôi thông thường
Pbh = Pngoài = 1 bar → nhiệt độ sôi tiêu chuẩn 1 bar = 0,987 atm
→ Ts thông thường > Ts tiêu chuẩn
VD: Ts thông thường của nước: 100 oC
Ts tiêu chuẩn của nước: 99,6 oC
TS. Nguyễn Thị Tuyết Mai 17 Hóa Lý, ĐHBKHN HÓA LÝ I
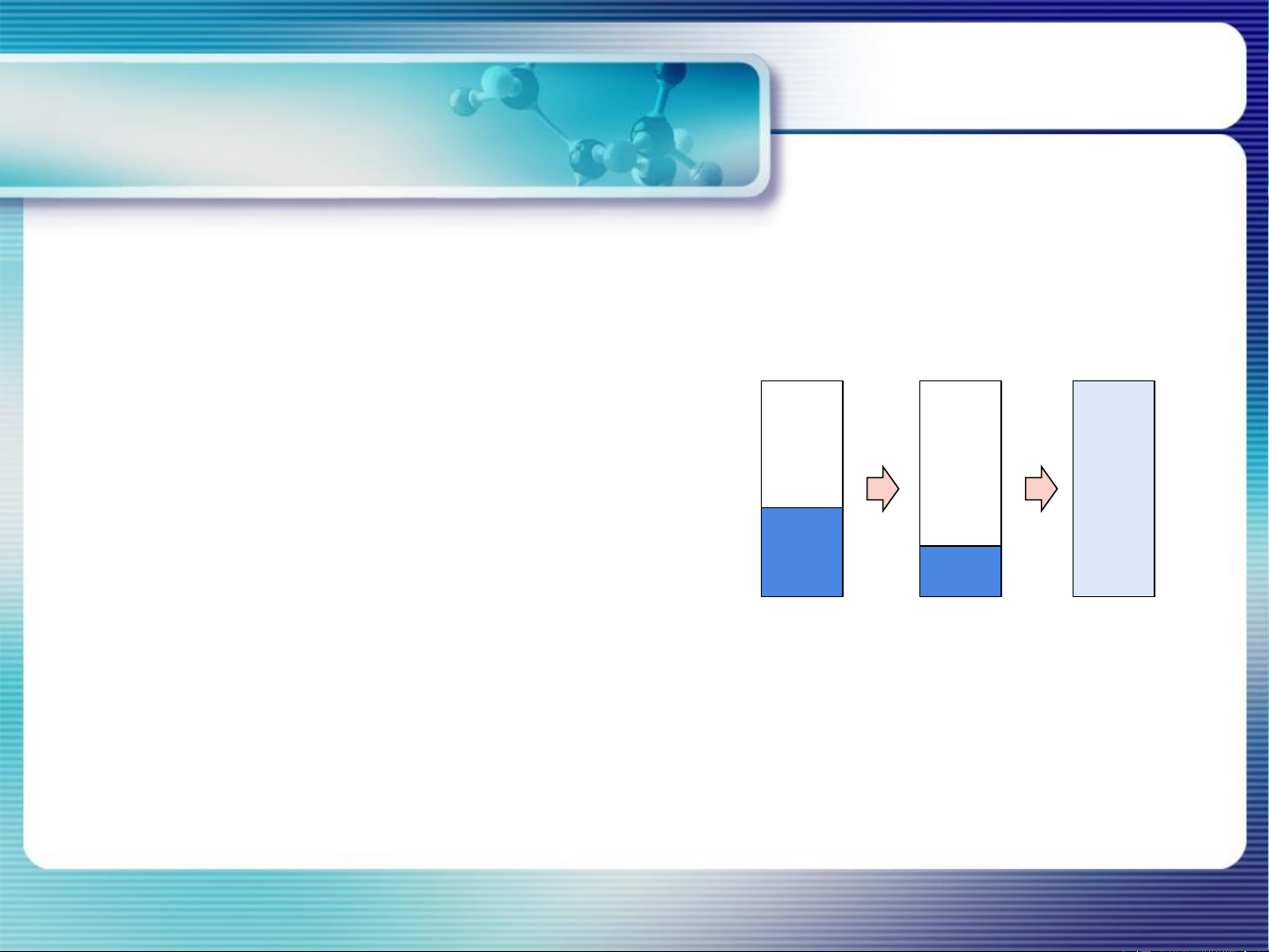
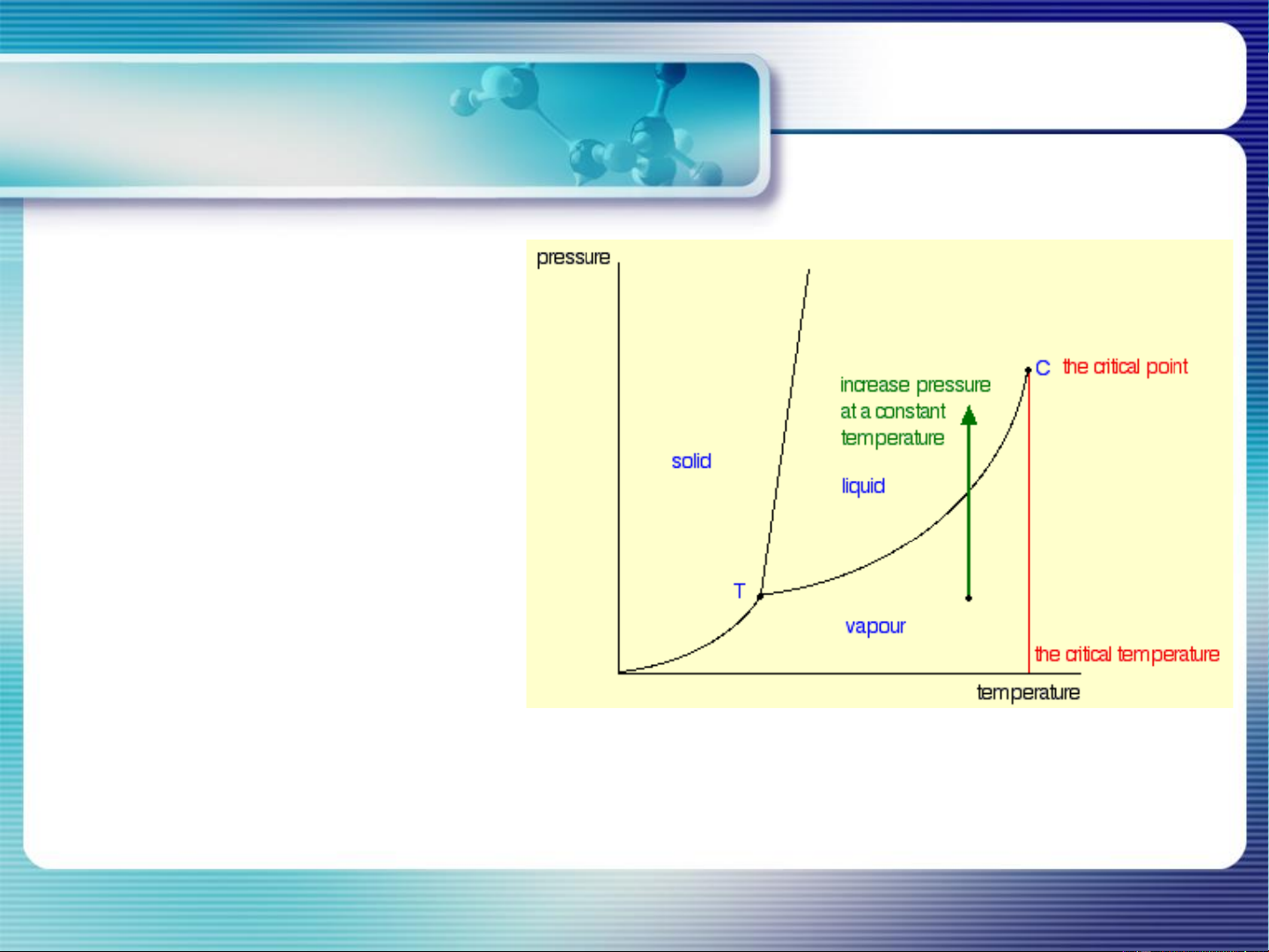
4. Giản đồ pha hệ 1 chất nguyên chất CHƯƠNG 4. CB PHA HỆ 1 CHẤT NGUYÊN CHẤT Điểm tới hạn:
Khi mật độ pha hơi = mật độ pha lỏng → Bề mặt phân cách pha biến mất → Điểm tới hạn
→ Nhiệt độ tới hạn (Tc)
→ Áp suất tới hạn (Tc)
Từ điểm tới hạn trở lên: chỉ còn 1 pha tồn tại gọi là pha lỏng siêu tới hạn
(điền đầy bình chứa, không có bề mặt phân cách)
https://www.youtube.com/watch?v=GEr3NxsPTOA
TS. Nguyễn Thị Tuyết Mai 18 Hóa Lý, ĐHBKHN
4. Giản đồ pha hệ 1 chất nguyên chất HÓA LÝ I
CHƯƠNG 4. CB PHA HỆ 1 CHẤT NGUYÊN CHẤT Điểm tới hạn: ▪ Ở T < Tc: tăng P
→ pha H ngưng tụ thành pha L ▪ Ở T Tc: tăng P
→ thu được chất lỏng siêu tới hạn
TS. Nguyễn Thị Tuyết Mai 19 Hóa Lý, ĐHBKHN HÓA LÝ I
4. Giản đồ pha hệ 1 chất nguyên chất CHƯƠNG 4. CB PHA HỆ 1 CHẤT NGUYÊN CHẤT Điểm nóng chảy:
Ở P xác định, 2 pha L và R cùng tồn tại, nằm cân bằng với nhau
→ Nhiệt độ nóng chảy (Tnc) = Nhiệt độ kết tinh (Tkt)
TS. Nguyễn Thị Tuyết Mai 20 Hóa Lý, ĐHBKHN




