













Preview text:
LOGO CH3050 - HÓA LÝ I
TS. Nguyễn Thị Tuyết Mai
Bộ môn Hóa lý, Viện Kỹ thuật Hóa học
Trường Đại học Bách Khoa Hà Nội
Email: mai.nguyenthituyet1@hust.edu.vn 1
Chương 4. DUNG DỊCH VÀ CH3041
CÂN BẰNG LỎNG - HƠI HÓA LÝ I
1. Đại cương về dung dịch
2. Tính chất nồng độ của dung dịch loãng
3. Sự hòa tan của chất khí trong chất lỏng
4. Sự hòa tan của lỏng trong lỏng và cân bằng dung dịch - hơi 2
1. ĐẠI CƯƠNG VỀ DUNG DỊCH HÓA LÝ I
CHƯƠNG 4. DUNG DỊCH PHÂN TỬ
Dung dịch (phân tử):
hệ đồng thể gồm ít nhất hai chất ở trạng thái phân tán phân tử mà
thành phần của chúng có thể thay đổi trong một giới hạn xác định.
Dung môi: chất có thành phần lớn nhất
Chất tan: chất có thành phần nhỏ hơn
1 cấu tử lỏng + 1 cấu tử rắn/khí → dm là cấu tử lỏng Số pha = 1
Tại trạng thái CB, thành phần và tính chất hóa lý ở mọi điểm trong
dung dịch là đồng nhất 3
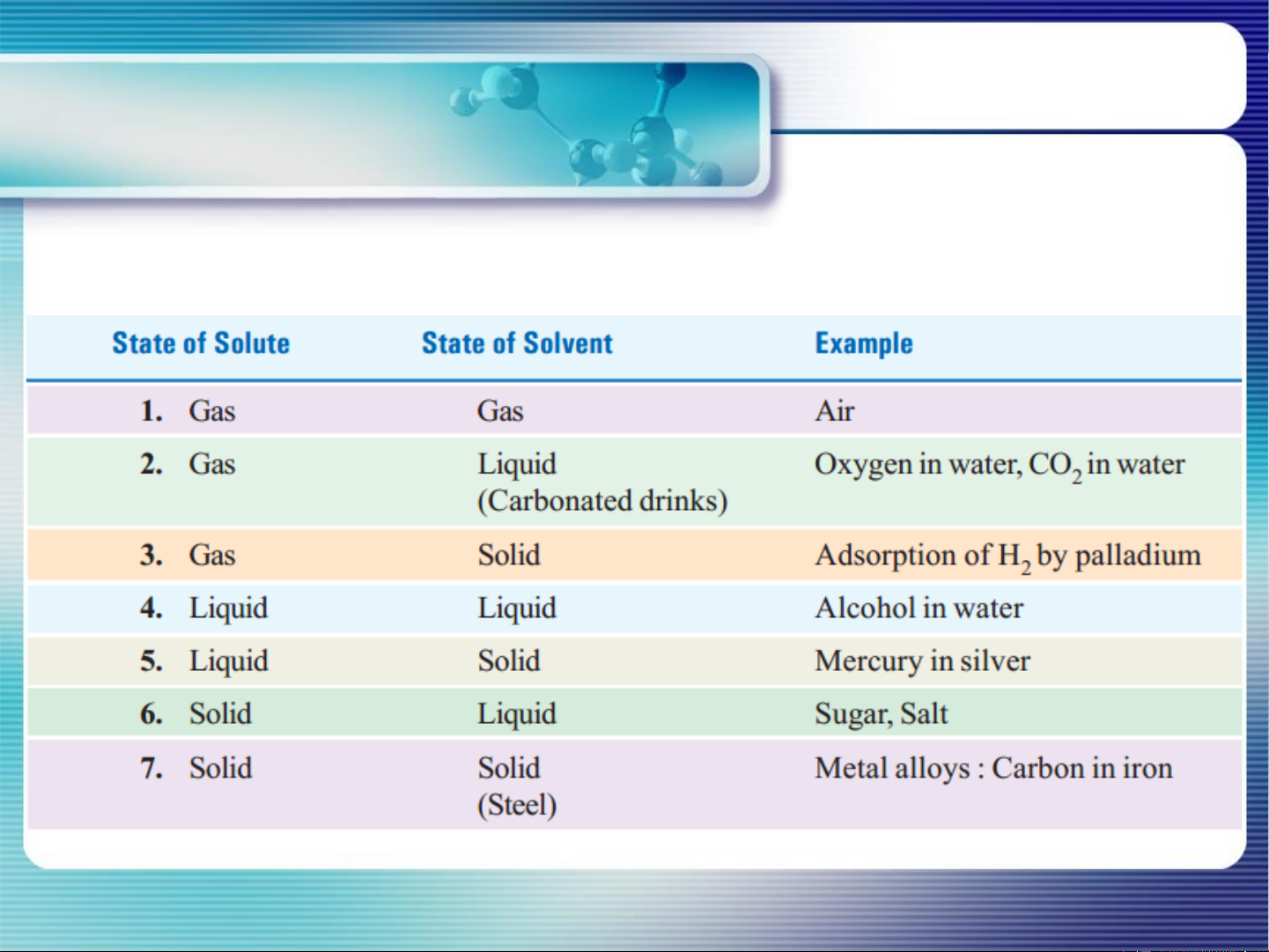
VD về 1 số dung dịch PROPERTIES OF MIXTURES Solutions
TYPES AND EXAMPLES OF SOLUTIONS 4 PROPERTIES OF MIXTURES
VD về 1 số dung dịch Solutions
TYPES AND EXAMPLES OF SOLUTIONS 5 HÓA LÝ I
Nồng độ dung dịch
CHƯƠNG 4. DUNG DỊCH PHÂN TỬ g C% = 100% (%) g + g + ... 1 2 n Khi C 0,02 M M C = (mol/L) M V Coi C = C M m n C = 1000 m (mol/Kg) mdm ni x = i n + n + ... 1 2 6 HÓA LÝ I Ví dụ
CHƯƠNG 4. DUNG DỊCH PHÂN TỬ
1. Sữa có phải là dung dịch?
2. Đồng đỏ bao gồm 90% Cu và 10% Zn, đâu là chất tan? Đâu là dung môi?
4. Nước biển chứa nhiều ion ngoài các ion Na+ và Cl-. Khi bay hơi
dần, muối đầu tiên kết tủa là CaCO (0,12 g/L), tiếp theo là 3
CaSO ⋅H O (1,75 g/L), sau đó là NaCl (29,7 g/L), MgSO (2,48 4 2 4
g/L), MgCl (3,32 g/L), NaBr (0,55 g/L) và KCl (0,53 g/L). Theo mô 2
tả, khi NaCl rắn bắt đầu hình thành, dung dịch thu được là dung
dịch bão hòa của những chất gì? 7 PROPERTIES OF MIXTURES
Phân loại dung dịch Solutions Trạng thái Bản chất Tính chất tập hợp chất tan dung dịch DD phân DD lý DD khí tử tưởng DD chất DD vô DD lỏng điện ly cùng loãng DD rắn DD thực 8 HÓA LÝ I
Dung dịch lý tưởng
CHƯƠNG 4. DUNG DỊCH PHÂN TỬ
- Dung dịch được tạo thành từ các cấu tử có cấu tạo và tính
chất hóa lý gần giống nhau
VD: hexan-cyclohexan; Fe-Ni; FeO-MnO
- Tương tác giữa các phân tử cùng loại và khác loại là như
nhau → Khi các cấu tử hòa tan vào nhau để tạo dung dịch: U = 0; H = 0; V = 0 9 HÓA LÝ I
Dung dịch lý tưởng
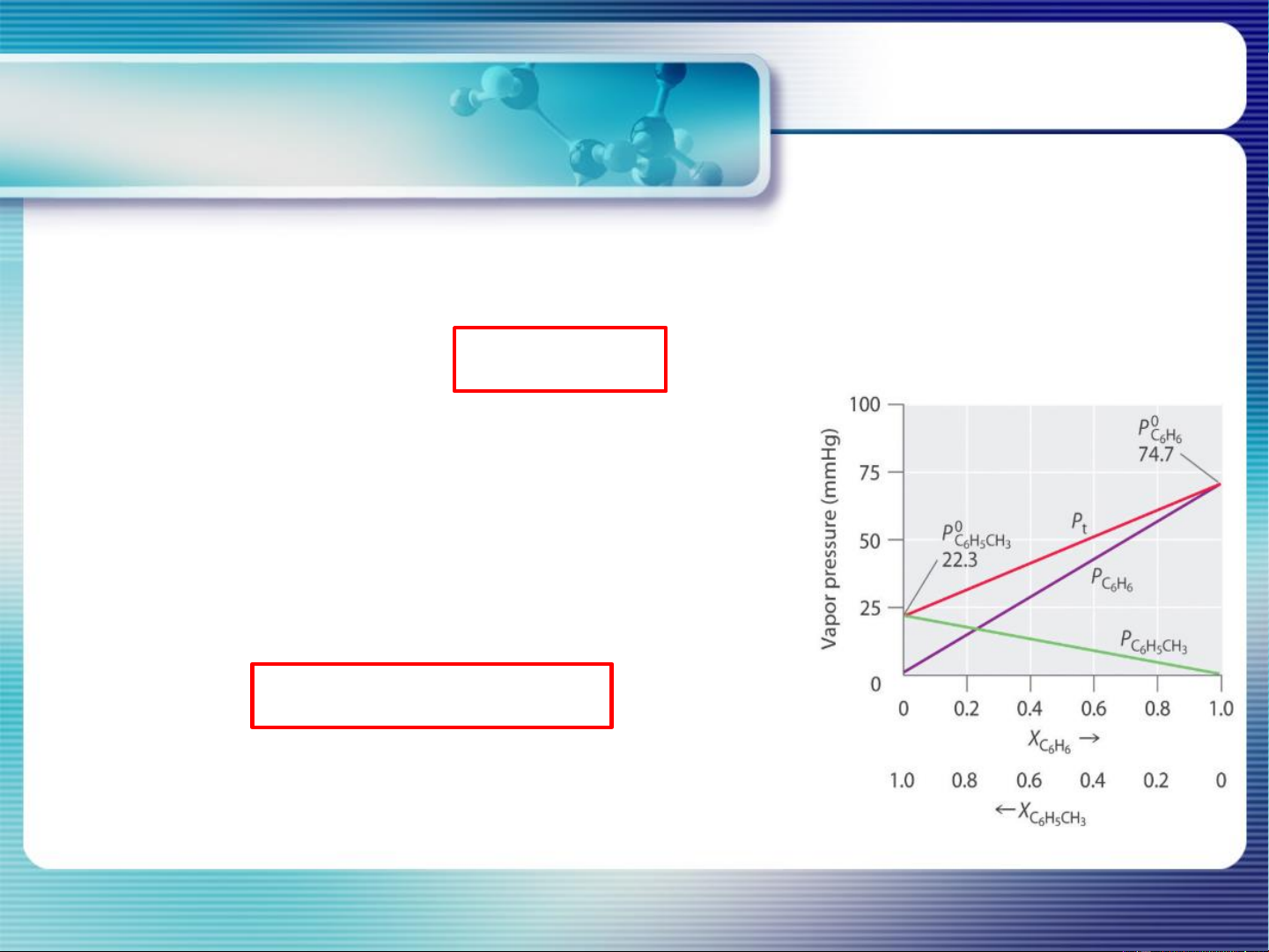
CHƯƠNG 4. DUNG DỊCH PHÂN TỬ -
Áp suất hơi riêng phần của mỗi cấu tử (P ) i
tuân theo định luật Raoult:
Dự đoán dạng đồ thị giản đồ
“P - x” của dd lý tưởng ? * i P = P .x i i i
P *: áp suất hơi bão hòa của i nguyên chất i
x : phần mol của cấu tử i trong dung dịch i -
Thế hóa của mỗi cấu tử trong dung dịch lý
tưởng không phụ thuộc vào bản chất của cấu
tử khác và tuân theo PT sau:
= * + R.T.lnx PT* i,1 i i
* thế hóa của cấu tử i nguyên chất i < * i,1 i 10 HÓA LÝ I
Dung dịch vô cùng loãng
CHƯƠNG 4. DUNG DỊCH PHÂN TỬ
- Khái niệm: chất tan và dung môi có bản chất rất khác nhau và
nồng độ chất tan vô cùng bé so với dung môi Phần mol dung môi: x → 1 1 Phần mol chất tan: x → 0 i1
Dung dịch phân tử nồng độ < 0,01 mol/L
Dung dịch chất điện ly nồng độ < 10-6 mol/L 11 HÓA LÝ I
Dung dịch vô cùng loãng
CHƯƠNG 4. DUNG DỊCH PHÂN TỬ
- Dung môi tuân theo định luật Raoult: P = P *.x 1 1 1
- Chất tan tuân theo Định luật Henry: P = K .x i H i K
hằng số Henry đối với chất tan được xác định bằng thực H nghiệm -
Thế hóa: (PT* vẫn đúng)
Dung môi: = * + R.T.lnx 1 1 1
Chất tan: = ch + R.T.lnx i i i
* : thế hóa chuẩn của dung môi ở trạng thái nguyên chất 1
ch ( *): thế hóa của chất tan i ở trạng thái chuẩn (P=1 bar) i i 12 HÓA LÝ I Dung dịch thực
CHƯƠNG 4. DUNG DỊCH PHÂN TỬ -
Khái niệm: dung dịch được tạo nên từ các cấu tử có cấu tạo và
tính chất khác nhau và nồng độ chất tan đáng kể H 0; V 0 -
Hoạt độ a của cấu tử i là đại lượng mà khi dùng nó thay cho x thì i i
PT* vẫn đúng và trở thành:
= ch + R.T.lna i i i
ch : thế hóa của i ở trạng thái chuẩn i
a : hoạt độ của chất i i
- Liên hệ x và a qua hệ số hoạt độ: = a / x i i i i i Dd thực: a = . x i i i Dd lý tưởng: a = x i i 13 HÓA LÝ I Hoạt độ ai
CHƯƠNG 4. DUNG DỊCH PHÂN TỬ
Có nhiều loại hoạt độ tương ứng với các cách biểu diễn nồng độ ▪ Khí lý tưởng: = o + R.T.ln (P /Po) i (k) i (k) i a = P /Po
(Po : áp suất tiêu chuẩn, 1 bar hoặc 1 atm) i i ▪ Khí thực: = o + R.T.ln (f /Po) i (k) i (k) i a = f /Po (f : fugat) i i i
▪ Chất rắn/lỏng nguyên chất:
= o + V* (P - Po) = o + R.T.lna (V*
: thể tích mol của i nguyên chất) i i m,i i i i m,i lna = V* (P - Po) /RT i m,i i 14
1. ĐẠI CƯƠNG VỀ DUNG DỊCH HÓA LÝ I
CHƯƠNG 4. DUNG DỊCH PHÂN TỬ Ví dụ:
Tính độ tan của O trong nước (mol/L) ở 25 oC 2
Biết áp suất riêng phần của oxy trong khí quyển là 160 Torr và K = 3,3.107 H(O2) 15
Chương 4. DUNG DỊCH VÀ CH3041
CÂN BẰNG LỎNG - HƠI HÓA LÝ I
1. Đại cương về dung dịch
2. Tính chất nồng độ của dung dịch loãng
3. Sự hòa tan của chất khí trong chất lỏng
4. Sự hòa tan của lỏng trong lỏng và cân bằng dung dịch - hơi 16
2. TÍNH CHẤT NỒNG ĐỘ CỦA HÓA LÝ I DUNG DỊCH LOÃNG
CHƯƠNG 4. DUNG DỊCH PHÂN TỬ
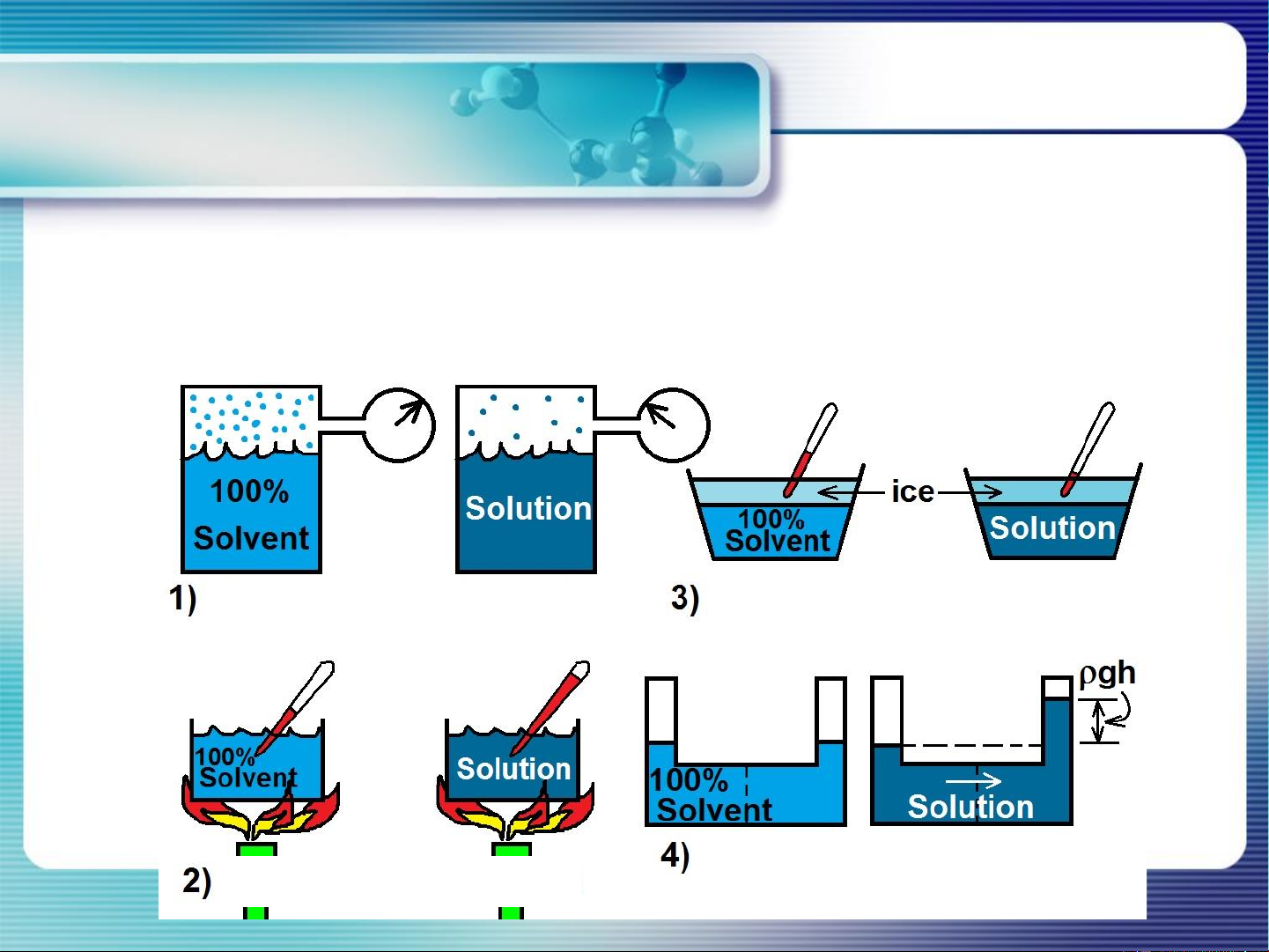
Khi hòa tan chất tan không bay hơi (nồng độ thấp) vào dung môi sẽ làm
thay đổi 1 số tính chất của dm. Sự thay đổi này không phụ thuộc vào bản
chất của chất tan, chỉ phụ thuộc nồng độ chất tan. Gồm: Giảm áp suất hơi
Hạ nhiệt độ kết tinh
Áp suất thẩm thấu
Tăng nhiệt độ sôi 17
2. TÍNH CHẤT NỒNG ĐỘ CỦA HÓA LÝ I DUNG DỊCH LOÃNG
CHƯƠNG 4. DUNG DỊCH PHÂN TỬ
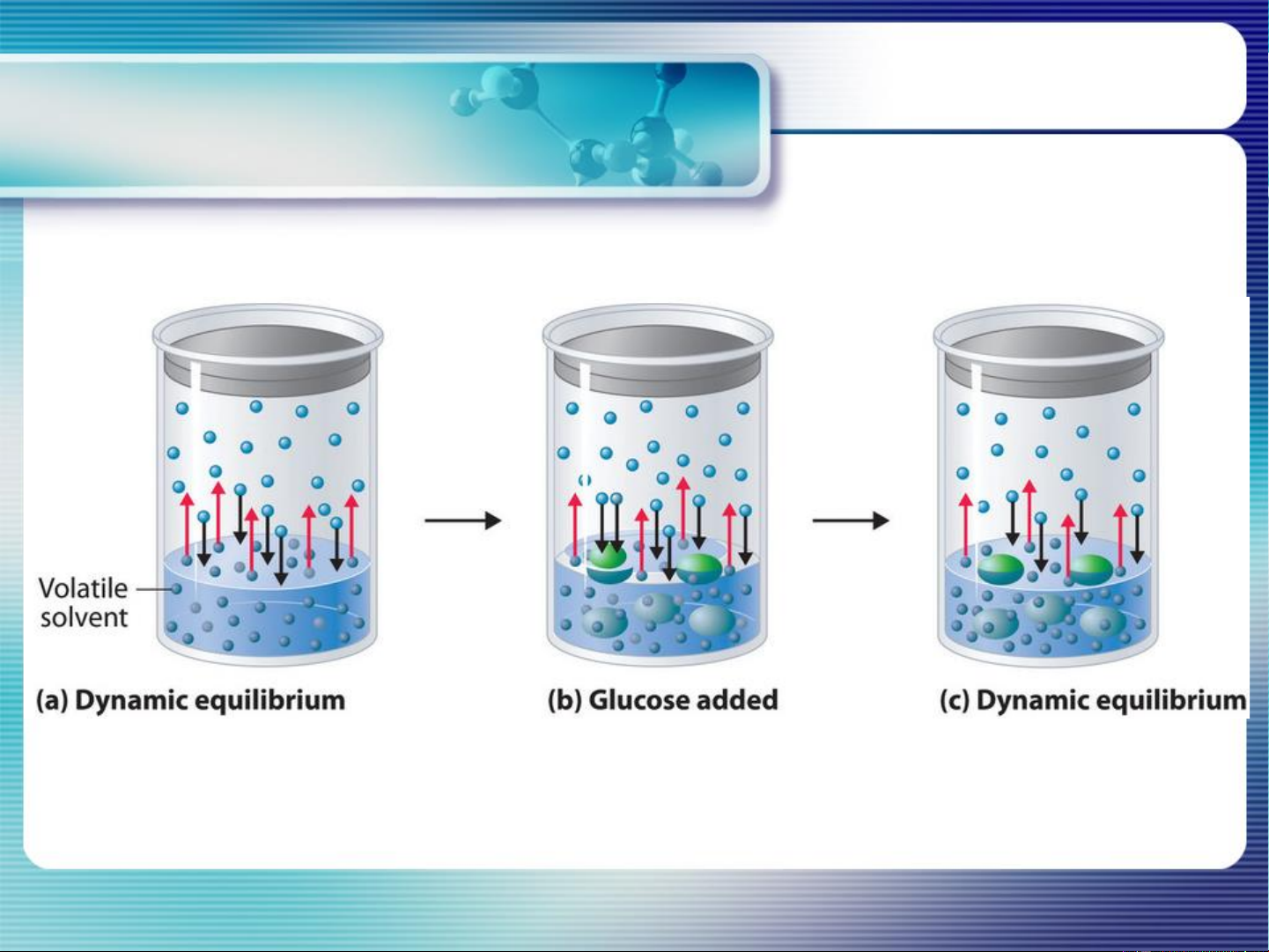
2.1. Giảm áp suất hơi:
- Giả thiết chất tan không bay hơi, phần mol chất tan: x2
Chất tan không bay hơi P = P = P0 .x < P0 P < P dd 1 1 1 1 dd dm
Dung môi tuân theo định luật Raoult: P = 0 P . x = P 0 1 – x 1 1 1 1 ( 2 ) 0 P − P
x , x : phần mol của dm và chất tan 1 1 1 2 x = 2 P : as hơi của dd 0 P dd 1
P : as hơi riêng phần của dm trong dd 1
P 0 : as hơi của dm nguyên chất 1
Vậy, as hơi của dm nguyên chất bị giảm khi có chất tan ko bay hơi hòa tan
vào. Độ giảm as hơi này chỉ phụ thuộc vào phần mol của chất tan.
Dung dịch càng đặc → áp suất hơi càng giảm mạnh. 18
2. TÍNH CHẤT NỒNG ĐỘ CỦA HÓA LÝ I DUNG DỊCH LOÃNG
CHƯƠNG 4. DUNG DỊCH PHÂN TỬ
2.1. Giảm áp suất hơi:
https://chem.libretexts.org/Bookshelves/General_Chemistry/Map %3A_Chemistry_-
_The_Central_Science_(Brown_et_al.)/13%3A_Properties_of_S
olutions/13.5%3A_Colligative_Properties 19
2. TÍNH CHẤT NỒNG ĐỘ CỦA HÓA LÝ I DUNG DỊCH LOÃNG
CHƯƠNG 4. DUNG DỊCH PHÂN TỬ
2.1. Giảm áp suất hơi: VD1
VD2: Ở 100°C, ASH của nước là 760 mmHg. Tính ASH của dung dịch
chứa 30,2% (theo khối lượng) ethylene glycol. ĐS: 675 mmHg 20




