







Preview text:
LOGO CH3050 - HÓA LÝ I
TS. Nguyễn Thị Tuyết Mai
Bộ môn Hóa lý, Viện Kỹ thuật Hóa học
Trường Đại học Bách Khoa Hà Nội
Email: mai.nguyenthituyet1@hust.edu.vn 1
Chương 4. DUNG DỊCH VÀ CH3041
CÂN BẰNG LỎNG - HƠI HÓA LÝ I
1. Đại cương về dung dịch
2. Tính chất nồng độ của dung dịch loãng
3. Sự hòa tan của chất khí trong chất lỏng
4. Sự hòa tan của lỏng trong lỏng và cân bằng dung dịch - hơi 2
3. SỰ HÒA TAN KHÍ TRONG LỎNG HÓA LÝ I
CHƯƠNG 4. DUNG DỊCH PHÂN TỬ
- Nồng độ khí trong lỏng thường bé → coi là dung dịch vô cùng loãng
- Độ hòa tan của khí : là lượng khí hòa tan trong 1 đơn vị thể
tích dung dịch bão hòa ở T, P = const. Đv: mol/l; g/l
- Độ hòa tan của khí phụ thuộc vào T, P, bản chất của khí và dung môi 3
3. SỰ HÒA TAN KHÍ TRONG LỎNG HÓA LÝ I
CHƯƠNG 4. DUNG DỊCH PHÂN TỬ
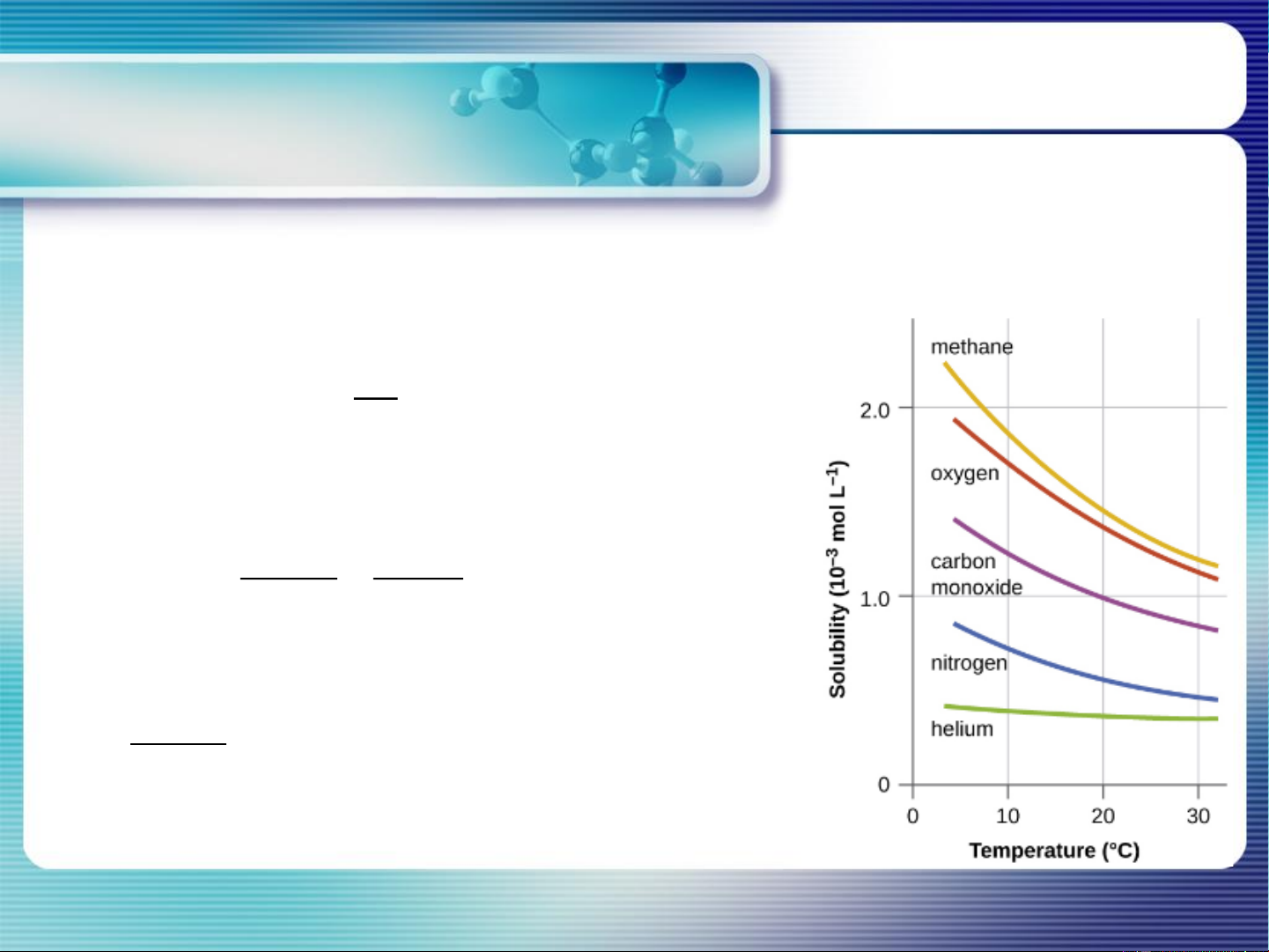
a. Ảnh hưởng của bản chất của khí và dung môi VD:
Độ tan của O trong nước = 3 Độ tan của He trong nước 2
Độ tan của O trong nước = 1/20 Độ tan của O trong hexane 2 2
Độ tan của O trong nước = 1/100 Độ tan của chloromethan 2 trong nước 4
3. SỰ HÒA TAN KHÍ TRONG LỎNG HÓA LÝ I
CHƯƠNG 4. DUNG DỊCH PHÂN TỬ
b. Ảnh hưởng của T đến độ hòa tan khí trong lỏng- PT Sreder
Khí A (Pi) dung dịch (xi) + Hhòa tan x ' i k = H pi
Áp dụng phương trình Van’t Hoff ' d ln k H H htan = PT Sreder 2 dT RT
Thường Hhòa tan < 0 (khí) quá trình tỏa nhiệt ' d ln kH
< 0 → T → độ hòa tan giảm dT và ngược lại 5
3. SỰ HÒA TAN KHÍ TRONG LỎNG HÓA LÝ I
CHƯƠNG 4. DUNG DỊCH PHÂN TỬ
b. Ảnh hưởng của T đến độ hòa tan khí trong lỏng- PT Sreder 6
3. SỰ HÒA TAN KHÍ TRONG LỎNG HÓA LÝ I
CHƯƠNG 4. DUNG DỊCH PHÂN TỬ
c. Ảnh hưởng của P đến độ hòa tan khí trong lỏng- ĐL Henry
(xét khí và dm ko tương tác hóa học → độ hòa tan nhỏ)
ĐL Henry: ở T=const, độ tan của khí trong lỏng tỉ lệ với áp suất của khí
đó trên bề mặt dung dịch. x = k ’.P i H i
k ’: hệ số Henry của khí (phụ thuộc vào T) H
P : áp suất riêng phần của khí trên bề mặt lỏng i
x : nồng độ phần mol của khí trong lỏng i 7
3. SỰ HÒA TAN KHÍ TRONG LỎNG HÓA LÝ I
CHƯƠNG 4. DUNG DỊCH PHÂN TỬ
c. Ảnh hưởng của P đến độ hòa tan khí trong lỏng- ĐL Henry 8
3. SỰ HÒA TAN KHÍ TRONG LỎNG HÓA LÝ I
CHƯƠNG 4. DUNG DỊCH PHÂN TỬ
Dung dịch siêu bão hòa:
Khí được hòa tan trong lỏng ở điều kiện T thấp hoặc/và P cao
Khi tăng T hoặc giảm P: dung dịch trở thành siêu bão hòa
(a) The 1986 disaster that killed more than 1700 people near Lake Nyos in Cameroon resulted
when a large volume of carbon dioxide gas was released from the lake. (b) A CO2 vent has
since been installed to help outgas the lake in a slow 9
3. SỰ HÒA TAN KHÍ TRONG LỎNG HÓA LÝ I
CHƯƠNG 4. DUNG DỊCH PHÂN TỬ BT:
Ở 20°C, nồng độ oxy hòa tan trong nước khi tiếp xúc với oxy
dạng khí ở áp suất riêng phần 101,3 kPa (760 torr) là 1,38 ×10−3
mol/L. Xác định độ hòa tan của oxy khi áp suất riêng phần của nó
là 20,7 kPa (155 torr), áp suất gần đúng của oxy trong bầu khí quyển Trái đất. ĐS: 2,82×10−4 mol/L 10
Chương 4. DUNG DỊCH VÀ CH3041
CÂN BẰNG LỎNG - HƠI HÓA LÝ I
1. Đại cương về dung dịch
2. Tính chất nồng độ của dung dịch loãng
3. Sự hòa tan của chất khí trong chất lỏng
4. Sự hòa tan của lỏng trong lỏng và cân bằng dung dịch – hơi
a. Dung dịch lý tưởng tan lẫn vô hạn
b. Dung dịch thực tan lẫn vô hạn 11
Dung dịch lý tưởng
MIXTURES OF LIQUIDS IN LIQUIDS tan lẫn vô hạn
Completely miscible liquids
A, B → dd lý tưởng tan lẫn vô hạn A-B H = 0; V = 0; f y = f(x ) A A A-A = fB-B = fA-B a.
Giản đồ thành phần – thành phần
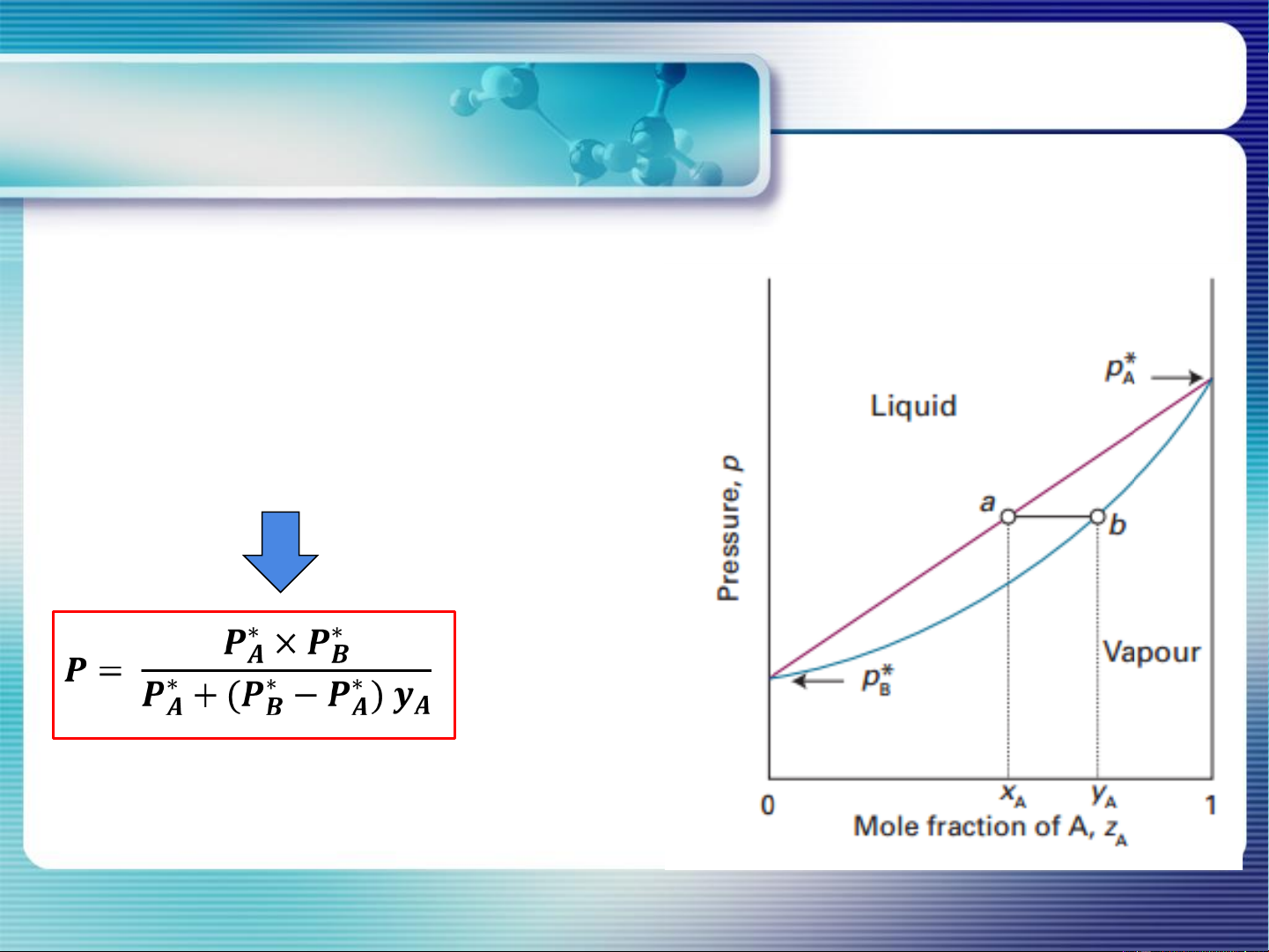
Xét cân bằng dung dịch – hơi:
dung dịch (A,B) hơi (A, B) xA yA, PA xB yB, PB xA + xB =1; yA + yB =1 P ∗ A +PB =P 𝑷 . 𝒙 𝒚 𝑨 𝑨 P 𝑨 = ∗ ∗ ∗ A = P*A . xA = P . yA
𝑷𝑩 + (𝑷𝑨 − 𝑷𝑩)𝒙𝑨 PB = P*B . xB = P. yB
Định luật Raoult P* / P* = A B 12
Dung dịch lý tưởng
MIXTURES OF LIQUIDS IN LIQUIDS
Completely miscible liquids tan lẫn vô hạn
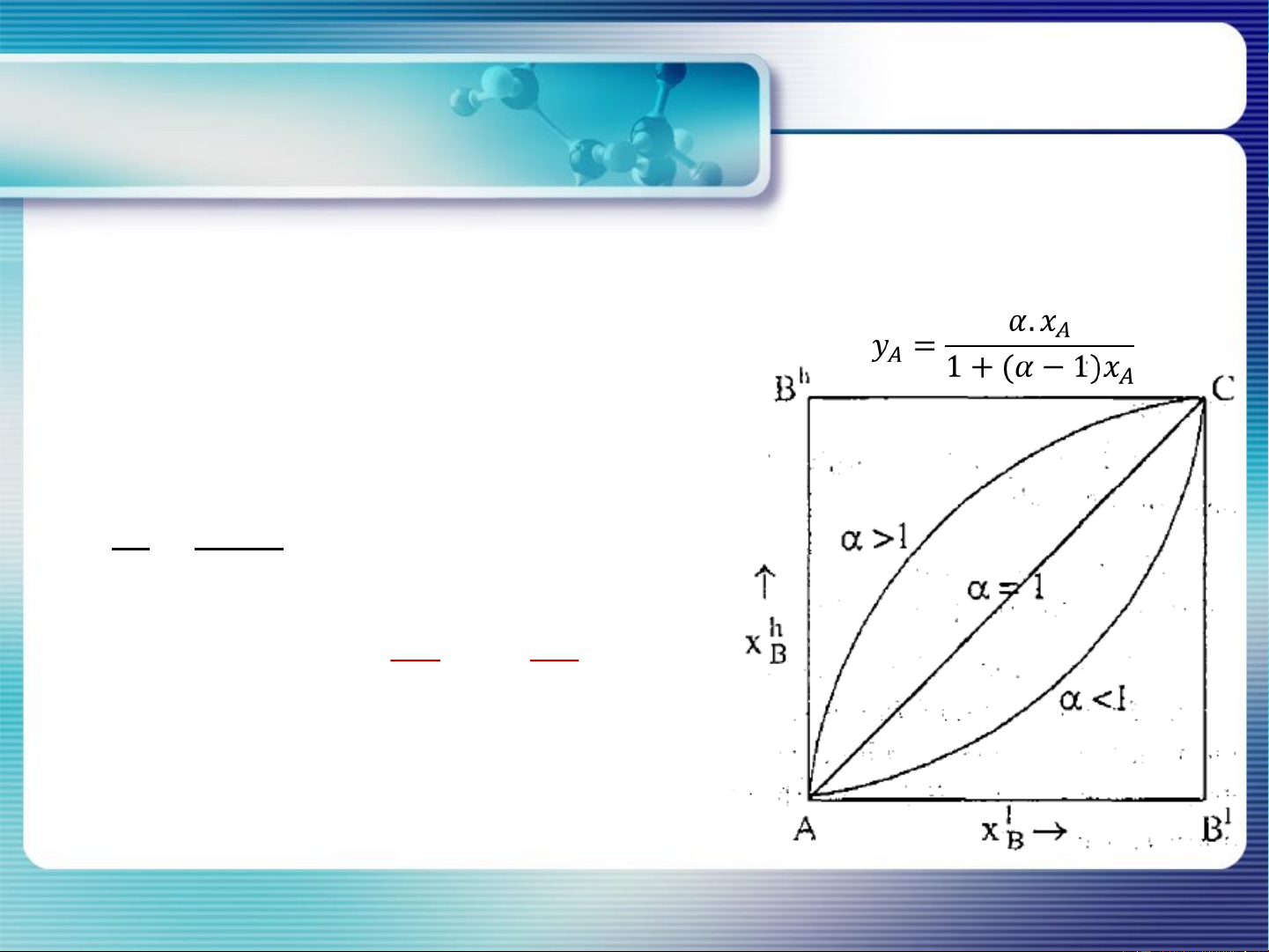
Cân bằng dung dịch – hơi: y = f(x ) A A
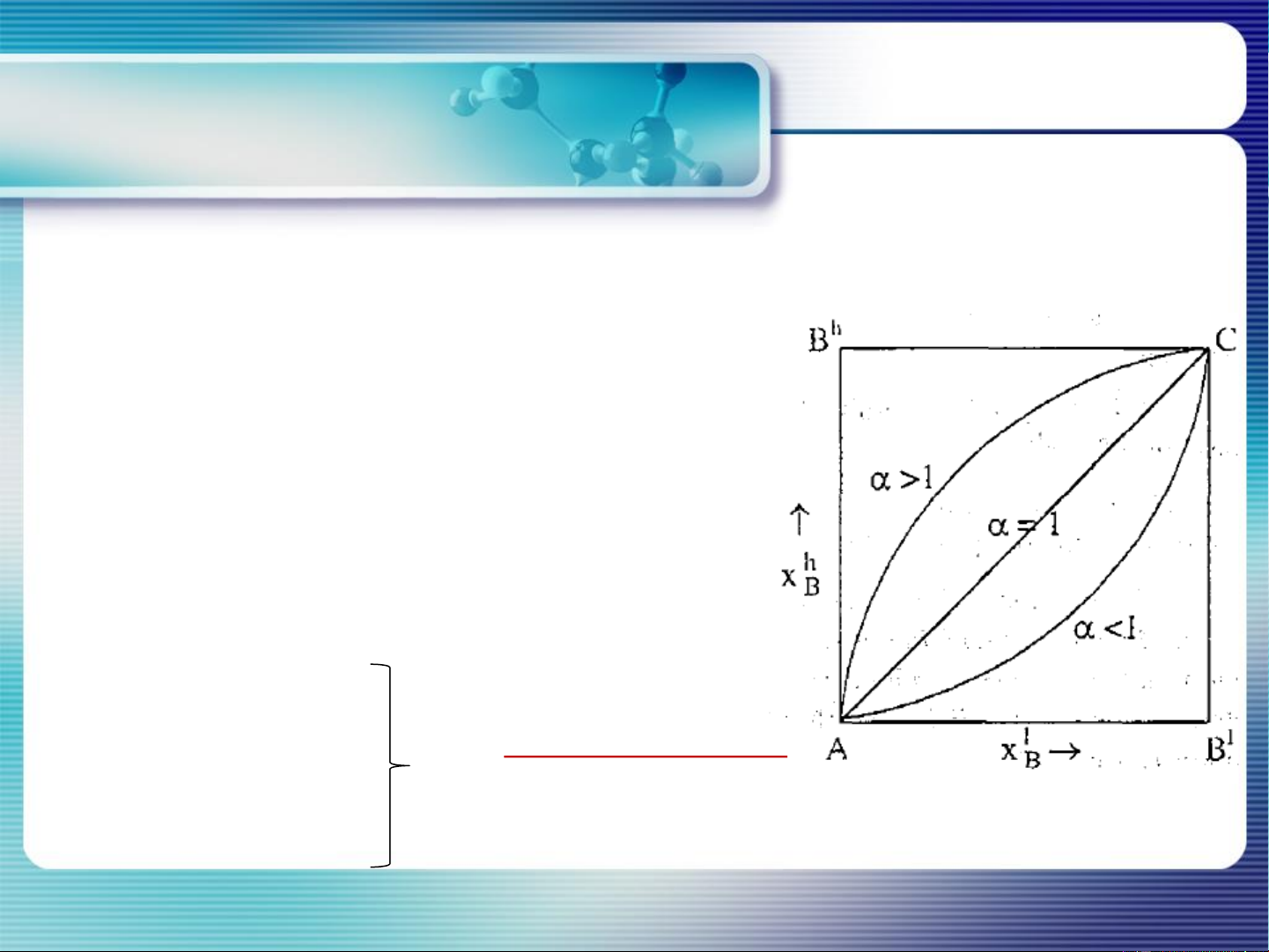
Dung dịch (A,B) hơi (A, B) P*A . xA = P . yA P*B . xB = P. yB 𝑦 ∗ 𝐴 𝑃 . 𝑥 = 𝐴 𝐴 𝑦 ∗ 𝐵 𝑃𝐵. 𝑥𝐵 𝒚𝑨 𝒙𝑨 P* = 𝜶 A / P*B = 𝒚𝑩 𝒙𝑩
> 1 yA > xA Định luật Konovalop I x A yA 13
Dung dịch lý tưởng
MIXTURES OF LIQUIDS IN LIQUIDS
Completely miscible liquids tan lẫn vô hạn
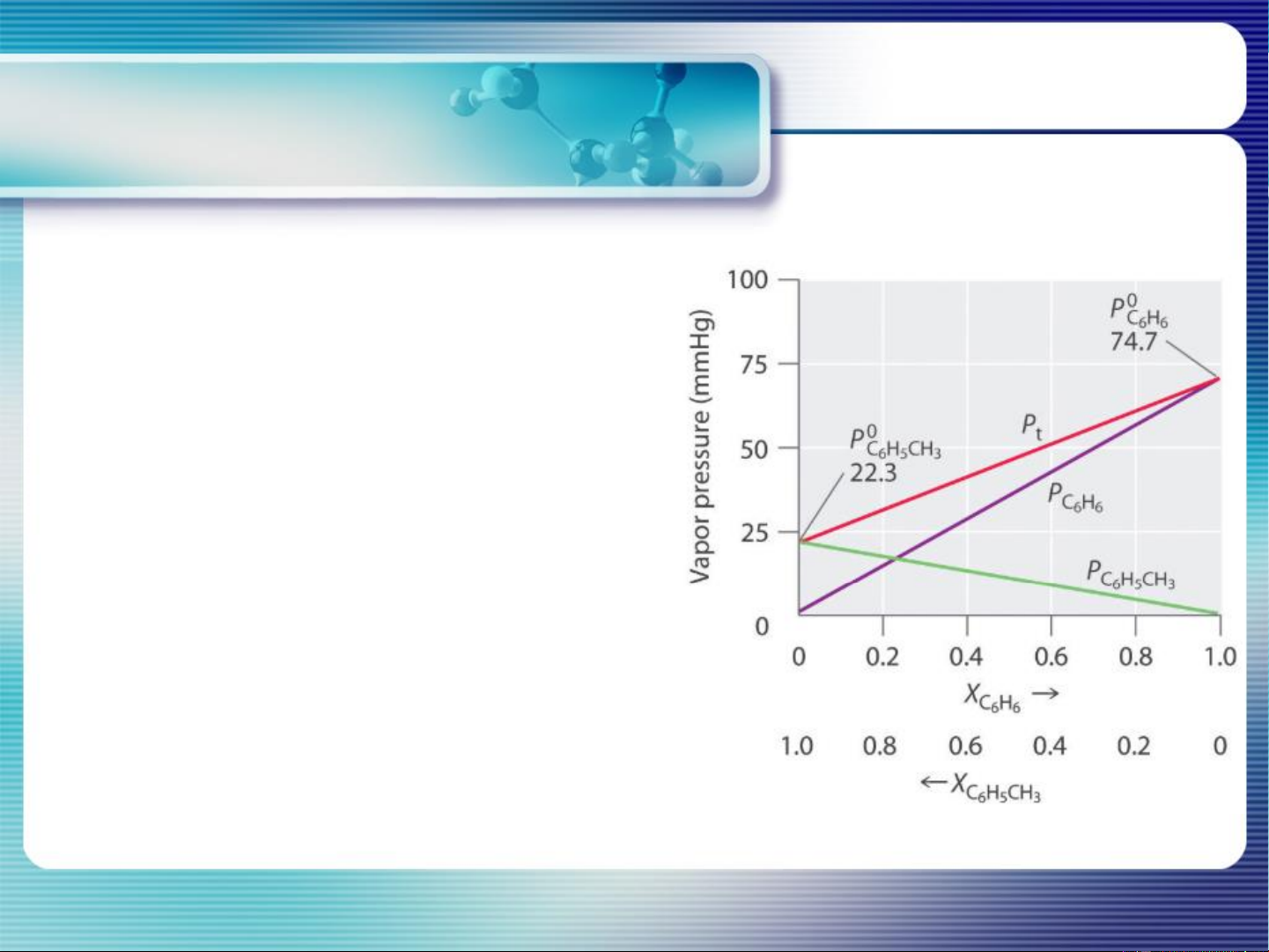
b. Giản đồ P- thành phần: P = f (x ) A
T = const; P* > P* Tb < Tb A B A B P = P* .x (pt đường thẳng) A A A P = P* .x = P* (1 – x ) B B B B A (pt đường thẳng)
P = P + P P= P* + (P* - P* )x A B B A B A (pt đường thẳng) x =1 P = P* A A x =0 P = P* A B 14
Dung dịch lý tưởng
MIXTURES OF LIQUIDS IN LIQUIDS
Completely miscible liquids tan lẫn vô hạn T = const; P* A > P*B TbA < TbB
P = f (x ) và P = f (y ) A A P = P* − B + (P*A P*B) xA
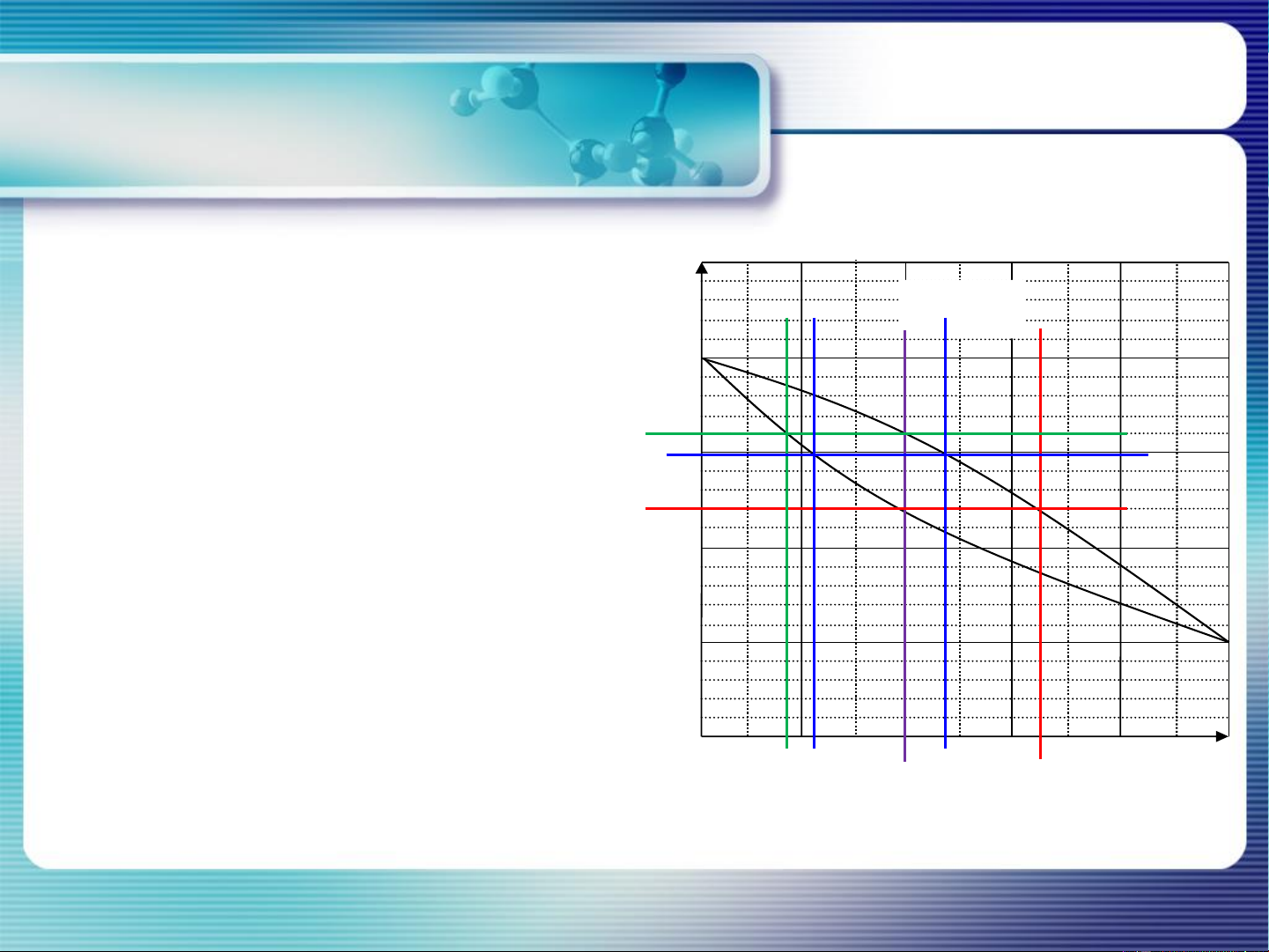
Thành phần pha lỏng và pha hơi tuân theo quy tắc đòn bẩy 15
Dung dịch lý tưởng
MIXTURES OF LIQUIDS IN LIQUIDS
Completely miscible liquids tan lẫn vô hạn
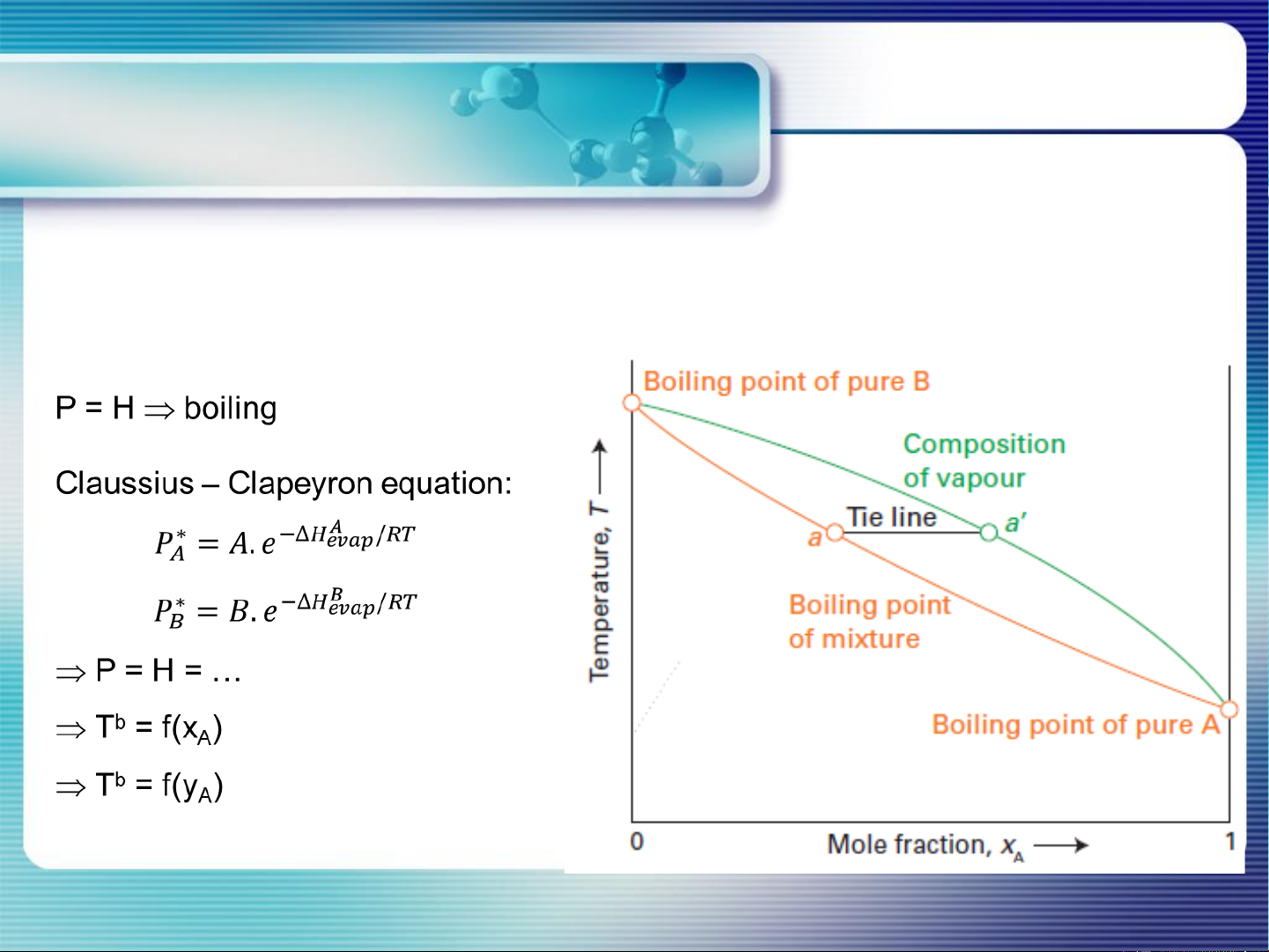
c. Giản đồ T – thành phần: (P = const; P*A > P*B) T = f (xA)
P = PA+ PB = P*A xA + P*B (1- xA)
Phân tích quá trình đa nhiệt… 16 Bài tập
Câu 8: Etanol và metanol tạo thành dung dịch xem như lý tưởng. Ở 20oC
áp suất hơi bão hòa của etanol và metanol lần lượt là 44,5 và 88,7 mmHg.
a) Tính thành phần mol các chất trong dung dịch chứa 100g etanol và 100g metanol.
b) Xác định các áp suất riêng phần và áp suất tổng của dung dịch.
c) Tính phần mol của metanol trong pha hơi nằm cân bằng với dung dịch trên.
ĐS: a) 0,41 và 0,59; b) 18,2mmHg, 52,3 mmHg và 70,5 mmHg; c) 0,74 17 Bài tập 120
Xem dung dịch của benzen và toluen là dung P=1 atm
dịch lý tưởng. Giản đồ (T-x,y) của hệ này
được xây dựng ở P =1 atm được cho ở hình 110
vẽ. Đun hỗn hợp chứa 4,0 mol benzen và 6,0
mol toluen dưới áp suất 1 atm: 100
a. Xác định nhiệt độ bắt đầu sôi của hỗn hợp 90
và thành phần của bong bóng hơi đầu tiên.
b. Đun nóng đến nhiệt độ nào thì hệ hóa hơi 80
hoàn toàn? Xác định thành phần của giọt lỏng cuối cùng. 70
c. Tính số mol pha hơi và pha lỏng nằm cân 0 0,2 0,4 0,6 0,8 1,0 → xBenzen
bằng ở 1000C và thành phần mỗi pha. 18 Hướng dẫn giải
a. Điểm bắt đầu sôi tại A có nhiệt độ 94oC 120
Từ điểm A kẻ đường song song với trục hoành, P=1 atm
cắt đường hơi tại điểm B thì được thành phần
của bong bóng hơi đầu tiên là 110 yB =0,65 và yA= 0,35 C
b. thành phần của giọt lỏng cuối cùng tại C là 100 M x L H B =0,16. B
c. Hệ ở 100oC có điểm biểu diễn tại M, cắt A 90
đường lỏng tại L, cắt đường hơi tại H. Theo quy tắc đòn bẩy ta có: 80
Thành phần pha lỏng là điểm L có xB= 0,22;
thành phần pha hơi là điểm H có yB=0,47. 70
Lượng L/Lượng H = MH/ML = 0,175/0,06 = 2,9 0 0,2 0,4 0,6 0,8 1,0
Mà lượng L + Lượng H = 10 mol. → xBenzen
lượng L = 7,44 mol và lượng H =2,56 mol 19 Dung dịch thực
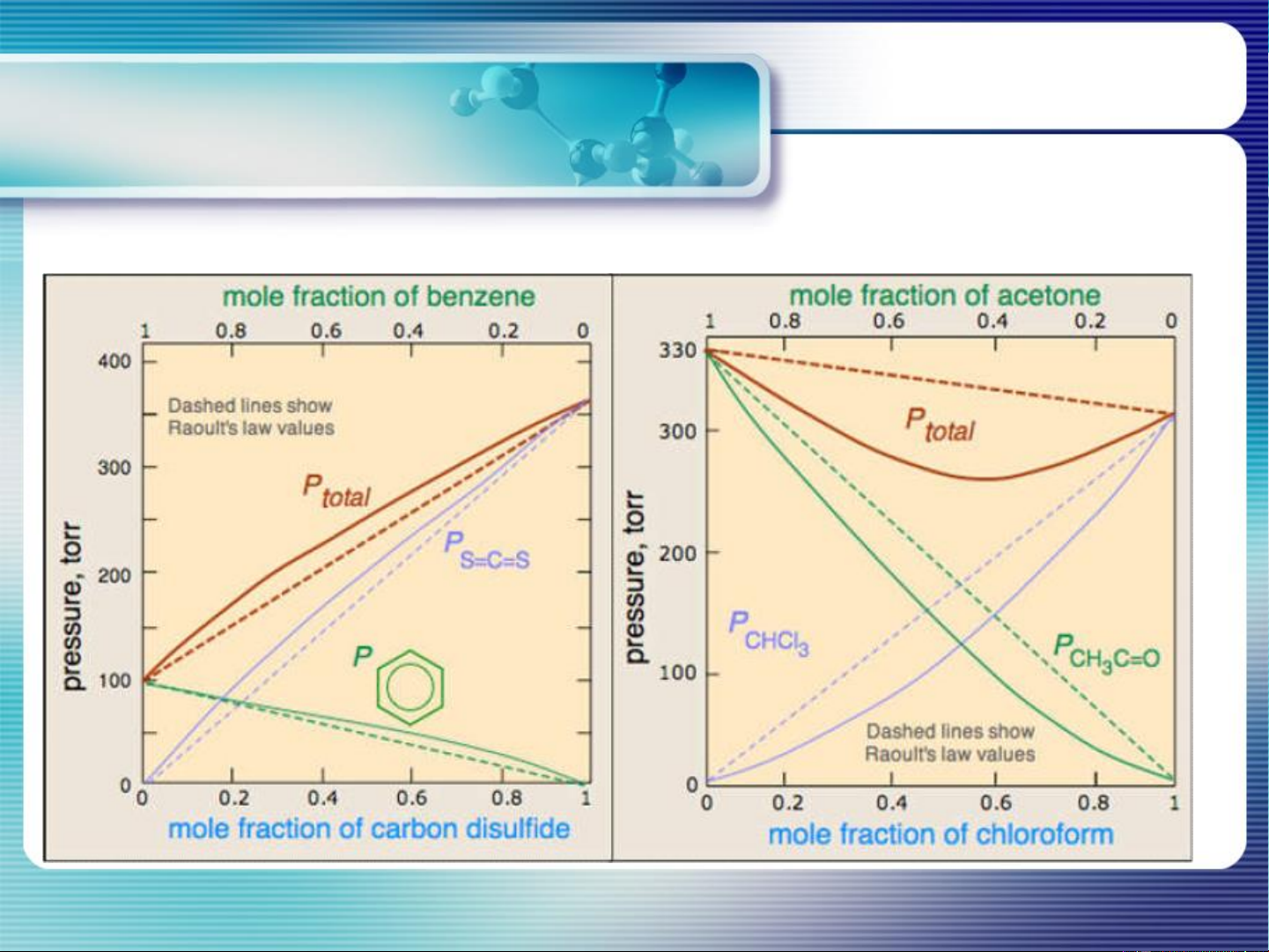
MIXTURES OF LIQUIDS IN LIQUIDS
Completely miscible liquids tan lẫn vô hạn f ≠ f ≠ f A-A B-B A-B f > f , f f < f , f A-B A-A B-B A-B A-A B-B 20




