















Preview text:
LOGO Hóa lý 1
TS. Nguyễn Thị Tuyết Mai
Bộ môn Hóa lý, Viện Kỹ thuật Hóa học
Trường Đại học Bách Khoa Hà Nội
Email: mai.nguyenthituyet1@hust.edu.vn 1 ĐỀ CƯƠNG
▪ Chương I. Cơ sở của nhiệt động hóa học
▪ Chương II: Cân bằng hóa học Thi ▪ Chương GK
III. Lý thuyết cân bằng pha và dung dịch
▪ Chương IV. Cân bằng pha của hệ đa cấu tử
▪ Chương V. Dung dịch các chất điện ly Thi CK
▪ Chương VI. Pin và điện cực 2 TÀI LIỆU HỌC TẬP
1. Đào Văn Lượng, 2002. Nhiệt động hóa học, NXB GD
2. Ngô Quốc Quyền, Trần Thị Thanh Thủy, 2013, Điện Hóa học, NXB Bách Khoa HN
3. Nguyễn Hữu Phú, 2003. Hoá lý và Hoá keo, NXB KH&KT.
4. Peter Atkins, Julio de Paula, James Keeler, 2018. Physical
Chemistry. Oxford University Press.
5. Robert G. Mortimer, 2008. Physical Chemistry. Academic Press 3
ĐÁNH GIÁ HỌC PHẦN Điểm thành Phương pháp đánh Mô tả Tỷ trọng phần giá cụ thể Điểm quá trình Đánh giá quá trình 30% Thảo luận trên lớp Thảo luận theo chủ đề 5% Bài tập Chữa bài Kiểm tra giữa kỳ Thi tự luận 25% Điểm cuối kỳ Thi cuối kỳ Thi tự luận + 70% trắc nghiệm 4 Chương 1: CƠ SỞ CỦA NHIỆT ĐỘNG HÓA HỌC
Ôn tập nguyên lý 1: ▪ Phát biểu?
▪ Biểu thức: U = Q - A Q ? •Q > 0 : pư thu nhiệt
•Q < 0 : pư tỏa nhiệt A ? •A > 0 : hệ sinh công U ?
•A < 0 : hệ nhận công 5 PHYSICAL CHEMISTRY 1 Enthalpy H Revisited thermodynamic
• T, V = const, hệ không sinh công : Q = ΔU V
• T, P = const : Q = ΔH (biến thiên enthalpy) P VD: cho pư: aA + bB = dD + eE
Xây dựng biểu thức ΔHo của phản ứng ?
ΔHo = ∑ ΔHo (sp) − ∑ ΔHo (tg) s s
ΔHo = ∑ ΔHo (tg) − ∑ ΔHo (sp) c c 6 PHYSICAL CHEMISTRY 1 Enthalpy H Revisited thermodynamic
ΔHo là nhiệt pư tạo thành 1 mol chất từ các đơn chất bền s vững nhiệt động
ΔHo của 1 đơn chất bền bững nhiệt động = 0 s VD: ΔHo (graphit) ΔHo s = 0 (O , k) s 2 = 0 ΔHo (kc) 0 ΔHo (O , l) s 2 s 0
ΔHo là nhiệt của pư cháy 1 mol chất với oxi tạo thành c
oxit hóa trị cao nhất Ex: C(gr) + O = CO ΔHo (C, gr) 2 2 c 7 PHYSICAL CHEMISTRY 1 Enthalpy - ĐL Hess Revisited thermodynamic
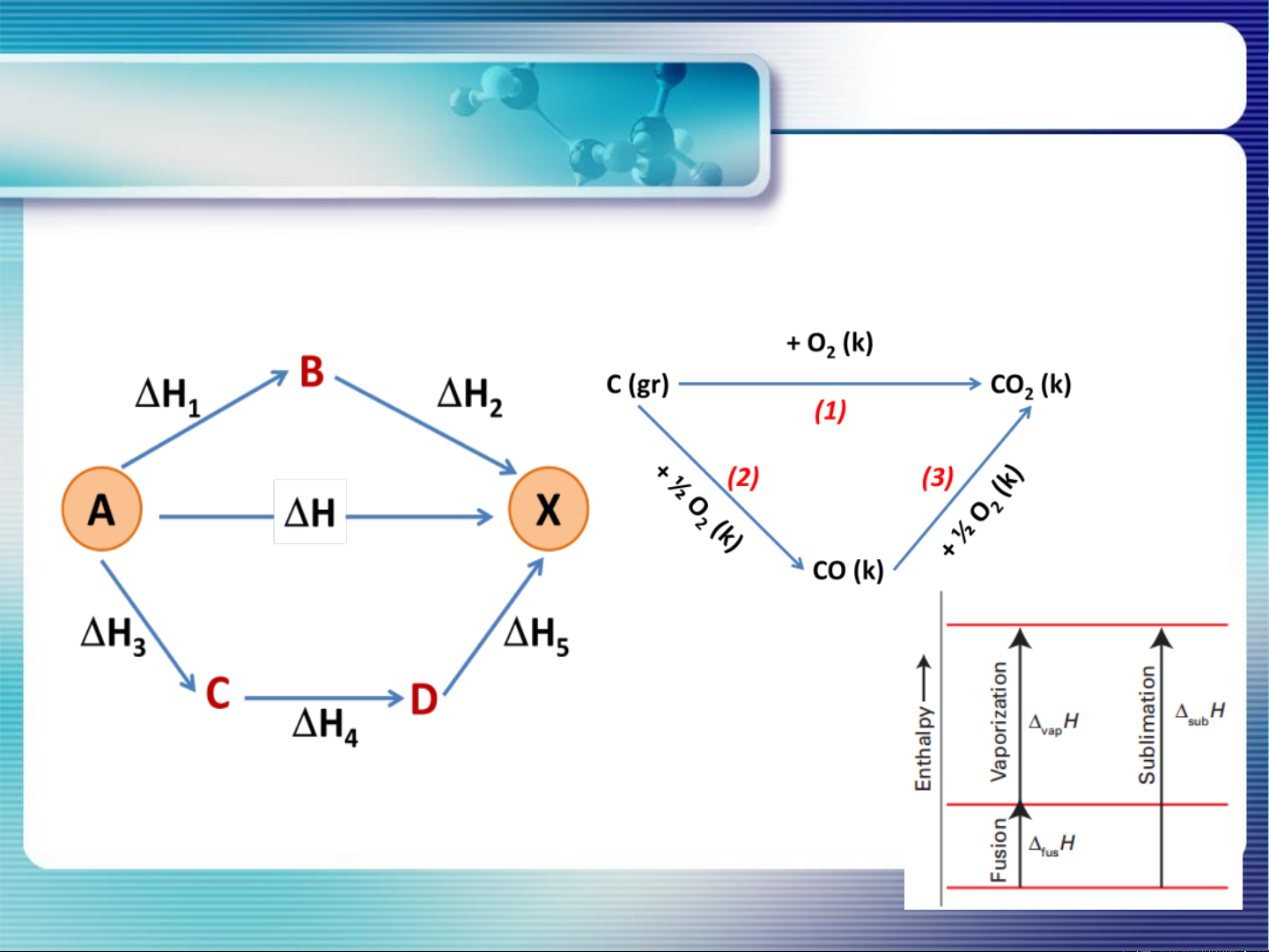
Enthalpy là hàm trạng thái, ko phụ thuộc vào quá trình, chỉ phụ thuộc
vào trạng thái đầu và cuối.
H = H + H = H + H + H 1 2 3 4 5 8 PHYSICAL CHEMISTRY 1 Enthalpy - ĐL Hess Revisited thermodynamic Hthuận = - Hnghịch 1. H (g) + 1/2O (g) → H O(g) ΔH° = -572 kJ 2 2 2 2. H O(g) → H (g) + 1/2O (g) ΔH° = ? 2 2 2 +572 kJ 9 Bài tập
Nhiệt đốt cháy của cacbon vô định hình, của graphit,
của kim cương lần lượt bằng – 409,2; -394,6 và
-395,3 kJ/mol. Tính nhiệt chuyển hóa thù hình:
a. Cacbon vô định hình thành graphit
b. Cacbon vô định hình thành kim cương c. Graphit thành kim cương ĐS: - 14,6; - 13,9; 0,9 kJ 10 Bài tập
Nhiệt hình thành của H O (lỏng) và của CO (khí) 2 2
bằng -285,8 và -393,5 kJ/mol ở 25 oC và 1 atm.
Cũng ở điều kiện này, nhiệt đốt cháy của CH bằng 4
-890,3 kJ/mol. Tính nhiệt hình thành của CH từ 4
các nguyên tố ở điều kiện đẳng áp. ĐS: -74,8 kJ/mol. 11 PHYSICAL CHEMISTRY 1 ĐL Kirchhoff Revisited thermodynamic 𝑇′
∆𝐻(𝑇′) = ∆𝐻(𝑇) + න ∆𝐶𝑃. 𝑑𝑇
C là nhiệt dung riêng đẳng áp p 𝑇
Trong khoảng T hẹp: ΔC = const p
ΔH(T′) = ΔH + ΔC × (T′−T) (T) p
ΔC = ∑C (sp) − ∑C (tg) p p p 12 Ôn tập nguyên lý 2 ▪ 13 PHYSICAL CHEMISTRY 1 Ôn tập nguyên lý 2 Revisited thermodynamic Ý nghĩa của NL 2:
Trong hệ cô lập, qtr tự xảy ra theo
chiều tăng entropy (tăng độ hỗn độn của hệ) S > 0 VD? 14 PHYSICAL CHEMISTRY 1 NL tự do Gibbs: G Revisited thermodynamic
G = H−TS (J/mol); (cal/mol)
Thế nhiệt động đẳng T, đẳng P: ΔG = ΔH − TΔS
Điều kiện để pư tự xảy ra: ΔS > 0 ΔG < 0
Dùng ΔG để xét chiều của pư 15 NL tự do Gibbs: G ▪ΔG = A’max VD: cho pư: aA + bB = dD + eE
Xây dựng biểu thức ΔGo của phản ứng ?
ΔGo = ∑ ΔGo (sp) − ∑ ΔGo (tg) s s T =const: ΔG = ΔH − TΔS T const: PT Gibbs Helhomzt 16 PHYSICAL CHEMISTRY 1 BT Revisited thermodynamic
1. Tính NL Gibbs của pư ở 298 K:
4 HCl(g) +O (g) →2 Cl (g)+2 H O(l) 2 2 2
từ các số liệu dưới đây: HCl(g) O (g) Cl (g) H O(l) 2 2 2 S 0 (J K−1 mol−1) 186.91 205.138 223.07 69.91 m H0(kJ mol−1) −92.31 0 0 −285.83 f 17 PHYSICAL CHEMISTRY 1 Thế hóa học Revisited thermodynamic
Là đạo hàm riêng của 1 trong các hàm
đặc trưng (G, H, U…) theo số mol của
cấu tử i khi các thông số tương ứng và
số mol của các cấu tử khác không đổi.
Khi T, P = const μ = G/n là thế đẳng áp mol riêng phần của cấu tử i i i Ý nghĩa của :
- Là đại lượng mol riêng phần
- Đặc trưng cho khả năng sinh công ngoài
- Đặc trưng cho tính không bền của cấu tử: → cao thấp 18 PHYSICAL CHEMISTRY 1 Tính chất của Revisited thermodynamic
▪ Những PT viết cho thế đẳng áp mol đều có thể viết tương tự cho hóa thế:
1 mol khí lý tưởng: μ = μ0 + RTlnP i i(T) i
P : as riêng phần của cấu tử i i μ0
: Thế hóa học chuẩn của cấu tử i ở nhiệt độ T, P=1atm i(T)
Hỗn hợp khí lý tưởng: μ = μ* + RTlnx i i(T,P) i
Thế hóa chuẩn của i nguyên chất: μ* = μ0 + RTlnP i(T,P) i(T) 19 Tính chất của
▪ T,P=const: thế đẳng áp của hệ bằng tổng thế hóa của
các cấu tử tạo thành hệ G= G - G sp tg
G = - sp tg VD: aA + bB → dD + Ee
G = d + e – (a + b ) D E A B 20




