

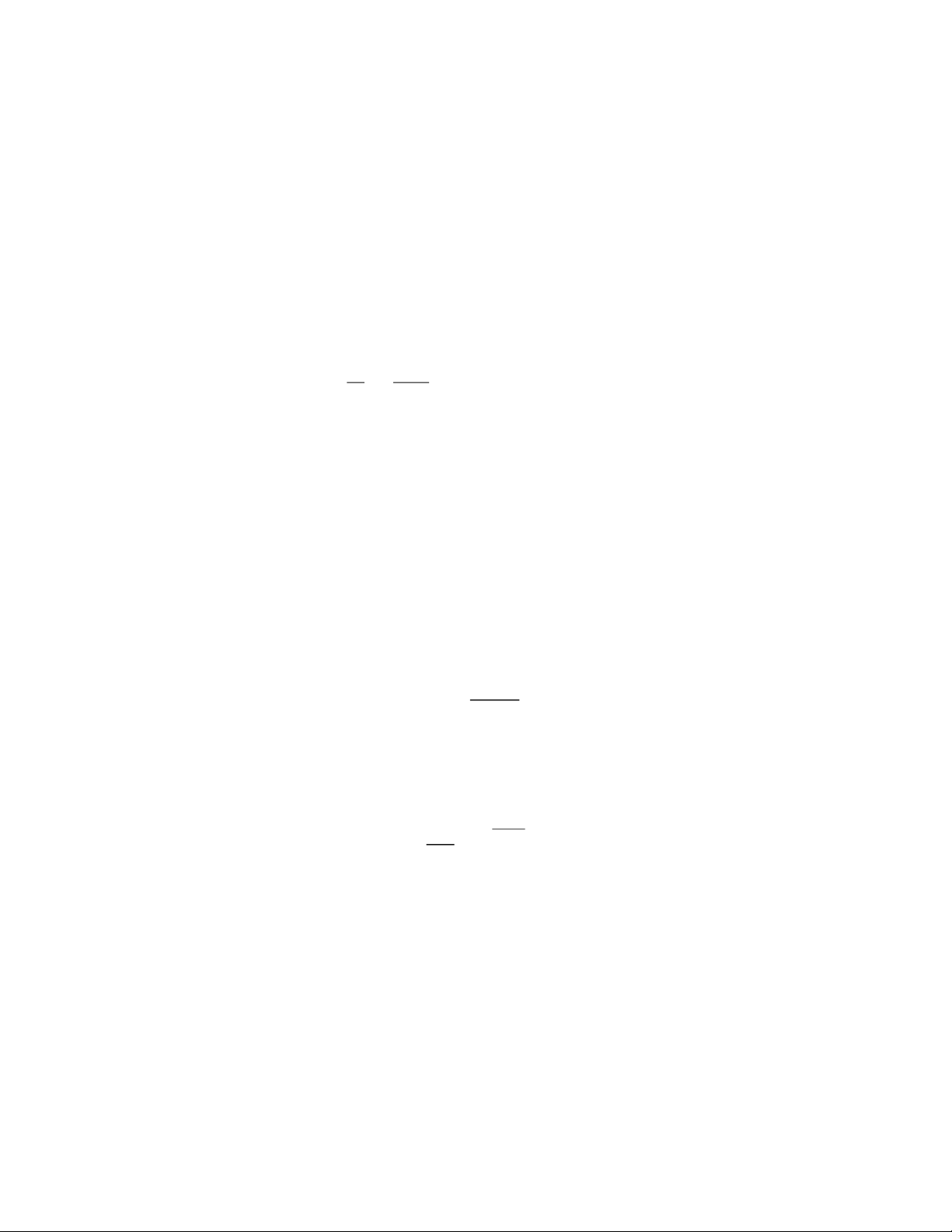

Preview text:
Chương I : ĐỘNG HỌC CÁC PHẢN ỨNG ĐƠN GIẢN VÀ PHỨC TẠP
1, Khái niệm về tốc độ phản ứng: VD: Xét phản ứng
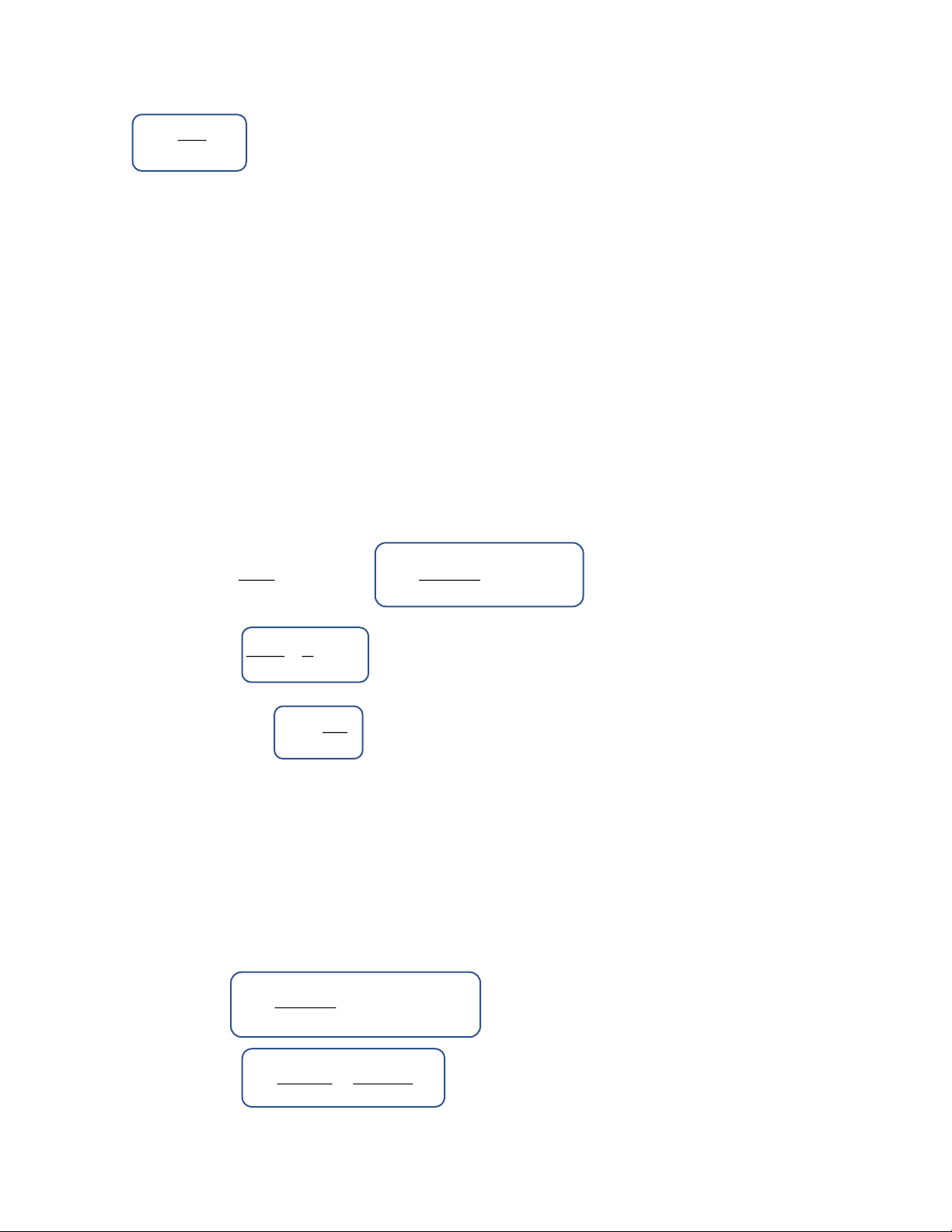
aA+ bB → dD +eE 1 d[A] 1 d[B] 1 d[D] 1 d[E]
Vận tốc chung của phản ứng: v = − = − = + = + chung a dt b dt d dt e dt (1)
Từ đó ta có thể suy luận được vận tốc theo từng chất của phản ứng như sau: d[A] d[B] v = = − . a v ;v = = − . b v A chung B chung dt dt d[D] d[E] v = = +d.v ;v = = + . e v D chung E chung dt dt v x y v = k A B
chung ta có thể xác định được từ biểu thức tác dụng khối lượng [ ] [ ] chung (2) 1 d[A] 1 d[B] 1 d[D] 1 d[E] Từ (1) và (2): v = − = − = + = +
= k[A]x[B]y chung a dt b dt d dt e dt
Trong đó: k: là hằng số tốc độ phản ứng chỉ phụ thuộc vào nhiệt độ, x,y là bậc đối với
chất A,B; x+y là bậc của phản ứng, x và y có thể bằng hoặc khác hệ số tỉ lượng (a, b)
2, Bậc và phân tử số của phản ứng
- Bậc của phản ứng: là tổng các lũy thừa nồng độ của các chất tham gia phản ứng
trong phương trình biểu diễn sự phụ thuộc của tốc độ phản ứng vào nồng độ chất pư.
- Phân tử số là hệ số tỉ lượng trong phản ứng hóa học.
- Phân tử số bao giờ cũng là một số nguyên, dương, bậc của phản ứng có thể là
nguyên hoặc phân số, dương, âm hoặc bằng 0.
3, Phản ứng đơn giản (pư sơ cấp)
Trong phản ứng đơn giản bậc phản ứng và phân tử số bằng nhau. VD:
Br2 → 2Br v = k .[Br2], bậc 1
I2 + H2 → 2HI v = k.[I2].[H2], bậc 2
2NO + O2 → 2NO2 v = k.[NO]2.[O2]
4, Động học các phản ứng đơn giản
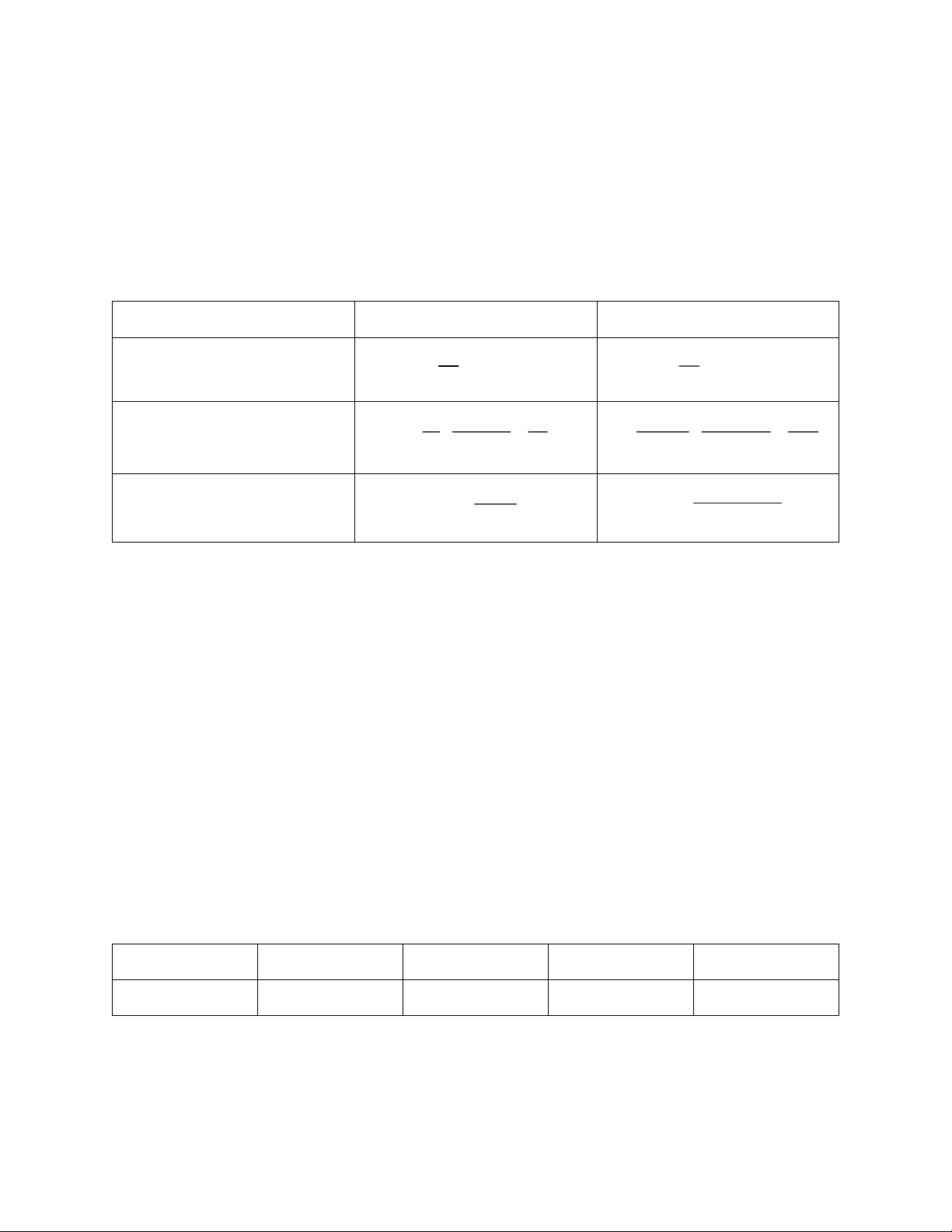
4.1 Phản ứng bậc 1: Xét phản ứng: A → sp t = 0 a
t = t a − x 1
Theo định nghĩa tốc độ phản ứng, định luật tác dụng khối lượng có: d[A]
d(a − x) v = − = k.[A] −
= k(a − x) dt dt
d(a − x)
= −k.dt ln(a − x) = −k.t + C a − x
Tại t = 0 thì x = 0 thay vào ta có: ln a = C
ln a = C ln(a − x) = −k.t + ln a ln a − ln(a − x) = k.t
ln a = k.t a − x
(3) Phương trình động học phản ứng bậc 1, dạng tích phân d[A] v = − = k.[A] dt
Phương trình động học phản ứng bậc 1, dạng vi phân
• Thời gian bán hủy t1/2 : là khoảng thời gian mà số phân tử giảm đi một nửa. a Tại t = t ln
= k.t ln 2 = k.t
1/2 thì x = a/2 thay vào (3) ta có: 1/2 a − a / 2 ln2 t = 1/2 k (4)
Thời gian bán hủy của phản ứng bậc 1. Nhận xét:
- t1/2 của phản ứng bậc 1 chỉ phụ thuộc vào h/s tốc độ phản ứng k, không phụ thuộc
vào nồng độ chất tham gia phản ứng.
- Đơn vị của hằng số k: s-1 4.2 Phản ứng bậc 2
a, Xét TH1: nồng độ đầu của 2 chất tham gia phản ứng bằng nhau a = b:
A + B → sp t = 0 a a
t = t a − x a − x 1 d[A]
d(a − x) Theo đ/n: 2 v = −
= k[A][B] v = −
= k(a − x) dt dt Bậc 2, dạng vi phân 1 1 Giải pt vi phân: − = k.t a − x a bậc 2, dạng tích phân. 1
Thời gian bán hủy: t = 1/2 k.a
, t1/2 phụ thuộc vào nồng độ đầu.
Đơn vị của hằng số k: L.mol-1s-1 b, trường hợp a ≠ b
A + B → sp t = 0 a b
t = t a − x b − x 1
d(a − x)
Dạng vi phân: v = −
= k(a − x)(b − x) dt 1 ( b a − x) Dạng tích phân: k = ln t(a − b) ( a b − x) 4.3 Bậc 3 và bậc n
Chỉ xét trường hợp nồng độ đầu các chất tham gia bằng nhau Bậc 3 Bậc n dx dx Dạng vi phân 3 v =
= k(a − x) v = = k a − x dt ( )n dt 1 1 1 1 1 1 Dạng tích phân k = − k = − 2 2 2t (a x) a − 1 − 1
(n −1)t (a − x)n n a − 3 n 1 2 − −1 t t = t = 1/2 1/2 2 2k.a 1/2 n 1
(n −1)k.a −
5. Các phương pháp xác định bậc phản ứng 5.1 Phương pháp thử
PP: Xác định nồng độ của các chất tham gia sau mỗi khoảng thời gian khác nhau. Thay
vào phương trình động học bậc 1, 2, 3,… để tính hằng số k. Phương trình nào cho các giá
trị k gần nhau nhất thì là bậc của phản ứng.
VD. Khi tiến hành phản ứng phân hủy acetone: CH3COCH3 → C2H4 + CO + H2
Áp suất tổng cộng biến đổi như sau: t (phút) 0 6,5 13 19,9 Ptổng (N.m-2) 41589,5 54386,6 65050,4 74914,6
Hãy xác định bậc phản ứng và tính hằng số tốc độ của phản ứng. Giải:
Các chất ở thể khí, áp suất riêng phần tỉ lệ với nồng độ (do V, T = const)
Gọi P0 là áp suất ban đầu của CH3COCH3, x là lượng CH3COCH3 giảm sau thời gian t1.
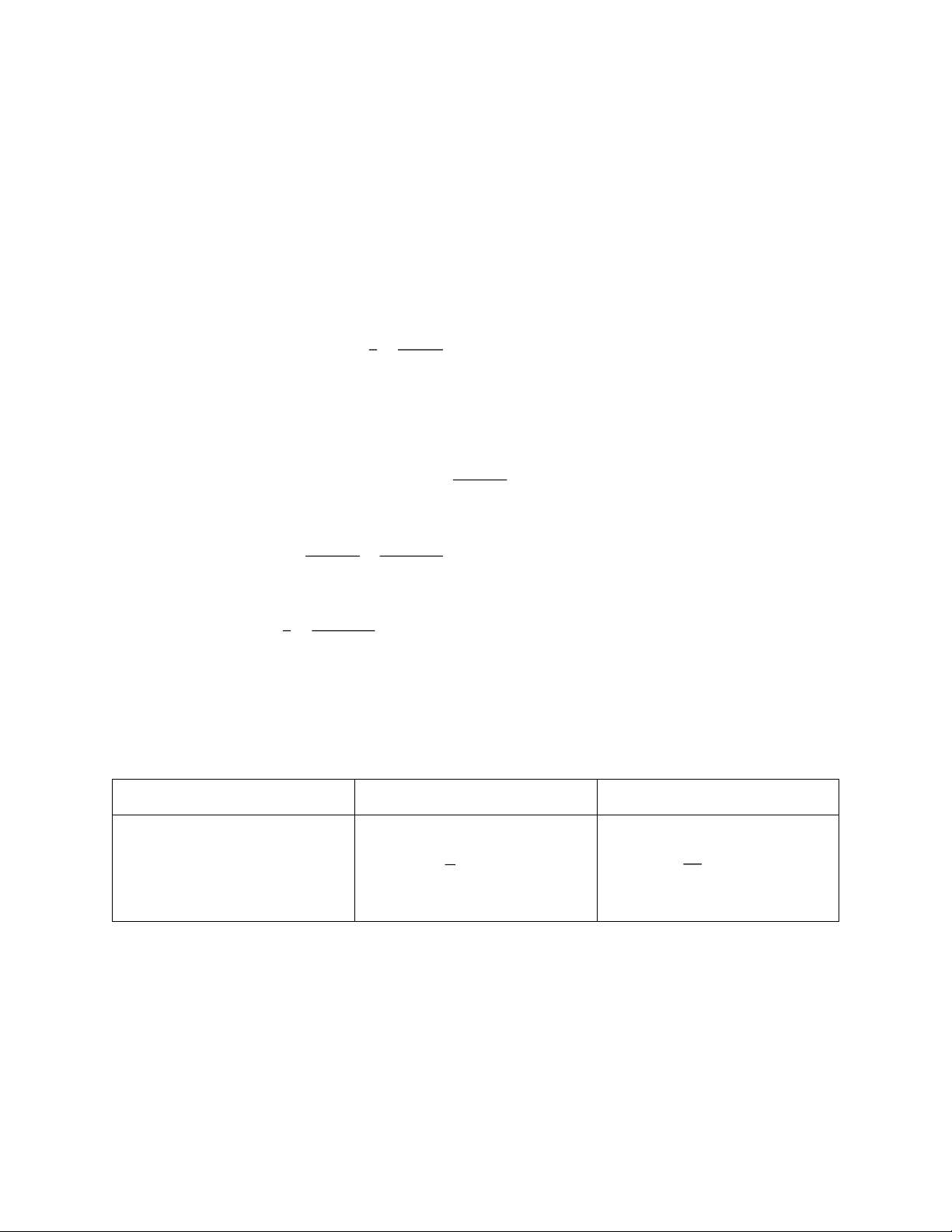
CH COCH → C H + CO + H 3 3 2 4 2 t = 0 P0 t = t P − x x x x 1 0 1 P
Giả sử là bậc 1. Biểu thức : 0 k = ln t P (*) − x 0
Ta có: t = 0 thì P0 = Ptổng = 41589,5 (N.m-2) P − P Tại 0
t = t P = P − x + 3x = P + 2x x = 1 0 0 2 P − P 3P − P Suy ra: 0 0
P = P − x = P − = 1 t 0 0 2 2 1 2P Thay vào (*) có: 0 k = ln t 3P . Thay vào, tính k − P
1,2,3 suy ra ktb = 0.0256 (s-1) 0
5.2 Phương pháp đồ thị Bậc 1 Bậc 2 Bậc 3
ln c = f (t) 1 1 = f (t) = f (t) c 2 c
Trong đó c là nồng độ chất tham gia tại các thời điểm khác nhau. Đồ thị nào cho dạng
đường thẳng thì chính hàm đó tương ứng với bậc của phản ứng, và từ đó suy ra hằng số
tốc độ phản ứng là k = tanα.
5.3 Phương pháp cô lập
PP: Thay đổi nồng độ 1 chất tham gia và giữ nguyên tất cả các chất tham gia còn lại, từ
đó đo tốc độ phản ứng để suy ra bậc từng chất tham gia, cuối cùng là bậc của cả phản ứng
Mô hình: = [ ]x[ ]y[ ]z v k A B C Giữ [B],[C] = const
t = t v = k.[ ] x
A [B]y[C]z v [A] x 1 1 1 t 1 1 t =
, từ đó tính được x
t = t v = k.[ ] x
A [B]y[C]z v [A] 2 2 2 t 2 t 2
Làm tương tự với chất B và C để tìm y, z từ đó bậc phản ứng : x + y + z.
6. Sự phụ thuộc của hằng số tốc độ phản ứng vào nhiệt độ. Năng lượng hoạt hóa
6.1 Quy tắc Van’t hoff:
Đối với phản ứng đồng thể trong khoảng nhiệt độ không lớn, Van’t Hoff đưa ra quy tắc
rằng khi tăng nhiệt độ lên 10 độ thì tốc độ phản ứng tăng từ 2 đến 4 lần. kT 10 + = k T
Trong đó γ là hệ số nhiệt độ của hằng số tốc độ phản ứng. Tổng quát: T −T 2 1 k 2T 10 = k 1 T
γ thường từ 2 đến 4.
Quy tắc van’t Hoff không áp dụng cho phản ứng dị thể và sinh hóa, do phản ứng dị thể
tăng rất chậm theo nhiệt độ và ngược lại, phản ứng sinh hóa tăng rất nhanh theo nhiệt độ.
6.2 Phương trình Arrhenius
- Định nghĩa NLHH E: là năng lượng tối thiểu cần cung cấp cho các tiểu phân để phản ứng có thể xảy ra. - Phương trình Arrhenius: − d ln k E a E Dạng vi phân: a = dạng tích phân: = . RT k A e 2 dT RT − − a E a E Có R 1 T R 2 k = . A e , k = . T A e
, giả sử Ea là hằng số trong khoảng nhiệt độ T1 – T2 ta có: 1 T 2 T − 1 1 a E k − k − T R T T T E 1 1 1 1 2 1 = e ln a = − k k R T T 2 T 2 T 1 2
Trong đó: Ea là năng lượng hoạt hóa của phản ứng (J/mol)
A là hằng số Arrhenius chỉ phụ thuộc vào bản chất của phản ứng
R là hằng số khí lý tưởng 8,314 (J/molK)
k là hằng số tốc độ phản ứng T là nhiệt độ oK
6.3 Ý nghĩa của năng lượng hoạt hóa:




