











Preview text:
Phần II: ĐIỆN HÓA HỌC Chương I:
SỰ DẪN ĐIỆN CỦA
DUNG DỊCH CHẤT ĐIỆN LY I. SỰ ĐIỆN LY
1. Chất điện ly và nguyên nhân của sự điện ly
vBằng chứng của sự tạo thành dung dịch điện ly:
ü Các dung dịch điện ly dẫn điện
ü Tính chất nồng độ của của dung dịch điện ly khác với các dung dịch phân tử Dung dịch phân tử Dung dịch điện ly
Độ tăng điểm sôi ∆Tb = Kb.Cm2 ∆Tb = i.Kb.Cm2
Độ hạ điểm nóng chảy ∆Tf = Kf.Cm2 ∆Tf = i.Kf.Cm2
Độ giảm áp suất hơi bão hòa ∆P = P1.x2 ∆P = i.P1.x2
Áp suất thẩm thấu π = C2.R.T π = i.C2.R.T
i: hệ số Van Hoff, i>1
Trong dung dịch, chất điện ly phân ly thành các ion
mang điện tích trái dấu I. SỰ ĐIỆN LY
1. Chất điện ly và nguyên nhân của sự điện ly
vBằng chứng của sự tạo thành dung dịch điện ly:
ü Các dung dịch điện ly dẫn điện
ü Tính chất nồng độ của của dung dịch điện ly khác với các dung dịch phân tử
VD: Điểm kết tinh của dung dịch K2SO4 0,4m trong nước là
-1,52oC. Coi hệ số Van't Hoff i không phụ thuộc nhiệt độ.
Tính áp suất hơi của dung dịch đó ở 25oC và nhiệt độ sôi ở 1 atm.
Biết: hằng số nghiệm lạnh của nước là 1,86
hằng số nghiệm sôi của nước là 1,51
áp suất hơi nước ở 25oC là 17,5 mmHg. I. SỰ ĐIỆN LY
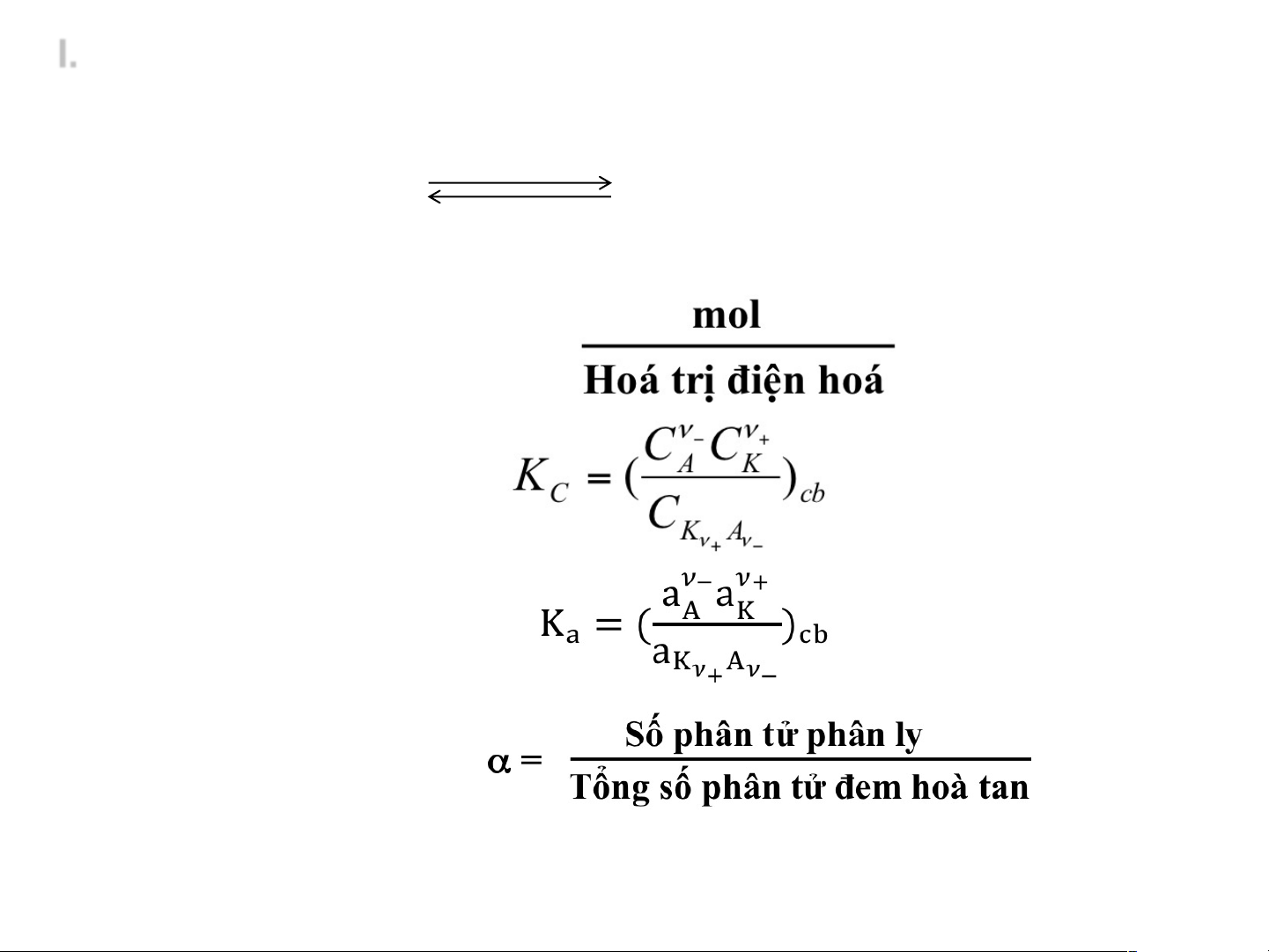
2. Các đại lượng đặc trưng cho sự điện ly Kn n +An- +Kz+ + n-Az-
v Hóa trị điện hóa: n+.z+=n-.|z-|=n
v Đương lượng gam = v Hằng số phân ly:
dung dịch lý tưởng dung dịch thực
v Độ phân ly a:
VD: tìm quan hệ giữa KC và a của chất điện ly 1 – 1 KA I. SỰ ĐIỆN LY
2. Các đại lượng đặc trưng cho sự điện ly Kn n +An-
+Kz+ + n-Az- (1)
v Hệ số Van’t Hoff
VD: Tìm quan hệ giữa i và a của cho cân bằng ion (1) I. SỰ ĐIỆN LY
3. Phân loại dung dịch điện ly
v Chất điện ly mạnh: là những chất phân ly hoàn toàn (a=1).
VD : axit mạnh, bazơ mạnh và và đại đa số muối.
v Chất điện ly yếu: là chất phân ly không hoàn toàn (a<1)
VD: axit và các bazơ hữu cơ, một số muối và HgCl2, Hg(CN)2, Fe(SCN)3, FeF3… I. SỰ ĐIỆN LY
4. Hoạt độ và hệ số hoạt độ của dung dịch điện ly Xét quá trình điện ly: K A n n + Kz+ + n - Az- + n -
Tương tác giữa các tiểu phân
Thế hóa học của ion i (âm hoặc dương)
Nếu dung dịch là lý tưởng: *
µ = µ + RT ln x (Trạng thái chuẩn: x i i i i = 1) *
µ = µ + RT ln m (Trạng thái chuẩn: m i i i i = 1) *
Nếu dung dịch thực: µ = µ + RT ln a i i i ai
ai = gi.mi è g i = mi
Hệ số hoạt độ của ion i I. SỰ ĐIỆN LY
4. Hoạt độ và hệ số hoạt độ của dung dịch điện ly Xét chất điện ly: K A n n+ Kz+ + n- Az- + n - Hoạt độ trung bình: a = ν ν ν a = ν a +a − ± K + − ν+ Aν − (n = n ν ν ++ n -)
Nồng độ molan trung bình:
m = ν m +m − ± + − Số ion trung bình: ν = ν νν+νν− ± + −
Hệ số hoạt độ trung bình: γ = ν γν+γν− ± + −
a± = m± .g± = m. n±.g± Ví dụ: NaCl a± = m. g± Na 3 4 2SO4 a± = .m. g±
II. LÝ THUYẾT TƯƠNG TÁC ION. CÂN BẰNG ION
1. Quy tắc thực nghiệm Lewis - Randall g± phụ thuộc vào: - Nồng độ ion Lực ion - Điện tích ion 1 I = m Z 2 ∑ 2 i i
VD: Hãy tính lực ion của dung dịch chứa 0,01m HCl và 0,09m CaCl2 1 I = (
" 1.10−2.12 +1.10−2.12)+ (9.10−2.22 + 9.10−2.11) 2 # $%= 0.28
II. LÝ THUYẾT TƯƠNG TÁC ION. CÂN BẰNG ION
Lesson > Topic 2: Ion interaction and Debye-Hückel Theory
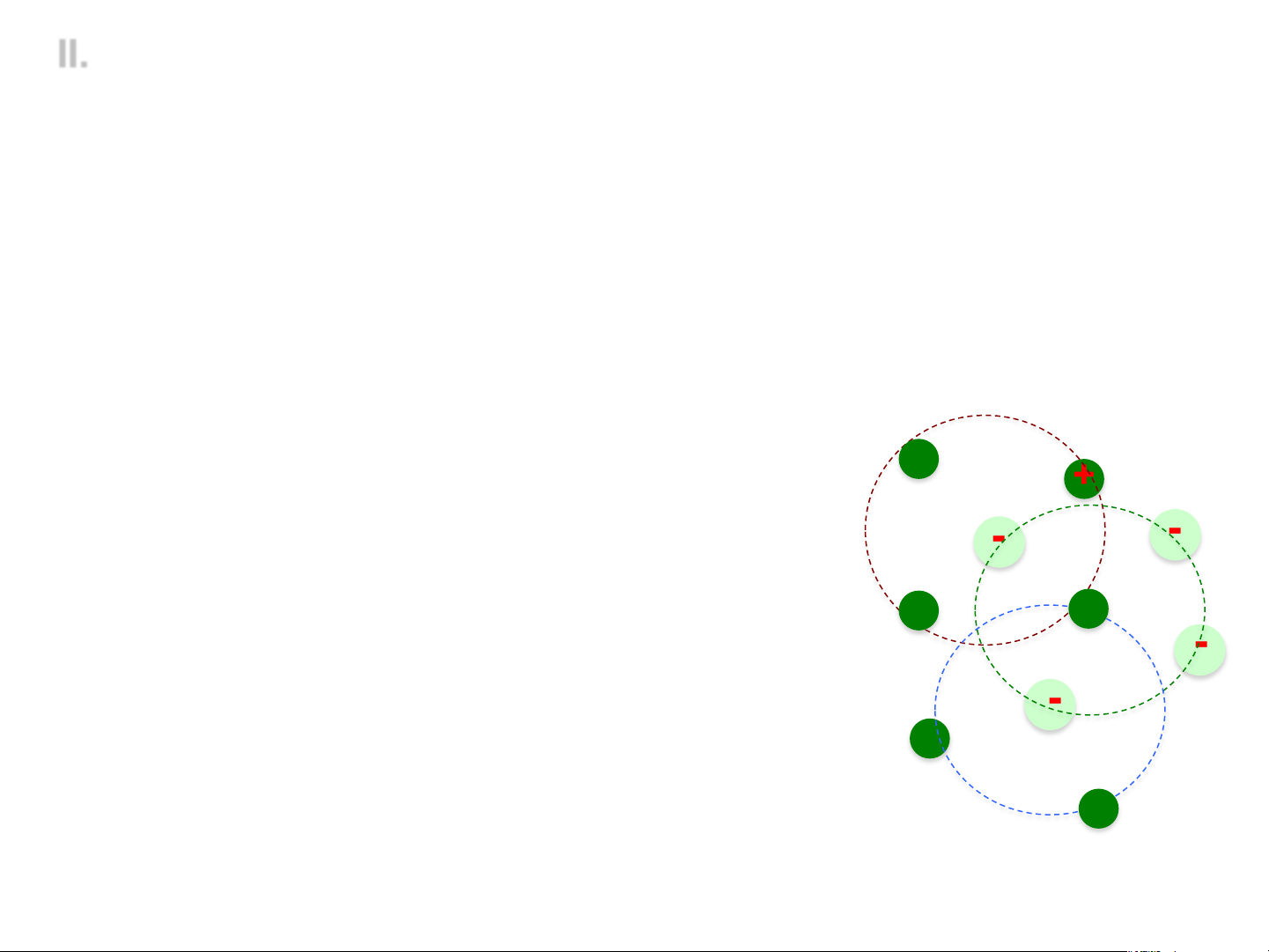
2. Thuyết Debye - Huckel
v Các yếu tố ảnh hưởng đến sự phân bố ion trong dung dịch:
- Lực tĩnh điện: è Sắp xếp trật tự
- Chuyển động nhiệt của ion è phá vỡ trật tự sắp xếp
v Bài toán: trên cơ sở tính được + +
năng lượng tương tác ion –
mây ion, ta cần xác định biến - -
thiên năng lượng Gibbs đặc + +
trưng cho sự sai khác so với -
trạng thái lý tưởng: - +
E º DG=µ thực ltưởng i -µi =RTlngI +
Mô hình mây ion trong dung dịch
II. LÝ THUYẾT TƯƠNG TÁC ION. CÂN BẰNG ION
2. Thuyết Debye - Huckel
v Lời giải phương trình Debye - Huckel: Nếu 0,02 < I < 0,2 A.Z 2 I A Z . . Z I logγ = − i logg = - + - i 1 ± + Ba I 1+ Ba I
Nếu dung môi là nước ở 298K:
A = 0.509 mol-1/2.kg-1/2 Ba = 1
Trong dung dịch loãng (I < 0,02):
logγ = −AZ 2 I i i
logγ = −A.Z . Z . I ± + −
II. LÝ THUYẾT TƯƠNG TÁC ION. CÂN BẰNG ION 3. Cân bằng ion
v Cân bằng ion đồng thể:
Ví dụ: xét sự phân ly của axit yếu HA trong nước HA + H2O A- + H3O+ æ a . + a - ö H O A K = ç g 2 3 ÷ ± a ç = K a a ÷ . C g HA H O è 2 øcb HA
VD: Hằng số phân ly của axit axetic là Ka=1,75.10-5 (ở 25oC). Tính độ
phân ly a của dung dịch axit axetic 0,01M có chứa NaCl nồng độ 0,01M . Cho biết:
- Hệ số hoạt độ tính theo phương trình Debye – Huckel
- Coi nồng độ H+ và CH3COO- không đáng kể so với nồng độ Na+ và Cl-
- Hệ số hoạt độ của axit axetic không phân ly là 1)
II. LÝ THUYẾT TƯƠNG TÁC ION. CÂN BẰNG ION 3. Cân bằng ion
v Cân bằng ion dị thể:
Ví dụ: xét sự phân ly của AgCl AgCl Ag+ + Cl- æ a . + a - ö Ag Cl K = ç ÷ = ( a a . ) a ç + - a ÷ Ag Cl cb AgCl è ø r cb
VD: độ tan của Ba(IO3)2 trong nước ở 25oC là 8.10-4 mol/lit.
Tính độ hòa tan của muối này trong:
a – dung dịch Ba(NO3)2 0,03M b – dung dịch KNO3 0,01 M
III. SỰ DẪN ĐIỆN CỦA DUNG DỊCH CHẤT ĐIỆN LY
1. Các loại độ dẫn điện 1 Ohm-1 hoặc Siemens v Độ dẫn điện L = R (Ω-1 hoặc S) 1 ℓ ℓ
v Độ dẫn điện riêng χ = . = L. (Ω-1.cm-1 hoặc S.cm-1) R S S χ
v Độ dẫn điện đương λ = .103 (Ω-1.cm2.đlg-1 N lượng CN hoặc S.cm2.đlg-1) χ
v Độ dẫn điện mol λ = .103 (Ω-1.cm2.mol-1 M C hoặc S.cm2.mol-1) M
III. SỰ DẪN ĐIỆN CỦA DUNG DỊCH CHẤT ĐIỆN LY 2. Linh độ ion v v Khái niệm u = i cm.s−1 i ( hoặc cm2.V-1.s-1) E V.cm−1
Tốc độ chuyển động của ion khi cường độ điện trường E=1
v Mối liên hệ giữa ui và λN ü Chất điện ly mạnh:
λ = λ+ + λ- = F(u+ + u-) ü Chất điện ly yếu:
λ = α(λ+ + λ-) = F α(u+ + u-) Nếu C → 0 thì λ → λ λ ∞ α = λ∞
III. SỰ DẪN ĐIỆN CỦA DUNG DỊCH CHẤT ĐIỆN LY
3. Các yếu tố ảnh hưởng tới độ dẫn điện v Nồng độ
ü Khi nồng độ tăng à linh độ
ion giảm à độ dẫn điện đương lượng giảm
ü Khi nồng độ vô cùng loãng à
Chất điện ly mạnh
linh độ ion là cực đại à độ
dẫn điện đương lượng là cực.
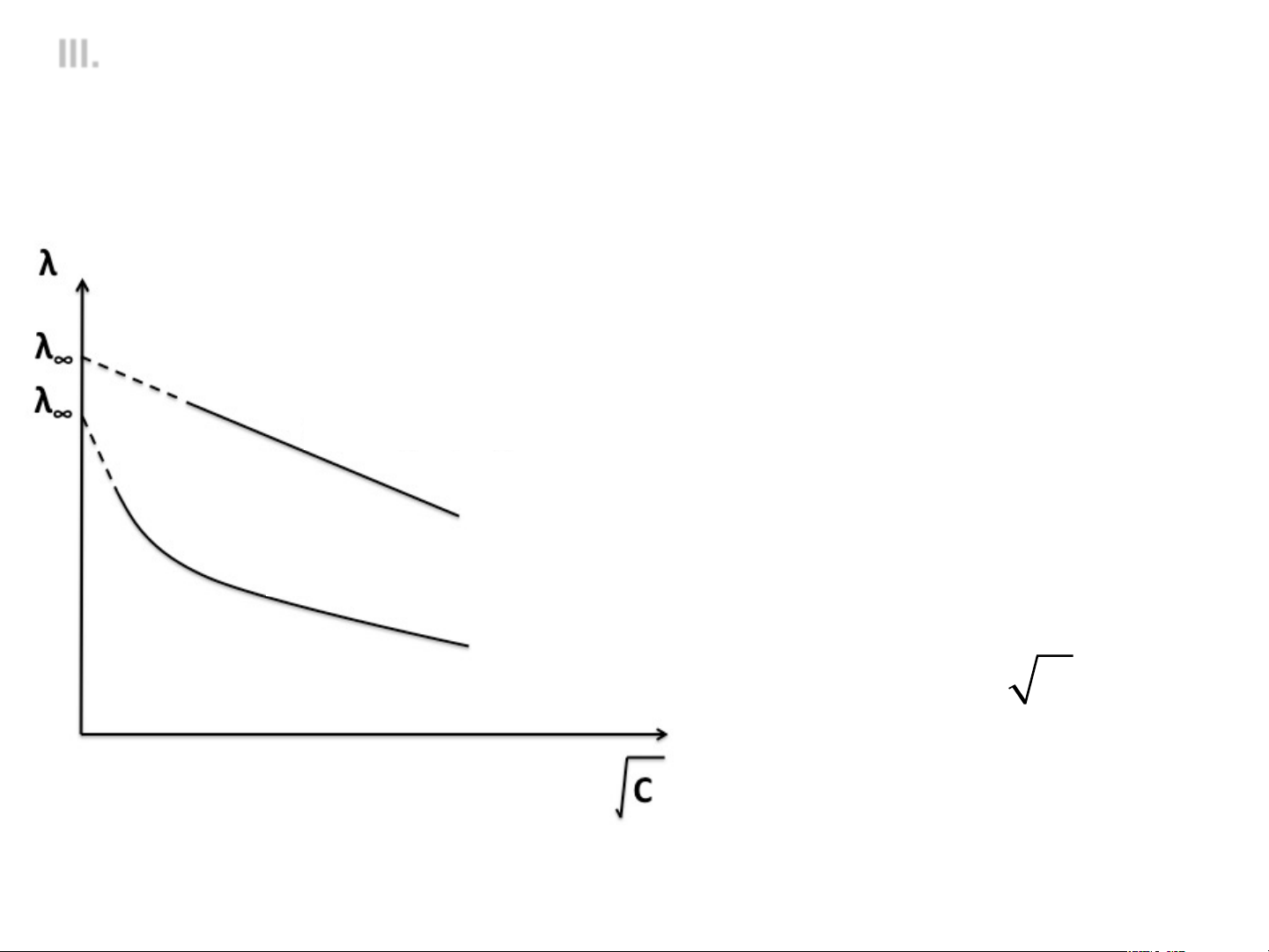
ü Đối với dung dịch chất điện ly Chất điện ly yếu mạnh: λ = λ − a C ∞
(Phương trình Kohlrausch)
Đồ thị biểu diễn sự phụ thuộc của
độ dẫn điện đương lượng vào nồng
độ dung dịch chất điện ly
III. SỰ DẪN ĐIỆN CỦA DUNG DỊCH CHẤT ĐIỆN LY
4. Ứng dụng của phép đo độ dẫn điện
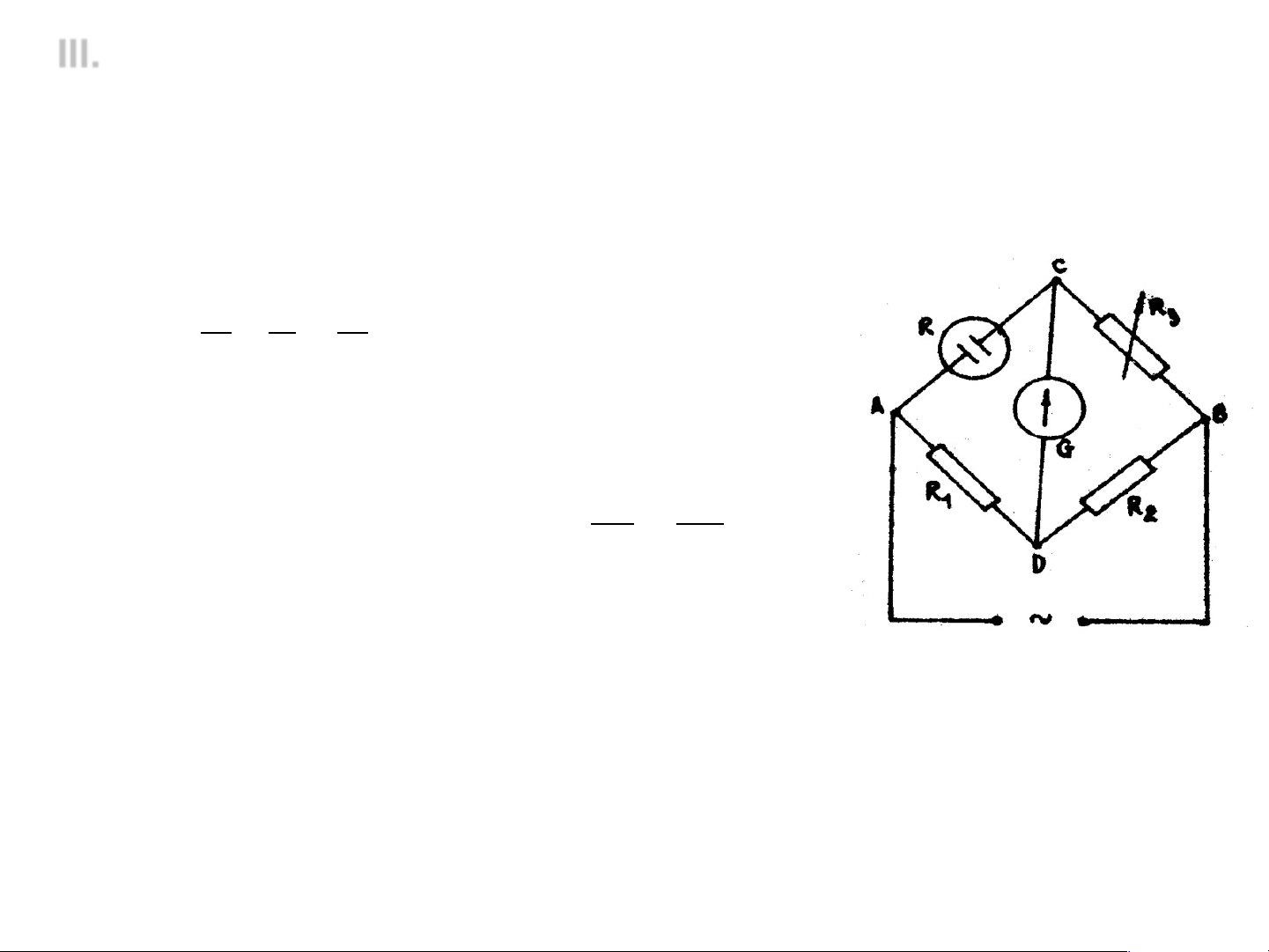
v Phép đo độ dẫn điện 1 ℓ B χ = × = R S R
Xác định R: Từ mạch cầu Wheatstone Khi mạch cầu cân bằng: R R = 3 iG = 0 à R R 1 2
Xác định B: Đo R của một dung dịch điện ly đã biết trước độ dẫn điện riêng
III. SỰ DẪN ĐIỆN CỦA DUNG DỊCH CHẤT ĐIỆN LY
4. Ứng dụng của phép đo độ dẫn điện
v Xác định l∞
Đối với dung dịch chất điện ly mạnh:
- Đo l của các dung dịch ở các nồng độ khác nhau
- Ngoại suy l đến giá trị C = 0 để xác định giá trị l∞
Đối với dung dịch chất điện ly yếu: l∞ = l∞ + + l∞ -
VD: Trộn dung dịch CH3COONa 0,1M và HCl 0,2M theo tỉ lệ thể tích
1:1 được dung dịch A. Tính độ dẫn điện riêng của dung dịch A.
Cho biết độ dẫn điện đương lượng (ứng với đlg/lit) lNaCl = 126 và lHCl
= 426 (S.cm2.đlg-1) và coi rằng các độ dẫn điện đương lượng này
không phụ thuộc vào nồng độ.
III. SỰ DẪN ĐIỆN CỦA DUNG DỊCH CHẤT ĐIỆN LY
4. Ứng dụng của phép đo độ dẫn điện
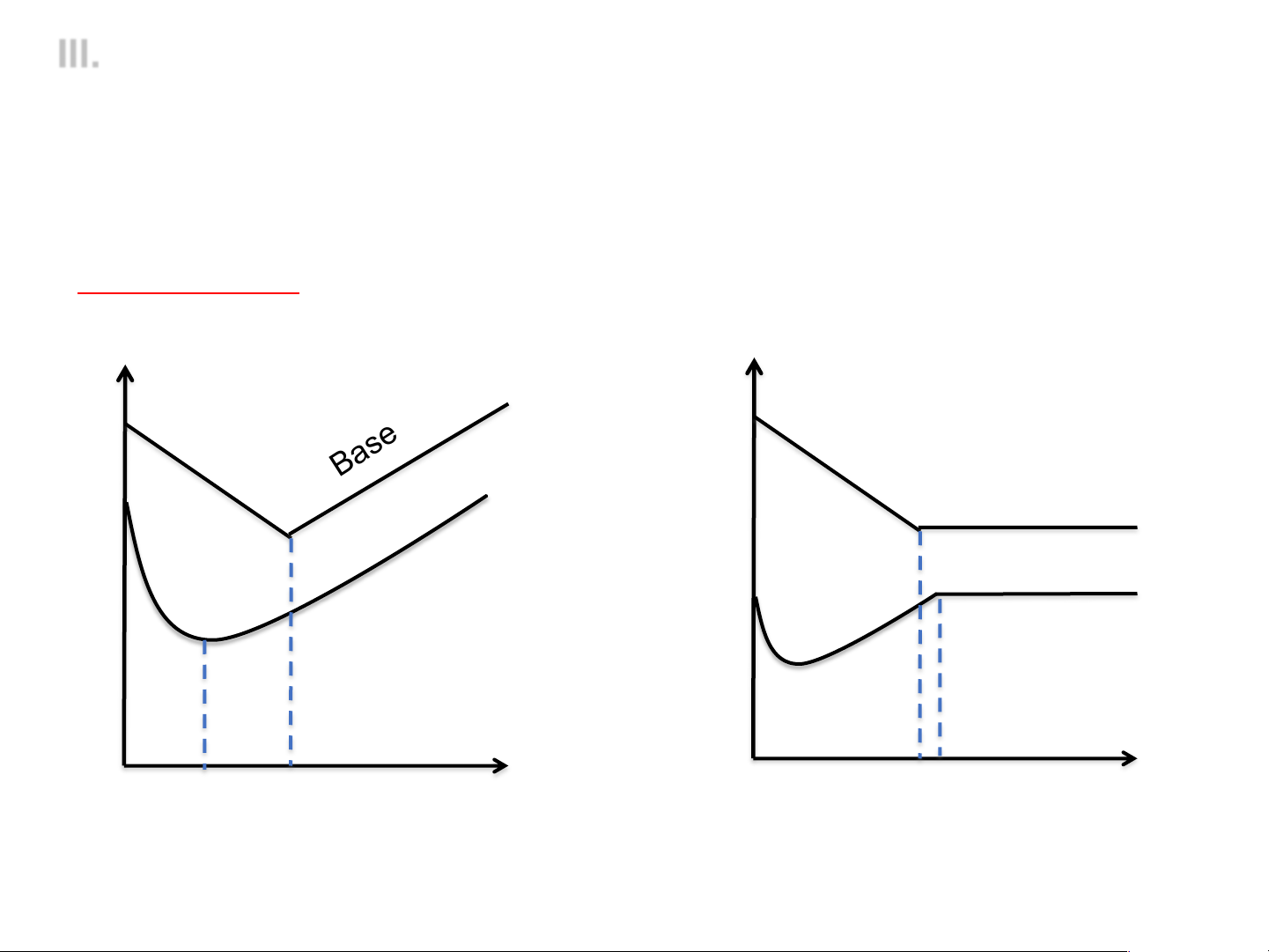
v Chuẩn độ dẫn điện
Nguyên tắc: quan sát sự biến đổi độ dẫn điện trong quá trình
chuẩn độ để xác định điểm tương đương L A L A ci nh ci (Ω-1) d d mạ mạ (Ω-1) mạ nh Base nh Base yếu nh Base mạ Base yếu Acid yế u Acid yếu Thể tích base (ml)
Thể tích của base (ml)
Chuẩn độ acid bằng base mạnh
Chuẩn độ acid bằng base yếu




