












Preview text:
LOGO HÓA LÝ I
TS. Nguyễn Thị Tuyết Mai
Bộ môn Hóa lý, Viện Kỹ thuật Hóa học
Trường Đại học Bách Khoa Hà Nội
Email: mai.nguyenthituyet1@hust.edu.vn 1 Chương 2. CH3051 CÂN BẰNG HÓA HỌC HÓA LÝ I
1. Khái niệm về cân bằng hóa học. Hằng số cân bằng
2. Phương trình đẳng nhiệt Van’t – Hoff.
3. Mối liên hệ giữa các cách biểu diễn hằng số cân bằng
4. Cân bằng hóa học của các phản ứng dị thể
5. Cân bằng hóa học trong hệ thực
6. Các yếu tố ảnh hưởng đến cân bằng hóa học
7. Các phương pháp xác định hằng số cân bằng 2 Chương 2. CH3051 CÂN BẰNG HÓA HỌC HÓA LÝ I
1. Khái niệm về cân bằng hóa học. Hằng số cân bằng
2. Phương trình đẳng nhiệt Van’t – Hoff.
3. Mối liên hệ giữa các cách biểu diễn hằng số cân bằng
4. Cân bằng hóa học của các phản ứng dị thể
5. Cân bằng hóa học trong hệ thực
6. Các yếu tố ảnh hưởng đến cân bằng hóa học
7. Các phương pháp xác định hằng số cân bằng 3 Định nghĩa Chemical equilibrium CBHH and equilibrium constant
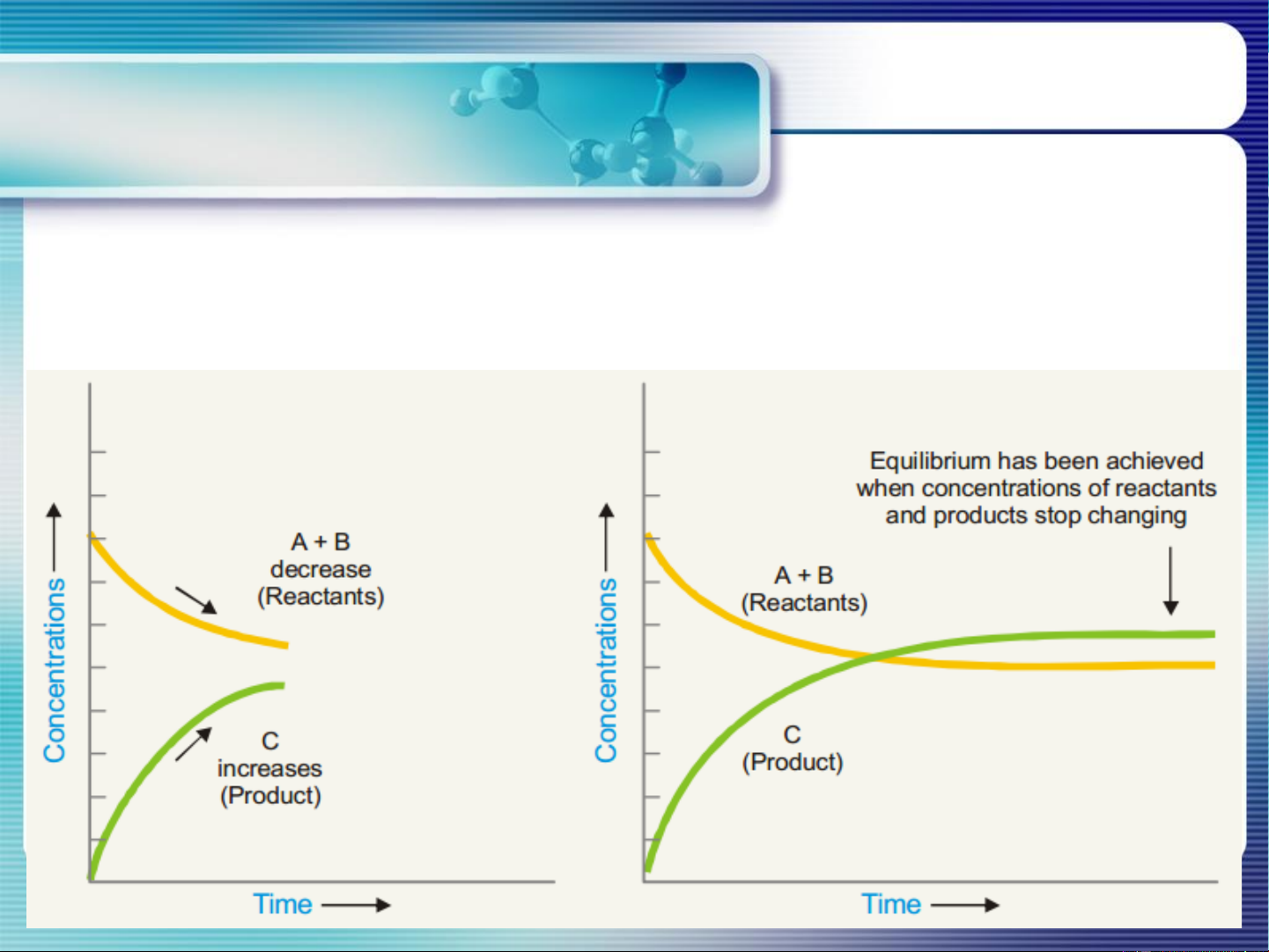
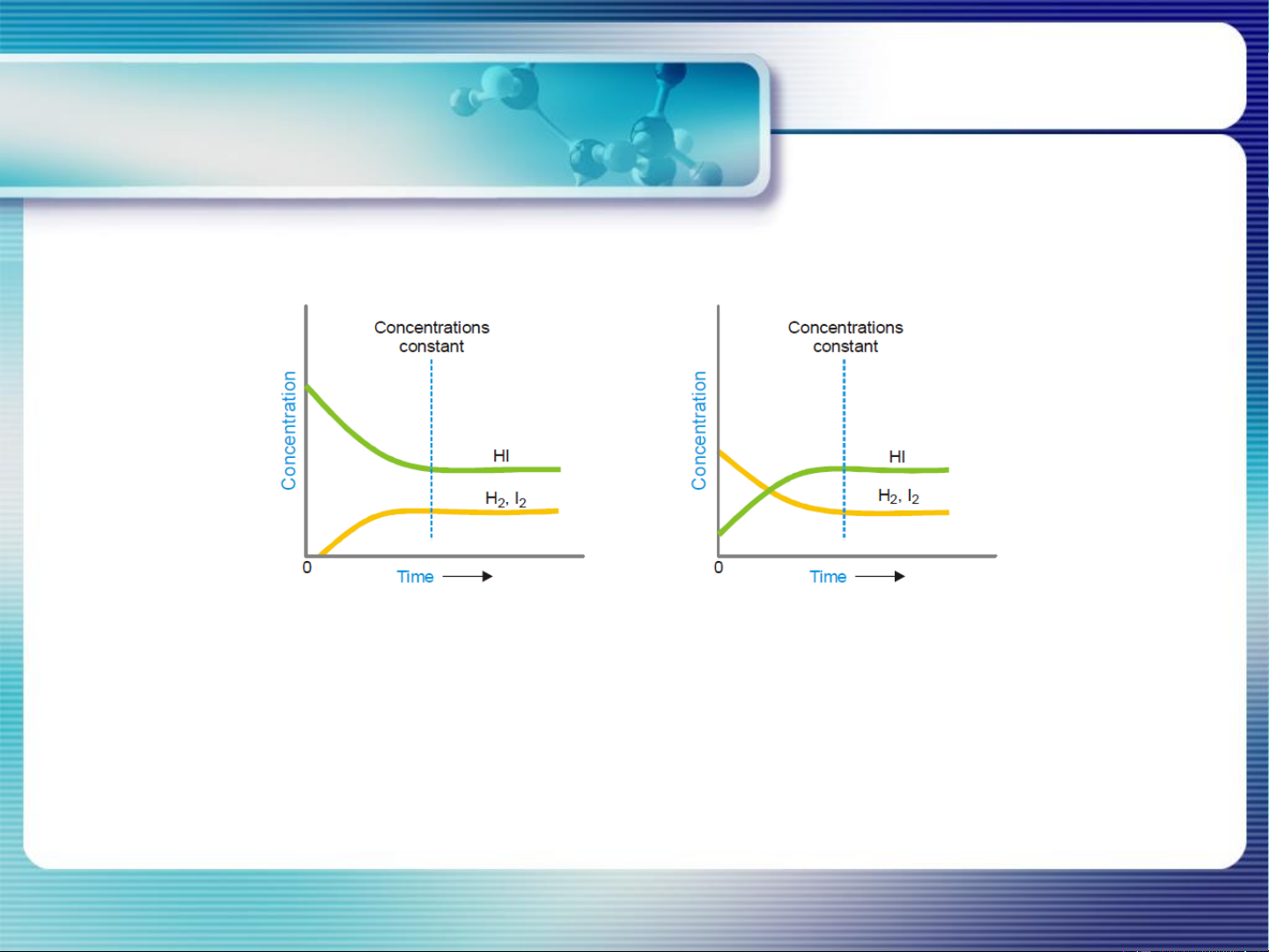
Là trạng thái mà tại đó tốc độ pư thuận = tốc độ phản ứng nghịch và
thành phần của hệ phản ứng không thay đổi theo thời gian khi điều
kiện bên ngoài không đổi
Đặc điểm của CBHH
• Tính 2 chiều: TTCB được thiết lập từ 2 phía.
• Tính bất biến: không thay đổi theo thời gian
• Tính linh động: CB bền (hết tác động, hệ trở về TTCB ban đầu);
CB không bền (hết tác động, hệ không quay về TTCB ban đầu)
• Tính chất động: TTCB có thể thay đổi khi các ytố bên ngoài thay đổi 5
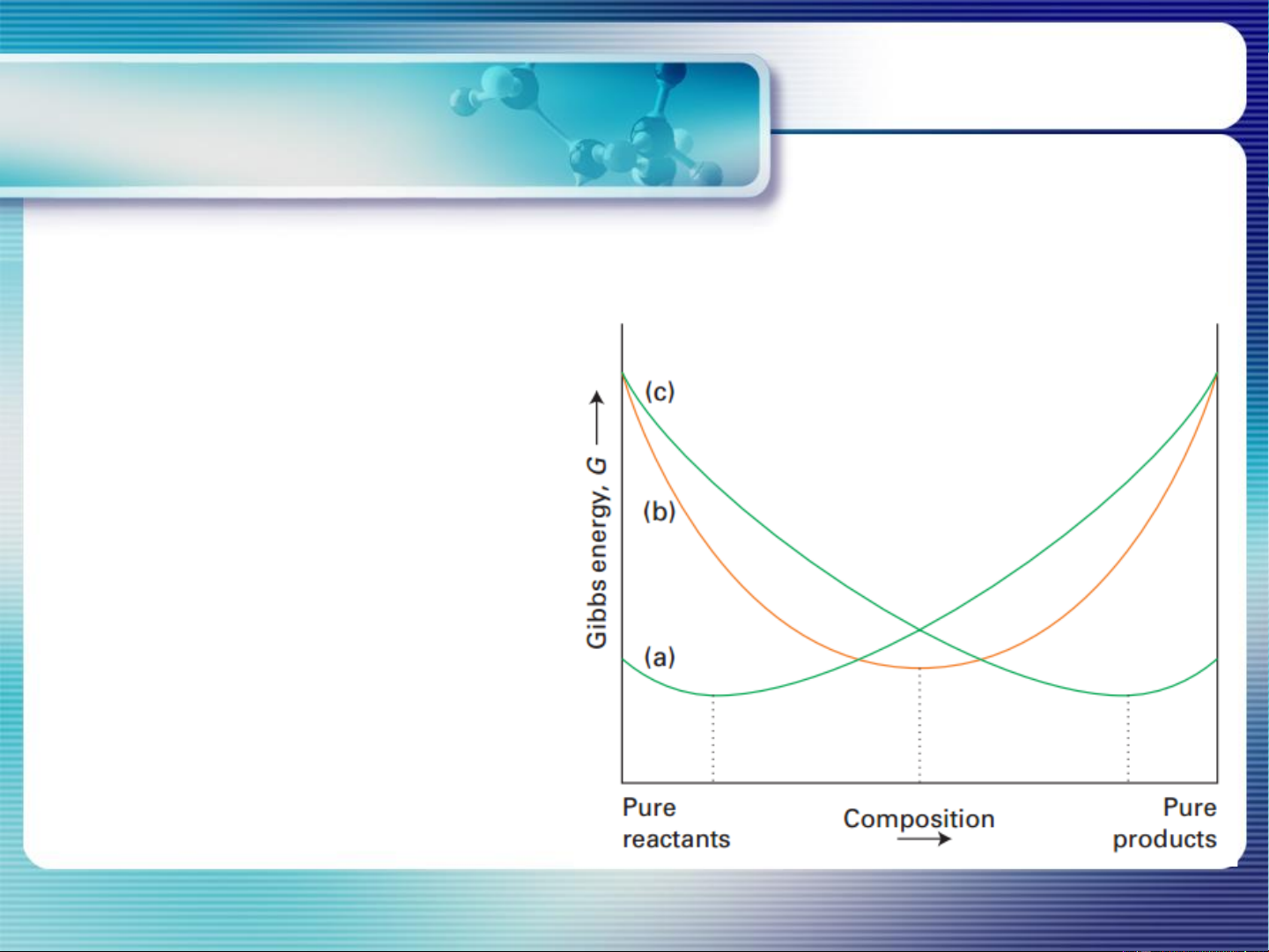
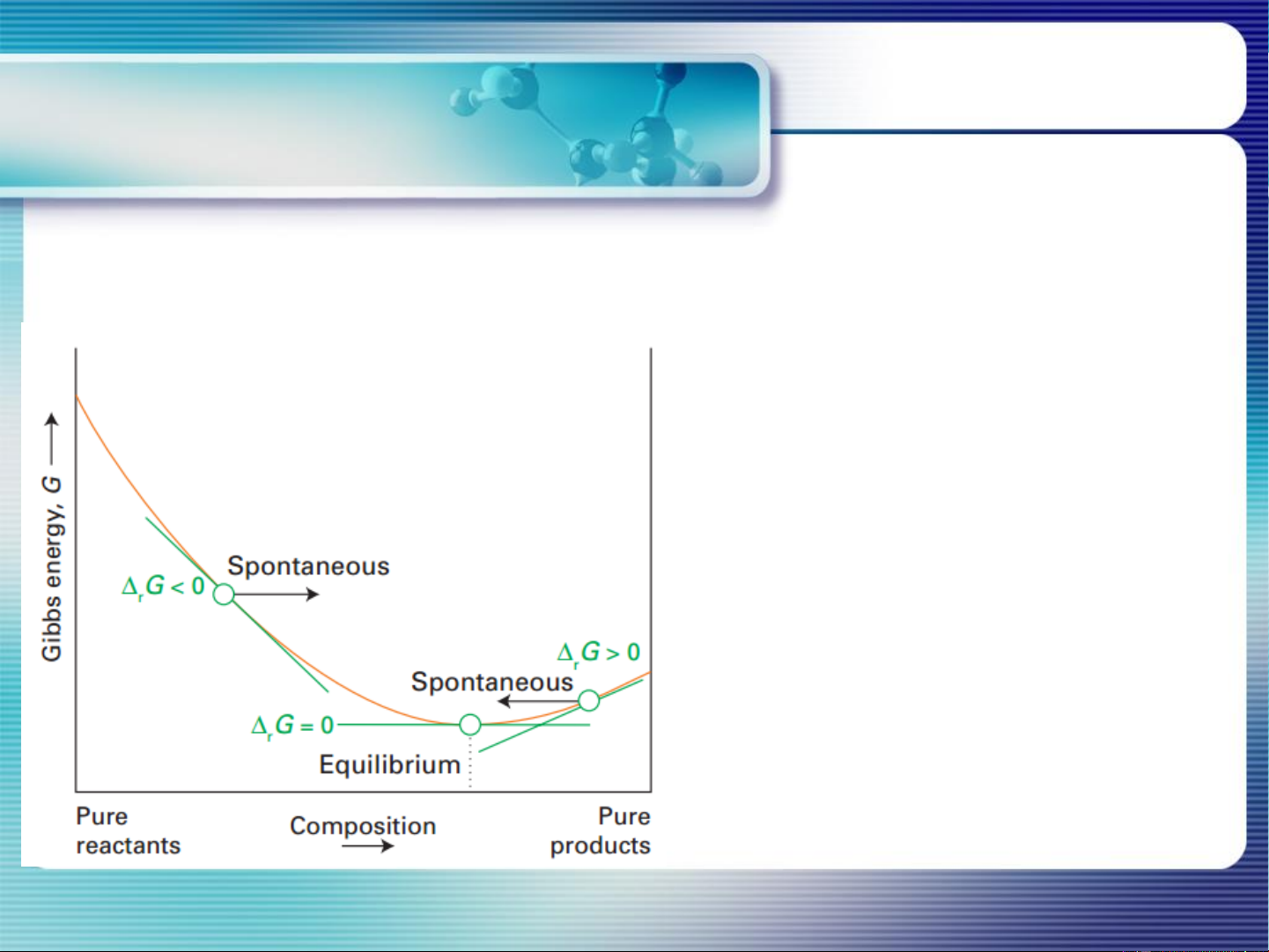
Điều kiện CB của pư hóa học Chemical equilibrium and equilibrium constant T, P=const,
Hỗn hợp pư có xu hướng
diễn ra theo chiều làm giảm
G, cho tới khi G đạt cực tiểu.
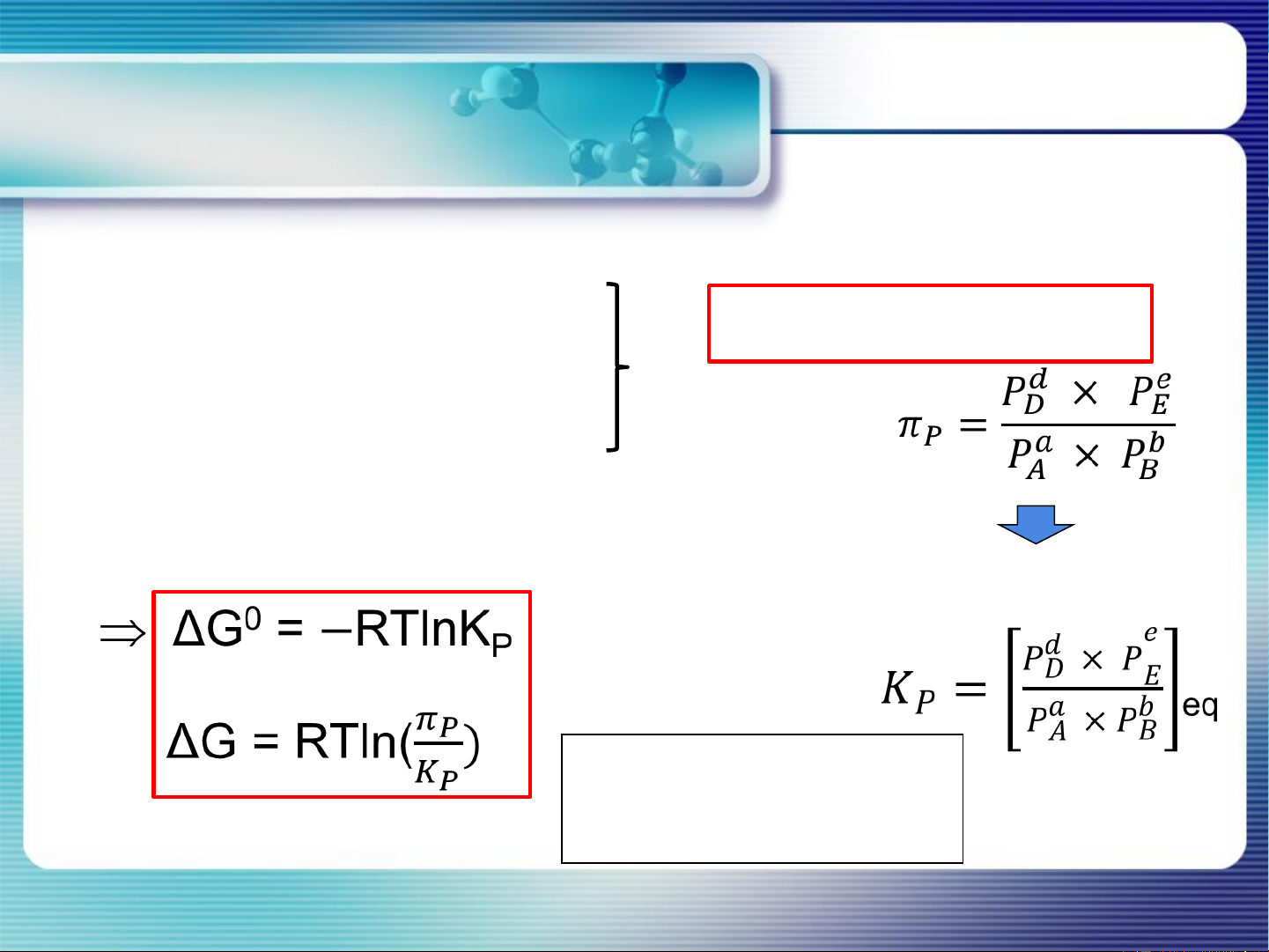
Điều kiện pư tự xảy ra: ΔG<0 6 Điều kiện Chemical equilibrium CB của pư hóa học and equilibrium constant Điều kiện CB của pư (T, P =const): ΔG=0 7 Hằng số Chemical equilibrium CB and equilibrium constant aA + bB dD + eE
(1) ΔG=(dμ +eμ ) −(aμ +bμ ) D E A B ΔG= ΔG0 + RTlnP
(2) ΔGo=(dμo +eμo ) −(aμo +bμo ) D E A B (3) μ =μo +RTlnP J J J
Điều kiện CB của pư: ΔG =0 HSCB R = 8,314 J/(mol.K) = 1,987 cal/(mol.K)
PT đẳng nhiệt Van’t Hoff = 0,082 atm.L/(mol.K) 8 Chemical equilibrium
PT đẳng nhiệt Van’t Hoff and equilibrium constant
< K G < 0 pư xảy ra theo chiều thuận, sp chiếm ưu thế P P
> K G > 0 chất tham gia chiếm ưu thế trong hỗn hợp pư P P
= K G = 0 pư đạt CB, nồng độ các chất không đổi P P Tại TTCB: Go = − RTlnKP
Go <0 K >1 phản ứng tự xảy ra theo chiều thuận P
Go >0 K <1 phản ứng tự xảy ra theo chiều nghịch P
Go =0 K =1 phản ứng đạt CB P 9 Chemical equilibrium BT and equilibrium constant
Cho phản ứng N (k) + H (k) = NH (k) 2 2 3
Biết 𝐺𝑜 của phản ứng tạo 298
thành NH (k) là −16.5 kJ.mol−1. 3
Tính biến thiên năng lượng tự do Gibbs của phản ứng trên nếu
áp suất riêng phần của N , H , và NH (coi là khí lý tưởng) lần 2 2 3
lượt là 3 atm, 1 atm, và 4 atm?
Phản ứng tự diễn ra theo chiều nào? 10 BT
Cho phản ứng: N O (k) = 2NO (k) 2 4 2 a. Tính 𝐺𝑜
của phản ứng biết 𝑜 của 298 𝐺298,𝑠 NO và N O 2 2 4
lần lượt là 51,25 và 97,787 kJ/mol.
b. Tính K tại 298 K. Nhận xét chiều của pư P
c. Tính toán thành phần CB khi biết hệ ban đầu gồm 1mol
N O chứa trong bình có thể tích V = 24,46 L ở 298 K 2 4 11 Chương 2. CH3051 CÂN BẰNG HÓA HỌC HÓA LÝ I
1. Khái niệm về cân bằng hóa học. Hằng số cân bằng
2. Phương trình đẳng nhiệt Van’t – Hoff.
3. Mối liên hệ giữa các cách biểu diễn hằng số cân bằng
4. Cân bằng hóa học của các phản ứng dị thể
5. Cân bằng hóa học trong hệ thực
6. Các yếu tố ảnh hưởng đến cân bằng hóa học
7. Các phương pháp xác định hằng số cân bằng 12
Các cách biểu diễn HSCB Chemical equilibrium and equilibrium constant aA +bB dD + eE x = n /n i i
Pư đồng thể ở pha khí: K , K n P pha lỏng: K , K n c pha rắn: K , K n x 13 Mối Chemical equilibrium
liên hệ giữa các HSCB and equilibrium constant K vs K P C P V = n RT P = (n RT)/V = C RT i i i i i (𝐶 𝐾
𝐷𝑅𝑇)𝑑 × (𝐶𝐸 𝑅𝑇)𝑒 𝑃 = 𝑒𝑞 = 𝐾 (𝐶
𝐶 × (𝑅𝑇) 𝑑+𝑒−𝑎−𝑏 = 𝐾𝐶 × (𝑅𝑇)𝑛
𝐴𝑅𝑇)𝑎 × (𝐶𝐵𝑅𝑇)𝑏
𝐾𝑃= 𝐾𝐶 × (𝑅𝑇)𝑛
n: biến thiên số mol theo ptpư n = (d+e) – (a+b) 14 Mối Chemical equilibrium
liên hệ giữa các HSCB and equilibrium constant K vs K and K P x n P V = n RT i i P : as riêng phần i PV = nRT P : as tổng cộng 𝑃 𝑛 𝑛 𝑖 = 𝑖 = 𝑥 𝑃 𝑖 𝑖 𝑖= 𝑃 𝑃 𝑛 𝑛 P = P. x K = K . Pn K = K . (P/n)n i i P x P n K & K phụ thuộc vào T P C
K phụ thuộc vào T và P x
K phụ thuộc vào T, P & n n 15 Mối Chemical equilibrium
liên hệ giữa các HSCB and equilibrium constant Nếu n = 0: K = K = K = K P C x n
VD: CH COOC H + H O = CH COOH + C H OH 3 2 5 2 3 2 5 Chú ý: N (k) + 3H (k) = 2NH (k) K 2 2 3 1
½ N (k) + 3/2 H (k) = NH (k) K 2 2 3 2 K = K 2 1 2 16 Chemical equilibrium BT and equilibrium constant
Cho phản ứng: N (k) + O (k) = 2 NO(k) 2 2
Áp suất ban đầu của N là 0,1 atm; của O là 0,2 atm 2 2
Biết K = 3.4 ×10−21 ở 800 K. P
Tính áp suất riêng phần của NO tại CB? Tính Kn [ĐS:8,2 atm] 17 Chemical equilibrium BT and equilibrium constant Xét pư thủy phân:
CH COOC H + H O = CH COOH + C H OH 3 2 5 2 3 2 5 Nếu lúc đầu, n = n
, thì khi CB có 1/3 lượng este bị thủy phân este H2O a. Tính HSCB của pư
b. Tính độ chuyển hóa của este nếu: n = 10.n este H2O
c. Tính tỉ lệ mol giữa nước và este đẻ khi CB có 99% este bị thủy phân. 18 Chương 2. CH3051 CÂN BẰNG HÓA HỌC HÓA LÝ I
1. Khái niệm về cân bằng hóa học. Hằng số cân bằng
2. Phương trình đẳng nhiệt Van’t – Hoff.
3. Mối liên hệ giữa các cách biểu diễn hằng số cân bằng
4. Cân bằng hóa học của các phản ứng dị thể
5. Cân bằng hóa học trong hệ thực
6. Các yếu tố ảnh hưởng đến cân bằng hóa học
7. Các phương pháp xác định hằng số cân bằng 19
HSCB của qtr dị thể PHYSICAL CHEMISTRY 1 Chemical equilibrium HSCB ? G = ? G = + - CaO CO2 CaCO3 = (* + RTlnx ) + (o + RTlnP ) CaO CaO CO2 CO2 - (* + RTlnx ) CaCO3s CaCO3 = (* + o - * ) + RTln [(x P )/x ] CaO CO2 CaCO3 CaO CO2 CaCO3 G = G o + RTln [(x P )/x ] CaO CO2 CaCO3 20




