
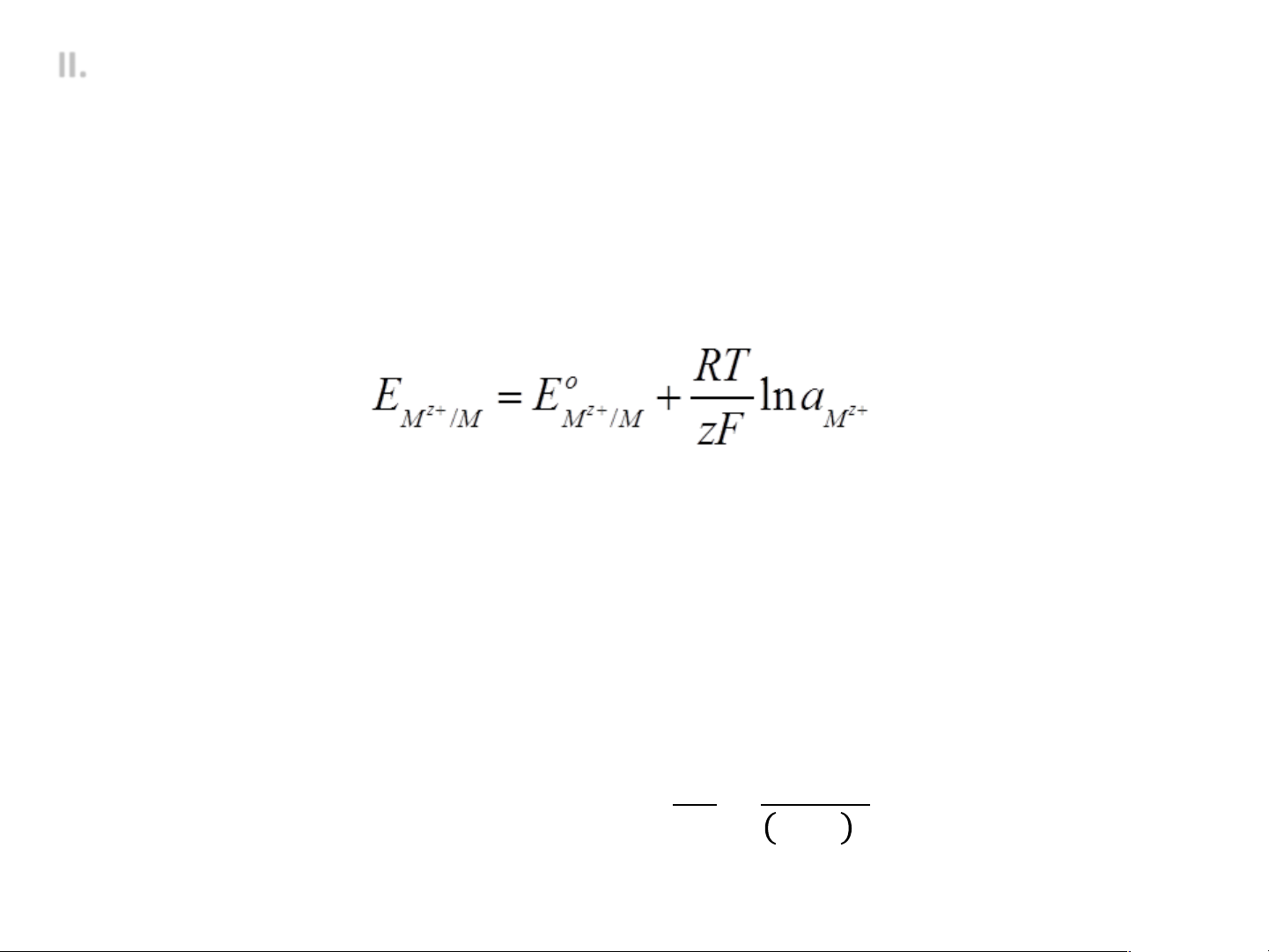





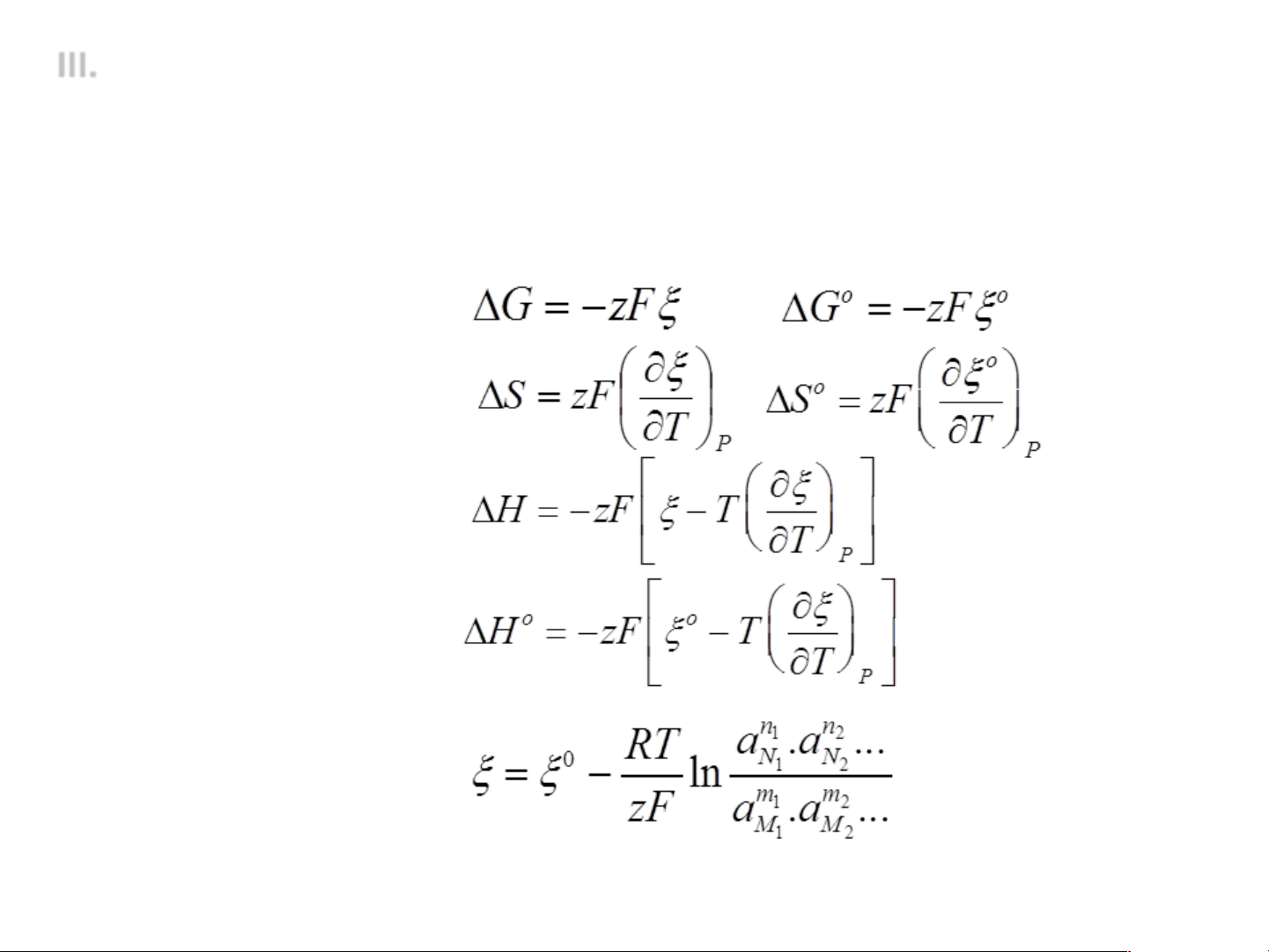

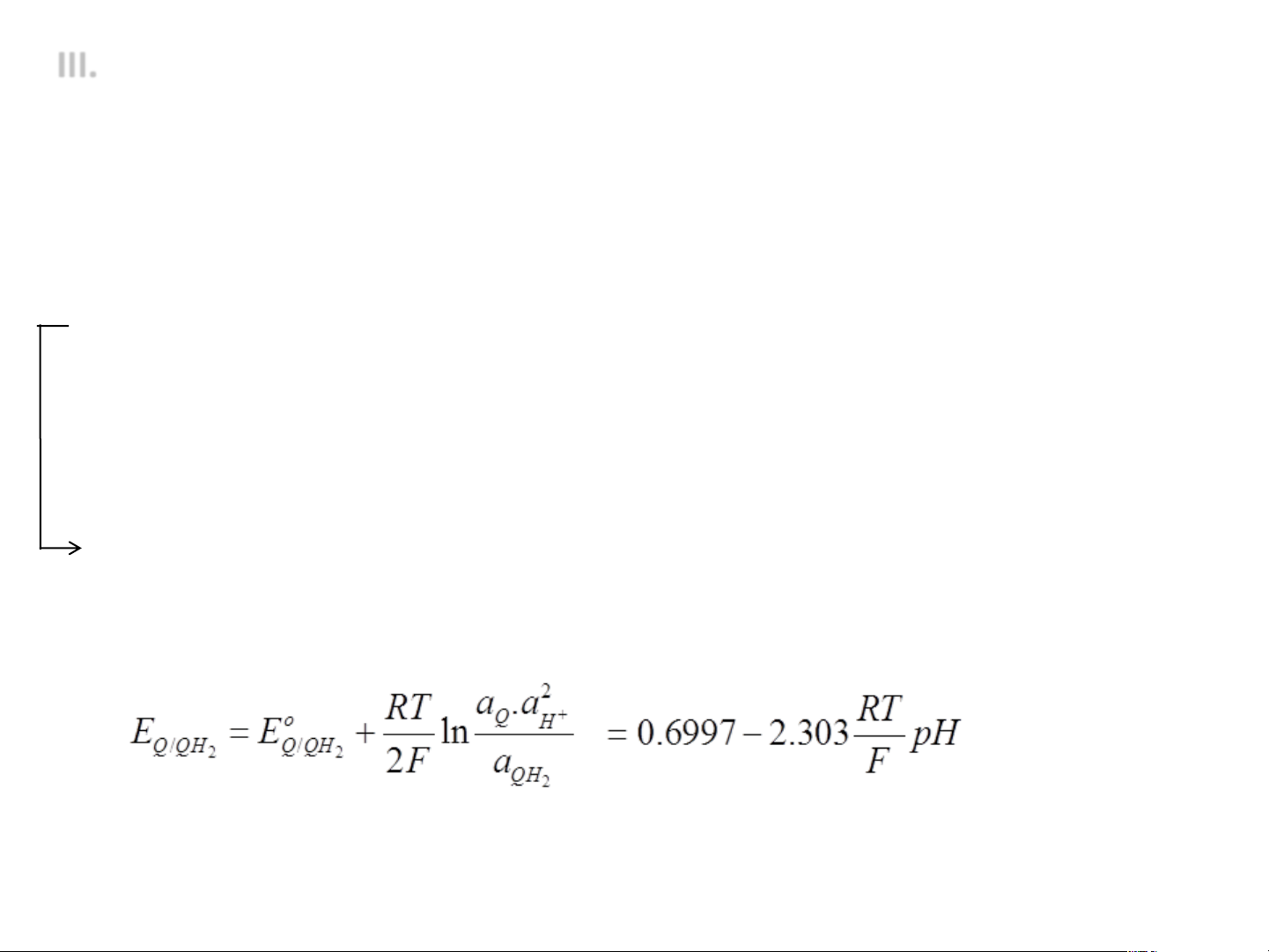

Preview text:
Chương II:
NHIỆT ĐỘNG CỦA HỆ ĐIỆN HOÁ
II. ĐIỆN CỰC VÀ THẾ ĐIỆN CỰC
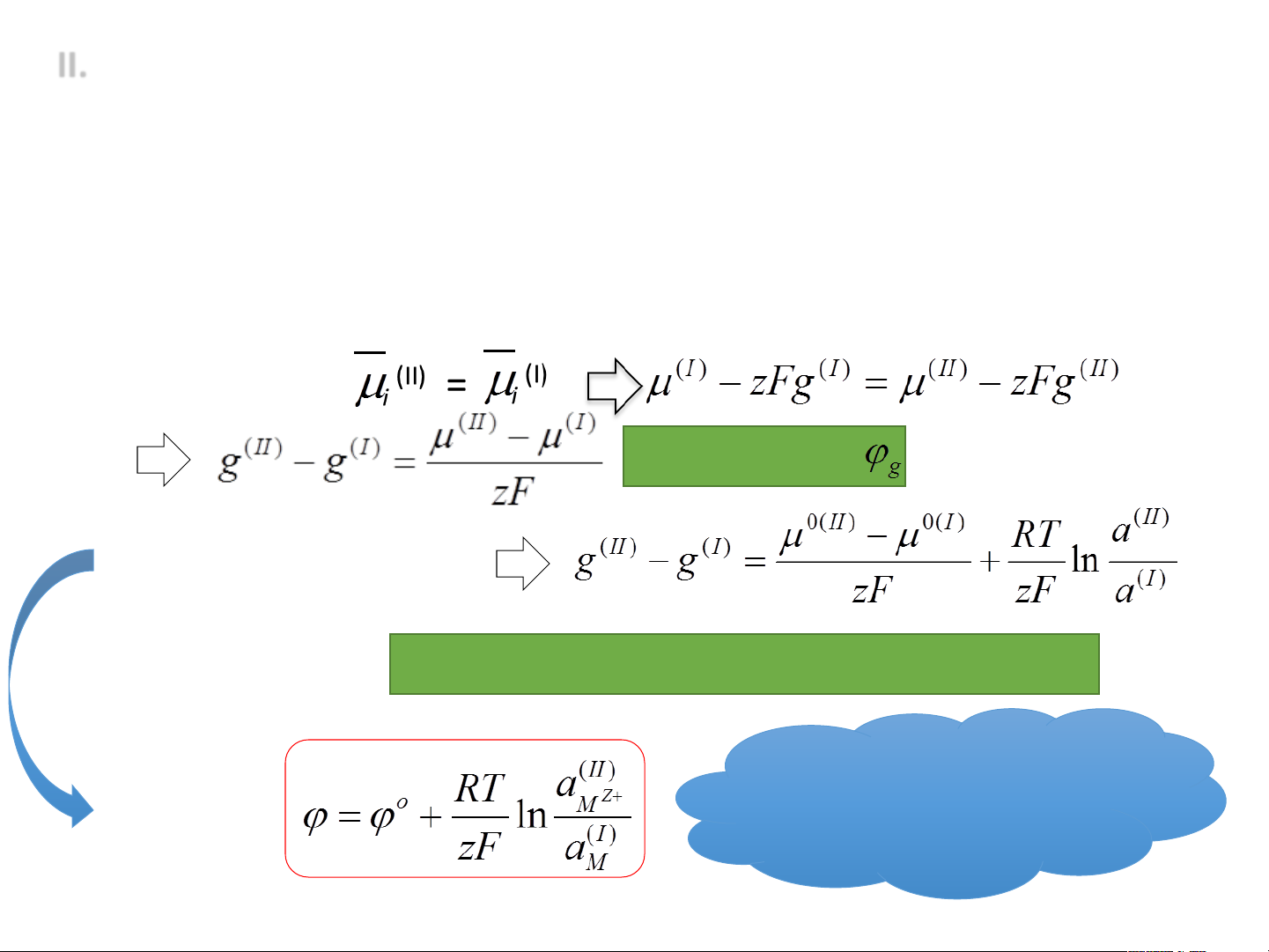
1. Phương trình Nernst cho thế Galvani Mz+ + ze ® M Dung dịch (pha II) Kim loại (pha I) Khi cân bằng: Thế Galvani Thay: μ = μo + RTlna
Thế Galvani chuẩn ϕ og (khi a(I) = a(II) = 1) Phương
Chú ý: không thể đo trình
được thế Galvani này Nernst
II. ĐIỆN CỰC VÀ THẾ ĐIỆN CỰC
2. Khái niệm thế điện cực
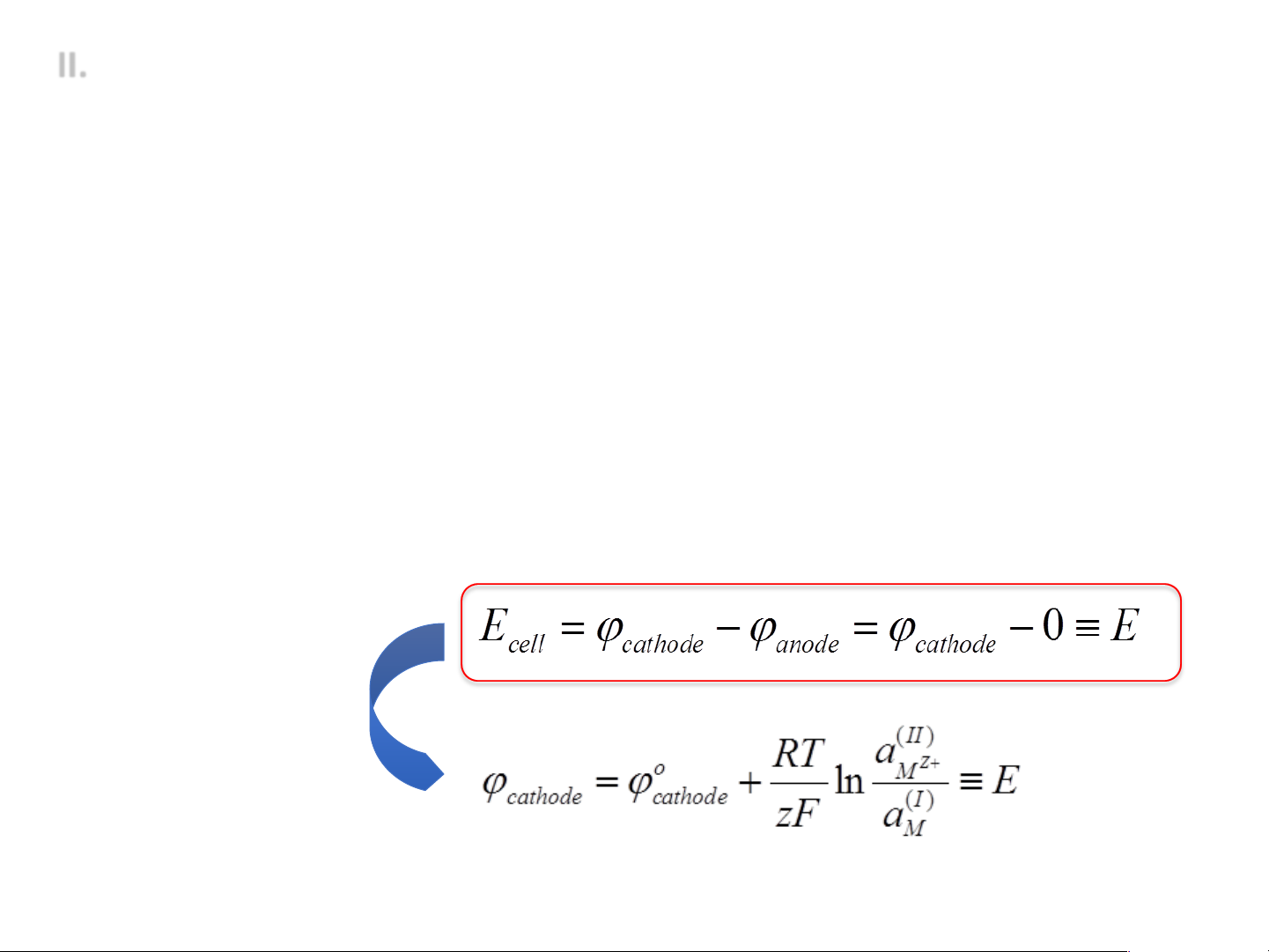
ü Thế điện cực (E): điện thế Galvani tương đối của một điện cực
so với một điện cực được lấy làm chuẩn
ü Đo thế điện cực: đo sức điện động của một pin (tế bào điện
hóa) gồm 2 điện cực như sau:
- Anode: điện cực hiđro chuẩn (quy ước thế điện cực = 0)
- Cathode: Là điện cực cần đo
Phản ứng điện cực: ox + ze ® red Quy ước:
II. ĐIỆN CỰC VÀ THẾ ĐIỆN CỰC
3. Thế điện cực chuẩn
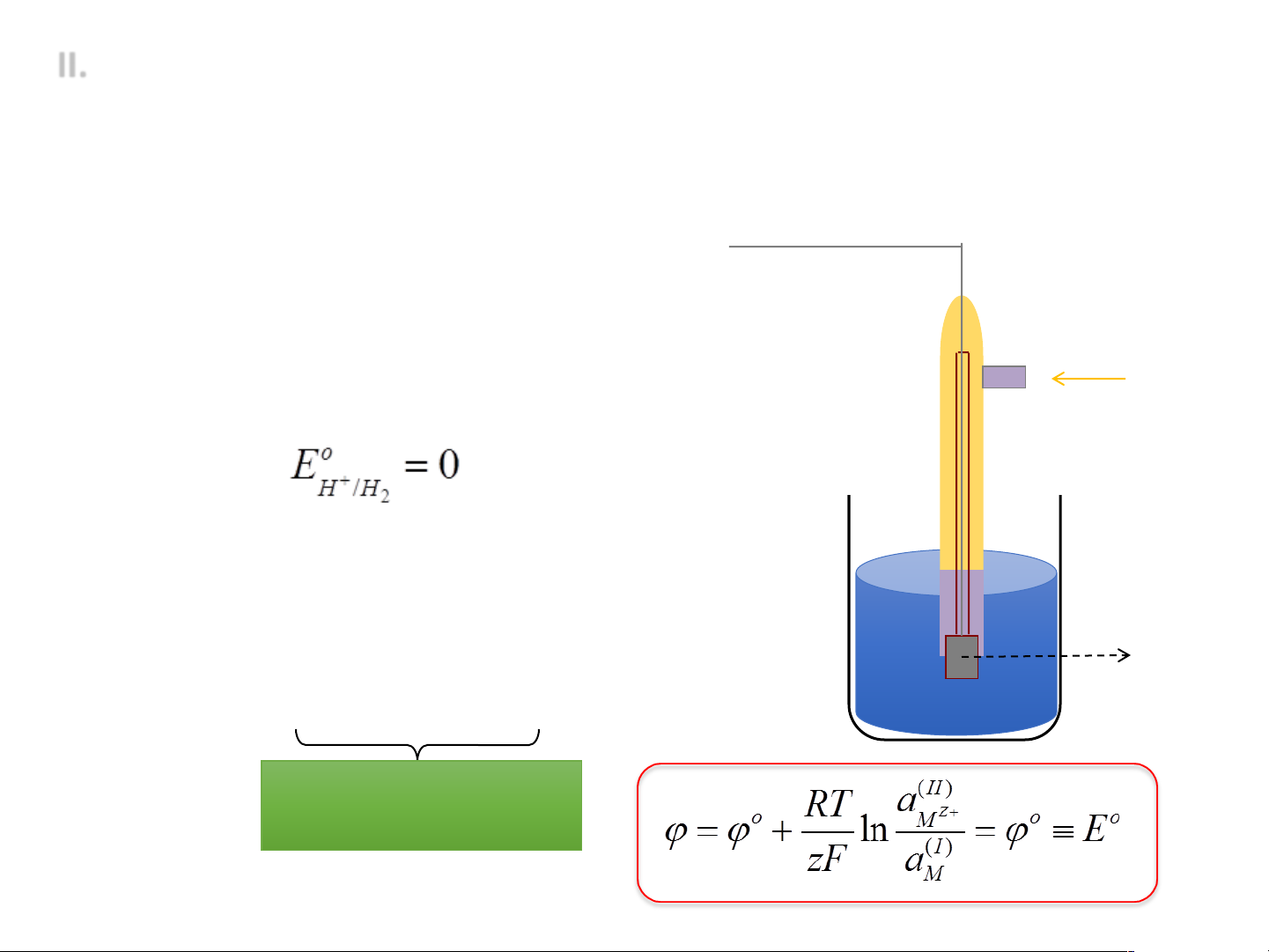
• Điện cực chuẩn hidro (SHE):
ü Kim loại: platinum đen ü Dung dịch acid: a = 1 M ü Khí hydrogen: f = 1 bar Khí H2
ü Phản ứng điện cực: 2H+ + 2e = H2 ü Quy ước: (mọi nhiệt độ)
• Thế điện cực chuẩn: Thế điện cực ở Platinum đen điều kiện chuẩn Dung dịch H+ - Dung dịch: a = 1 M - Khí: f = 1 bar
II. ĐIỆN CỰC VÀ THẾ ĐIỆN CỰC
4. Một số điện cực điển hình
• Điện cực kim loại – ion kim loại:
ü Nhúng kim loại M vào dung dịch Mz+: M|Mz+
ü Phản ứng điện cực: Mz+ + ze ® M ü Thế điện cực • Điện cực khí:
ü Ví dụ: H+/H2, Cl2/Cl-, O2/H2O…
ü Thanh kim loại trơ (Pt) được hấp phụ bão hòa khí,
nhúng trong dung dịch chứa ion của khí đó VD: (Pt) Cl2|Cl-
ü Phản ứng điện cực: Cl2 + 2e ® 2Cl- ü Thế điện cực: 𝑅𝑇 𝑃 𝐸 !"! !" 𝑙𝑛 !/!"" = 𝐸$ + 2𝐹 𝑎!"" %
II. ĐIỆN CỰC VÀ THẾ ĐIỆN CỰC
4. Một số điện cực điển hình
• Điện cực ion – ion
ü VD: Fe3+/Fe2+, MnO -4/Mn2+
ü Kim loại trơ (Pt) nhúng trong dung dịch Mx+ và My+: Pt|Mx+, My+
ü Phản ứng điện cực: My+ + (y-x)e è Mx+ ü Thế điện cực:
• Điện cực muối khó tan
ü VD: Ag/AgCl/Cl-, Hg/Hg2Cl2/Cl-
ü Kim loại phủ muối khó tan của nó, nhúng trong dung
dịch chứa anion của muối: Ag|AgCl|Cl-
ü Phản ứng điện cực: AgCl + 1e è Ag + Cl- ü Thế điện cực:
III. SỨC ĐIỆN ĐỘNG VÀ PIN ĐIỆN HOÁ
1. Sự hình thành tế bào Galvani
• VD: kết hợp 2 điện cực Zn|Zn2+ và Cu|Cu2+
Nối 2 thanh kim loại bằng dây dẫn
Nối 2 dung dịch bằng cầu muối
Điện cực phía trái: Zn ® Zn2+ + 2e (cathode)
(Zn2+ từ thanh Zn sang dung dịch)
Điện cực phải: Cu2+ + 2e ® Cu (anode)
(Cu2+ từ dung dịch sang thanh Cu)
Phản ứng: Zn + Cu2+ ® Zn2+ + Cu
Sơ đồ pin: (-) Zn|Zn2+ || Cu2+|Cu (+) • Quy ước:
- Dòng điện trong pin đi từ trái sang phải
- Kí hiệu | chỉ bề mặt phân cách giữa 2 pha,
- Kí hiệu || chỉ cầu muối !
III. "S#Ứ$% C &$'
ĐIỆ (N) Đ(* Ộ +' NG "V$& À ,' PIN ĐIỆN HOÁ
1. Sự hình thành tế bào Galvani
Viết sơ đồ pin trong đó xảy ra các phản ứng sau: 1. I2 + H2 → 2HI
2. Cu + 2AgCl → 2Ag + 2Cl- + Cu2+ 3. 2AgBr + I2 → 2AgI + Br2
4. Ag + Fe(NO3)3 → AgNO3 + Fe(NO3)2 5. HgO + H2 → Hg + H2O
6. 10 Cl- + 2MnO -4 + 16H+ → 5Cl2 + 2Mn2+ + 8H2O !
III. "S#Ứ$% C &$'
ĐIỆ (N) Đ(* Ộ +' NG "V$& À ,' PIN ĐIỆN HOÁ
1. Sự hình thành tế bào Galvani
Viết sơ đồ pin trong đó xảy ra các phản ứng sau: 1. I2 + H2 → 2HI Cực (–) H2 – 2e → 2H+ Cực (+) I2 + 2e → 2I–
Sơ đồ pin: (-) (Pt) H2|H+ || I–| I2 (+)
Hoặc: (-) (Pt) H2|H+ , I–| I2 (+)
2. Cu + 2AgCl → 2Ag + 2Cl- + Cu2+ Cực (–) Cu – 2e → Cu2+ Cực (+) AgCl + 1e → Ag + Cl–
Sơ đồ pin: (-) Cu|Cu2+ || Cl–| AgCl | Ag (+) Hoặc: (-) Cu|Cu2+, Cl–| AgCl | Ag (+)
III. SỨC ĐIỆN ĐỘNG VÀ PIN ĐIỆN HOÁ 2. Sức điện động
• Sức điện động của 1 pin điện hóa (EMF - x) : tổng đại số của thế Galvani
trên pin khi pin làm việc thuận nghịch
VD. Xét pin : (-) Zn|Zn2+ || Cu2+|Cu (+) gồm các thế
- Thế điện cực Cu – Cu2+
- Thế tiếp xúc: Cu – dây dẫn
- Thế tiếp xúc: Zn – dây dẫn
- Thế điện cực Zn – Zn2+
- Thế khuếch tán dung dịch ≈0 ≈0 ≈0 (Do dùng cầu muối)
III. SỨC ĐIỆN ĐỘNG VÀ PIN ĐIỆN HOÁ 2. Sức điện động
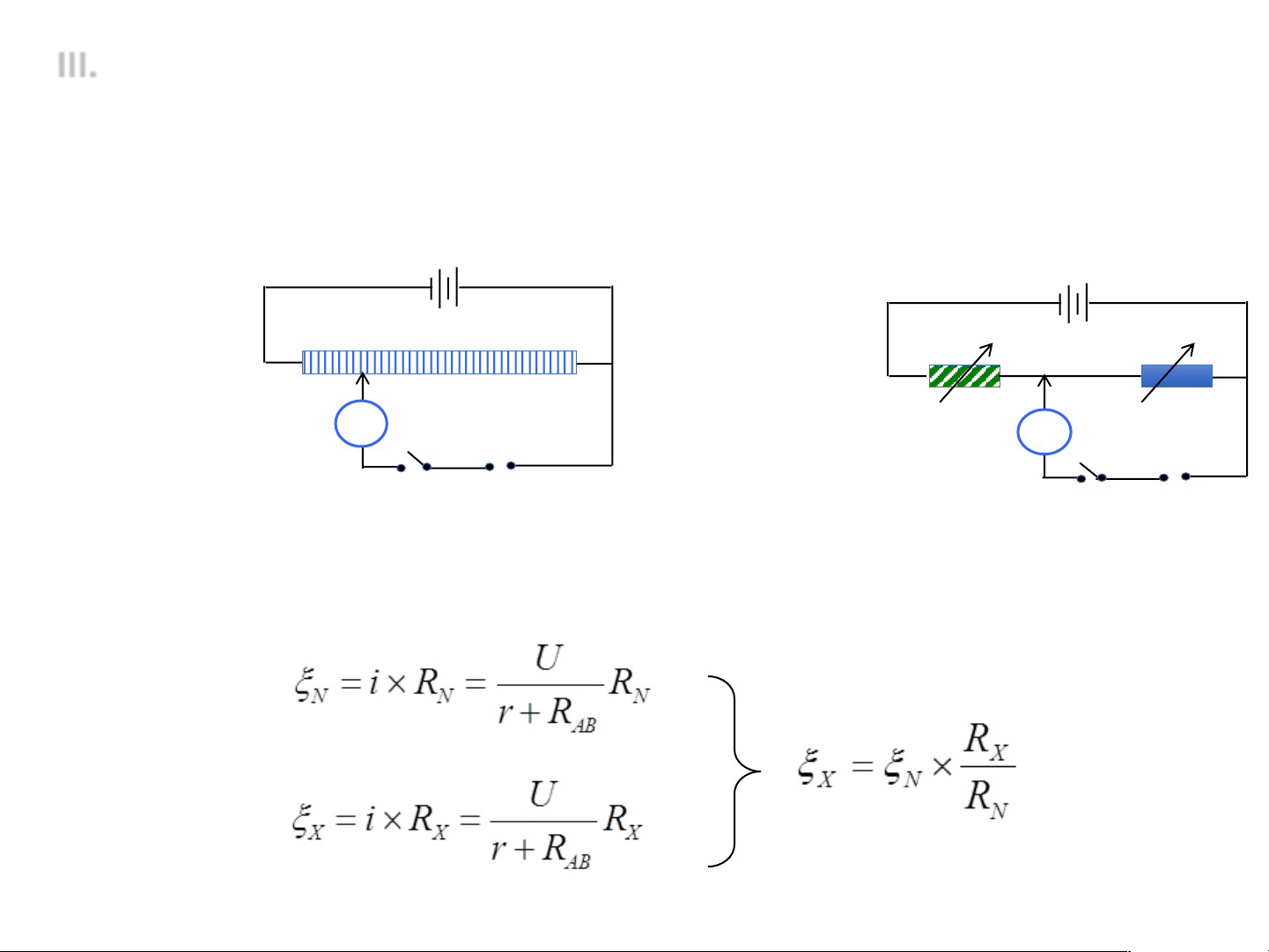
• Đo sức điện động: Phép đo chính xác khi pin làm việc thuận nghịch - + - + A C B R R2 1 G K Thực nghiệm: G Nguyên tắc đo - + K - + R1 + R2 = const EN hoặc EX EN hoặc EX
ü Với pin mẫu (VD: Weston x = 1.018 V): khi IG = 0 ® BC = RN
ü Với pin cần đo: khi IG = 0 ® BC = RX
III. SỨC ĐIỆN ĐỘNG VÀ PIN ĐIỆN HOÁ
3. Phương trình nhiệt động cơ bản của pin điện hoá
• Năng lượng tự do
• Biến thiên entropi
• Biến thiên entanpi
• Sức điện động
III. SỨC ĐIỆN ĐỘNG VÀ PIN ĐIỆN HOÁ
4. Ứng dụng của phép đo sức điện động • Pin mẫu Weston 8
(-) Cd(Hg)|CdSO4. H2O|CdSO4(aq) 3 (+) Hg|Hg2SO4|CdSO4(aq) Sơ đồ pin: (-) Cd(Hg)|CdSO 8 4. H2O|CdSO4Hg2SO4|Hg (+) 3 x = 1,018 V
!"#$%&'()*+*,-./*012345&1*6%477*891:
III. SỨC ĐIỆN ĐỘNG VÀ PIN ĐIỆN HOÁ
4. Ứng dụng của phép đo sức điện động
• Đo pH: đo EMF của pin gồm
ü Điện cực so sánh: điện cực bạc clorua, điện cực calomel
ü Điện cực phụ thuộc pH: Điện cực hydro: E = -0,059pH Điện cực quinhydrone E = 0,6997 - 0,059pH Điện cực bismuth E = 0,132 - 0,059pH Điện cực antimony E = -0,050 - 0,059pH
III. SỨC ĐIỆN ĐỘNG VÀ PIN ĐIỆN HOÁ
4. Ứng dụng của phép đo sức điện động
• Xác định g±
VD: Xác định g± trong dung dịch HCl
Xét phản ứng trong pin ½ H2(1atm)+ AgCl = Ag + H+(m)+ Cl-(m)
Xác định g±: tạo pin không cầu muối
Đo giá trị x và nồng độ m, tính g±




