
















Preview text:
Chương IV Nguyên tố nhóm IIIA
PGS.TS. Phạm Chiến Thắng Bộ môn Hóa Vô cơ Nội dung 1. Nguyên tố 2. Đơn chất 3. Hợp chất ơn giản 2
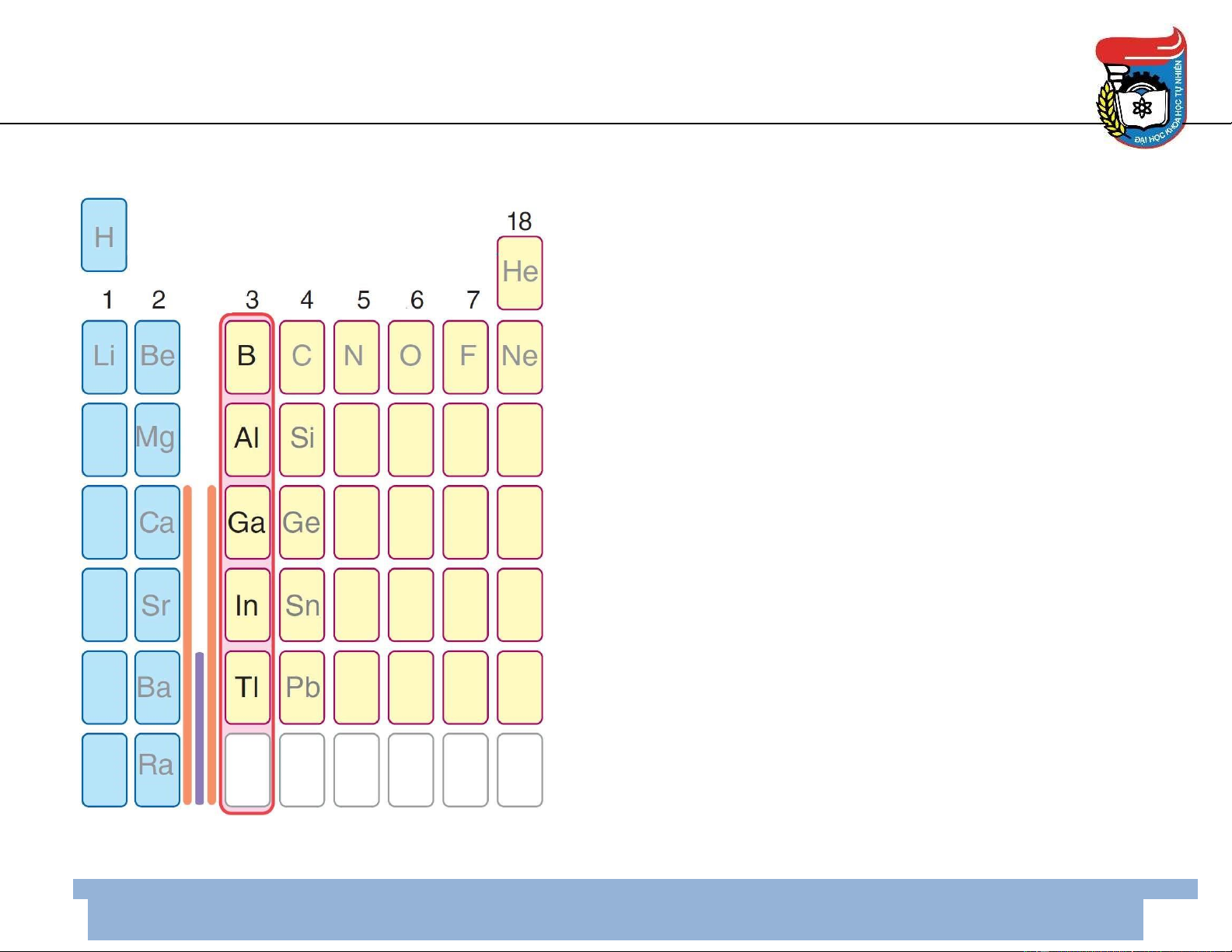
Vị trí trong bảng HTTH Hóa học 3 • B, Al, Ga, In, Tl 4
• Cấu hình electron lớp ngoài cùng: ns2 np1 • Vị trí: nhóm III A 5 Sự biến ổi tính chất B Al Ga In Tl
Sô ́ hiệu nguyên tử, Z 5 13 31 49 81
Cấu hình e ở trạng thái cơ bản [He] 2s2 2p1 [Ne] 3s2 3p1 [Ar] 3d10 4s2 4p1 [Kr] 4d10 5s2 5p1 [Xe] 4f14 5d10 6s2 6p1
Nhiệt ộ nóng chảy (°C) 2180 660 30 157 303,5 Nhiệt ộ sôi (°C) 4000 2519 2204 2082 1457 Tỉ khối 2,33 2,7 5,91 7,31
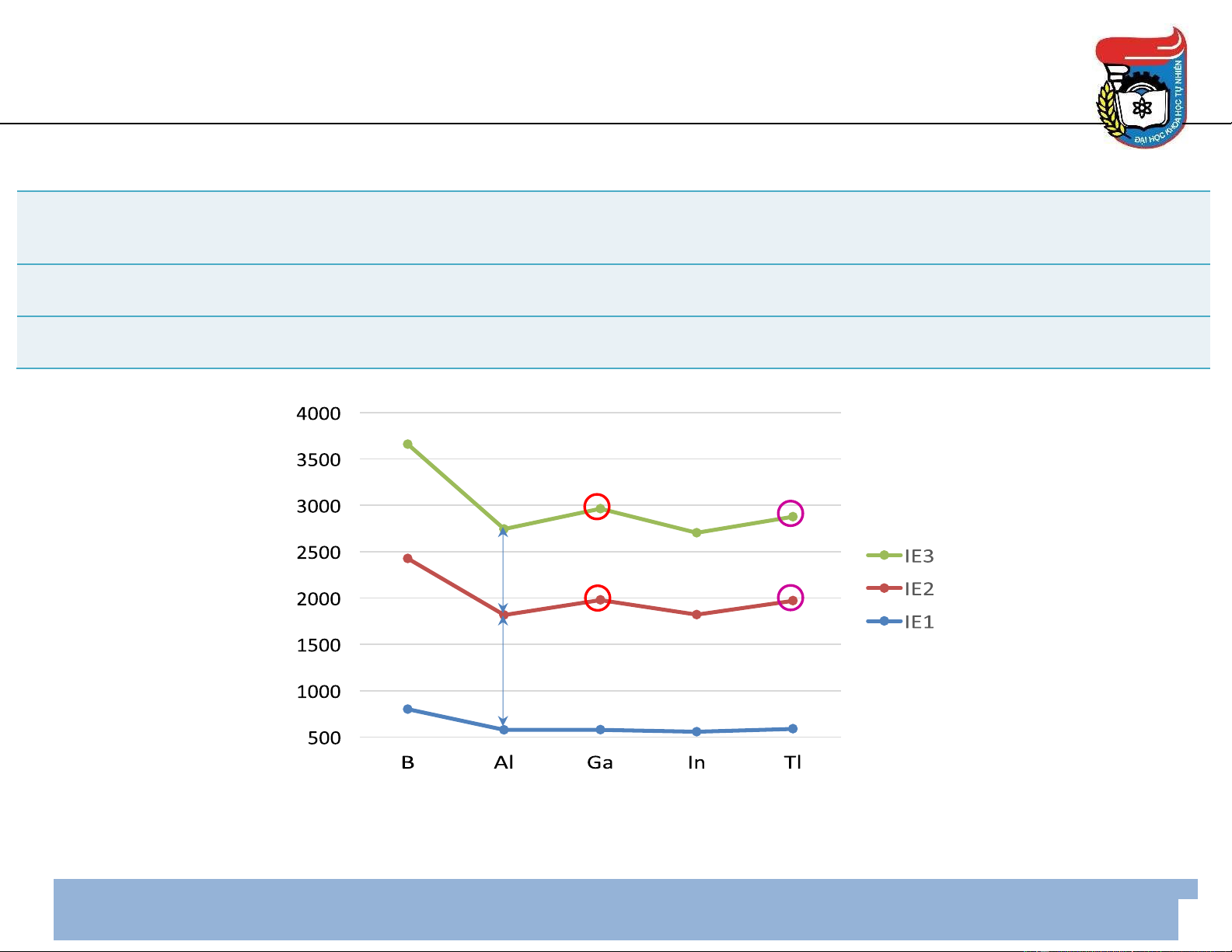
Năng lượng ion hóa thứ nhất, IE1 (kJ/mol) 800,6 577,5 578,8 558,3 589,4
Năng lượng ion hóa thứ hai, IE2 (kJ/mol) 2427 1817 1979 1821 1971
Năng lượng ion hóa thứ ba, IE3 (kJ/mol) 3660 2745 2963 2704 2878 6 Sự biến ổi tính chất
Năng lượng ion hóa thứ tư, IE4 (kJ/mol) 25030 11580 6200 5200 4900
Thế khử tiêu chuẩn 𝐸 / (V) – –1,66 –0,55 –0,34 +0,72
Thế khử tiêu chuẩn 𝐸 / (V) – – –0,2 –0,14 –0,34
Năng lượng ion hóa (kJ/mol)
• Sự khác nhau giữa IE1 & IE2 lớn hơn sự khác nhau giữa IE2 & IE3 7 Sự biến ổi tính chất
• Sự tăng IE2 & IE3 tại Ga & In do sư ̣ co d
• Sự tăng IE2 & IE3 tại Tl do sư ̣ co f
• Sự tăng IE2 & IE3 tại Ga, In & Tl → tăng ộ bền của số oxi hóa +1 (Tl(I) hiệu ứng cặp tr 6s2)
• Tính kim loại tăng tư ̀ B ến Tl:
B không kim loại; Al, Ga, In, & Tl kim loại
Sự biến ối bản chất liên kết trong các hợp chất tư ̀ cộng hóa trị sang ion
• Cấu hình electron lớp ngoài cùng ns2np1 Tạo cation M3+
Tạo tối a 3 liên kết cộng hóa trị bình thường → 6 electron trong lớp vỏ hóa trị → các hợp
chất lớp có khả năng nhặn thêm 1 cặp electron ể hoàn thành lớp vỏ hóa trị 8 electron 8 Sự biến ổi tính chất
Trạng thái oxi hóa +3 ộ bền giảm từ Al ến Tl
Trạng thái oxi hóa +1 ộ bền tăng tư ̀ Al ến Tl do hiệu ứng cặp trơ 9 Nội dung 1. Nguyên tố 2. Đơn chất 3. Hợp chất ơn giản 10
Đơn chất – Tính chất hóa học
Đơn chất – Tính chất vật lý
• B: xám bạc, nhiệt ộ nóng chảy cao & ộ dẫn iện thấp
• Al: màu trắng bạc, cứng
• Ga: màu trắng bạc, nhiệt ộ nóng chảy thấp 30 °C
• In: màu trắng bạc, mềm 11 • Tl: màu xám, mềm
• B: rất trơ trong iều kiện thường, chỉ tương tác trực tiếp với F2
ở nhiệt ộ cao tương tác với nhiều nguyên tố 12
Đơn chất – Tính chất hóa học 13
Đơn chất – Tính chất hóa học
• Al: rất dê ̃ bị oxi hóa trong không khí & ̀ trong nước nhưng bị thụ ộng hóa bởi lơṕ Al2O3 (10-6 – 10-4 mm)
Đơn chất – Tính chất hóa học
• Al: rất dễ bị oxi hóa trong không khí va ̀ trong nước nhưng bị thụ ộng hóa bởi lơṕ Al2O3 (10-6 – 10-4 mm)
Phản ứng với hầu hết các nguyên tố không kim loại
Phản ứng với hầu hết các axit nhưng bị thụ ộng hóa bởi HNO3 và H2SO4 ặc nguội
Phản ứng với dung dịch kiềm
Phản ứng khử oxit kim loại 15
Đơn chất – Tính chất hóa học
• Ga, In: bền với không khí do lớp oxit bao phủ; Tl: bị oxi hóa chậm
• Ga, In & Tl: tan trong hầu hết các axit
• Riêng Ga phản ứng với dung dịch kiềm (tương tự Al) Trạng thái thiên nhiên
• Al: kim loại phổ biến nhất trong vỏ trái ất; khoáng aluminosilicate, boxit Al2O3.nH2O va ̀cryolit Na3[AlF6] Quặng boxit 17
• B: borăc, Na2B4O7.10H2O, & kernit, Na2B4O7.4H2O
• Ga, In, Tl: lượng vết trong một số quặng của những kim loại khác Điều chế
• B: khử B2O3 bằng Mg hoặc khử BBr3 bằng H2 hoặc phân hủy BI3 18
• Al: iện phân nóng chảy hỗn hợp Al2O3 & Na3[AlF6] (cryolit) tại 960oC đ
• Ga, In, Tl : iện phân dung dịch muối clorua hoặc dùng hi ro khử oxit kim loại. Nội dung 1. Nguyên tố 2. Đơn chất 3. Hợp chất ơn giản 19 Nội dung 1. Hi rua 2. Halogenua 3. Oxit 4. Oxoaxit/ Hydroxit 20




