


Preview text:
Chương V:
CÂN BẰNG LỎNG - LỎNG
I. HỆ HAI CHẤT LỎNG TAN LẪN CÓ GIỚI HẠN
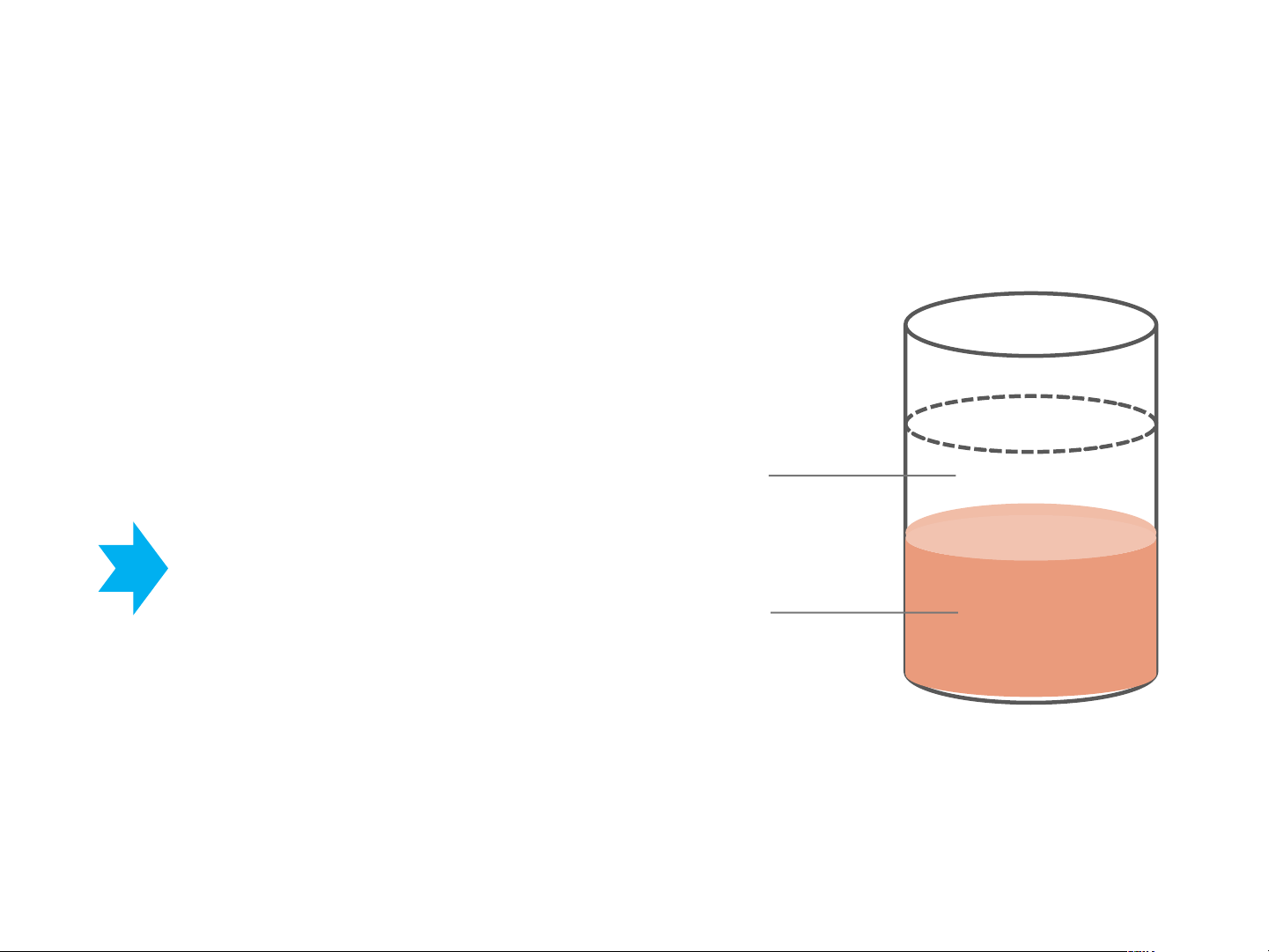
1. !" #$% &'% () *+,+ -.% (/$ -0 -$+ (-1# &2%* Quy tắc pha Gibbs: c = k – f + 1 Lớp nước Ở mỗi nhiệt độ xác định, thành phần 2 pha là xác định Lớp phenol
CHƯƠNG V: CÂN BẰNG LỎNG - LỎNG. 1
I. HỆ HAI CHẤT LỎNG TAN LẪN CÓ GIỚI HẠN
1. !" #$% &'% () *+,+ -.% (/$ -0 -$+ (-1# &2%* T T T T H H x 2O x Phenol phenol 2O nico)n Nico,n
Giản đồ T – x của hệ Phenol - nước
Giản đồ T – x của hệ Nicotin - nước
CHƯƠNG V: CÂN BẰNG LỎNG - LỎNG. 2
I. HỆ HAI CHẤT LỎNG TAN LẪN CÓ GIỚI HẠN
2. 3+4% 56 %-+0# 57 8 #-9%- :-;%
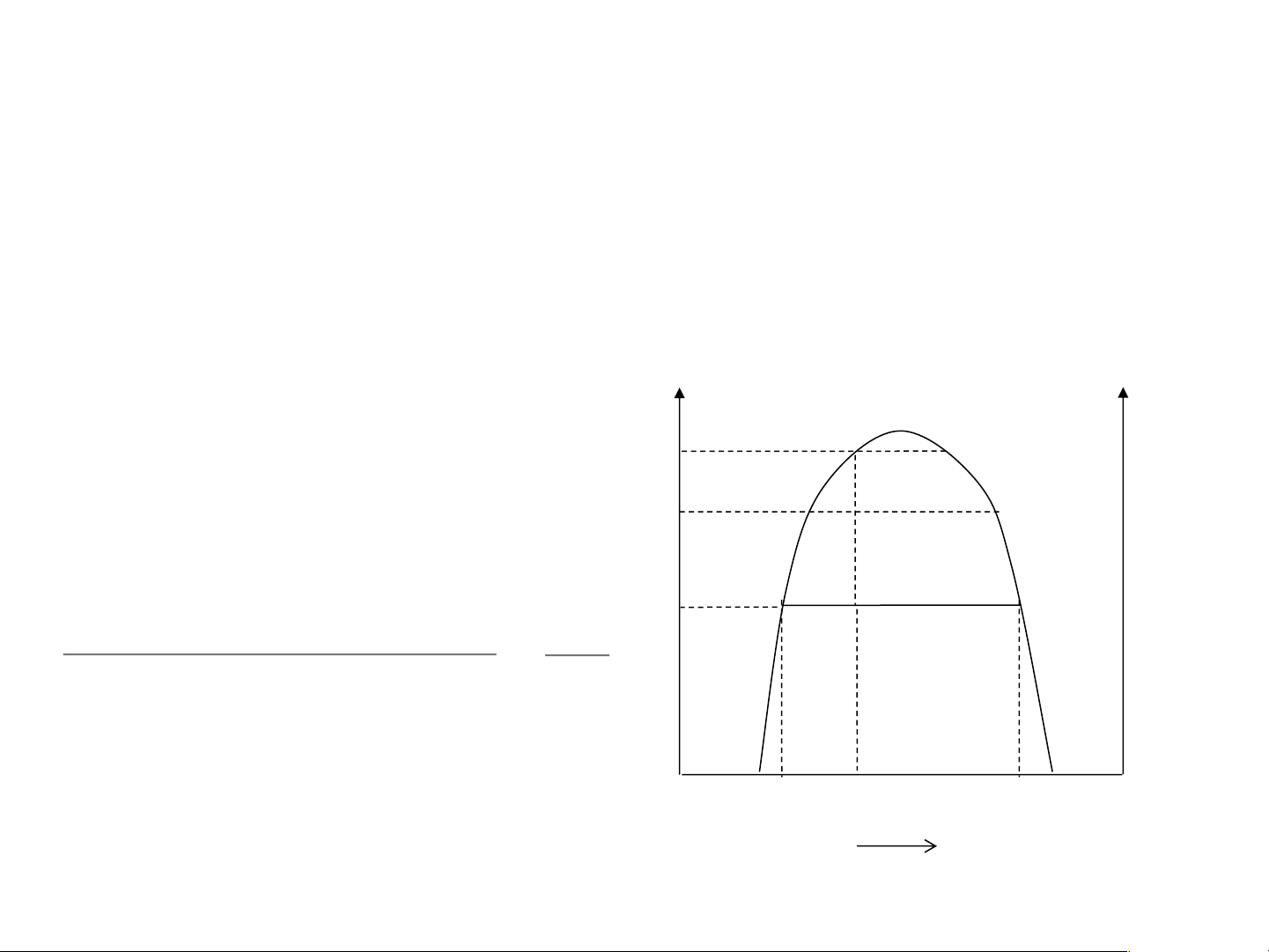
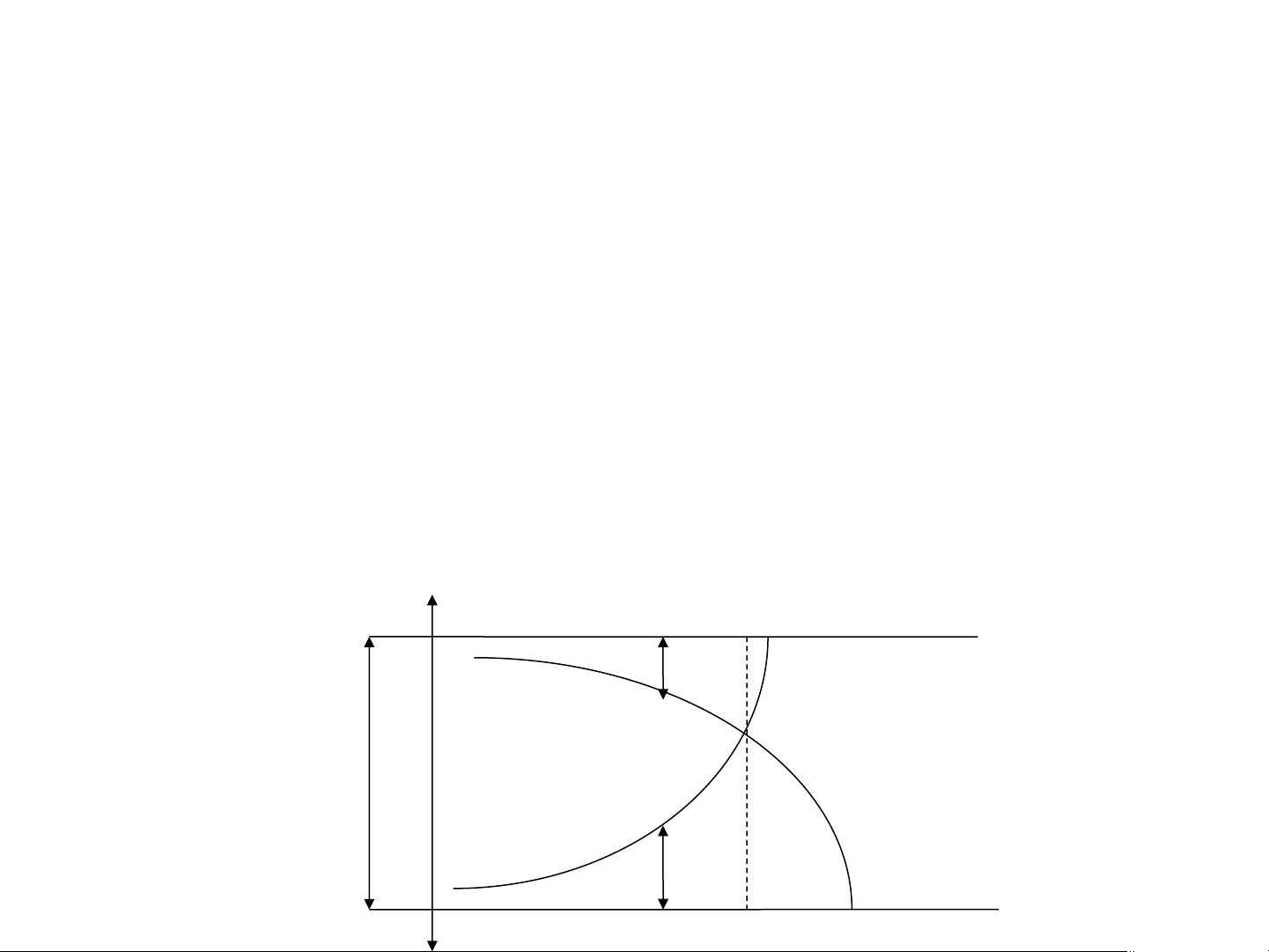
Xét quá trình đa nhiệt của 1 hệ: T T
Nhiệt độ: T1 → T2 → T3 TK Q Q2 Điểm hệ: H → P → Q T3 P1 P P T 2 2 Tính thành phần hệ, ví dụ tại điểm P: H1 H2 T1
Lượng pha P1 (phenol/nước) P2P H =
Lượng pha P2 (nước/phenol) P1P
TK: nhiệt độ tới hạn – nhiệt độ cao
nhất mà hệ còn tồn tại dị thể x1 x x H 2 2O Phenol xB
CHƯƠNG V: CÂN BẰNG LỎNG - LỎNG. 3
I. HỆ HAI CHẤT LỎNG TAN LẪN CÓ GIỚI HẠN
2. 3+4% 56 %-+0# 57 8 #-9%- :-;%
Phương pháp xây dựng giản đồ:
v Phương pháp hoá học: - Trộn lẫn hai cấu tử T T
- Giữ hệ ở những nhiệt độ khác nhau ở Đồng trạng thái cân bằng thể
- Phân tích thành phần hai pha ở mỗi nhiệt độ
- Vẽ giản đồ nhiệt độ – thành phần Dị thể
v Phương pháp hoá lý:
- Tạo những hệ có thành phần khác nhau H x Phenol
- Xác định nhiệt độ tại đó có sự chuyển pha 2O phenol
(từ trong sang đục và ngược lại) 4
III. ĐỊNH LUẬT PHÂN BỐ NERNST. SỰ CHIẾT VÀ TRÍCH LY 1. <-=+ %+0>
v Trích ly: là quá trình lấy 1 chất ra khỏi một
hỗn hợp rắn bằng 1 dung môi có khả năng
hoà tan tốt chất tan đó mà không hoà tan các chất còn lại.
v Chiết: là quá trình lấy 1 chất ra khỏi một
dung dịch bằng 1 dung môi không tan (hay
ít tan) vào dung dịch này xong lại có khả
năng hoà tan chất tan tốt hơn.
III. ĐỊNH LUẬT PHÂN BỐ NERNST. SỰ CHIẾT VÀ TRÍCH LY
2. ?@%- &AB# :-C% DE FGH%I#
Xét hệ gồm các cấu từ A, B và Y: - Y tan được trong A - Y tan được trong B
- A và B hoàn toàn không tan lẫn (hoặc tan lẫn một phần)
Quy tắc pha Gibbs: xét ở T=const, P=const (áp suất khí quyển) c = k – f
v Định luật phân bố Nernst:
CY / A = K (T, P = const) CY /B
III. ĐỊNH LUẬT PHÂN BỐ NERNST. SỰ CHIẾT VÀ TRÍCH LY
2. ?@%- &AB# :-C% DE FGH%I# J9 K%* LM%*
v Ứng dụng định luật phân bố Nernst trong chiết
Xét dung dịch thể tích Vo chứa a mol chất tan. Mỗi lần dùng thể tích Vc
dung môi để chiết, xn là số mol chất tan còn lại sau lần chiết thứ n. Cctan/ K = dm > 1 C 2 c tan/ d a − x% V
Ø Sau lần chiết thứ 1: 𝐶!/#$ V = K = & x ' C x % = a. !/## % V V ' + KV( n ' æ V ö x = a. 0 n Ø Sau lần chiết thứ n: ççV + K V ÷÷ è . 0 c ø
Ví dụ: Có 0,06 g iod trong 2 lít nước. Tính lượng iod còn lại trong đó sau
khi chiết bằng 50 ml CCl4 theo 2 cách:
a. Chiết 1 lần bằng 50 ml CCl4 b. Chiết 2 lần, mỗi lần dùng 25 ml CCl4 Biết hệ số phân bố CI2 /CCl4 K = = 80 CI2 /H2O
IV. HỆ HAI CHẤT LỎNG HOÀN TOÀN KHÔNG TAN LẪN
1. Tính chất của hệ
- Áp suất tổng cộng: P=xA.PoA+xB.PoB = PoA+PoB
- Thành phần pha hơi ở trạng thái cân bằng chỉ phụ thuộc
nhiệt độ mà không phụ thuộc thành phần hỗn hợp lỏng
- Nhiệt độ sôi của hỗn hợp không phụ thuộc vào thành
phần của nó mà chỉ phụ thuộc áp suất ngoài
- Tshh- Xác định nhiệt độ sôi T 0 (2) Png (1) 0 T T hệ
IV. HỆ HAI CHẤT LỎNG HOÀN TOÀN KHÔNG TAN LẪN
2. Chưng cất lôi cuốn hơi nước
Khái niệm: dùng hơi nước để lôi kéo 1 cấu tử A không tan
trong nước ra khỏi 1 hỗn hợp.
Ý nghĩa: Nhiều chất hữu cơ không thể đun đến nhiệt độ
sôi vì nó dễ bị phân huỷ. Để tách ra khỏi hỗn hợp thường
chưng cất lôi cuốn theo hơi nước.
Nguyên tắc: Đun sôi hỗn hợp chứa A và nước, chưng cất
phần hơi. Nhiệt độ sôi của hỗn hợp A – nước thấp hơn
nhiệt độ sôi của từng cấu tử H2O và A riêng rẽ.
Xác định lượng hơi nước tối thiểu để chưng cuốn m kg chất A 0 y n m /18 P H O H O H O H O 2 2 2 = = Þ 18 m = 2 . × m y n m / M H O 2 0 A P M A A A A A A




