

Preview text:
Chương VI: CÂN BẰNG GIỮA
DUNG DỊCH LỎNG VÀ PHA RẮN HOÁ LÝ 1
CHƯƠNG VI: !"#$$%'$'()*$+,#'$+-!.$/0#'$12$3.*$45#
1. SỰ HOÀ TAN CHẤT RẮN TRONG CHẤT LỎNG
1.1. !"# $%&'( ()* $+'
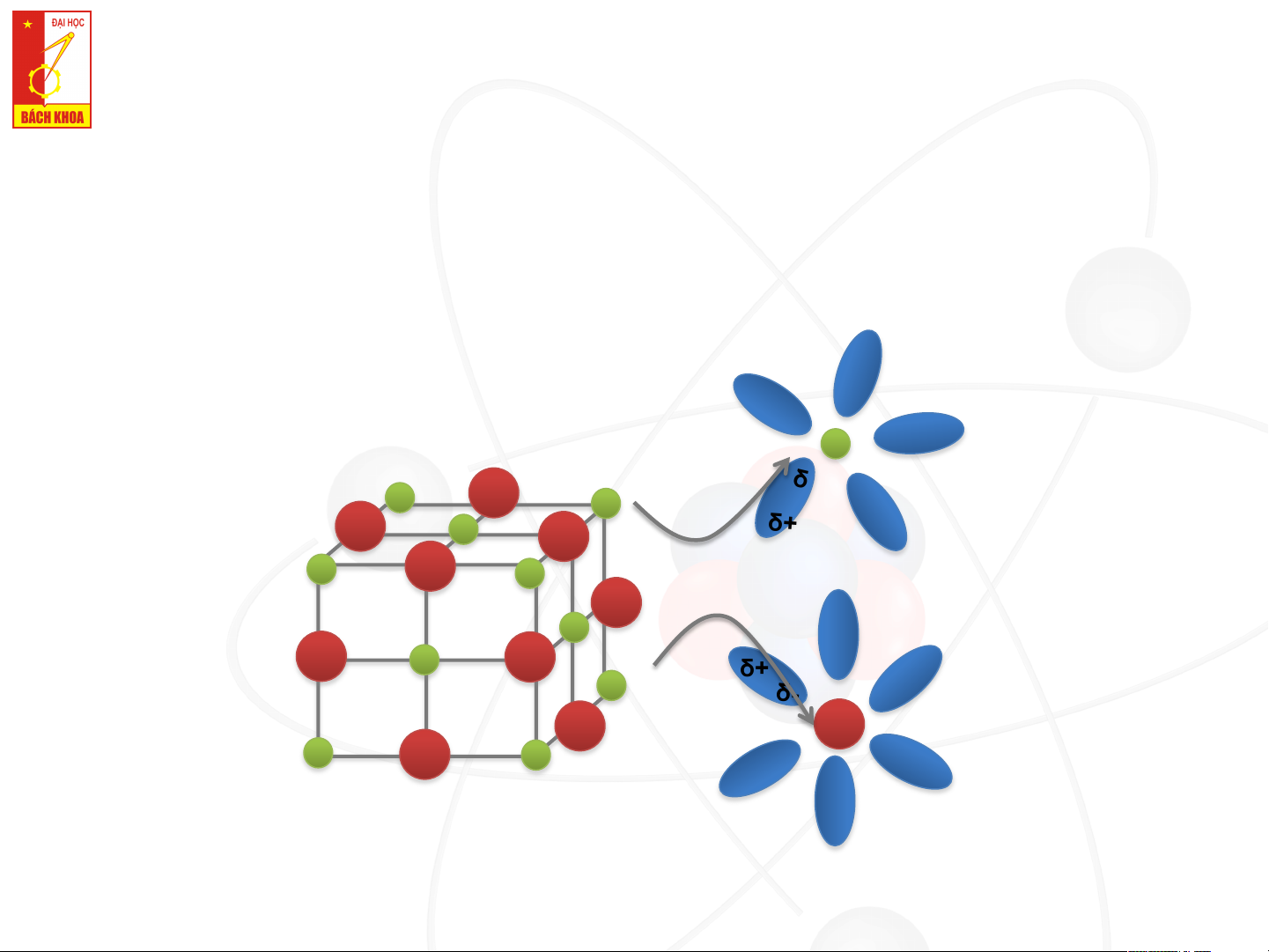
VD: sự hoà tan của muối ăn trong nước δ+ δ+ - Ion Na+ δ δ - + δ- δ+ solvat hóa (hydrat hóa) + - δ- δ - + - + δ+ δ+ + Solvat hóa - - + (hydrat hóa) - δ+ - + - + + δ+ δ- δ+ δ Ion Cl- solvat - - δ- hóa (hydrat + - - + δ δ- - δ+ hóa) δ+ δ- δ+
CHƯƠNG VI: CÂN BẰNG GIỮA DUNG DỊCH LỎNG VÀ PHA RẮN. 1 HOÁ LÝ 1
CHƯƠNG VI: !"#$$%'$'()*$+,#'$+-!.$/0#'$12$3.*$45#
1. SỰ HOÀ TAN CHẤT RẮN TRONG CHẤT LỎNG
1.2. ,'( (-.'/ 01+ '(23$ 45 46' 45 ()* $+' 01+ 0(7$ %8'9 :(-;'/ $%&'( <(%=>=% Chất rắn i Dung dịch chất i Nóng chảy Solvat hóa Phân bố vào dung môi Chất lỏng i Chất i trong dung dịch Pha loãng chất lỏng i
Có: λhòa tan =λnóng chảy + λpha loãng + λsolvat hóa
Coi dung dịch là lý tưởng: λpha loãng = 0 λsolvat hóa = 0 λhòa tan ≈ λnóng chảy
CHƯƠNG VI: CÂN BẰNG GIỮA DUNG DỊCH LỎNG VÀ PHA RẮN. 2 HOÁ LÝ 1
CHƯƠNG VI: !"#$$%'$'()*$+,#'$+-!.$/0#'$12$3.*$45#
1. SỰ HOÀ TAN CHẤT RẮN TRONG CHẤT LỎNG
1.2. ,'( (-.'/ 01+ '(23$ 45 46' 45 ()* $+' 01+ 0(7$ %8'9 :(-;'/ $%&'( <(%=>=% d ln x l i ht
Phương trình dạng vi phân = 2 dT RT
Phương trình dạng tích phân không cận li - l RT ln x i = -
+ ln k Þ x = k e . i i RT
Phương trình dạng tích phân có cận xi T l dT l æ 1 1 ö
d ln x = - i . Û ln x = - ò i ò i i çç - ÷÷ R T R T T 1 0 T è 0 ø
CHƯƠNG VI: CÂN BẰNG GIỮA DUNG DỊCH LỎNG VÀ PHA RẮN. 3 HOÁ LÝ 1
CHƯƠNG VI: !"#$$%'$'()*$+,#'$+-!.$/0#'$12$3.*$45#
2. SỰ KẾT TINH CỦA DUNG DỊCH HAI CẤU TỬ
2.1. Hệ không tạo dung dịch rắn, không tạo hợp chất hóa học
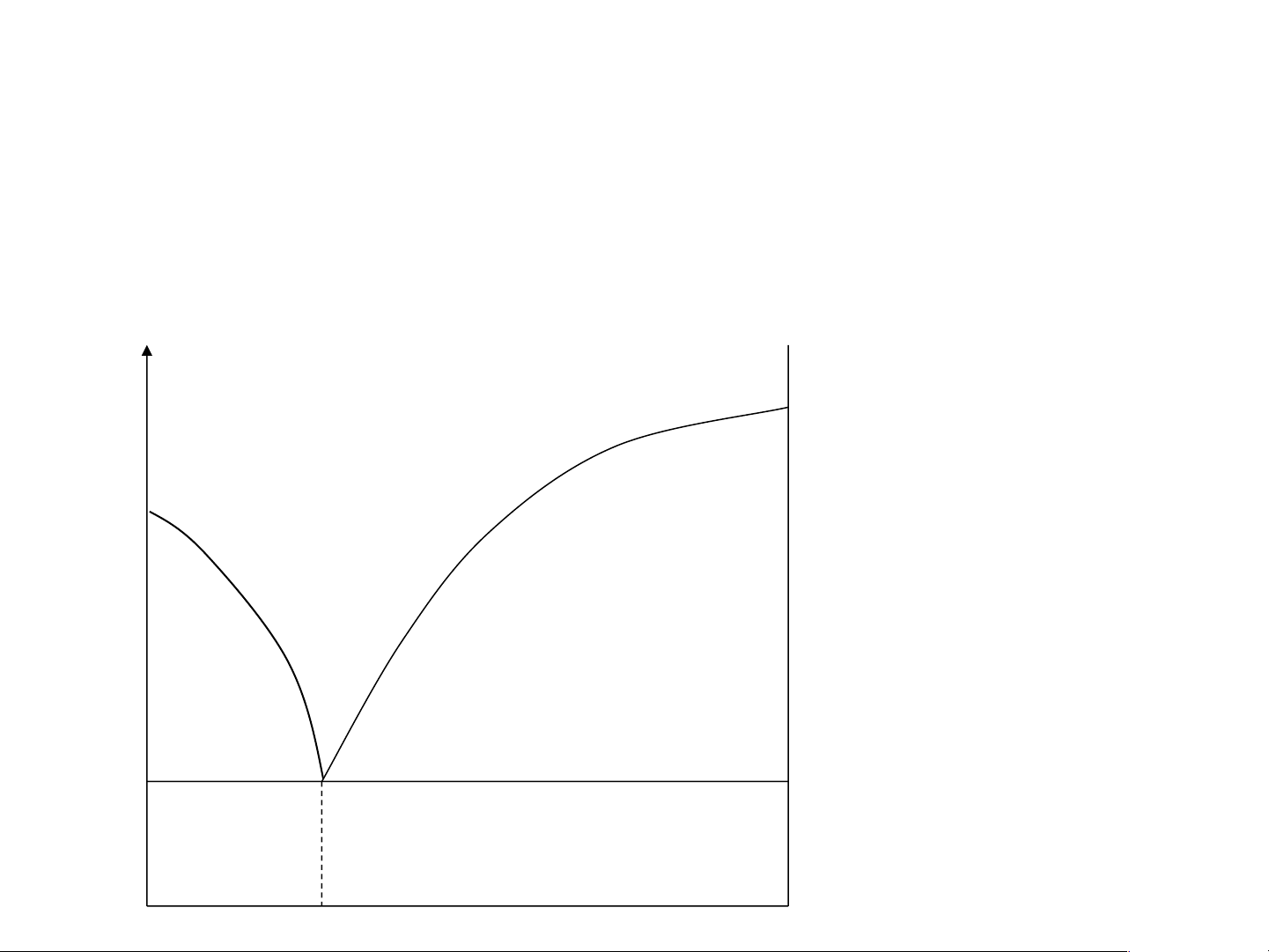
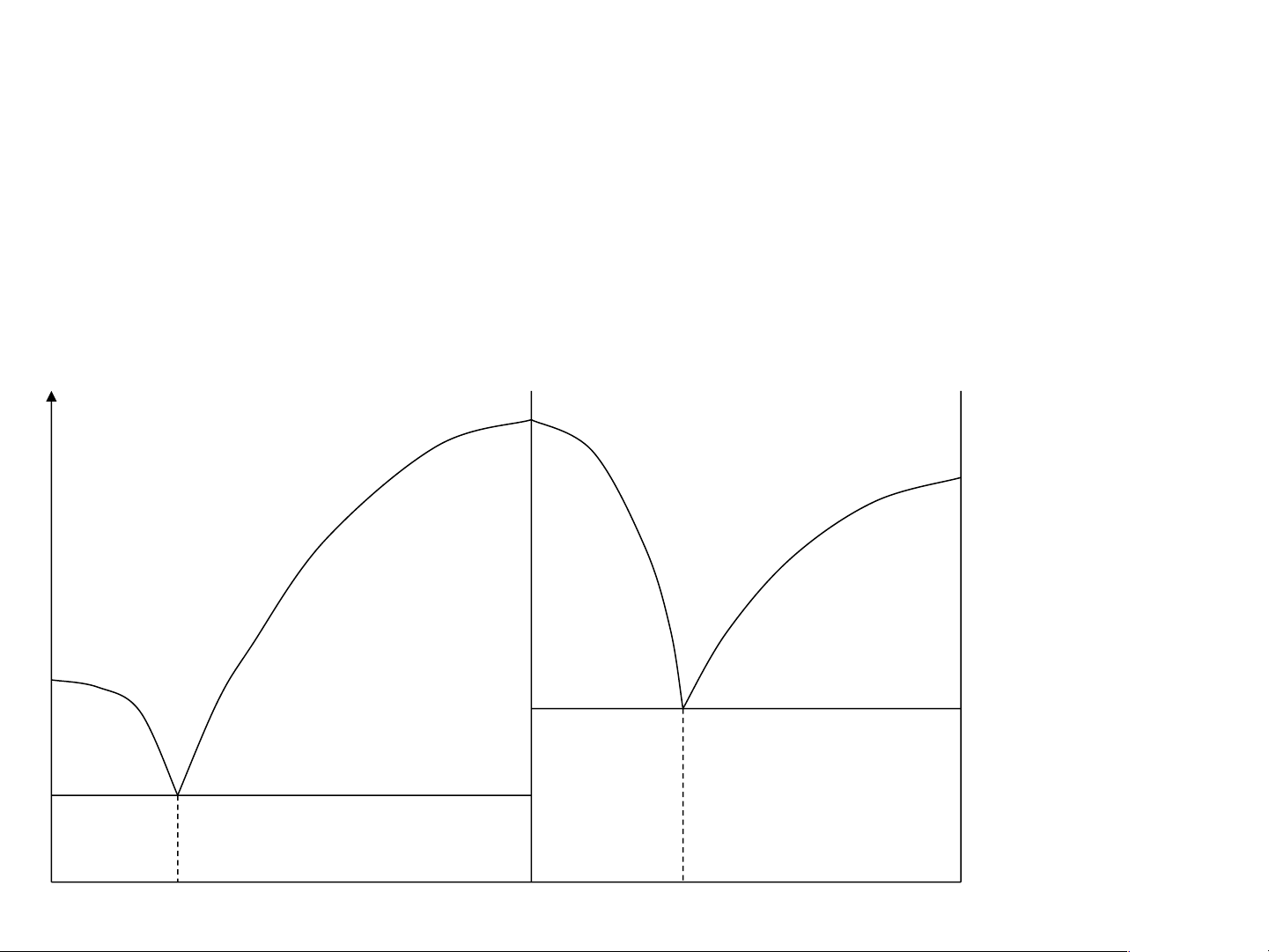
VD: NaCl – H2O, KCl – LiCl, Ag – Pb … T a, b: nhiệt độ kết tinh của cấu tử A, B b nguyên chất L aeb: đường lỏng a AB arr'b: đường rắn Điểm e: điểm eutecti RB ⇌ L RA ⇌ L e r r’ A B E HOÁ LÝ 1
CHƯƠNG VI: !"#$$%'$'()*$+,#'$+-!.$/0#'$12$3.*$45#
2. SỰ KẾT TINH CỦA DUNG DỊCH HAI CẤU TỬ
2.2. Hệ hai cấu tử không tạo dung dịch rắn, kết tinh tạo hợp chất hóa học bền
hệ CuSO4 – H2O, khi kết tinh tách ra CuSO4. 5H2O T Q1 Đồ thị gồm 2 d giản đồ ghép lại: CuSO b 4 - CuSO4.5H2O và H2O - CuSO4.5H2O L ⇌ RD L ⇌ RB a e2 RA ⇌ L e1 A D E E 1 2 B HOÁ LÝ 1
CHƯƠNG VI: !"#$$%'$'()*$+,#'$+-!.$/0#'$12$3.*$45#
2. SỰ KẾT TINH CỦA DUNG DỊCH HAI CẤU TỬ
?9@9 A3 (+2 07" $B $C) $(*'( >"'/ >D0( %8' $+' EF' GH (C'
?9I9 A3 (+2 07" $B $C) $(*'( >"'/ >D0( %8' $+' 0J /2K2 (C'
CHƯƠNG VI: CÂN BẰNG GIỮA DUNG DỊCH LỎNG VÀ PHA RẮN. 6




