






Preview text:
CHUYÊN ĐỀ: CHUẨN ĐỘ ACID – BASE 2019
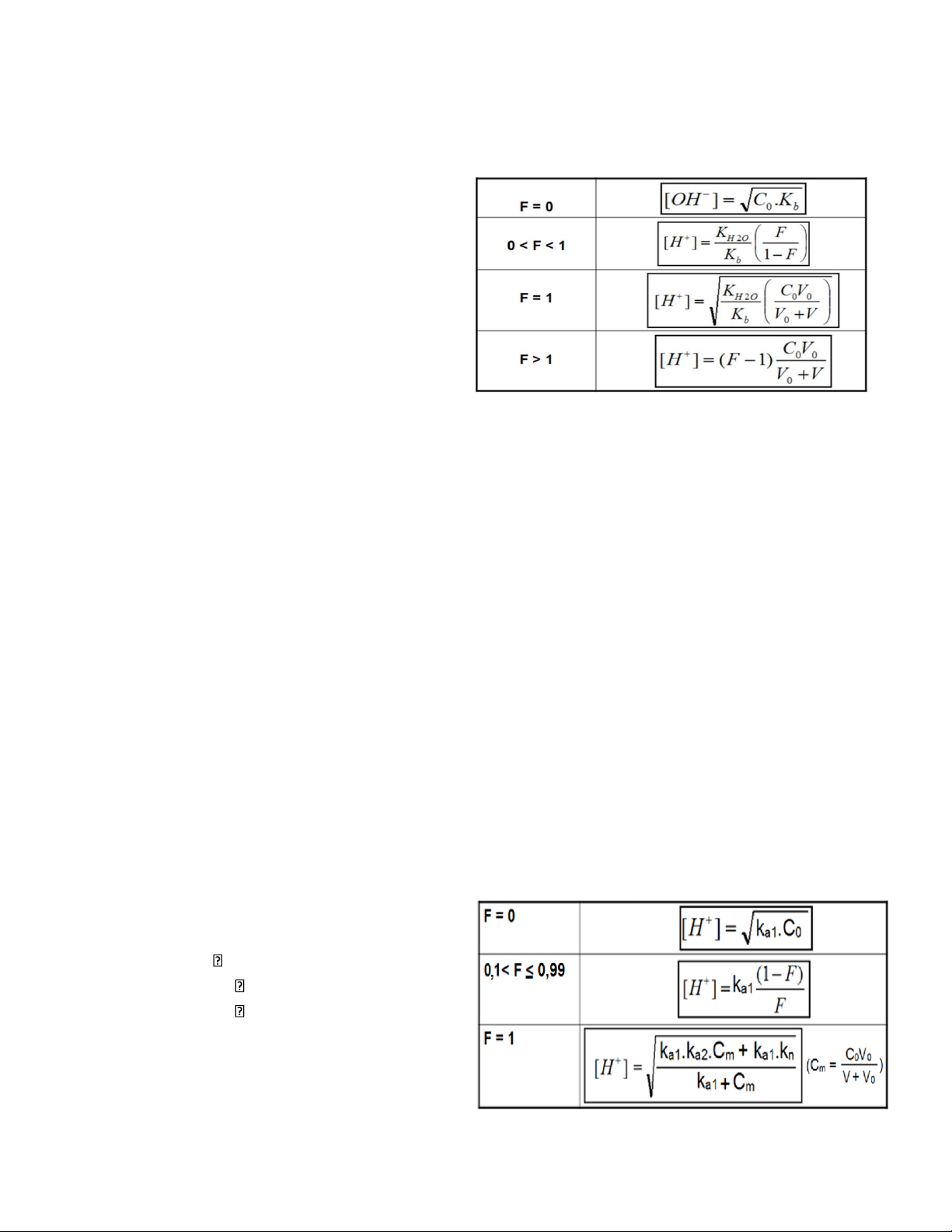
1) Chuẩn độ acid mạnh bằng base mạnh
Chuẩn độ V0 mL acid mạnh HA (C0) bằng NaOH (C) HA + NaOH = NaA + H2O
Mức độ định phân: F = CV / C0V0
Công thức tính pH trong quá trình chuẩn độ:
Ví dụ: Vẽ đường định phân khi chuẩn độ 100 ml dung dịch HCl 0,1 M bằng NaOH 0,1 M. Chọn chỉ thị nào khi
chuẩn độ HCl bằng NaOH?
Nguyên tắc chọn chỉ thị acid – base: pT ∆pHđp; pT pHĐTĐ
2) Chuẩn độ base mạnh bằng acid mạnh
Chuẩn độ V0 mL base mạnh BOH (C0) bằng HCl (C) BOH + HCl = BCl + H2O
Mức độ định phân: F = CV / C0V0
Công thức tính pH trong quá trình chuẩn độ
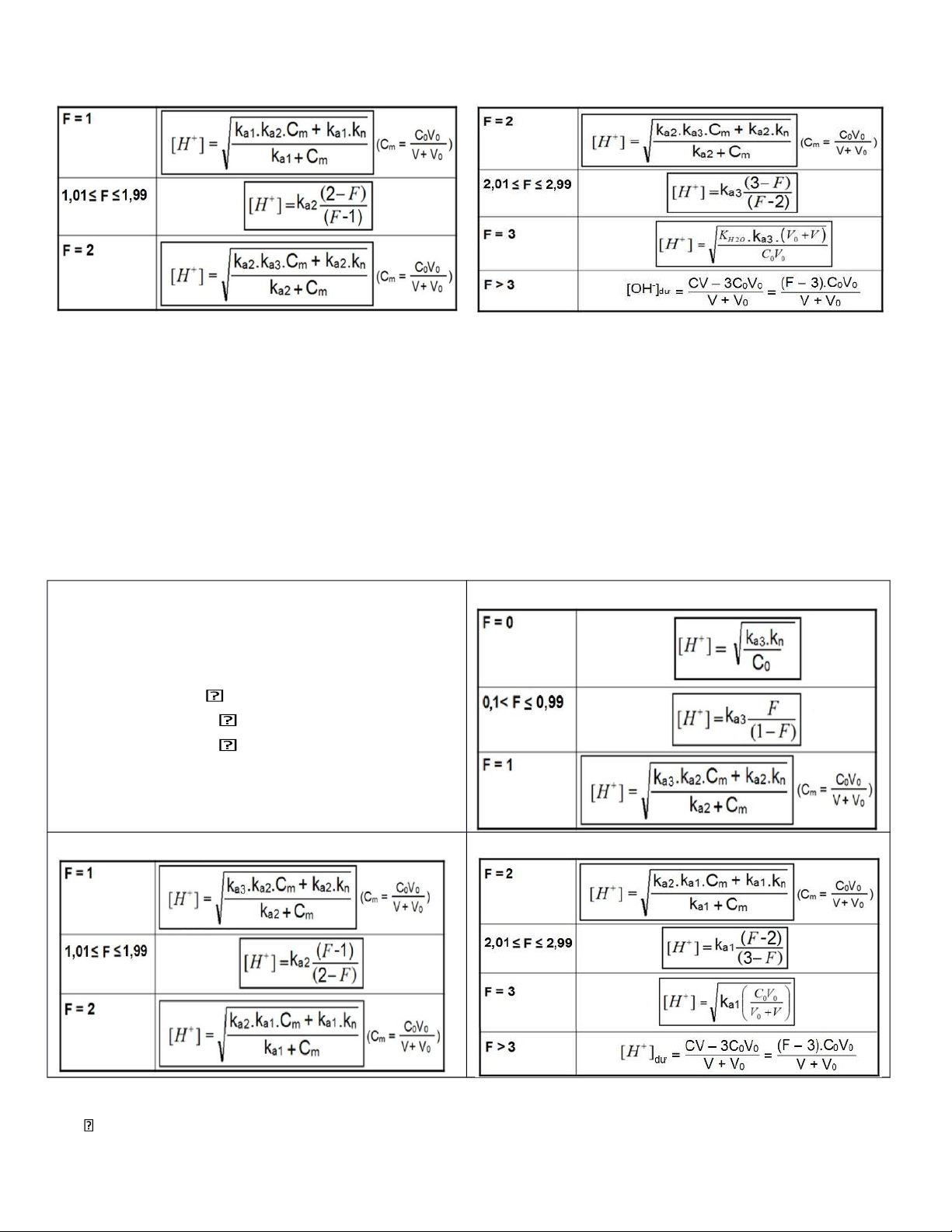
3) Chuẩn độ đơn acid yếu bằng base mạnh
Chuẩn độ V0 mL đơn acid yếu HA (C0, Ka) bằng NaOH (C) HA + NaOH = NaA + H2O
Mức độ định phân: F = CV / C0V0
Công thức tính pH trong quá trình chuẩn độ:
VD 1: Vẽ đường định phân khi chuẩn độ 100 ml dung dịch CH3COOH 0,1 M bằng NaOH 0,1 M. Cho: pKCH3COOH = 4,75
1/ So sánh ∆pHđp khi chuẩn độ HCl, HCOOH và CH3COOH có cùng nồng độ.
Cho: pKHCOOH = 3,74; pKCH3COOH = 4,75
2/ Chọn chỉ thị nào khi chuẩn độ CH3COOH bằng NaOH? 1
NST Đào Tú Anh 0986666904. Chăm chỉ luyện tập mới có kết quả!!!
CHUYÊN ĐỀ: CHUẨN ĐỘ ACID – BASE 2019
VD2: Giải thích tại sao với những acid có ka < 10– 9 không định lượng bằng phương pháp chuẩn độ trực tiếp với
base mạnh được? (với sai số chuẩn độ 0,1%)
4) Chuẩn độ đơn base yếu bằng acid mạnh
Chuẩn độ V0 mL đơn base yếu B (C0, Kb) bằng HCl (C) B + HCl = HA + BCl
Mức độ định phân: F = CV / C0V0
Công thức tính pH trong quá trình chuẩn độ
VD3: Vẽ đường định phân khi chuẩn độ 100 ml dung dịch NH4OH 0,1 M bằng HCl 0,1M. Cho: pKNH4OH = 4,75
1/ Có chuẩn độ được dung dịch CH3COONa bằng dung dịch HCl không?
2/ Chọn chỉ thị nào khi chuẩn độ NH4OH bằng HCl
Bài 1) Cần chọn chỉ thị có pT bằng bao nhiêu để sai số chỉ thị của các phép chuẩn độ sau không vượt quá 0,1%: HCl 0,01 M bằng KOH 0,01 M
HCOOH 0,01 M bằng KOH 0,01 M. Cho pkHCOOH = 3,74
KCN 0,01 M bằng HCl 0,01 M. Cho pkHCN = 9,21 2)
Chuẩn độ NH4OH 0,01 M bằng HCl 0,01 M.
a) Tính pHĐTĐ của phép chuẩn độ.
b) Dùng chỉ thị nào sau đây sẽ mắc sai số chỉ thị nhỏ nhất:
Metyl đỏ (pT = 5); Phenol đỏ (pT = 7); Phenolphtalein (pT = 9). Biết: pKNH4OH = 4,75
5) Chuẩn độ đa acid bằng base mạnh
Chuẩn độ V0 mL đa acid yếu H3A (C0; Ka1, Ka2, Ka3)
- Điểm tương đương 1:
bằng NaOH (C). (Giả thiết: Ka1 >> Ka2 >> Ka3) Phản ứng chuẩn độ:
Nấc 1: H3A + NaOH NaH2A + H2O
Nấc 2: NaH2A + NaOH Na2HA + H2O
Nấc 3: Na2HA + NaOH Na3A + H2O
+ Gọi V là thể tích NaOH (ml) nhỏ vào ở thời điểm
nào đó trong quá trình chuẩn độ Mức độ định phân: F = CV / C0V0 2
NST Đào Tú Anh 0986666904. Chăm chỉ luyện tập mới có kết quả!!!
CHUYÊN ĐỀ: CHUẨN ĐỘ ACID – BASE 2019
- Điểm tương đương 2
- Điểm tương đương 3:
VD4: Hãy phác họa đường định phân và lựa chọn chất chỉ thị cho phép chuẩn độ 50,00 ml dung dịch H3PO4 0,1
M bằng dung dịch NaOH 0,1 M. Biết: H3PO4 có pKa1 = 2,12; pKa2 = 7,21; pKa3 = 12,36 Có thể nhận ra được tất
cả các ĐTĐ của quá trình chuẩn độ không? Bài tập:
a) Chuẩn độ 20,00 mL dung dịch H3PO4 bằng NaOH 0,1 M với chỉ thị Metyl da cam thì tiêu tốn hết 17,40
ml NaOH. Cho biết sự thay đổi màu sắc dung dịch ở ĐTĐ và tính nồng độ H3PO4 trong dung dịch.
b) Câu hỏi tương tự nếu chuẩn độ với chỉ thị Phenolphatalein.
6) Chuẩn độ đa base bằng acid mạnh
Chuẩn độ V 0 mL dung dịch đa base yếu Na 3 A (C 0 )
- Điểm tương đương 1:
bằng HCl (C). Gọi: K a1 , K a2 , K a3 là các hằng số acid của đa acid yếu H 3 A Phản ứng chuẩn độ:
Nấc 1: Na 3 A + HCl Na 2 HA + NaCl
Nấc 2: Na 2 HA + HCl NaH 2 A + NaCl
Nấc 3: NaH 2 A + HCl H 3 A + NaCl
+ Gọi V là thể tích HCl (ml) nhỏ vào ở thời điểm nào
đó trong quá trình chuẩn độ
+ Mức độ định phân: F = CV / C 0 V 0
- Điểm tương đương 2:
- Điểm tương đương 3:
BÀI TOÁN CHUẨN ĐỘ ACID BASE VÀ SAI SỐ CHỈ THỊ
Các bước xây dựng đường cong chuẩn độ: 3
NST Đào Tú Anh 0986666904. Chăm chỉ luyện tập mới có kết quả!!!
CHUYÊN ĐỀ: CHUẨN ĐỘ ACID – BASE 2019
Bước 1: Phải xác định rõ thể tích có thay đổi hay không (dựa vào đề hoặc tự chọn)
Bước 2: Xác định sai số chuẩn độ: dựa vào đề hoặc phải lựa chọn Bước
3: Chọn 5 điểm để xác định pH:
1-bắt đầu; 2-thường 90% hoặc 99%; 3- tương đương – ss; 4 – tương đương ;5- tương đương + ss
Bước 4: Nhận xét bước nhảy chú ý viết 3 giá trị pH theo tứ tự (TĐ - SS; TĐ; TĐ + SS)
Xác định sai số chỉ thị
Sai số gây ra do điểm kết thúc không trùng với điểm tương đương. Có 2 loại sai số:
SS(-) là sai số khiến cho kết quả phân tích < giá trị thực
SS(+) là sai số khiến cho kết quả phân tích > giá trị thực
Bước 1: Xác định loại sai số (là sai số âm hay dương) dựa vào giá trị pT và của bước nhảy Bước 2: Áp dụng công thức:
SS(-) = * 100% ( lưu ý đây chỉ là về mặt độ lớn khi kết luận phải thêm dấu “-“ vào đằng trước để thể hiện đó là sai số âm)
SS(+) = * 100% ( lưu ý đây chỉ là về mặt độ lớn khi kết luận phải thêm dấu “+“ vào đằng trước để thể hiện đó là sai số dương) • Lựa chọn chỉ thị
Cách 1: Việc lựa chọn chỉ thị phụ thuộc vào khoảng chuyển màu và giá trị pT của chỉ thị đó: bước nhảy phải
chứa điểm tương đương, Còn tiêu chí về khoảng chuyển màu không bắt buộc phải tuân thủ nghiêm ngặt.
Cách 2: Dựa vào sai số chỉ thị tính được so với ngưỡng sai số chấp nhận: Nếu sai số tính được nhỏ hơn ngưỡng
thì chấp nhận và ngược lại.
Khoảng chuyển màu là khoảng pH mà tại đó chất chỉ thị đổi màu
pT là giá trị mà tại đó sự đổi màu của chất chỉ thị là rõ nhất. cũng được hiểu là giá trị pH khi dừng chuẩn
độ (đây là một giá trị mang tính quy ước)
• Lựa chọn chỉ thị tối ưu
Chỉ thị tối ưu là chỉ thị có sai số nhỏ nhất (về mặt độ lớn)
• Xây dựng điều kiện chuẩn độ riêng biệt
Câu 9: Chuẩn độ một hỗn hợp 2 acid yếu HA1 (pka1) và HA2 (pka2). CMR nếu
pka1-pka2 ≥ 4 thì có thể chuẩn độ riêng biệt 2 acid trên với sai số 1%.
Từ đó xây dựng điều kiện để chuẩn độ riêng biệt được 2 acid trên với sai số 0,1%.
Câu 1: Đề D2K57 – 2 4
NST Đào Tú Anh 0986666904. Chăm chỉ luyện tập mới có kết quả!!!
CHUYÊN ĐỀ: CHUẨN ĐỘ ACID – BASE 2019
Chứng minh điều kiện để định lượng riêng biệt 2 acid trong hôn hợp với sai số 0,1%. Xét cụ thể trong trường hợp
2 acid HA1 (pk1 = 4) và HA2 (pk2 = 10,5) xem có định lượng được không?
Câu 2: (3,5 điểm) K70-02
Khi chuẩn độ dung dịch Na3PO4 0,1N bằng HCl 0,1N
1. Có thể chuẩn độ được riêng biệt từng nấc với sai số chỉ thị là bao nhiêu?
Câu 3: (3,0 điểm) Đề K72.4
Thực hiện phép chuẩn độ 25,00 ml dung dịch Na2CO3 0,12M bằng dung dịch HCl 0,15M
1. Giải thích bằng tính toán cụ thể tại sao bước nhảy thứ 2 thì có thể chuẩn độ được với sai số 1% còn bước nhảy 1 thì không?
Xây dựng đường cong chuẩn độ Câu 1: Đề 63-01
Khảo sát sự biến đổi của pH, vẽ đường cong chuẩn độ, nhận xét chọn chỉ thị khi định lượng HCOOH 0,1N bằng
dung dịch NaOH 0,1N với sai số 0,1%. Biết ka = 1,77.10-4 và coi sự thay đổi thể tích không đáng kể.
Câu 1: (3 điểm) Đề K6503
Xây dựng đường cong chuẩn độ H3AsO4 0,05M bằng dung dịch NaOH 0,05M. Về lý thuyết có thể lựa chọn những
chỉ thị nào cho mỗi điểm tương đương?
Hãy chịn một chỉ thị ở 1 điểm tương đương để tính sai số chỉ thị.
Câu 1: (3 điểm) Đề K66-06
Khảo sát sự biến đổi pH, vẽ đường biễu diễn định lượng, nhận xét và chọn chất chỉ thị khi định lượng dung dịch
ethylamine 0,1N (kb = 4,28.10-4) bằng dung dịch HCl 0,1N với sai số không quá 0,1% (Bỏ qua sự tháy đổi về thể tích)
Câu 1: (3 điểm) Đề LTK4401
Khảo sát sự biến đổi của pH; vẽ đường cong chuẩn độ; nhận xét và chọn chỉ thị khi định lượng dung dịch HCOOH
0,1N bằng dung dịch NaOH 0,1N với sai số không quá 0,1% Cho biết ka = 1,77.10-4 và coi thể tích không đáng kể. Câu 1: Đề LT K4907
Khảo sát đường biểu diễn định lượng NaOH 0,1N bằng HCl 0,1N
Câu 1: (3,5 điểm) Đề LTK4601
Khảo sát sự biến đổi của pH, vẽ đường cong chuẩn độ, nhận xét và chọn chỉ thị khi định lượng dung dịch
ammoniac 0,1500N bằng dung dịch HCl 0,1500N với sai số không quá 0,1% (Coi thể tích thay đổi không đáng kể).
Câu 1: (3,5 điểm) Đề LTK4702 5
NST Đào Tú Anh 0986666904. Chăm chỉ luyện tập mới có kết quả!!!
CHUYÊN ĐỀ: CHUẨN ĐỘ ACID – BASE 2019
Xây dựng đường cong chuẩn độ H3AsO4 0,05M bằng dung dịch NaOH 0,05M. Về lý thuyết, có thể lựa chọn chỉ
thị nào cho mỗi điểm tương. Hãy chọn một chỉ thị ở 1 điểm tương đương để tính sai số chỉ thị.
Câu 3: (3,5 điểm) Đề LTK4802
Chuẩn độ dung dịch NH4OH 0,1M bằng dung dịch HCl 0,1M a,
Tính pH của dung dịch ở điểm tương đương
b, Tính bước nhảy của đường định phân. Cần dùng chỉ thị có pT bằng bao nhiêu để sai số chỉ thị không quá 0,1%?
Có nên dùng phenolphthalein (pT=9) làm chỉ thị trong pháp chuẩn độ này không? Giải thích. Cho pk(NH4OH) = 4,75
Câu 4: Giả sử chuẩn độ acid yếu HA 0,1M bằng dung dịch chuẩn NaOH 0,1M với chỉ thị có pT = 7 thì giá trị pka
của acid HA phải nằm trong khoảng nào để sai số không quá 0,1%. Tính sai số chỉ thị và lựa chọn chỉ thị
Câu 1: Cho 20,0 ml dung dịch CH3COOH 0,1M (pka =4,75). Nếu chuẩn độ dung dịch trên bằng dung dịch NaOH
0,1M và dừng chuẩn độ khi pH=7 thì sai số mắc phải bằng bao nhiêu? Câu 2: (K70-06)
a, Thêm acid HCl 0,1M vào dung dịch triethylamin 0,01M để pha dung dịch đệm. Để thu được dung dịch có pH
= 10,5 thì số ml HCl cần cho vào 100ml triethylamin 0,01M là bao nhiêu? Biết pka (dạng acid-Triethylamin) = 10,75.
b, Nếu coi đây là một phép chuẩn độ thì tính đến pH này đã chuẩn độ được bao nhiêu %? Nếu trong phòng thí
nghiệm chỉ có 2 loại chỉ thị là đỏ trung tính và đỏ methyl thì có thể dùng loại chỉ thị nào cho phản ứng này?
Câu 2: (3,5 điểm) K70-02
Khi chuẩn độ dung dịch Na3PO4 0,1N bằng HCl 0,1N
2. Có thể chuẩn độ được riêng biệt từng nấc với sai số chỉ thị là bao nhiêu?
3. Xây dựng đường cong chuẩn độ bỏ qua sự thay đổi thể tích
4. Lựa chon một chỉ thị để xác định được mỗi điểm tương đương
Câu 3: (3,0 điểm) Đề K72.4
Thực hiện phép chuẩn độ 25,00 ml dung dịch Na2CO3 0,12M bằng dung dịch HCl 0,15M
1. Điền các giá trị pH vào bảng sau (có tính đến sự thay đổi thể tích)
VHCl cho vào (ml) 19,00 20,00 21,00 39,80 40,00 40,20 pH dung dịch
2. Giải thích bằng tính toán cụ thể tại sao bước nhảy thứ 2 thì có thể chuẩn độ được với sai số 1% còn bước nhảy 1 thì không? Câu 1: ĐHBK
Chuẩn độ V0 ml dung dịch acid HA bằng NaOH cùng nồng độ 0,1M. Xác định ka để bước nhảy pH là ΔpH = 2,55 với sai số +/-0,1%. 6
NST Đào Tú Anh 0986666904. Chăm chỉ luyện tập mới có kết quả!!!
CHUYÊN ĐỀ: CHUẨN ĐỘ ACID – BASE 2019
Nếu sử dụng chỉ thị metyl đỏ pT = 5 và phenolphthalein pT = 9 thì kết thúc chuẩn độ kết quả định phân được bao nhiêu %? Câu 1:
a, Chuẩn độ 50,0 mL dung dịch NH3 0,01M bằng dung dịch HCl 0,02M. Tính pH 10,0; 25,0; 26,0 mL dung dịch
HCl. Biết kb = 1,75.10-5 b, Tính sai số khi sử dụng chỉ thị Methyl da cam pT=5,0 và Phenolphtalein pT=9,0. Câu 2: (5 điểm)
a, Tính pH tại thời điểm khi thêm 99,5 mL; 100 mL; 100,5 mL dung dịch HCl 0,1M vào 100,0 mL dung dịch NH3
0,1M cho kb = 10-4,75 b, Theo em có thể sử dụng chỉ thị nào trong 2 chỉ thị sau cho quá trình chuẩn độ trên để có sai số nhỏ nhất
1. Methyl đỏ có khoảng chuyển màu từ 4,2-6,3 màu của dạng acis-base là đỏ-vàng
2. Phenolphthalein: khoảng chuyển màu 8,3-10,0 màu của dạng acid-base là không màu-màu hồng Miêu
tả sự chuyển màu của chỉ thị và tính sai số chỉ thị.
Câu 1: Chuẩn độ dung dịch acid acetic 0,1N (dưới bình tam giác) bằng dung dịch NaOH 0,1N (trên buret) (giá trị
pH được xác định liên tục bằng thiết bị phù hợp)
a, Xây dựng đường cong chuẩn độ chấp nhận sai số là 0,1% (bỏ qua thay đổi thể tích) b,
Tính sai số chỉ thị khi sử dụng khi sử dụng chỉ thị có pT lần lượt là 3,0; 8,0; 9,0
c, Trong số các chỉ thị phenolphatalein (pT=9,0); Bromthymol xanh (pT= 6,9); Cresol đỏ (pT=8,0) có thể sử dụng
chỉ thị nào cho phép chuẩn độ này để sai số chuẩn độ không quá 0,1%. d, Trong số những chất chỉ thị được dùng
ở câu c thì sử dụng chỉ thị nào là tối ưu nhất.
e, Nếu trong quá trình chuẩn độ trên ta chuyển NaOH xuống bình tam giác còn acid acetic lên buret thì có hợp lý
không? Nếu tiến hành như vậy thì dùng chỉ thị nào là phù hợp?
Câu 2: Tính sai số chỉ thị khi chuẩn độ acid acetic 10-3M bằng NaOH cùng nồng độ và kết thúc chuẩn độ khi pH
= 7,5 (Tính đến sự thay đổi thể tích)
Câu 3: Thể tích NaOH cần dùng để chuẩn độ 50ml acid acetic 0,2M với chỉ thị có pT = 4,0 và 7,0 là bao nhiêu ml? Câu 5:
a, Xây dựng đường cong chuẩn độ acid H3PO4 0,1M.
b, Có chuẩn độ được riêng biệt từng nấc không với sai số 1% c, Nên lựa
chọn chỉ thị theo bước nhảy nào vì sao? Và lựa chọn chỉ thị nào? d, Tính
sai số chỉ thị tương ứng với chỉ thị đã chọn (pT là điểm chính giữa khoảng
chuyển màu) Câu 6: Coi trong quá trình chuẩn độ thể tích không thay đổi
a, Tính sai số chỉ thị khi chuẩn độ Na2CO3 0,1M nấc 1 bằng HCl 0,1M khi dùng chỉ thị có pT=9 7
NST Đào Tú Anh 0986666904. Chăm chỉ luyện tập mới có kết quả!!!
CHUYÊN ĐỀ: CHUẨN ĐỘ ACID – BASE 2019
b, Tính sai số chỉ thị khi chuẩn độ H3PO4 0,1M bằng NaOH 0,1M nếu sử dụng chỉ thị có pT = 4,3 (cho nấc thứ
nhất) và pT=10 cho nấc thứ 2.
Câu 7: Cần thêm bao nhiêu ml NaOH 0,05M vào 20ml hỗn hợp HCl 0,05M và H3PO4 0,1M để được dung dịch
có pH=4 và pH=9. Từ đó tính sai số chỉ thị của mỗi chất khi chuẩn độ hỗn hợp trên bằng NaOH khi dùng chỉ thi
Metyl da cam có pT=4 và phenolphthalein có pT=9. (Bỏ qua sự thay đổi thể tích)
Câu 8: Chuẩn độ acid H3PO4 để sai số chỉ thị không vượt quá 0,05% thì phải dùng chất chỉ thị có pT bằng bao nhiêu?
Định lượng hỗn hợp
Câu 3: (3,5 điểm) Đề LTK4803
Cân 0,4307 g một mẫu xút kỹ thuật (có lẫn Na2CO3 và các tạp chất khác) rồi đem hòa tan thành dung dịch. Chuẩn
độ dung dịch này với chỉ thị phenolphtaleine thì tiêu tốn 49,08 ml dung dịch HCl 0,1734 N. Thêm vào dung dịch
vài giọt chỉ thị Metyl da cam rồi chuẩn độ tiếp tục thì tiêu tốn 7,68 ml.
a, Viết các phương trình xảy ra trong quá trình chuẩn độ b,
Tính %(kl/kl) của NaOH và Na2CO3 trong mẫu xút ban đầu.
Bài toán nghịch kết hợp chuẩn độ Câu 1:
a, Lấy chính xác 0,6000g một acid yếu HA pha thành 100 mL dung dịch. Chuẩn độ 20,0 mL dung dịch này bằng
dung dịch NaOH 0,08M. Hết 22,50 mL thì được dung dịch có pH=5,8. Còn khi thêm 25,0 mL thì đến điểm tương
đương. Tính hằng số acid HA?
b, Cần kết thúc chuẩn độ tại pH bằng bao nhiêu để sai số chuẩn độ không quá 0,1%
Câu 1: Hòa tan hết 1,25g một đơn acid vào nước được 50ml dung dịch A. Tiến hành chuẩn độ dung dịch A bằng
dug dịch chuẩn độ A bằng dung dịch chuẩn NaOH 0,09N. Biết khi thêm 8,24ml dung dịch NaOH vào dung dịch
A thì pH của dung dịch thu được là 4,30; Khi thêm 41,20ml dung dịch NaOH vào dung dịch A đạt điểm tương
đương. a, Tính pH của dung dịch tại điểm tương đương.
b, Chọn chất chỉ thị phù hợp cho phép chuẩn độ trên trong số các chỉ thị sau: Metyl da cam (3,1- 4,4); Metyl đỏ
(4,2-6,2); Phenolphtalein (8,0-10)
Câu 1: Cân chính xác 0,8203g một acid yếu HA hòa tan hết vào bình định mức 250mL. lấy 50mL dung dịch này
chuẩn độ bằng NaOH 0,1M đến điểm tương đương thì hết 20,0 mL. Biết pH tại điểm tương đương là 8,9. Tính
sai số chỉ thị khi dùng Bromocresol xanh có pT=7.
Bài toán biện luận thành phần dung dịch, chỉ thị
Câu 4: Đề D2(1995-1996)
Có 3 dung dịch có thể là một hoặc một tổ hợp nhiều thành phần của các chất NaOH; Na2CO3; NaHCO3. Để xác
định người ta đem chuẩn độ lần lượt 3 dung dịch này bằng dung dịch HCl 0,1224N. Với chỉ thị Bromocresol (có
pH chuyển màu 3,5 – 5,5) hết V1 ml với chỉ thị Phenolphtalein hết V2 ml. Kết quả như sau 8
NST Đào Tú Anh 0986666904. Chăm chỉ luyện tập mới có kết quả!!!
CHUYÊN ĐỀ: CHUẨN ĐỘ ACID – BASE 2019 Dung dịch V 1 ml HCl V 2 ml HCl Thành phần dung dịch A 40 , 45 12 , 66 NaHCO 3 + Na 2 CO 3 B 36 , 82 , 36 8 ? NaOH C 43 , 47 21 , 74 ? Na 2 CO 3
a, Hãy giải thích và cho biết thành phần của dung dịch A, B, C b,
tính hàm lượng (mg) của các chất trong các dung dịch
Câu 3: (4,0 điểm) Đề K6105
1. Hỏi chất nào trong các chất KOH, K2CO3 và KHCO3 có trong dung dịch X nếu:
a, Khi chuẩn độ dung dịch X với chỉ thị phenolphthalein và Methyl da cam thì hết những lượng HCl như nhau b,
Khi chuẩn độ dung dịch X với chỉ thị phenolphthalein thì lượng HCl cần dùng ít hơn khi chuẩn độ dung dịch X
với chỉ thị Methyl da cam 2 lần.
c, Dung dịch X không có phản ứng kiềm với phenolphthalein nhưng có thể chuẩn độ được với methyl da cam
2. Trình bày các cách định lượng (nguyên tắc, cách tiến hành) khi định lượng hỗn hợp chứa H2SO4 và
CH3COOH cùng nồng độ 0,1N
Câu 1: (3,5 điểm) Đề LTK4908
Cho hai hỗn hợp A và B. Hỗn hợp A chứa Na2CO3 và NaHCO3; B chứa Na2CO3 và NaOH. Một trong hai hỗn hợp
trên được hòa tan vào nước, tạo thành dung dịch C có V=100mL. Chuẩn độ HCl 0,2000M; nếu dùng chỉ thị
phenolphtalein, tốn hết 36,15mL HCl, nếu dùng chỉ thị metyl da cam, tốn hết 43,8mL HCl.
1. Cho biết hỗn hợp nào đã được phân tích. Vì sao?
2. Xác định % khối lượng các chất trong hỗn hợp đã phân tích.
Cho biết pH chuyển màu của Phenolphtalein từ 8,3-10,0; Metyl da cam từ 3,1-4,4
Câu 10: (T318-319) Quy trình chuẩn độ dung dịch A gồm: Na2CO3 0,04M và NaHCO3 0,04M như sau:
+ Lấy 10ml dung dịch trên cho vào bình nón, thêm vài giọt chỉ thị X và chuẩn độ bằng HCl 0,04M đến khi dung
dịch đổi màu thì dừng lại.
+ Thêm tiếp vài giọt chỉ thị Y vào dung dịch thu được ở trên. Chuẩn độ tiếp bằng HCl 0,04M đến khi dung dịch đổi màu.
a, Giải thích vì sao dung dịch Na2CO3 có thể chuẩn độ riêng nấc 1 và nấc 2. Biết pka1(H2CO3) = 6,62, pka2(H2CO3)
= 10,35 b, Lựa chọn các chất chỉ thị X, Y thích hợp từ các chất chỉ thị dưới đây.
Metyl lục (0,1-2,0); Metyl da cam (3,1-4,4); Metyl đỏ (4,2-6,2); Bromthymol xanh (6,0-7,6); Phenolphtalein (8,0-
10); Alizarin vàng (10,1-12,1)
Biết CO2 tạo thành tan hoàn toàn trong dung dịch; Độ tan của CO2 là 0,03M 9
NST Đào Tú Anh 0986666904. Chăm chỉ luyện tập mới có kết quả!!!
CHUYÊN ĐỀ: CHUẨN ĐỘ ACID – BASE 2019
c, Với mỗi trường hợp sau đây cho biết nồng độ Na2CO3 xác định được là cao hơn hay thấp hơn so với giá trị thực? Giải thích.
TH1: Pipet dùng để lấy 100ml dung dịch A chỉ lấy được 9,95ml dung dịch
TH2: Dùng Bromphenol đỏ (5,0 – 6,8) để xác định điểm tương đương thứ nhất
TH3: Có bóng khí xuất hiện ở đầu Buret trước khi tiến hành chuẩn độ, nhưng biến mất trong quá trình chuẩn độ nấc 1
TH4: Buret không được tráng bằng dung dịch HCl 0,04M sau khi được rửa sạch bằng nước cất.
Đ/số: a, Chuẩn độ được vì ka1/ka2 > 104 (sai số 1%); b, X: Phenolphtalein, Y: Metyl da cam
c, TH1: Thấp hơn; TH2: Cao hơn; TH3: Cao hơn; TH4: Cao hơn Câu 4: ĐHKHTN
Cho dãy dung dịch hãy cho biết chất nào trong các chất sau có trong mỗi dung dịch NaOH, NaHCO3, Na2CO3.
Biết rằng khi lấy 25,0 ml một trong số các dung dịch chuẩn độ bằng HCl 0,1202M với chỉ thị Phenolphtalein
pT=9 (1) và Metyl da cam pT= 4 (2) thì thể tích HCl tiêu tốn được thể hiện dưới bảng sau: Dung dịch V(1) (mL) V(2) (mL) A 22 , 43 22 , 43 B 15 , 67 42 , 13 C 29 , 64 36 , 42 D 16 , 12 32 , 23 E , 0 00 33 , 33
Căn cứ vào bảng dữ liệu hãy tính nồng độ của từng dung dịch. Biết pk a1 ( H 2 CO 3 ) = 6,35; pk a2 ( H 2 CO 3 ) = 10,33 và
M(NaOH) = 40; M(NaHCO3) = 84; M(Na2CO3) = 106.
Bài toán xây dựng khoảng chuyển màu của chất chỉ thị
Câu 2: Khoảng pH chuyển màu của chất chỉ thị acid-base là gì? Một chất acid yếu Hind có hằng số acid ka = 10-
7,3, dạng acid có màu vàng, dạng base có màu xanh. Mắt người nhận được màu của dạng acid khi nồng độ của nó
lớn hơn nồng đọ dạng base 10 lần và nhận được màu của dạng base khi nồng độ của nó lớn hơn nồng độ dạng
acid 2 lần. Tính khoảng pH chuyển màu của chất chỉ này. Chất chỉ thị pH chuyển màu pT Màu dạng acid Màu dạng base Phenolphtalein 8,0 - 10,0 9,0 Không màu Hồng Phenol đỏ 6,4 - 8,0 7,0 Vàng Đỏ Metyl đỏ 4,4 – 6,2 5,0 Đỏ Vàng Metyl da cam 3,1 – 4,4 4,0 Da cam Vàng 10
NST Đào Tú Anh 0986666904. Chăm chỉ luyện tập mới có kết quả!!!




