




Preview text:
THCS TT TU GV: Nguyễn Thị Minh
Chuyên đề: PHẢN ỨNG NHIỆT PHÂN A – LÍ THUYẾT
I/ Khái niệm - Bản chất của phản ứng: -
Khái niệm: Phản ứng nhiệt phân là phản ứng phân huỷ các hợp chất hoá học
dưới tác dụng của nhiệt độ. -
Bản chất: Phân cắt các liên kết kém bền trong phân tử hợp chất vô cơ hay hữu cơ bởi nhiệt độ. * Lưu ý:
(1) Phản ứng nhiệt phân có thể thuộc phản ứng oxi hoá - khử hoặc không: +5 -2 -1 0 VD: 2KClO3
2KCl + 3O2 : Thuộc phản ứng oxi hoá - khử. +2 +4 -2 +2 -2 +4 -2 CaCO3
CaO + CO2 : Không thuộc phản ứng oxi hoá - khử. (2)
Phản ứng điện phân nóng chảy không thuộc phản ứng nhiệt phân vì nó phân huỷ
dưới tác dụng của dòng điện một chiều.
II/ Các tr ư ờng hợp nhiệt phân:
1/ Nhiệt phân hi đ roxit:
* NX: Các bazơ không tan đều bị phân huỷ ở t0 cao: PƯ: 2M(OH)n
M2On + nH2O. (Với M khác Li; Na; K; Ca; Ba) * Lưu ý:
+ Phản ứng nhiệt phân Fe(OH)2 trong chân không (không có không khí) Fe(OH)2 FeO + H2O
+ Phản ứng nhiệt phân Fe(OH)2 có mặt không khí: 4Fe(OH)2 + O2 2Fe2O3 + 4H2O
+ Với AgOH và Hg(OH)2 : Không tồn tại ở nhiệt độ thường. Nếu sinh ra sau phản ứng bị phân huỷ. 2AgOH Ag2O màu trắng + H2O 2 Hg(OH) HgO + H2O Ở nhiệt
độ cao (ánh sáng) thì Ag2O và HgO tiếp tục bị phân huỷ: 2Ag2O 4Agmàu xám + O2 2HgO 2Hg + O2
2/ Nhiệt phân muối: a/ Nhiệt phân
muối amoni (NH + 4 ):
* NX: - Tất cả các muối amoni đều kém bền nhiệt và bị phân huỷ khi nung nóng. -
Nguyên nhân: Do cấu trúc của ion NH + 4 không bền. -
Sản phẩm của phản ứng nhiệt phân phụ thuộc vào bản chất của
aniongốc axit trong muối (có hay không có tính oxi hoá). * TH 3- 2-
1: Nếu anion gốc axit trong muối không có tính oxi hoá (VD: X-; PO4 ; CO3
...) với X là halogen (Cl, Br, I) PƯ: (NH4)nA
nNH3 + HnA : Không thuộc phản ứng oxi hoá khử. 1
THCS TT TU GV: Nguyễn Thị Minh VD: NH4Cl (rắn)
NH3 (k) + HCl (k) (NH4Cl có tính thăng hoa) (NH4)2CO3 (rắn)
NH3 (k) + CO2 (k) + H2O (hơi) (bột nở) * TH - - 2-
2: Nếu anion gốc axit trong muối có tính oxi hoá (VD: NO3 ; NO2 ; Cr2O4 ...)
thì sản phẩm của phản ứng không phải là NH3 và axit tương ứng: VD: NH4NO3 N2O + 2H2O
(Nếu nung ở > 5000C có thể cho N2 và H2O) NH4NO2 2 N + 2H2O (NH 2 4)2 Cr O4 Cr2O3 + N2 + 4H2O
b/ Nhiệt phân muối nitrat (NO -3):
* NX: - Tất cả các muối nitrat đều dễ bị nhiệt phân. -
Nguyên nhân: Do cấu trúc của ion NO -3 kém bền với nhiệt. -
Sản phẩm của quá trình nhiệt phân phụ thuộc vào khả năng hoạt
động củakim loại có trong muối. Có 3 trường hợp: TH1: TH2 TH3
K Ba Ca Na Mg Al Zn Fe Co Ni Sn Pb H2 Cu Hg Ag Pt Au
Muối nitrit (NO -2) + O2 Oxit KL + NO2 + O2 Kim loại+NO2+O2 VD: 2NaNO3 2NaNO2 + O2 2Cu(NO3)2 2CuO + 4NO2 + O2 2AgNO3 2Ag + 2NO2 + O2 * Lưu ý: + Ba(NO3)2 thuộc TH2
+ Tất cả các phản ứng nhiệt phân muối nitrat đều thuộc phản ứng oxi hoá - khử.
+ Khi nhiệt phân muối Fe(NO3)2 trong môi trường có hoặc không có không
khí đều thu được Fe2O3, NO2 và O2 vì O2 sinh ra phản ứng với FeO chuyển toàn bộ FeO
thành Fe2O3 và O2 vẫn còn dư.
2Fe(NO3)2 2FeO + 4NO2 + O2 (1) 4Fe(NO3)2
4FeO + 8NO2 + 2O2 (1’) (nhân đôi hệ số) 4FeO + O2 2Fe2O3 (2) Viết gộp (1’,2): 4Fe(NO3)2 2Fe2O3 + 8NO2↑ + O2↑ (3)
+ Nếu phản ứng hoàn toàn (nung đến khối lượng không đổi) thì chất rắn
trong bình sau phản ứng là Fe2O3. c/ Nhiệt phân muối hiđrocacbonat và muối cacbonat:
* Nhiệt phân muối hiđrocacbonat (HCO -3) :
NX: Tất cả các muối hiđrocacbonat đều kém bền nhiệt và bị phân huỷ ngay khi đun nóng dung dịch. 2
THCS TT TU GV: Nguyễn Thị Minh PƯ: 2M(HCO3)n M2(CO3)n + nCO2 + nH2O VD: 2NaHCO3 Na2CO3 + CO2 + H2O
* Nhiệt phân muối cacbonat (CO 2- 3 ) :
NX: Các muối cacbonat không tan (trừ muối amoni) đều bị phân huỷ bởi nhiệt. PƯ: M2(CO3)n M2On + CO2 VD: CaCO3 CaO + CO2 * Lưu ý:
- Các phản ứng nhiệt phân muối cacbonat và hiđrocacbonat đều không thuộc phản ứng oxi hoá - khử.
- Phản ứng nhiệt phân muối FeCO3
+ trong môi trường chân không (không có không khí) FeCO3 FeO + CO2
+ trong môi trường không khí 4FeCO3 + O2 2Fe2O3 + CO2
d/ Nhiệt phân muối chứa oxi của clo:
* NX: Tất cả các muối chứa oxi của clo đều kém bền với nhiệt, dễ bị phân huỷ khi
nung nóng và phản ứng phân huỷ đều thuộc phản ứng oxi hoá - khử. VD1: 2NaClO
2NaCl + O2 (thuộc phản ứng oxi hoá nội phân tử). VD2: Phản
ứng nhiệt phân muối KClO3 xảy ra theo 2 hướng. 4KClO3 KCl + 3KClO4 (1)(Phản ứng tự oxi hoá - khử).
2KClO3 2KCl + 3O2 (2) (phản ứng oxi hoá nội
phân tử). VD3: 2CaOCl2 2CaCl2 + O2 (clorua vôi)
e/ Nhiệt phân muối sunfat (SO 2- 4 ):
- Nhìn chung các muối sunfat đều khó bị phân huỷ bởi nhiệt so với các muối khác
B- BÀI TẬP PHẢN ỨNG NHIỆT PHÂN
Câu 1: Nung 13,4 gam hỗn hợp 2 muối cacbonat của 2 kim loại hóa trị 2, thu được
6,8 gam chất rắn và khí X. Lượng khí X sinh ra cho hấp thụ vào 75 ml dung dịch
NaOH 1M, khối lượng muối khan thu được sau phản ứng là bao nhiêu?
Câu 2: Khi nung hỗn hợp các chất Fe(NO3)2; Fe(OH)3; FeCO3 trong không khí đến
khối lượng không đổi, cho biết chất rắn thu được gồm các chất nào? Viết công thức
tính khối lượng chất rắn? Đáp án: 4Fe(NO3)2 2Fe2O3 + 8NO2 + O2 2Fe(OH)3 Fe O 2 3 + 3H2O 4FeCO3 2 + O 2Fe2O3 + 4CO2
Chất rắn sau phản ứng gồm: Fe2O3 3
THCS TT TU GV: Nguyễn Thị Minh
mrắn = mmuối - mkhí = mmuối -
Câu 3: Thu được chất nào khi đun nhẹ muối amoni nitrit? A. N2; H2O B. N2O; H2O C. H2; NH3; O2 D. H 2; N2; H2O Đáp án: NH4NO2 N2 + 2H2O
Câu 4: Nhiệt phân hoàn toàn 1 muối amoni của axit cacbonic sau đó dẫn toàn bộ
sản phẩm vào 50 gam dung dịch H2SO4 19,6 % thì đủ tạo một muối trung hoà có
nồng độ 23,913%. Tìm công thức và khối lượng của muối ban đầu? Đáp án: Tính Nhiệt
phân muối amoni của axit cacbonic có 2 trường hợp: (NH4)2CO3 2NH3 + CO2+ H2O (1) NH4HCO3 NH3 + CO2+ H2O (2)
Nhiệt phân muối amoni của axit cacbonic sản phẩm thu được chứa CO2, NH3 và
H2O. Khi dẫn sản phẩm khí vào 50 gam dung dịch H2SO4 19,6 % thì đủ tạo một muối
trung hoà vậy xảy ra phản ứng: 2NH3 + H2SO4 (NH4)2SO4 0,2 0,1 0,1 (mol) Ta có: mdd sau phản ứng= mdd sau phản ứng
= 55,2 – 50 – 0,2.17 = 1,8 (gam) 1,8 : 18 = 0,1 (mol)
Ta có: = 0,1 : 0,2 = 1 : 2. Vậy xảy ra phản ứng (1). Muối là (NH4)2CO3 Câu 5: Đem
nung nóng m gam Cu(NO3)2 một thời gian rồi dừng lại, làm nguội và đem cân thấy
khối lượng giảm 0,54 gam so với ban đầu. Khối lượng muối Cu(NO3)2 đã bị nhiệt phân là bao nhiêu? Đáp án:
Gọi số mol O2 sinh ra là x mol 2Cu(NO3)2 2CuO + 4NO2↑ + O2↑ 2x 2x 4x x (mol)
Khối lượng giảm đi là khối lượng NO2 và O2.
Ta có: 46.4x + 32.x = 0,54 x = 0,0025 (mol)
Khối lượng muối Cu(NO3)2 đã bị nhiệt phân là: 2.0,0025.188 = 0,94 (gam) Câu 6:
Tiến hành nung 6,06g muối nitrat của một kim loại kiềm thu được 5,1g muối nitrit
.Tìm công thức muối nitrat của kim loại đem phân hủy? Đáp án:
Gọi CTHH của muối nitrat là MNO3, số mol là x mol 2MNO3 2MNO2 + O2↑ 4
THCS TT TU GV: Nguyễn Thị Minh x x 0,5x (mol)
mkhí = 6,06 – 5,1 = 0,96 32.0,5x = 0,96 x= 0,06 (mol) m : n = 6,06
: 0,06 = 101 M + 62 = 101 M = 39 (gam). M là kali. Vậy muối là KNO3
Câu 7: Nung 316g KMnO4 một thời gian thấy còn lại 300g chất rắn. Tính hiệu suất phản ứng? Đáp án: Cách 1: = 316 : 158 = 2 mol
Gọi số mol KMnO4 phản ứng là là x mol 2KMnO4 K2MnO4 + MnO2 + O2↑ x 0,5x 0,5x 0,5x (mol) = 2 – x (mol)
Chất rắn còn lại là KMnO4 dư, K2MnO4, MnO2.
158(2-x) + 0,5x.197 + 0,5x.87 = 300 x = 1 H = Cách 2: 2KMnO4 K2MnO4 + MnO2 + O2↑ x 0,5x 0,5x 0,5x (mol)
mkhí = 316 – 300 = 16 32.0,5x = 16 x = 1 (mol) H =
Câu 8: Nhiệt phân hoàn toàn hỗn hợp MgCO3; CaCO3 rồi cho toàn bộ khí thoát ra
(khí A) hấp thụ vừa hết bằng dung dịch Ca(OH)2 thu được kết tủa B và dung dịch C.
Hỏi A, B, C lần lượt là những chất gì? Đáp án: Phương trình phản ứng: 3 MgCO MgO + CO2 CaCO3 CaO + CO2 A là CO2, B là CaCO3
Khí CO2 hấp thụ vừa hết bằng dung dịch Ca(OH)2 thu được kết tủa B và dung dịch
C vậy trong C chứa chất tan xảy ra 2 TH:
TH1: Ca(OH)2 dư, dung dịch C chứa Ca(OH)2 dư Ca(OH)2 + CO2 CaCO3↓ TH2: CO2 dư dung dịch C chứa Ca(HCO3)2 Ca(OH)2 + CO2 CaCO3↓ + H2O Ca(OH)2 + CO2 Ca(HCO3)2 5
THCS TT TU GV: Nguyễn Thị Minh
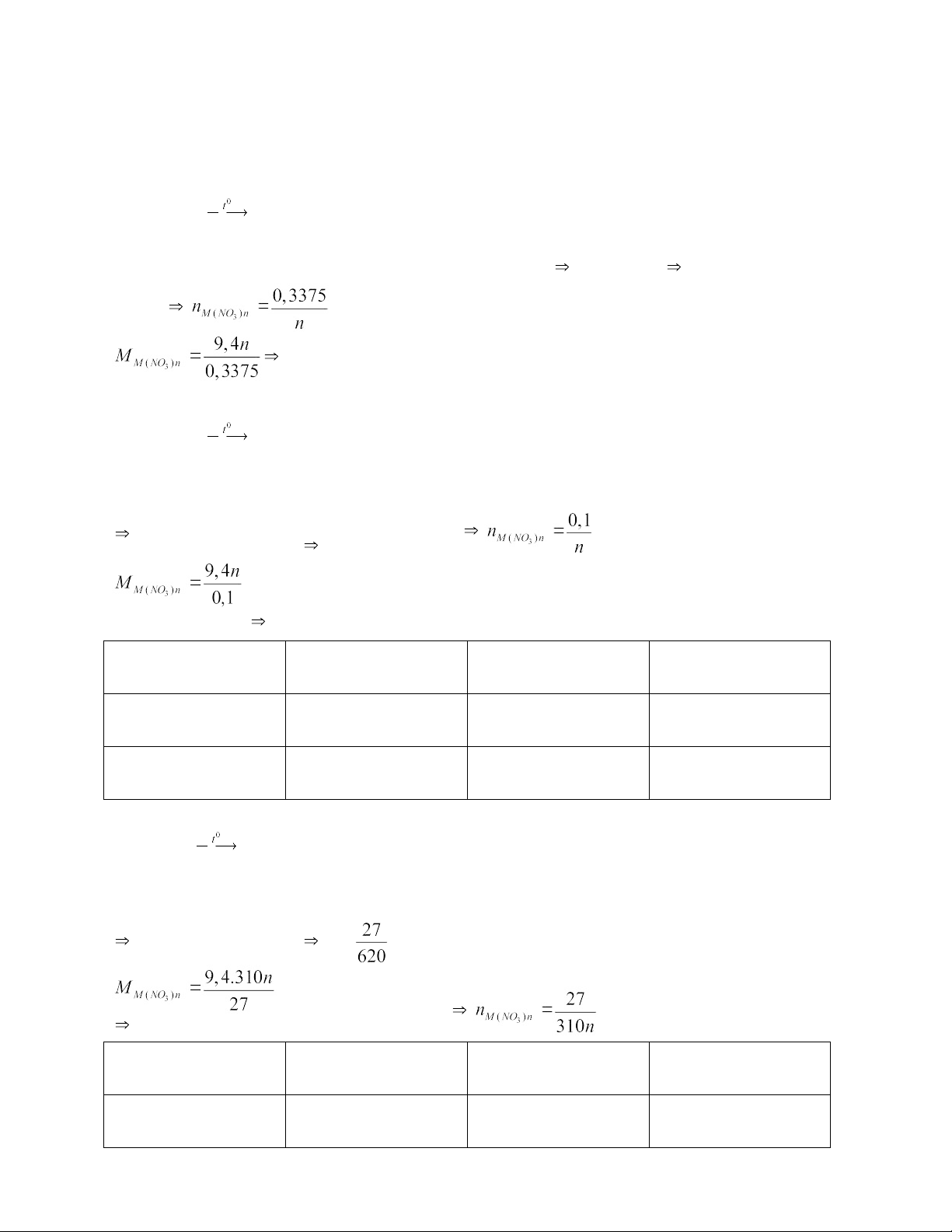
Câu 9: Nhiệt phân hoàn toàn 9,4 gam một muối nitrat của kim loại R thì sau phản
ứng ta thu được 4 gam chất rắn. Xác định công thức phân tử của muối trên. Gọi
CTHH của muối nitrat là R(NO3)n, (n€ N*, n≤ 3), gọi số mol oxi là x mol mkhí = 9,4 – 4 = 5,4 (gam) TH1: 2R(NO3)n 2R(NO2)n + nO2↑ 2x/n x (mol)
Khối lượng chất rắn giảm đi là khối lượng khí oxi 32x = 5,4 x= 0,16875 ( mol) 0,3375(M + 62n) = 9,4n (gam)
0,3375M = -11,525 (loại) TH2: 2R(NO3)n R2On + 2nNO2 + n/2O2↑ 4x/n 4x x (mol)
Khối lượng chất rắn giảm đi là khối lượng khí NO2 và O2
32.x + 46.4x = 5,4 x= 0,025 (mol) = 94n (gam) M + 62n = 94n M = 32n n 1 2 3 M 32 64 96 Kết quả Loại Cu(NO3)2 Loại
Vậy muối là Cu(NO3)2 TH3: R(NO3)n R+ nNO2 + n/2O2↑ 2x/n 2x x (mol)
Khối lượng chất rắn giảm đi là khối lượng khí NO2 và O2 32 .x + 46.2x = 5,4 x= (gam) M = 45,926n (mol) n 1 2 3 M 45,926 91,852 137,778 6
THCS TT TU GV: Nguyễn Thị Minh Kết quả Loại Loại Loại
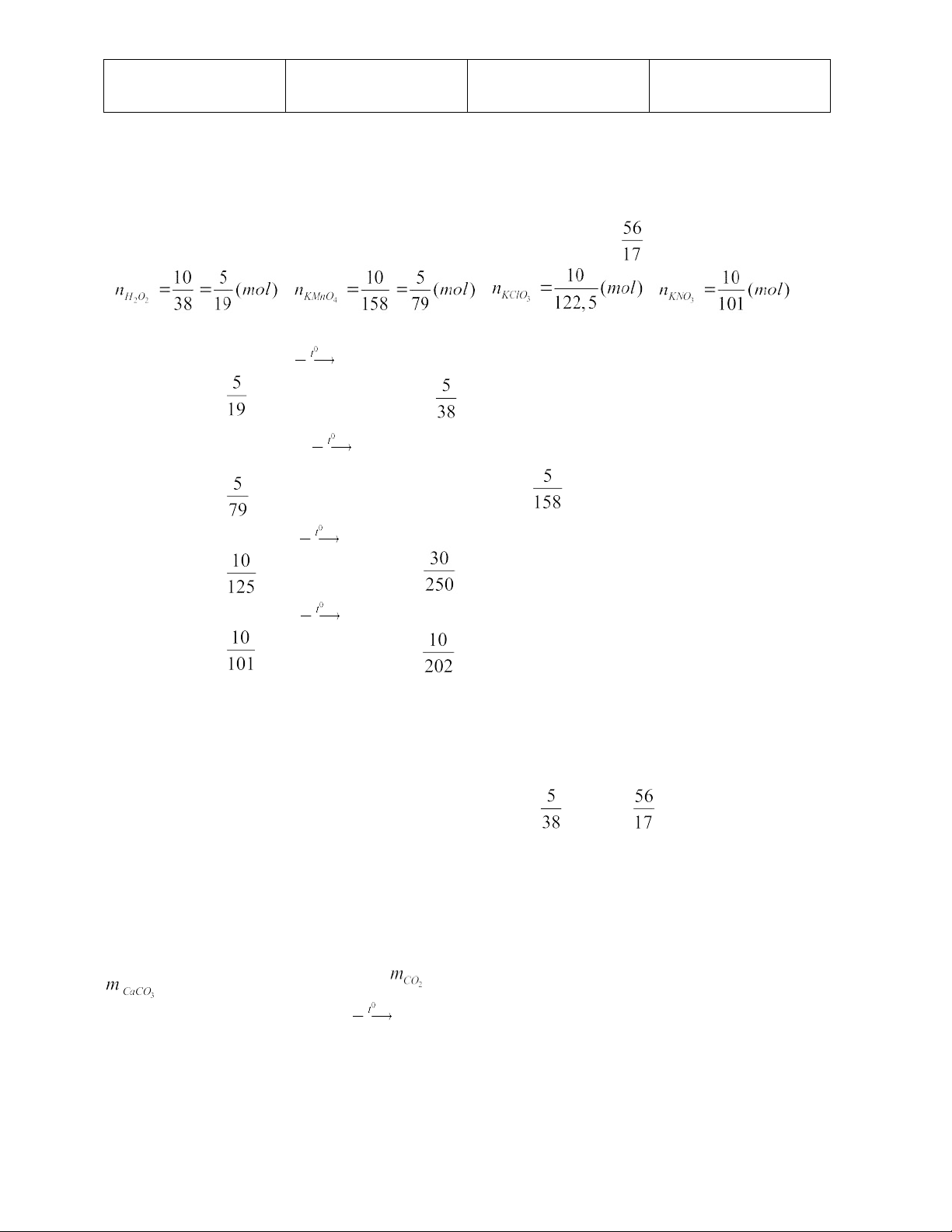
Câu 10: Khí oxi thu được khi nhiệt phân các chất: H2O2, KMnO4, KClO3, KNO3 .
Khi nhiệt phân 10 gam mỗi chất trên, thể tích khí oxi thu được ở điều kiện tiêu chuẩn lớn nhất là bao nhiêu?
* Đáp án: Khi nhiệt phân 10 gam mỗi chất trên, thể tích khí oxi thu được ở điều
kiện tiêu chuẩn lớn nhất là nhiệt phân 2 H O2 , thể tích O2 là lit ; ; ; 2H2O2 2H2O + O2 (mol) 2KMnO4 K2MnO4 + MnO2 + O2 (mol) 2KClO3 2KCl + 3O 2 (mol) 2KNO3 KNO2 + O2 (mol)
So sánh số mol oxi sinh ra ở 4 phương trình phản ứng ta thấy số mol oxi sinh ra do
nhiệt phân H2O2 là lớp nhất. Do trong cùng điều kiện nhiệt độ, áp suất thì thể tích tỉ lệ thuận với số mol.
Vậy: Khi nhiệt phân 10 gam mỗi chất trên, thể tích khí oxi thu được ở điều kiện tiêu
chuẩn lớn nhất là nhiệt phân H2O2, thể tích O2 là .22,4 = lit
Chú ý: Nếu đề bài yêu cầu so sánh thể tích khí thì chỉ cần sao sánh số mol vì: trong
cùng điều kiện nhiệt độ, áp suất thì thể tích tỉ lệ thuận với số mol.
Câu 11: Một loại đá vôi chứa 80% CaCO3, phần còn lại là tạp chất trơ. Nung m gam
đá một thời gian thu được chất rắn nặng 0,78m gam. Tính hiệu suất phân huỷ CaCO3 * Đáp án: H = 50% = m.80% = 0,8m (gam).
= 0,8m – 0,78m = 0,02 m CaCO3 CaO + CO2 Theo PTPƯ: 1 1 1 (mol) 100 56 44 (gam) 7
THCS TT TU GV: Nguyễn Thị Minh m ← 0,02m (gam) = m : 0,8m).100% 56,82% = =(
Chú ý: Theo PTPƯ có thể tính theo số mol hoặc khối lượng hoặc thể tích.
CT tính hiệu suất:
Câu 13: Nhiệt phân hoàn toàn hỗn hợp 2 muối NH4HCO3; (NH4)2CO3 thu được hỗn
hợp khí và hơi trong đó CO2 chiếm 30% về thể tích. Tính tỉ lệ số mol NH4HCO3; (NH4)2CO3?
Đáp án: tỉ lệ số mol NH4HCO3; (NH4)2CO3 là 2:1
Câu 14: Nhiệt phân hoàn toàn 5,24 gam hỗn hợp Cu(NO3)2 và Mg(NO3)2 đến khối
lượng không đổi thì sau phản ứng phần chất rắn giảm 3,24 gam. Tính thành phần %
khối lượng mỗi muối trong hỗn hợp ban đầu?
Đáp án: Thành phần % khối lượng mỗi muối Cu(NO3)2 và Mg(NO3)2 trong hỗn hợp
ban đầu là: 71,76% và 28,24%
Câu 15: Nung nóng hoàn toàn 27,3 gam hỗn hợp NaNO3; Cu(NO3)2. Hỗn hợp khí
thoát ra được dẫn vào nước dư thì thấy có 1,12 lít khí (đktc) không bị hấp thụ (lượng
O2 hoà tan không đáng kể). Tính % khối lượng Cu(NO3)2 trong hỗn hợp ban đầu?
Đáp án: 1,12 lít khí (đktc) không bị hấp thụ theo PTPƯ: 4NO2 + O2 + 2H2O → 4HNO3
khối lượng Cu(NO3)2 là 18,8 gam, %khối lượng Cu(NO3)2 là 68,86%
Câu 16: Nhiệt phân hoàn toàn m gam Cu(NO3)2 thu được 0,56 lít hỗn hợp khí X
(đktc) và chất rắn Y. Tính giá trị của m ?
Đáp án: m = 1,88 gam.
Câu 17: (Chuyên Đồng Nai 2019 – 2020)
Cho hỗn hợp X gồm FeS và FeS2. Nung m gam X trong một bình kín dung tích
không đổi chứa không khí đến khi các phản ứng xảy ra hoàn toàn, thu được chất rắn
Y và hỗn hợp khí Z có thành phần phần trăm theo thể tích của O2 và SO2 lần lượt là
4,63% và 10,6% còn lại là phần trăm của N2. Hòa tan chất rắn Y trong dung dịch
H2SO4 vừa đủ thu được dung dịch T. Cho dung dịch Ba(OH)2 dư vào T, lọc lấy kết
tủa làm khô rồi nung ở nhiệt độ cao tới khối lượng không đổi, thu được 12,885 gam
chất rắn (coi không khí chỉ gồm O2 và N2 với tỉ lệ phần trăm về thể tích lần lượt là 20% và 80%).
a. Viết các PTHH xảy ra. b. Tính m.
* Chú ý: Khi nhiệt phân muối trong không khí các chất MS, MS2, M2S (M là
kim loại) thì oxi tham gia phản ứng tạo thành khí SO2 và oxit kim loại trong đí
M có hoá trị cao nhất Hướng dẫn: 8
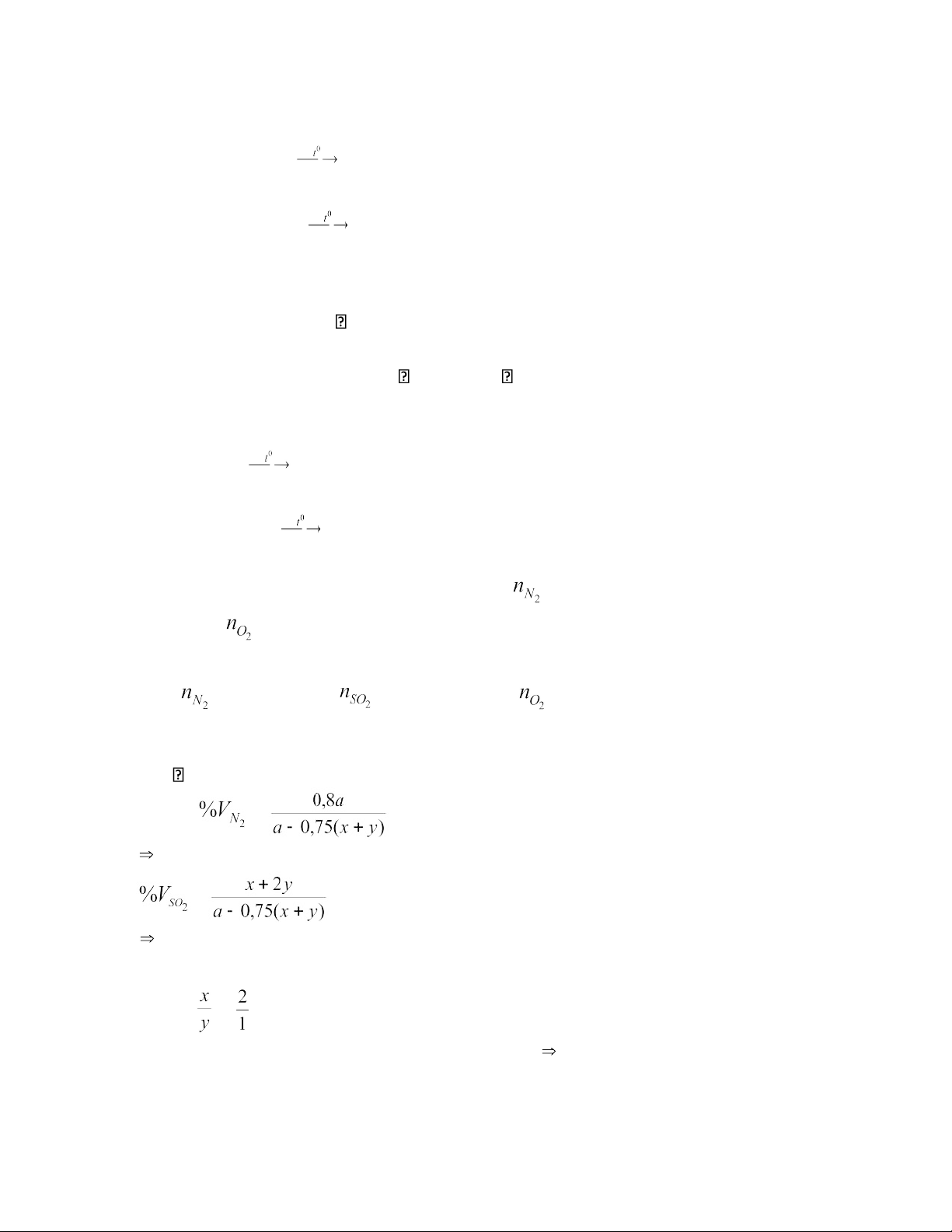
THCS TT TU GV: Nguyễn Thị Minh a.
Đặt x, y là số mol của FeS và FeS2 trong X
a là số mol của không khí trong bình trước khi nung 4FeS + 7O 2 2Fe2O3 + 4SO2 x 1,75x 0,5x x (mol) 4FeS2 + 11O2 2Fe2O3 + 8SO2 y 2,75y 0,5y 2y (mol)
Chất rắn Y là Fe2O3 có số mol: 0,5(x+y)
Fe2O3 + 3H2SO4 Fe2(SO4)3 + 3H2O 0,5(x+y) 0,5(x+y) (mol)
Fe2(SO4)3 + 3Ba(OH)2 → 2Fe(OH)3 + 3BaSO4
0,5(x+y) (x+y) 1,5(x+y) (mol) Khi nung kết tủa: BaSO4 không đổi 1,5(x+y) 2Fe(OH)3 Fe2O3 + 3H2O (x+y) 0,5(x+y) (mol) b.
Số mol các khí trước khi nung: = 0,8a (mol); = 0,2a (mol) Số mol các khí sau khi nung: = 0,8a (mol); = (x+2y) (mol); dư = 0,2a – 1,75x - 2,75y (mol)
tổng số mol khí sau khi nung = a – 0,75(x+y) Ta có: = = 84,77% a = 13,33(x+y) (1) = = 10,6%
a = 10,184x + 16,618 y (2)
Từ (1) và (2) ta có: 13,33(x+y) = 10,184x + 16,618 y = Nên : (3)
Ta có: 233.1,5(x+y) + 160.0,5(x+y) = 12,885 x+y = 0,03 (4)
Giải hệ (3) và (4) ta có: x = 0,02; y = 0,01
m = 88.0,02+120.0,01 = 2,96 (gam) 9




