





Preview text:
CÂN BẰNG PHA HỆ 1 CẤU TỬ
- Sự chuyển pha hệ 1 cấu tử
- PT chuyển pha loại I
- Giản đồ pha hệ 1 cấu tử
Chuyển pha trong hệ 1 cấu tử (1)
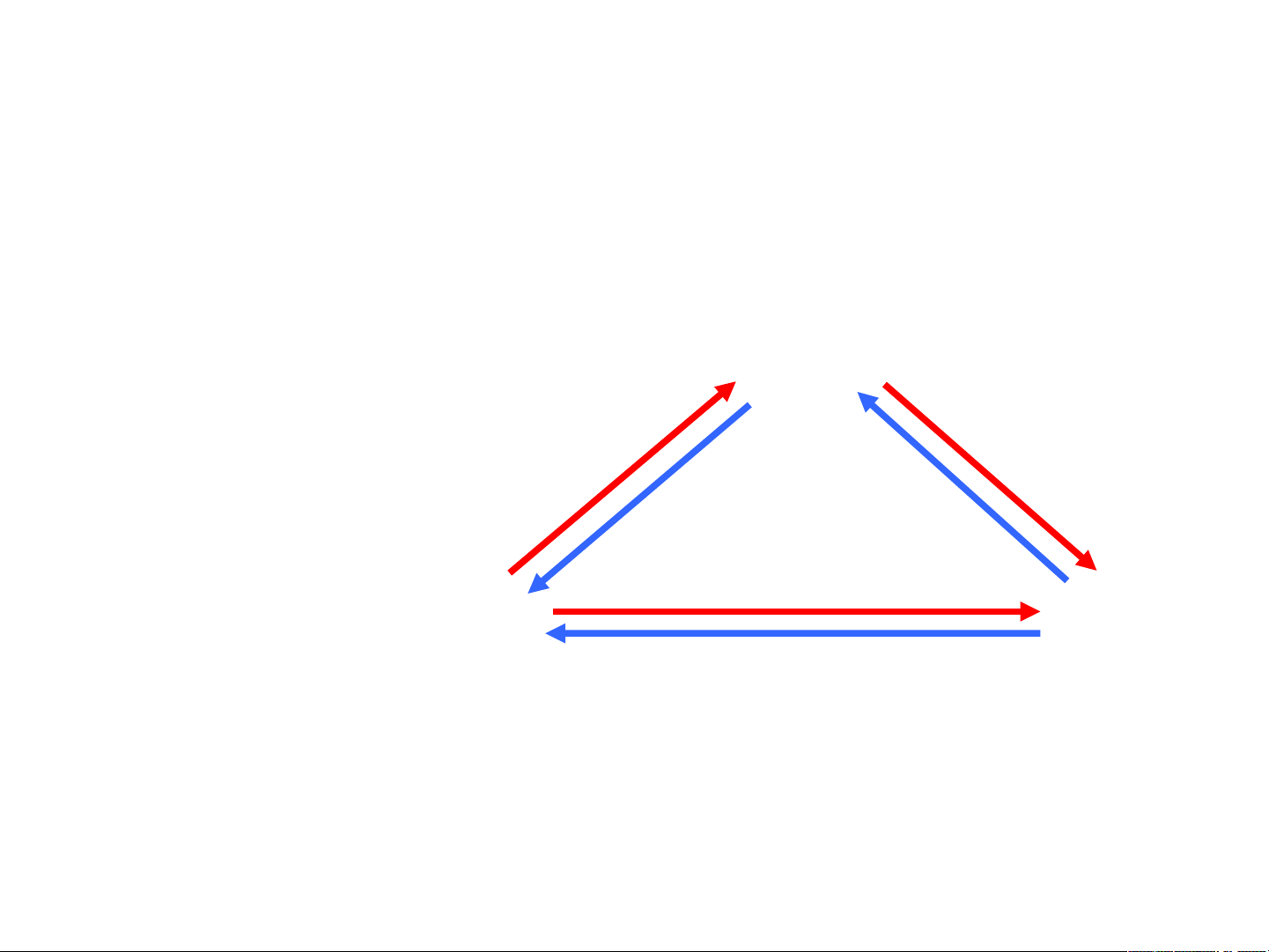
C=k-f+2=1-f+2=3-f ≥0 à f ≤3 à Tối đa 3 pha nằm CB Các quá trình LỎNG ảy Hoá h chuyển pha hệ Ng ơ 1 cấu tử Nóng ch ưng t i Kết tinh ụ Thăng hoa RẮN HƠI Ngưng kết
NẾU: 2 pha cân bằng à Số bậc tự do C=3-
2=1 à T hoặc P biến thiên tuỳ ý. Tức là Tcp= f(Pngoài) hoặc Pbh=f(T)
Phương trình chuyển pha loại I Pha 1! Pha 2
TTCB thì G1 = G2 ở T, P xác định
T biến thiên dT; P biến thiên dPà dG1 và dG2 à 1 TTCB mới dG1 = dG2 (2) (1)
dG = −S dT + V dP = −S dT + V dP = dG 1 1 1 1 1 2 2 2 2 2 (3)V − V
−S dT + V dP = −S dT + V dP ⇒ dT = 2 1 = ΔV 1 1 2 2 dP S − S ΔS 2 1 ΔH (4) cp dT T ΔV ΔS = = cp PT Clausius Tcp dP ΔH cp Clapeyron I
Phương trình chuyển pha loại I Pha 1! Pha 2
TTCB thì G1 = G2 ở T, P xác định
T biến thiên dT; P biến thiên dPà dG1 và dG2 à 1 TTCB mới dG1 = dG2
dG = −S dT + V dP = −S dT + V dP = dG 1 1 1 1 1 2 2 2 2 2 V − V
−S dT + V dP = −S dT + V dP ⇒ dT = 2 1 = ΔV 1 1 2 2 dP S − S ΔS 2 1 ΔHcp dT T ΔV ΔS = = cp PT Clausius Clapeyron I Tcp dP ΔH cp T ΔV
Hệ ngưng tụ (R-L; R-R): dT ≈ ΔT = cp (5)
Ảnh hưởng của P rất nhỏ dP ΔP ΔH cp
Ảnh hưởng của P đến Tcp PT Clausius Clapeyron I dT T ΔV = cp (1) dP ΔH cp
VD: qt nóng chảy: ∆Hn/c >0; ∆V=Vl-Vr >0 TRỪ Bi, H2O, Ga, Ge.
∆V>0: dT/dP>0 à P tăng à T0n/c tăng
∆V<0: dT/dP<0 à P tăng à T0n/c giảm
VD: qt hóa hơi hoặc thăng hoa: ∆Hhh >0 và ∆V=Vh-Vl>0
nên dT/dP>0 à P tăng àTs tăng.
Hệ số dT/dP à mức độ ả/h của P đến Tcp
Xác định hệ số ảnh hưởng dT/dP
Ví dụ: Ở 0°C, nhiệt nóng chảy của nước đá là ∆Hn/c
=1434,6 (cal.mol-1); Vr=1,098 ml/g; Vl=1,001ml/g. Xác
định hệ số ảnh hưởng của áp suất đến nhiệt độ nóng chảy của nước đá. dT(1) T ΔV cp PT Clausius Clapeyron I ≈ ΔT = dP ΔP ΔH cp ⎛ 18 g ⎞ 273K − 18 g dT T (2) ΔV
⎝⎜ 1,001ml / g 1,098 ml / g⎠⎟ ≈ ΔT = cp = dP ΔP ΔH 1436,6 cal cp K (3) Bài toán đơn vị = K.ml ? atm cal
Xác định hệ số ảnh hưởng dT/dP
Ví dụ: Ở 0°C, nhiệt nóng chảy của nước đá là ∆Hn/c =1434,6 (cal.mol-1); Vr=1,098 ml/g;
Vl=1,001ml/g. Xác định hệ số ảnh hưởng của áp suất đến nhiệt độ nóng chảy của nước đá dT T ΔV PT Clausius Clapeyron I ≈ ΔT = cp dP ΔP ΔH cp ⎛ 18 g ⎞ 273K − 18 g dT T ΔV
⎝⎜ 1,001ml / g 1,098 ml / g⎠⎟ ≈ ΔT = cp =
= −0,00082(K / atm) (4) dP ΔP ΔH 41,3.1436,6 cal cp K (3) = K.ml ? = K.ml atm cal 41,3.ml.atm
Giá trị của Hằng số khí LT R (1)
0,082 l.atm/mol.K = 1,987 cal/mol.K = 8,314 J/mol.K (2)
82 ml.atm = 1,987 calà 1 cal = 41,3 ml.atm
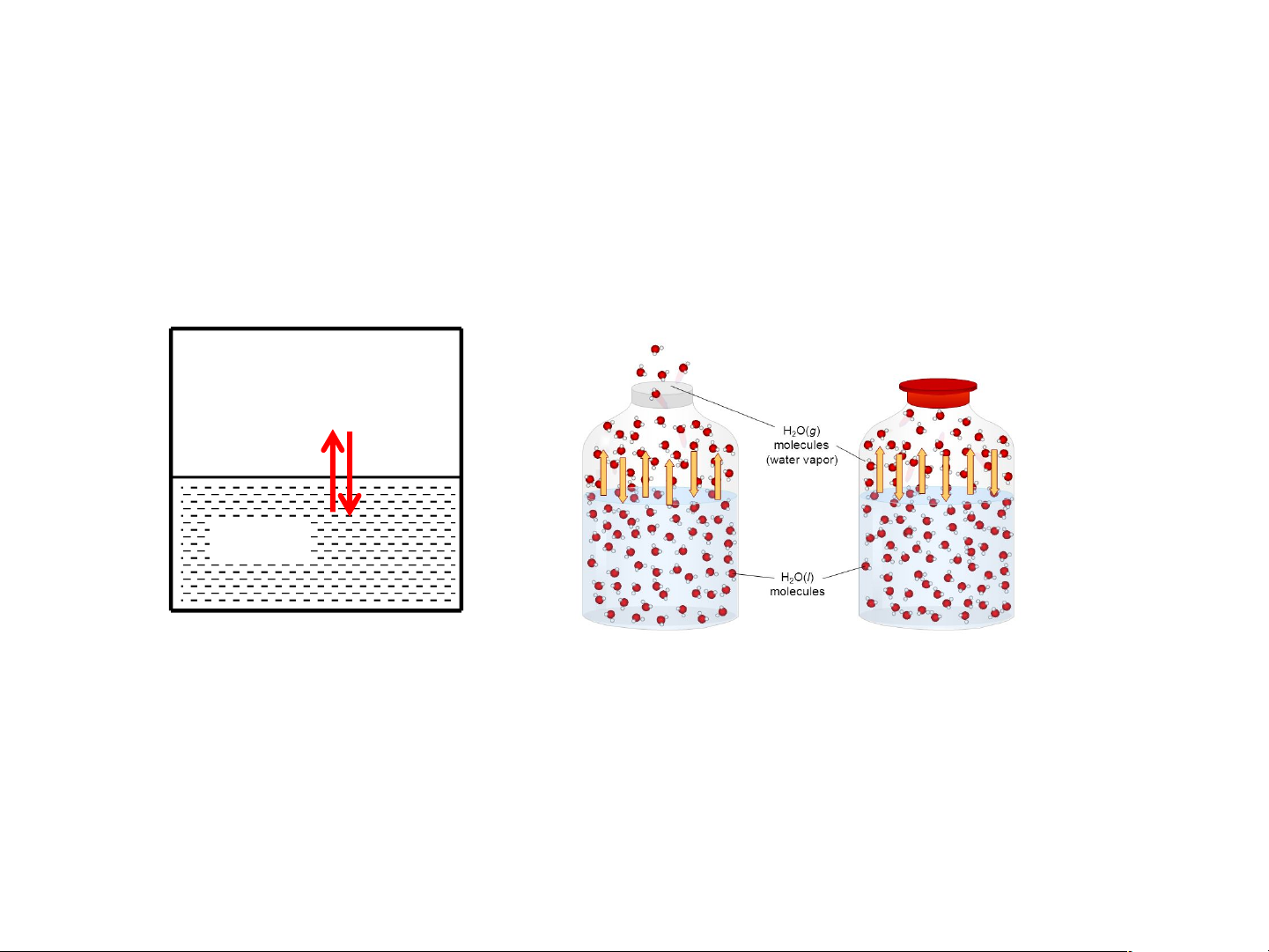
Ảnh hưởng của T đến Pbão hoà Quá trình hoá Lỏng = Hơi (bay hơi) hơi/thăng hoa Rắn = Hơi (thăng hoa) Ko CB Cân bằng Hệ kín Phơi L,R
Áp suất hơi bão hòa: là áp suất của pha hơi khi
cân bằng với pha rắn/lỏng của 1 chất nguyên chất.
(a) áp suất hơi trên bề mặt lỏng Ph/l
(b) áp suất hơi trên bề mặt rắn Ph/r
Ảnh hưởng của T đến Pbão hoà PT Clapeyron-Clausius I dP ΔH = cp (1) dT TΔV
Vl<<Xét 1 mol hơi:
∆V=Vh-Vl≈Vh>0 ΔV ≈ V = RT 1mol h P dP ΔH .P (2 Δ ) H = cp → dlnP = cp PT Clapeyron- dT RT2 dT RT2 Clausius II Nhận xét:
∆Hhh>0; ∆Hth>0 à dlnP/dT>0; khi T tăngà Pbh tăng
Ảnh hưởng của T đến Pbão hoà Định lượng dlnP ΔH ΔH = cp lnP = cp dT (1) dT RT2 ∫ + J RT2 ü ∆H lnP (2) cp= f(T) = f(T) dT ∫ + J = g(T) RT2 ΔH 1 ü ∆H cp cp= const lnP = − . + J (3) R T
Lấy cận ở 2 nhiệt độ ln P xác định, ΔH=const ΔH J tgα = − cp R P (4) 1 ln 2 = − ΔH( − 1 ) P R T T 1 2 1 1/T
X/đ nhiệt độ sôi của chất lỏng
Nhiệt độ sôi của 1 chất lỏng là nhiệt độ tại đó Pbh
hoà của nó bằng với áp suất khí quyển Pkq lnP = f(T) dT ∫ + J = g(T ) kq RT2 s
VD: Áp suất hơi bão hòa của axit HCN phụ thuộc vào T
theo pt: lgP (mmHg) = 7,04- 1237/T
Xác định Ts và ΔHhh của HCN ở đk thường.
lg760 = 7,04- 1237/Tsà Ts = 297 K hay 24,4°C dlnP(1 Δ ) H
lnP=2,303.lgP = 2,303(7,04- 1237/T) = cp dT RT2 Δ dlnP 1237 H = RT2 = 8,314.T2.2,303. cp dT T2
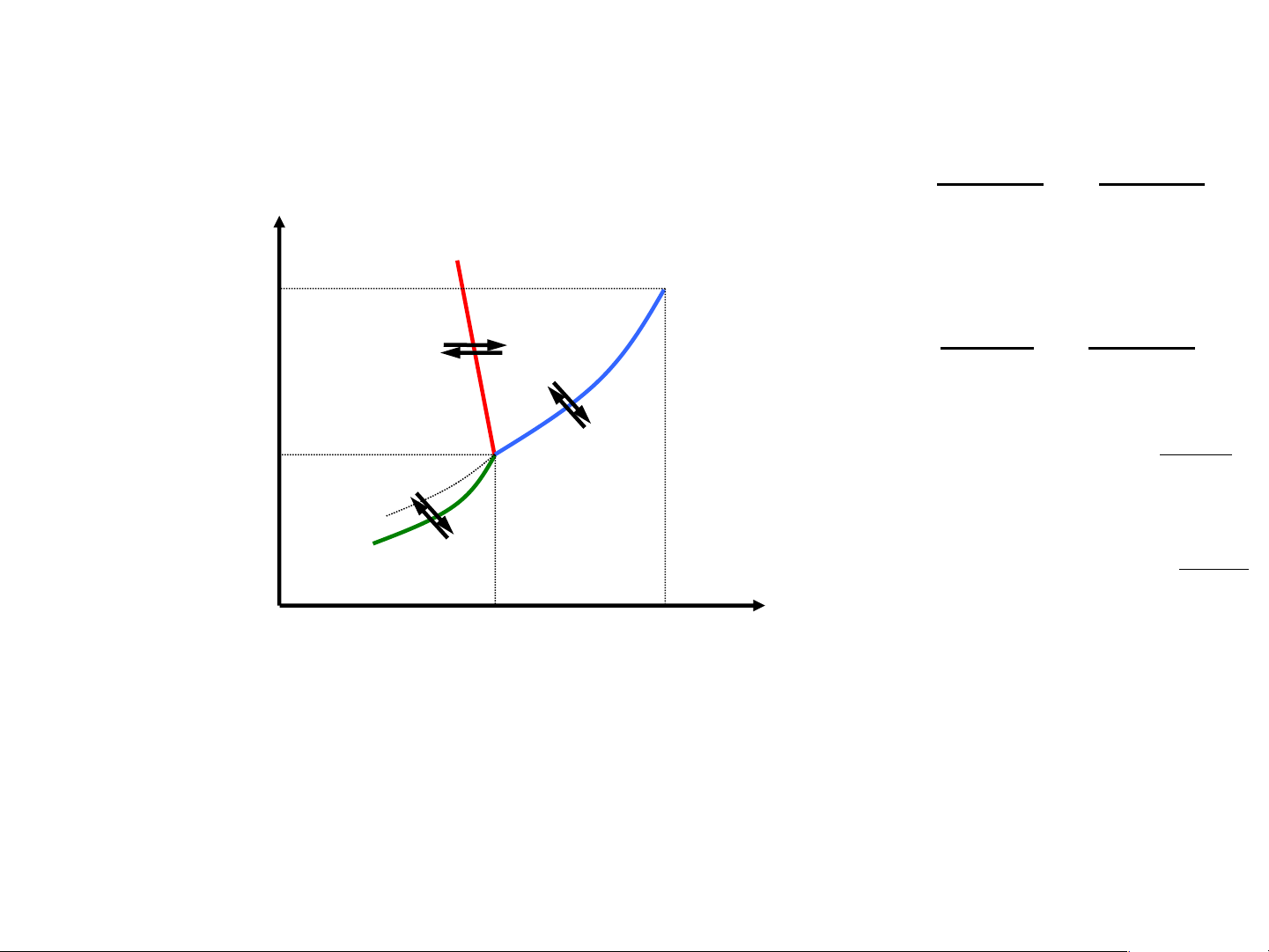
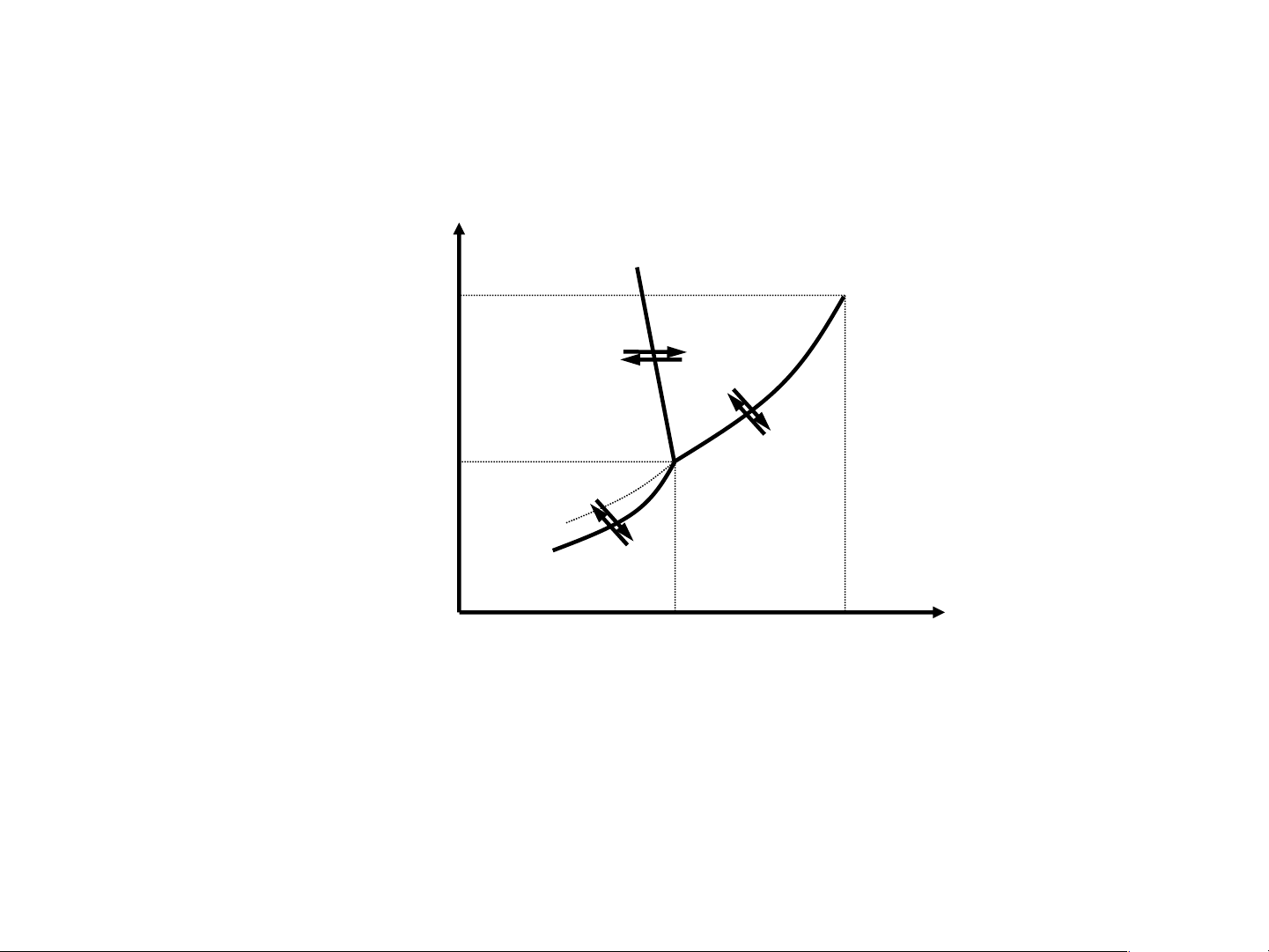
Giản đồ pha hệ 1 cấu tử (1)
Giản đồ có 3 đường, 3 vùng, 1 điểm dlnP ΔH = hh P, atm dT RT2 B C 218 atm dP Δ (2) H Rắn Lỏng OB: ng = nc dT TΔV (3) ΔH 4,579 mmHg − hh O Hơi OC: RT D P = K e h/l 1 ΔH A (4) − th OA: RT 0,0099°C 374°C t°C P = K e h/r 2
Đường OD (kéo dài của OC): sự phụ thuộc áp suất
của nước lỏng quá lạnh vào nhiệt độ à xảy ra hiện tượng chậm đông.
Giản đồ pha hệ 1 cấu tử Theo quy tắc pha: 3 vùng P, atm B C 218 atm Rắn Lỏng 4,579 mmHg O Hơi D M A 0,0099°C 374°C t°C
OAB, OBC, OCA: hệ 1 pha à C=k-f+2=1-1+2=2
→ 2 thông số P, T được phép thay đổi tùy ý trong 1
giới hạn mà số pha vẫn không đổi.
Giản đồ pha hệ 1 cấu tử Theo quy tắc pha: 3 đường P, atm dP ΔH B C OB: ng = nc 218 atm dT TΔV Rắn Lỏng ΔH − hh OC: = K e RT 4,579 mmHg Ph/l 1 O Hơi ΔHth D − OA: = K e RT A Ph/r 2 0,0099°C 374°C t°C
Đường OA, OB, OC: 2 pha cân bằng C= 1-2+2=1
à chỉ có 1 thông số được thay đổi, thông số kia là
thông số phụ thuộc (mô tả bởi PT Clapeyron- Clausius).
Giản đồ pha hệ 1 cấu tử Theo quy tắc pha: 1 điểm ba P, atm B C 218 atm Rắn Lỏng 4,579 mmHg O Hơi D A 0,0099°C 374°C t°C
Điểm O: 3 pha CB à C= 1-3+2=0 à P, T hoàn
toàn xác định. Nếu thay đổi 1 thông số bất kì à số pha hệ thay đổi KẾT LUẬN - PT chuyển pha
- Ảnh hưởng của T đến Pbh
- Ảnh hưởng của P đến Tcp
- Giản đồ pha hệ 1 cấu tử




