




Preview text:
CƠ CHẾ PHẢN ỨNG
I. Nhắc lại về khái niệm tốc độ phản ứng: VD:
aA+ bB → dD +eE 1 d[A] 1 d[B] 1 d[D] 1 d[E]
Vận tốc chung của phản ứng: v = − = − = + = + chung a dt b dt d dt e dt
Từ đó ta có thể suy luận được vận tốc theo từng chất của phản ứng như sau: d[A] d[B] v = = − . a v ;v = = − . b v A chung B chung dt dt d[D] d[E] v = = +d.v ;v = = + . e v D chung E chung dt dt v x y v = k A B
chung ta có thể xác định được từ biểu thức tác dụng khối lượng [ ] [ ] chung
II. Cơ chế phản ứng:
- Cơ chế phản ứng là tập hợp của các phản ứng đơn giản để giải thích cho toàn bộ quá
trình phản ứng xảy ra.
- Tóm tắt một số quá trình hay phản ứng đơn giản. Bậc phản ứng
Phản ứng đơn giản
Biểu thức định luật tác
dụng khối lượng 1 A → sp v = k[ ] A 2
A + A → sp 2 v = k[A]
A + B → sp
v = k[A][B] 3
A + A + A → sp 3 v = k[A]
A + 2B → sp 2
v = k[A][B]
A + B +C → sp v = k[ ] A [B][C]
Trong các phản ứng trên A,B và C có thể là chất tham gia, chất trung gian hoặc sản phẩm.
2.1 Giai đọan chậm quyết định tốc độ phản ứng:
- Cơ chế phản ứng bao gồm các phản ứng kiểu phản ứng nối tiếp từ chất tham gia, chất
trung gian, chất sản phẩm. Trong đó giai đoạn chậm sẽ quyết định tốc độ của phản ứng chính.
Ta xét phản ứng nối tiếp sau (với A là chất tham gia, B là hợp chất trung gian, C là sp) (1) (2) A ⎯⎯⎯ → B ⎯⎯⎯ →C chËm nhanh a 0 0
(x = y + z) a − x y z
Nếu coi như là phản ứng nối tiếp với hằng số tốc độ k1 và k2 thì ta có thể thiết lập biểu
thức nồng độ chất B và chất C theo nồng độ đầu của [A]o = a.
Tại thời điểm t ta đang xét: a − 1 k .t − 2 k . [C] = z = [k (1− e ) −(k (1 t − e )] t 2 1 (*) k − k 2 1
Giai đoạn (1) chậm, giai đoạn (2) nhanh có nghĩa là k k 2 1 . Khi đó k t
k − k k e− → k → 0 2 1 2 , 2 . 0 , 1
vì k2 rất lớn và k1 rất nhỏ, dẫn đến (*) trở thành: − 1 k . [C] ( a 1− e t )
v = k .(a − x) = k [ ] A . Đây là t và 1 1
dạng phương trình động học bậc 1, đổi
với phản ứng trực tiếp từ A ra chất C. Vì vậy, giai đoạn (1) quyết định tốc độ cho toàn bộ
phản ứng nối tiếp. Như vậy, phản ứng nối tiếp nhiều giai đoạn thì giai đoạn chậm quyết
định tốc độ phản ứng. Một số ví dụ. VD1: Xét phản ứng:
2NO + F → 2NO F 2 2 2 Xảy ra theo cơ chế sau: 1 . k
i NO + F ⎯⎯→ NO F + F (chËm) 2 2 2 2 i . k
i NO + F ⎯⎯→ NO F (nhanh) 2 2
Vì giai đoạn 1 có tốc độ chậm nhất nên nó quyết định tốc độ phản ứng: 1 d[NO ] 2 v = −
= k [NO ][F ] p.u 1 2 2 2 dt
vì NO2 và F2 đều là chất ban đầu nên đây là biểu thức tốc độ phản ứng.
Bài tập luyện tập
Bài 1: Phản ứng H + Br → 2HBr 2 2
xảy ra theo cơ chế sau: 1 .i Br k ⎯⎯→
⎯⎯ 2Br (c¶ 2 ®Òu nhanh) 2 k 1− 2 . ii Br + H k ⎯⎯→HBr + H (chËm) 2 3 . iii H + Br k ⎯⎯→HBr + Br (nhanh) 2
Thiết lập biểu thức tốc độ phản ứng theo tốc độ hình thành HBr.
Bài 2: Xác định biểu thức tốc độ phản ứng theo cơ chế được đề nghị sau của phản ứng hình k k
thành Photgen từ Cl2 và CO. Với 1 K = K = 1 và
2 như là hằng số cân bằng của các k 2 k 1 − 2 −
phản ứng đơn giản, và M là phân tử trơ bất kỳ. .i Cl + M 2Cl + M (c©n b»ng nhanh,K ) 2 1
i .i Cl + CO + M ClCO + M (c©n b»ng nhanh,K ) 2
ii .i ClCO + Cl → Cl CO + Cl (chËm,k ) 2 2 3
Phản ứng : Cl + CO → COCl 2 2
Bài 3: Trong môi trường axit, có cơ chế của phản ứng: NH+ HNO N 2H O H+ + → + + 4 2 2 2 .i HNO + H+
H O + NO+ (c©n b» , ng K ) 2 2 1 i .i NH+ NH + H+ (c©n b» , ng K ) 4 3 2
ii .i NO+ + NH → NH NO+ (chËm, k ) 3 3 3 i .
v NH NO+ → H O + H + (nhanh, k ) 3 2 4
Xác định vận tốc phản ứng.
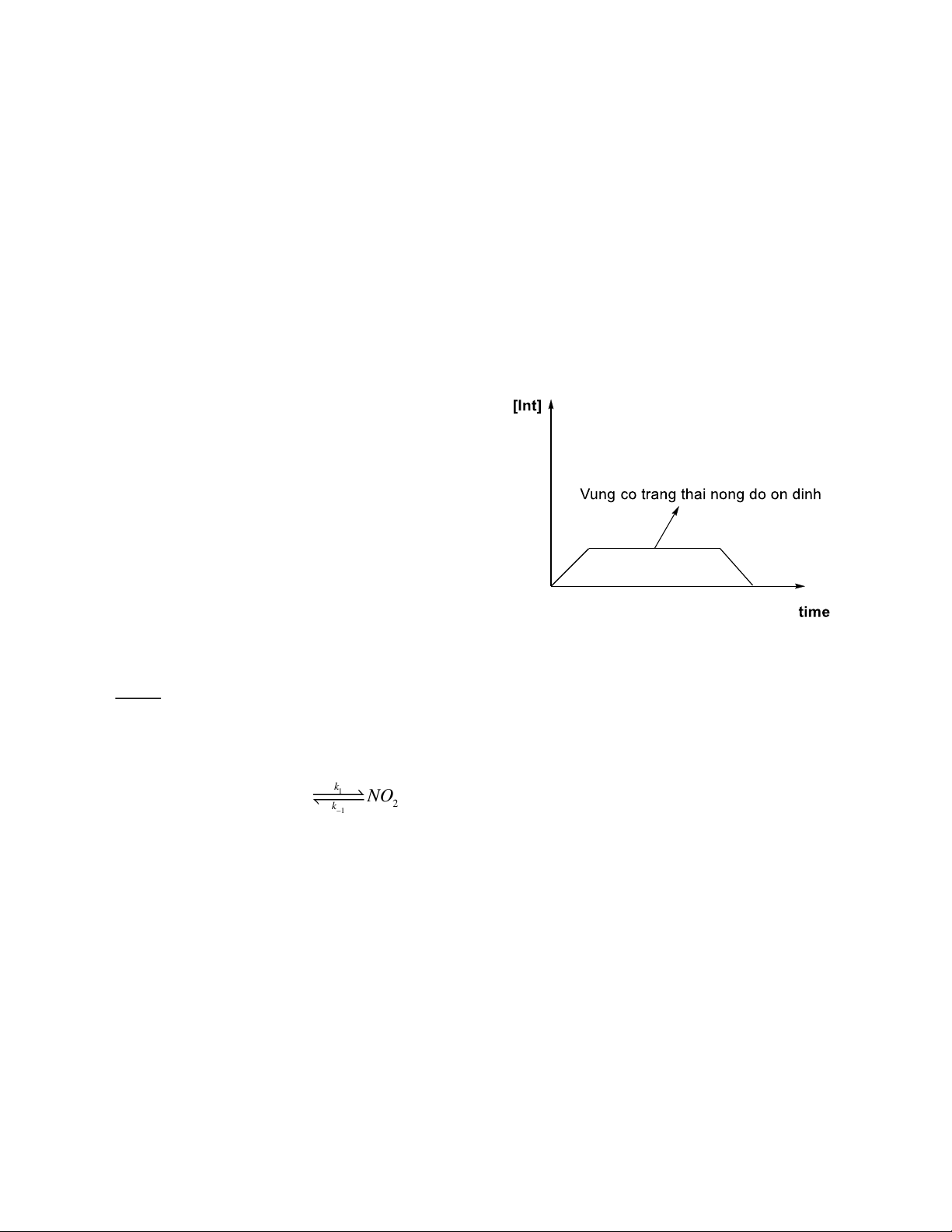
2.2 Trạng thái nồng độ ổn định
- PP nồng độ ổn định sử dụng khi cơ chế không xác định được giai đoạn nào quyết định tốc độ phản ứng!
- Trạng thái ổn định:
Khi một phản ứng có một hoặc nhiều chất trung gian, nồng độ của một trong các chất đó
là không đổi ở một vài giai đoạn của phản ứng. Do đó, phản ứng đạt trạng thái ổn định (
trạng thái dừng), ta gọi PP này là PP áp dụng gần đúng trạng thái ổn định.
Khi cơ chế phản ứng có nhiều giai đoạn với
tốc độ khác nhau, và giai đoạn quyết định tốc
độ không chắc chắn là giai đoạn nào. Có
những chất trung gian xuất hiện ở vài giai
đoạn. Sử dụng PP nồng độ ổn định hợp lí cho
các chất trung gian trong cơ chế phản ứng.
Trong PP này, coi biến thiên nồng độ chất
trung gian theo thời gian t là bằng 0, hay tốc độ
hình thành = tốc độ mất đi. d[Int] = 0 dt
VD1: Phản ứng 2N O → 4NO + O 2 5 2
2 diễn ra theo cơ chế sau: 1 . k i N O NO + NO 2 5 k 2 3 1 − 2 i . k i
NO + NO ⎯⎯→ NO + NO + O 3 2 2 2 3 ii . k i
NO + NO ⎯⎯→2NO 3 2
Sử dụng gần đúng trạng thái ổn định để xác định định luật tốc độ phản ứng. Giải:
Thấy NO và NO3 là chất trung gian, ta áp dụng nồng độ ổn định cho 2 chất này:
- NO sinh ra ở phản ứng 2 và mất đi ở 3 nên: d[NO] k2
= v − v = k [NO ][NO ] − k [NO ][NO] = 0 [NO] = [NO ] (1) 2 3 2 3 2 3 3 2 dt k 3
- NO3 sinh ra ở (1) và mất đi ở (-1), (2) và (3) nên ta có: d[NO ] d[NO ] 3 3 = 0
= v − v − v − v 1 1 − 2 3 dt dt
k [N O ] − k [NO ][NO ] − k [NO ][NO ] − k [NO ][NO] = 0 1 2 5 1 − 2 3 2 3 2 3 3 k [N O ] 1 2 5 [NO ] = (2) 3
(k + k )[NO ] + k [NO] 2 1 − 2 3
Vận tốc phản ứng định nghĩa theo sự hình thành O2: d[O ] 2 v =
= v = k [NO ][NO ] (3) p.u 2 2 2 3 dt
Thế (1) vào (2) rồi thế [NO3] vào (3) ta thu được:
d[O ] k .k .[N O ] k k 2 1 2 2 5 v = =
= k[N O ]trong đó k = p.u 2 5 1 2 dt k + 2k k + k 1 − 2 1 − 2 Bài tập luyện tập
Bài 1: Phản ứng phân hủy axit nitric xảy ra theo cơ chế : 1 k HNO ⎯⎯ → HO + NO 3 2 k2 HO + NO ⎯⎯ → HNO 2 3 3 k HNO + HO ⎯⎯ → H O + NO 3 2 3
Thiết lập phương trình tốc độ của phản ứng, biết HO là tiểu phân trung gian hoạt động.
Bài 2: Phản ứng nhiệt phân etan thành etylen và hidro xảy ra theo cơ chế sau: • • 1 k CH CH ⎯⎯ →CH + CH 3 3 3 3 • k • 2 CH CH + CH
⎯⎯→CH CH + CH 3 3 3 3 2 4 • k • 3 CH CH
⎯⎯→CH = CH + H 3 2 2 2 • k • 4 CH CH + H ⎯⎯ →CH CH + H 3 3 3 2 2 • • 5 k CH CH
+ H ⎯⎯→CH CH 3 2 3 3
Tìm biểu thức tốc độ của phản ứng.
Bài 3: Phương trình động học của phản ứng quang hóa tetracloetylen trong dung dịch d[C Cl ] CCl 2 4 4 là: 3/ 2 − = k[Cl ] 2 dt
Đây là phản ứng dây chuyền có hiệu suất lượng tử cao. Tìm phương trình vi phân trên
nếu phản ứng xảy ra theo sơ đồ: Sinh mạch: 0 k Cl hv 2Cl• + ⎯⎯→ 2 • k • 1 Cl + C Cl ⎯⎯ →C Cl Phát triển mạch: 2 4 2 5 • k • 2 C Cl + Cl ⎯⎯ →Cl + C Cl 2 5 2 2 6 Ngắt mạch: • 3 2 k C Cl ⎯⎯ →C Cl +C Cl 2 5 2 6 2 4
Bài 4: Cơ chế của phản ứng H2 + Br2 → 2HBr là: • 1 k Br ⎯⎯ →2Br 2 • k • 2 Br + H ⎯⎯ → HBr + H 2 • k • 3 H + Br ⎯⎯ → HBr + Br 2 • k • 4 H + HBr ⎯⎯ → H + Br 2 • 5 2 k Br ⎯⎯ → Br2
Xác định biểu thức tốc độ phản ứng.




