














Preview text:
PHẦN I: ĐẠI CƯƠNG VỀ CẤU TẠO CHẤT
CHƯƠNG I: CẤU TẠO NGUYÊN TỬ - ĐỊNH LUẬT TUẦN HOÀN
VÀ BẢNG HỆ THỐNG TUẦN HOÀN CÁC NGUYÊN TỐ HOÁ HỌC MỤC TIÊU
1. Phân tích được những ưu điểm và nhược điểm của các mẫu nguyên tử cổ điển Rutherford và Bohr.
2. Trình bày được những luận điểm cơ bản của cơ học lượng tử trong việc nghiên cứu nguyên tử.
3. Mô tả được những đặc trưng của các orbital nguyên tử.
4. Vận dụng được những quy luật phân bố electron trong nguyên tử, để biểu diễn cấu
hình electron của nguyên tử một nguyên tố.
5. Mô tả được cấu trúc của bảng tuần hoàn các nguyên tố hóa học và quy luật biến
thiên tính chất của các nguyên tố trong bảng tuần hoàn.
A. CẤU TẠO NGUYÊN TỬ
I. SƠ LƯỢC VỀ LỊCH SỬ NGHIÊN CỨU CẤU TẠO NGUYÊN TỬ
Khái niệm nguyên tử đã ra đời từ thời cổ đại (thế kỷ thứ V trước công nguyên)
nhưng đến thế kỷ XIX mới được công nhận. Sau những phát hiện về tia âm cực, năm
1887 nhà vật lý người Anh Thompson tìm ra electron, 1909 nhà vật lý Millikan (Mỹ)
xác định được điện tích của electron. Năm 1911 nhà bác học Anh Rutherford tìm ra
hạt nhân nguyên tử mang điện tích dương và các hạt proton. Năm 1932, khi nghiên
cứu phản ứng hạt nhân, nhà vật lý học người Anh Chadwick đã tìm ra hạt nơtron.
Ngày nay khối lượng và điện tích của các hạt cơ bản đã được xác định chính
xác, nhưng vì điện tích của electron có trị số nhỏ nhất và được lấy làm đơn vị điện
tích, ta nói: electron mang một đv điện tích âm
(-e), còn proton mang một đv điện tích dương (+e) , nơtron có điện tích bằng 0.
Nguyên tử trung hòa điện do đó:
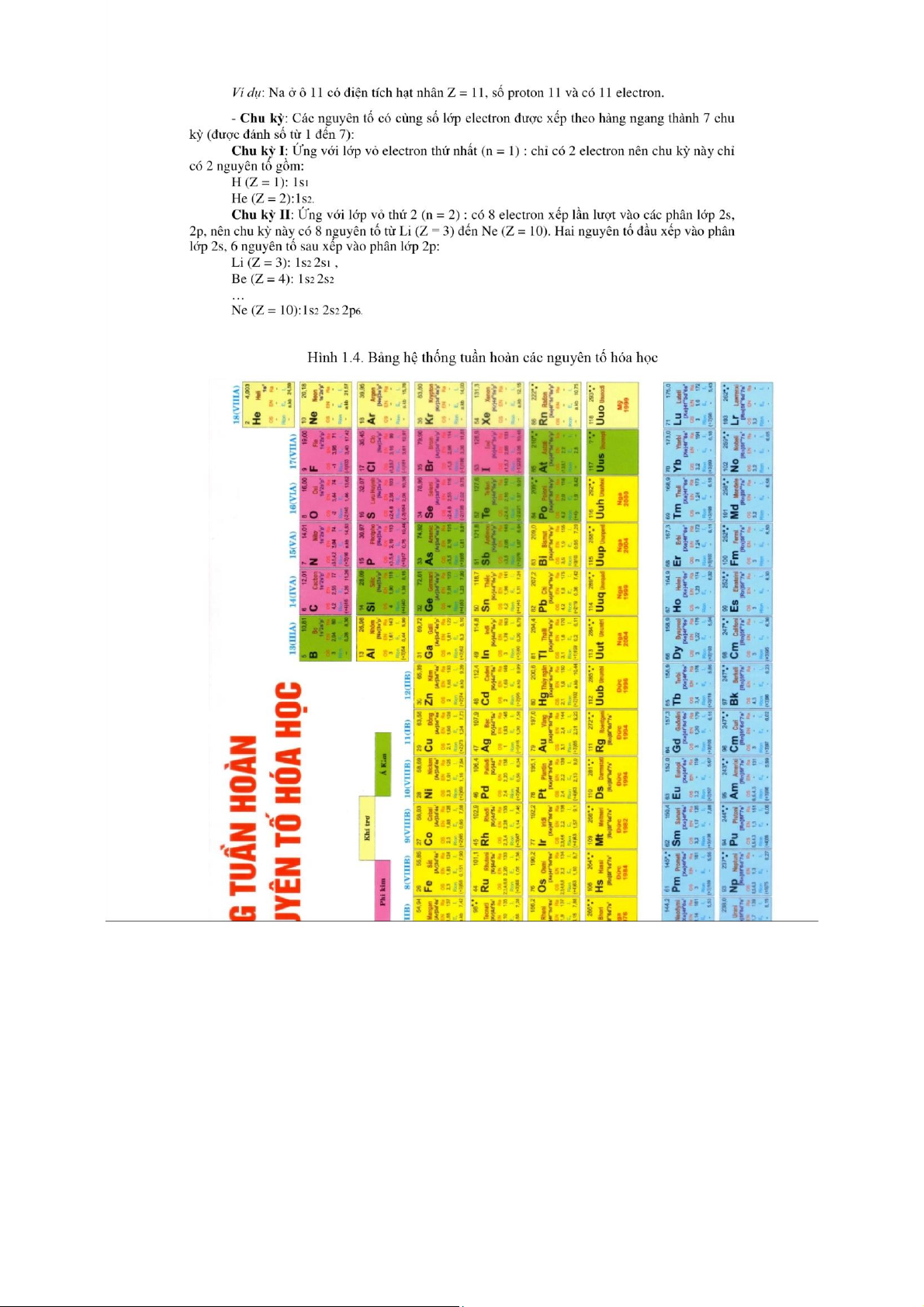
Điện tích dương của hạt nhân Z = số p = số e = STT nguyên tố
trong HTTH Ví dụ:
1/ Nguyên tố Ca ở ô số 20 trong HTTH ta biết: điện tích hạt nhân của Ca, ký
hiệu là Z = +20, nguyên tử Ca có 20 hạt proton ở hạt nhân và có 20 electron ở lớp
vỏ. Ion Ca2+ có 20 hạt proton, Z = +20 và có 18 electron.
2/ Nguyên tố Cl có STT = 17, nguyên tử Cl có Z = +17, có 17 hạt proton, 17
electron. Ion Cl- có 17 hạt proton, Z = +17 và có 18 electron.
. Như vậy, số lượng tử chính n xác định
trạng thái năng lượng của electron trong nguyên tử. Những trạng thái nhất định của
electron trong nguyên tử ứng với những giá trị năng lượng nhất định gọi là những trạng thái lượng tử.
Số lượng tử chính n có những trị số : 1, 2, 3, 4, 5,….. . Tương ứng với các trị
số năng lượng: E1, E2, E3, E4, E5, …..E . Ở trạng thái E1(n = 1) là trạng thái cơ
bản hay mức bình thường, ở các trạng thái khác là trạng thái kích thích. Khi elelctron
có E = 0, xem như electron tách rời khỏi nguyên tử.
Trạng thái lượng tử ứng với mức năng lượng cơ bản là trạng thái bền ổn định
vì electron liên kết với hạt nhân bền vững nhất. Ở các mức kích thích trạng thái
electron không bền, không ổn định vì electron liên kết với hạt nhân kém bền vững hơn.
Sự chuyển electron từ trạng thái này sang trạng thái khác có kèm theo sự phát
ra hay thu vào năng lượng. Khi bị kích thích, nguyên tử sẽ hấp thụ năng lượng theo
những lượng nhất định tương ứng với hiệu số các mức năng lượng, khi đó electron
sẽ chuyển từ trạng thái lượng tử có mức năng lượng thấp lên trạng thái có mức năng
lượng cao. Ở trạng thái này, electron tồn tại không lâu (khoảng 10-8 – 10-10 giây)
và electron sẽ chuyển ngược lại từ trạng thái lượng tử có mức năng lượng cao về
trạng thái có mức năng lượng thấp ban đầu khi đó electron sẻ phát ra năng lượng đã
hấp thụ Nguyên nhân xuất hiện quang phổ là tử đây. Do các mức năng lượng cách
nhau một số nguyên lần nên các bước sóng của những năng lượng bức xạ khác nhau
không thể có giá trị liên tục và vì vậy quang phổ nguyên tử phải là quang phổ vạch.
Những electron được đặc trưng bằng cùng một giá trị số lượng tử chính n, nghĩa
là cùng mức năng lượng, hợp thành lớp lượng tử hay lớp electron.
Mặt khác, số lượng tử chính n cho ta biết độ lớn của orbitan nguyên tử.
. Để thuận tiện trong sử dụng, người ta ký hiệu như sau :
Số lượng tử chính n : 1 2 3 4 5 6 7
Lớp lượng tử : K L M N O P Q Khi n càng lớn
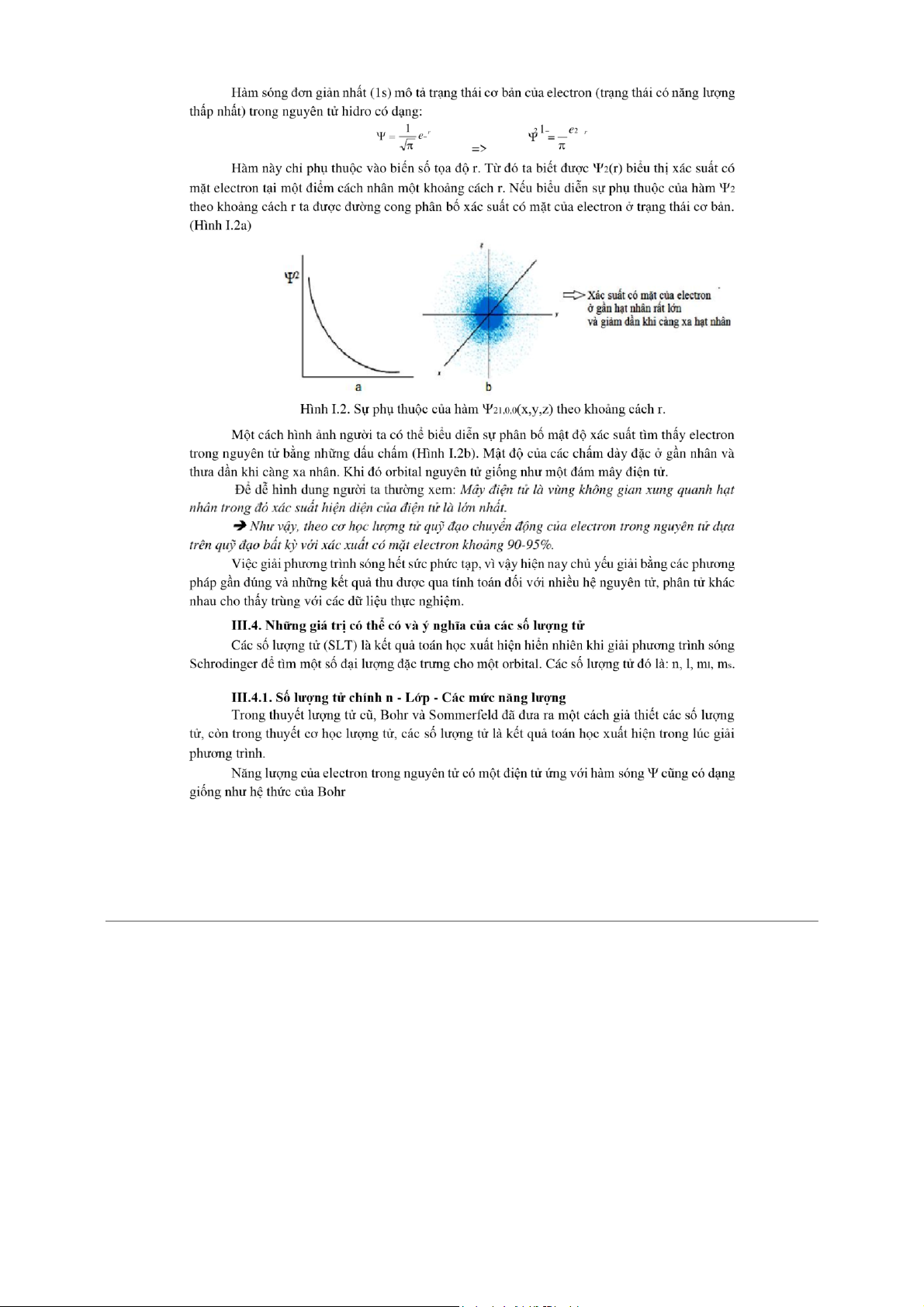
electron càng xa hạt nhân nên kích thước của AO càng lớn và mật độ đám mây
electron càng loãng. (Hình I.2b).
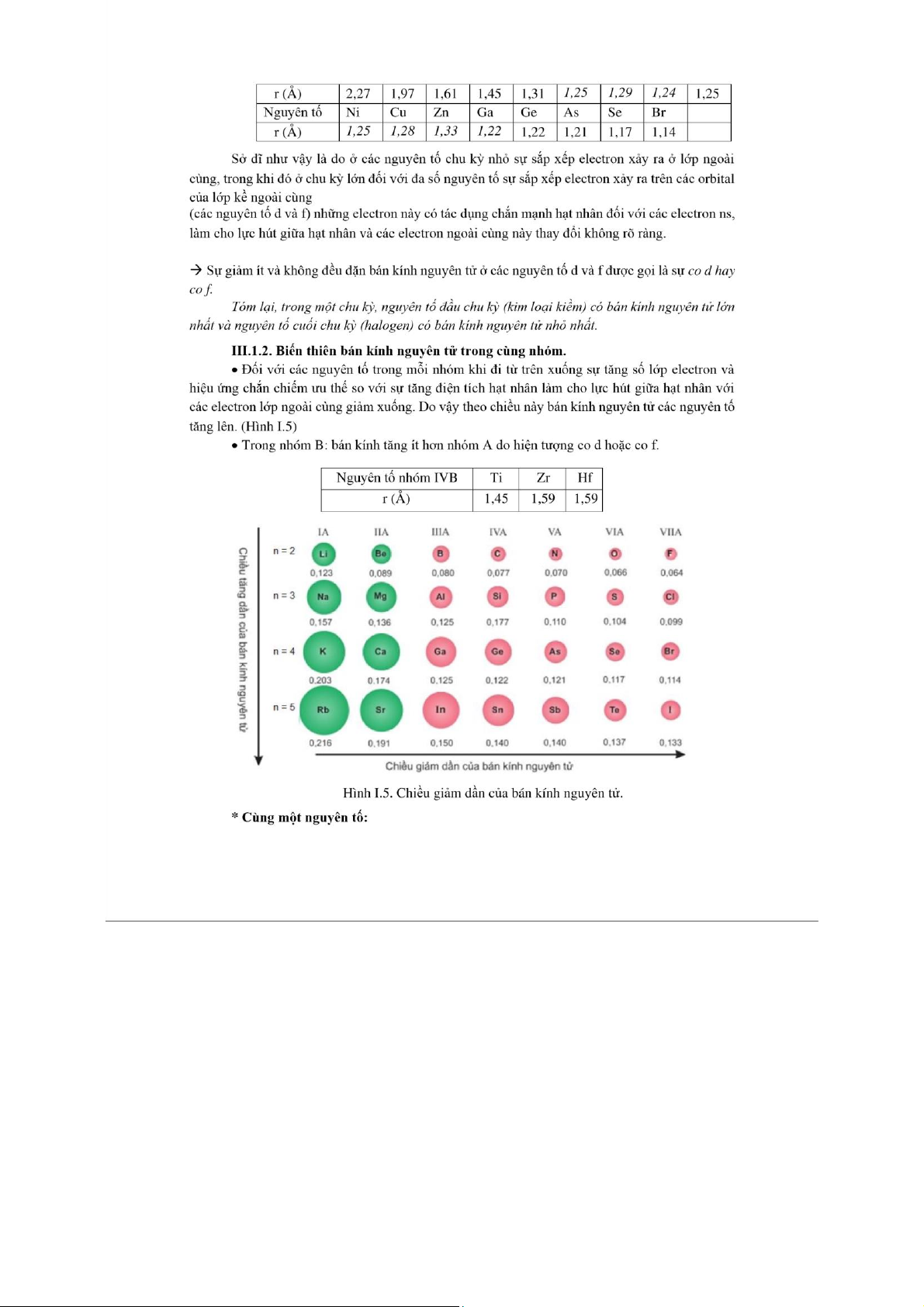
III.4.2. Số lượng tử phụ l - Phân lớp - Hình dạng orbital nguyên tử
Đối với nguyên tử nhiều electron thì các trạng thái năng lượng của những
electron ở cùng mức năng lượng không phải hoàn toàn giống nhau và có khác nhau
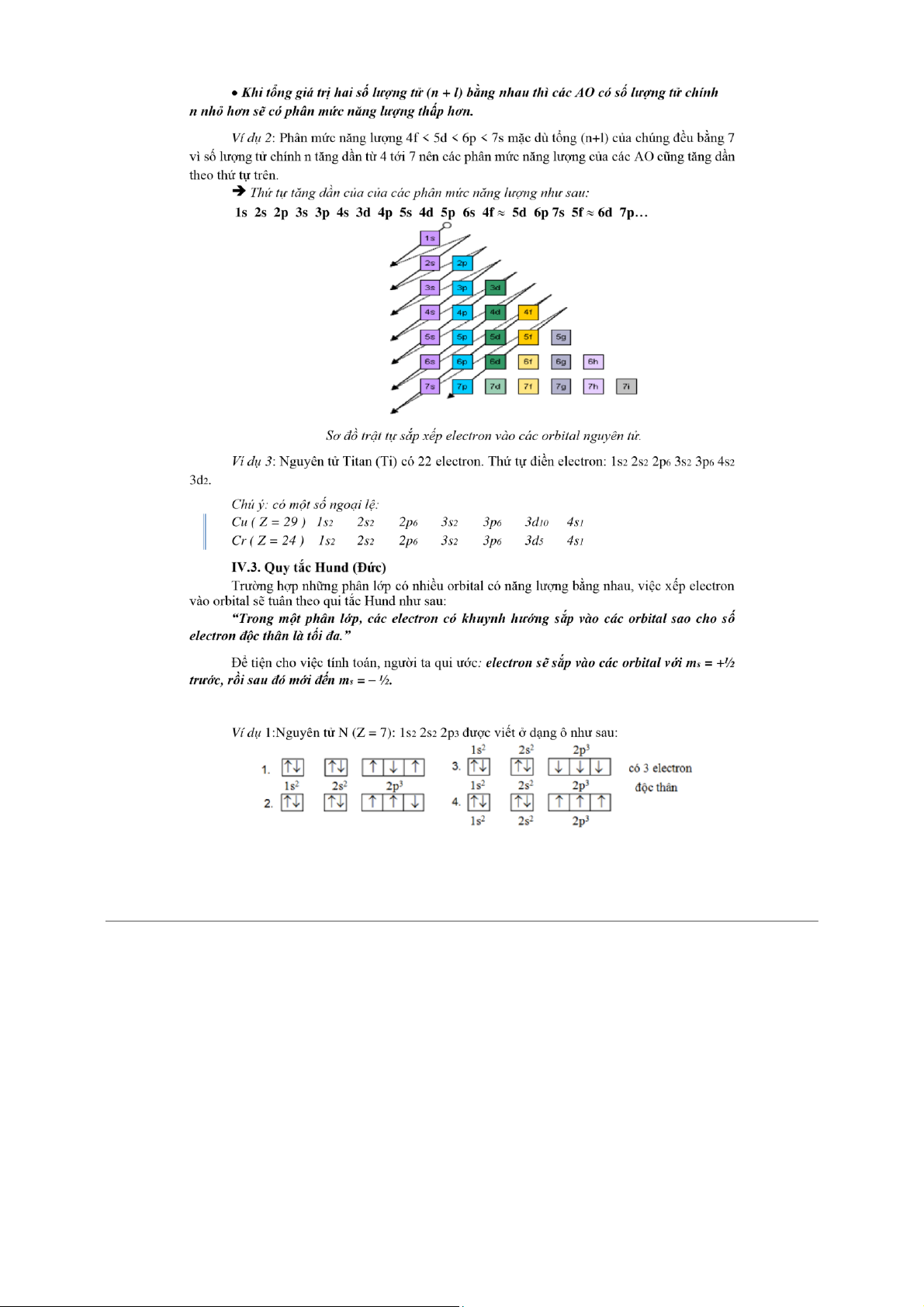
chút ít do chịu ảnh hưởng của nhiều yếu tố mới xuất hiện và được đặc trưng bằng số lượng tử phụ l. S ng t ph l
ợng tử n. Ứng với một giá trị của , n thì l n- l. 4 l = 0, 1, 2, 3.
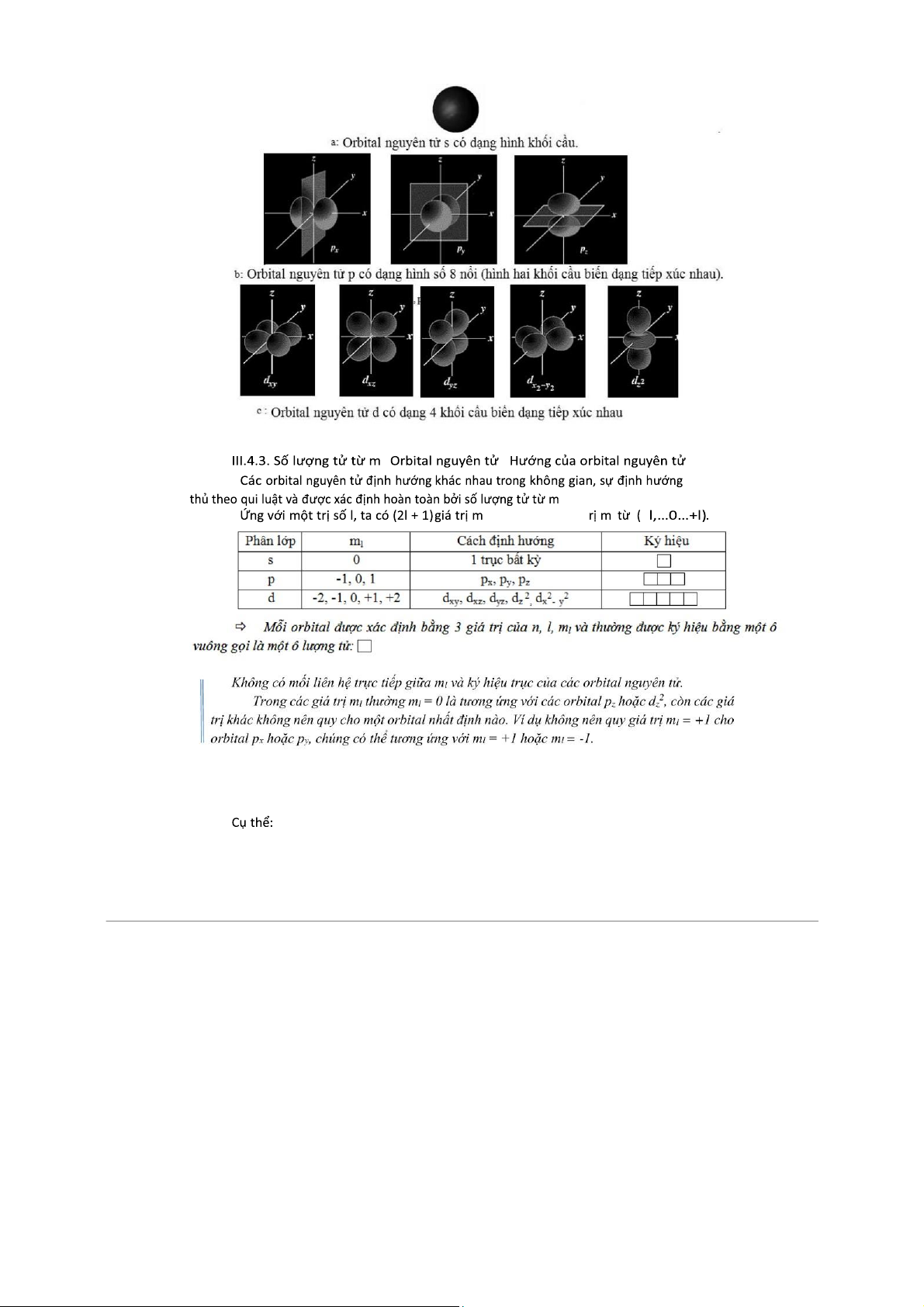
và có n phân lớp . a/ n = 2). b/ n = 3). có 7 orbital . l còn l -
l 0) : có dạng khối cầu . -
l 1) : có dạng 2 khối cầ . -
d ( l 2) : có dạng 4 khối cầ . - các
Hình d ng
c ác orbital nguyên t
nh b n g s ng t ph l , khi l khác nhau
thì các orbital có hình d ng khác nhau. (Hình I.3)
Người ta gọi trạng thái năng lượng của elctron được đặc trưng bằng những giá
trị nhất định của l gọi là phân lớp năng lượng.Trị số l càng lớn thì phân lớp năng
lượng có giá trị càng cao.
Các electron trong cùng một phân lớp sẽ hợp thành phân lớp electron. Các phân
lớp electron được ký hiệu bằng chữ cái viết thường như sau:
Hình I.3. Hình dạng các orbital nguyên tử: s (a), p (b), d (c ) l - - - nà y tuân l . -
l, đó là những giá t l - 3s, có Na (Z = 11): [ Ne] 3s 1 Mg (Z = 12): [ Ne] 3s 2 Al (Z = 13): [ Ne] 3s 2 3 p 1 Ar (Z = 18): [ Ne] 3s 2 3 p 6
còn được gọi là các chu kỳ nhỏ. Ch các xếp vào l = 3+2=5) = l 4+1=5) =3 K (Z = 19): [ Ar] 4s 1 Ca (Z = 20): [ Ar] 4s 2 Sc (Z = 21): [ Ar] 4s 2 3 d 1 Zn (Z = 30): [Ar] 4s 2 d 3 10 Ga (Z = 31): [ Ar] 4s 2 3 d 4 10 p 1



