














Preview text:
lOMoARcPSD| 36625228
CHƯƠNG II: LIÊN KẾT HÓA HỌC VÀ CẤU TẠO PHÂN TỬ MỤC TIÊU
1. Định nghĩa và nêu ược mối quan hệ giữa các ại lượng ặc trưng của liên kết.
2. Trình bày ược những luận iểm cơ bản của thuyết liên kết hóa trị (VB).
3. Nêu ược những ặc iểm của các kiểu lai hóa, dự oán lai hóa và cấu trúc không gian
của một số phân tử iển hình.
4. Dựa vào các liên kết hidro, liên kết Van Der Waals giải thích ược một số tính chất
vật lý và hóa học của các phân tử.
I. NHỮNG KHÁI NIỆM VỀ LIÊN KẾT HÓA HỌC
I.1. Độ dài liên kết: là khoảng cách giữa hai hạt nhân nguyên tử trong liên kết ( ơn vị là o A ).
Ví dụ 1: Bằng phương pháp thực nghiệm người ta xác ịnh ộ dài liên kết d trong các nguyên
tử hidro halogenua như sau:
I.2. Góc hóa trị: là góc tạo thành bởi hai oạn thẳng tưởng tượng nối hạt nhân nguyên tử
trung tâm với hai hạt nhân nguyên tử liên kết.
Ví dụ 2: Nước là một phân tử có cơ cấu góc với góc hóa trị HOH = 1040,5.
I.3. Năng lượng liên kết
- Là năng lượng cần tiêu tốn ể phá hủy liên kết.
- Là năng lượng ược giải phóng ra khi tạo thành liên kết.
- Liên kết càng bền thì năng lượng liên kết càng lớn ( ơn vị là kcal/mol hay kJ/mol).
Ví dụ 3: Phân tử A2 : Li2 2Li , H = +25 kcal/mol.
Phân tử A-B: H-Cl H + Cl , H = +103 kcal/mol.
- Phân tử ABn ta có giá trị năng lượng liên kết trung bình.
Ví dụ 4: Năng lượng liên kết trung bình của liên kết O-H trong phân tử nước.
H – O – H H – O. + H. , HO-H = + 118 kcal/mol.
H – O. H. + .O. , HO-H = 102 kcal/mol.
H – O – H .O. + 2H. , Hlk trung bình (O-H) = ½ 118 + 102 = 110 kcal/mol.
I.4. Bậc liên kết : là số mối liên kết ược hình thành giữa hai nguyên tử. lOMoARcPSD| 36625228 Ví dụ 5: Etan: H3C-CH3 bậc liên kết = 1. Etilen: H2C = CH2 bậc liên kết = 2. Acetilen: HC CH bậc liên kết = 3.
II. LIÊN KẾT CỘNG HÓA TRỊ THEO CƠ HỌC LƯỢNG TỬ
Cho ến nay ã có nhiều lý thuyết nghiên cứu các kiểu liên kết hóa học. Các lý thuyết khác
nhau thành công ở mức ộ khác nhau, không giống nhau trong việc giải thích cách tạo liên kết, chủ
yếu là cách di chuyển electron, và sự thay ổi cấu hình electron của nguyên tử khi i vào phân tử.
Tựu chung có thể nêu ra các kiểu liên kết sau: cộng hóa trị, ion, kim loại, hydro… nhưng trong ó
quan trọng nhất và cơ bản nhất là kiểu liên kết cộng hóa trị. Vì vậy trước hết chúng ta xét kiểu liên
kết này và xét theo quan iểm cơ học lượng tử ể hiểu cơ chế tạo thành và các ặc iểm của nó.
Nghiên cứu cấu tạo phân tử hay liên kết giữa các nguyên tử, theo cơ học lượng tử, thực
chất là giải phương trình Schrodinger cho hệ phân tử. Nhưng như ã biết, phương trình Schrodinger
chỉ giải chính xác cho các hệ ơn giản như nguyên tử hidro hay các hệ tương tự. Đối với các hệ
phức tạp như phân tử, cơ học lượng tử phải sử dụng hai phương pháp gần úng trong ó có hai
phương pháp ược sử dụng rộng rãi là: -
Phương pháp liên kết hóa trị (Valence – bond method) dựa trên cơ sở phương pháp nhiễu loạn. -
Phương pháp orbital phân tử (Molecular – orbital) dựa trên cơ sở phương pháp biến thiên.
II.1. Phương pháp liên kết hóa trị (phương pháp VB)
II.1.1. Sự hình thành liên kết trong phân tử H2
Phương pháp VB dựa trên cơ sở nghiên cứu sự hình thành liên kết trong phân tử H2.
Luận iểm chủ yếu của thuyết này là khi tạo liên kết hóa học các nguyên tử vẫn giữ nguyên
cấu trúc và chỉ tương tác với nhau theo từng cặp electron.
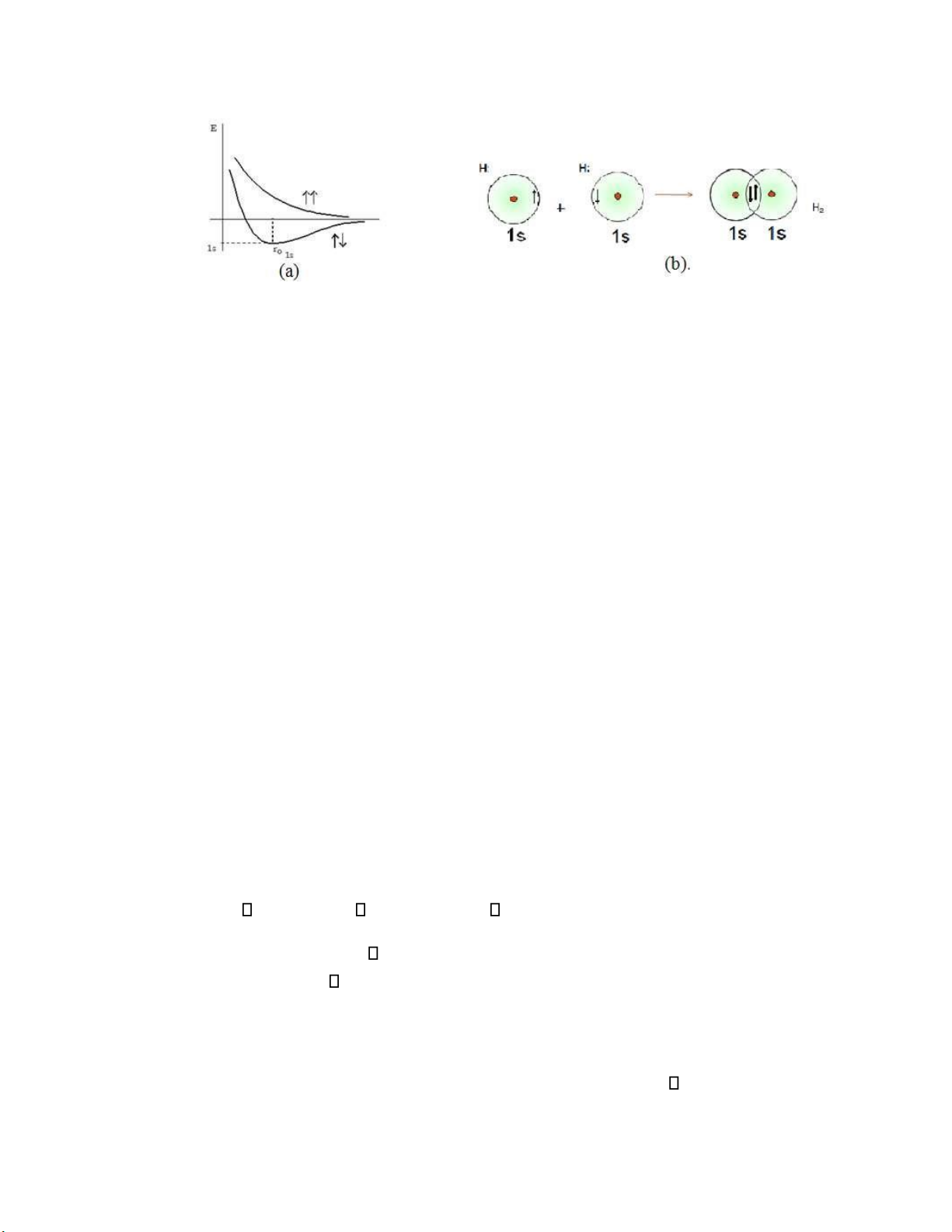
Xét sự tạo thành liên kết trong phân tử H2. Mỗi nguyên tử H có một electron ở trạng thái
cơ bản 1s. Khi hai nguyên tử H tiến lại gần nhau sẽ có hai khả năng xảy ra: -
Nếu hai electron có số lượng tử spin cùng dấu (cùng bằng 1/2 hoặc cùng bằng -1/2),
thì khi khoảng cách r giữa 2 nhân nguyên tử giảm năng lượng của hệ tăng liên tục, ó là trạng thái
không bền, không tạo thành liên kết hóa học. -
Nếu hai electron có số lượng tử spin ngược dấu nhau, khi khoảng cách r giảm năng
lượng của hệ giảm dần, và tại khoảng cách r o
0 = 0,74A , năng lượng E0 thấp nhất, khi ó hệ ở trạng
thái bền vững, ó là trạng thái hình thành liên kết (hình II.1a). lOMoARcPSD| 36625228
Hình II.1. Đường cong thế năng (a); sự xen phủ các orbital của phân tử hidro (b).
Nếu lưu ý rằng mỗi orbital s có bán kính 0,53 o
A thì khi tiếp xúc nhau khoảng cách giữa hai hạt nhân phải là 1,06 o o
A . Trong khi ó khoảng cách khi hình thành liên kết chỉ còn 0,74A . Điều ó
chứng tỏ khi hình thành liên kết, hai orbital s ã che phủ lên nhau, làm tăng xác suất có mặt electron
ở vùng giữa hai hạt nhân, mật ộ iện tích âm tăng lên gây ra sự hút hai hạt nhân và liên kết chúng với nhau (hình II.1b).
Như vậy liên kết hóa học cũng có bản chất tĩnh iện.
II.1.2. Những luận iểm cơ bản của phương pháp VB -
Liên kết hình thành là do sự kết ôi của hai electron ộc thân có spin trái dấu, ta nói
có sự phủ hai orbital nguyên tử. Vì thế liên kết cộng hóa trị ược gọi là liên kết hai electron - hai tâm. -
Liên kết cộng hóa trị càng bền khi ộ che phủ các orbital nguyên tử càng lớn, liên kết
ược thực hiện theo phương tại ó ộ che phủ là lớn nhất.
Độ che phủ lại phụ thuộc vào kích thước, hình dạng của orbital, hướng che phủ và kiểu che phủ giữa chúng.
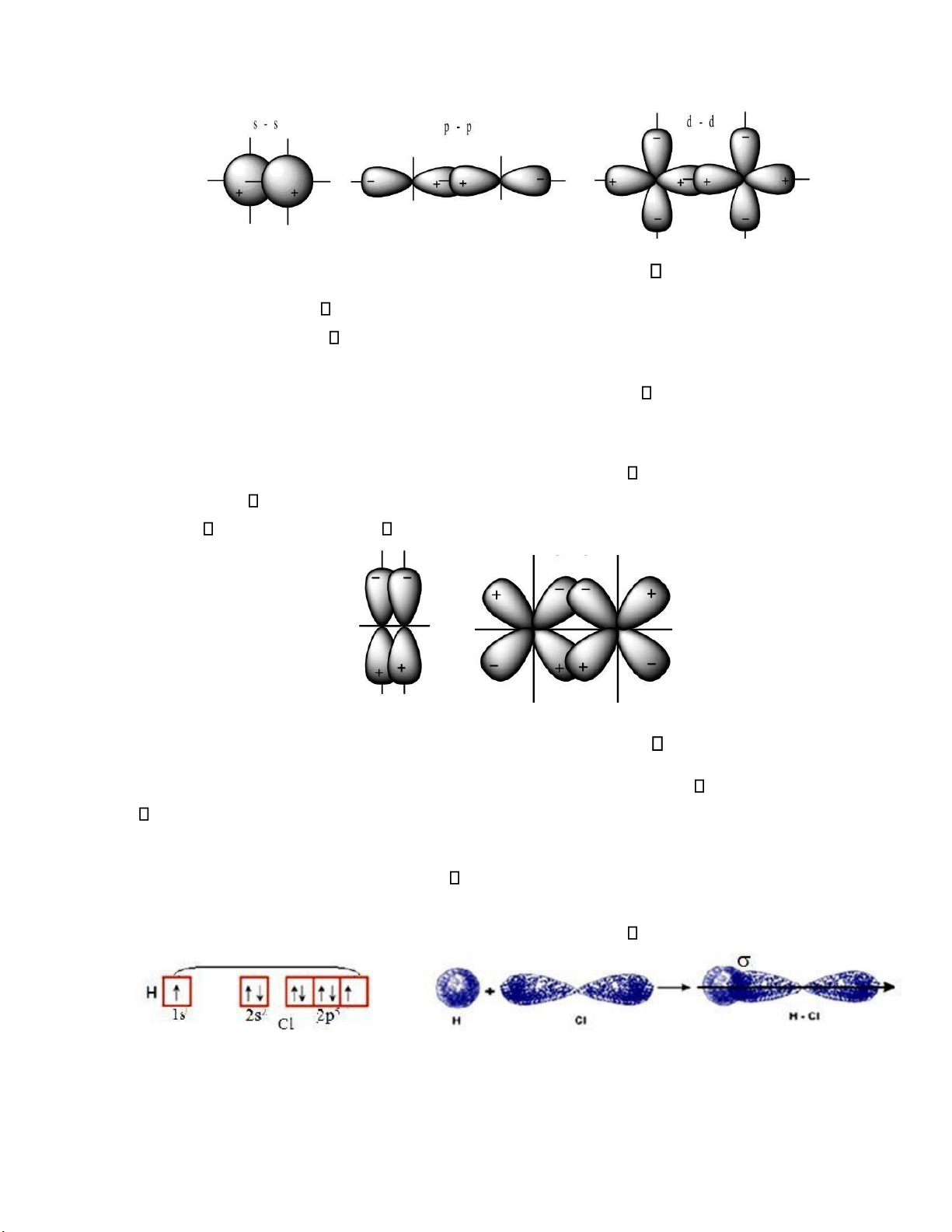
II.1.3. Tính ịnh hướng của liên kết - Các kiểu che phủ của các orbital:
Sự che phủ của các orbital nguyên tử có thể thực hiện bằng nhiều cách do chúng có hình
dạng khác nhau. Tùy thuộc vào cách che phủ và tính ối xứng của orbital phân tử tạo thành ối với
trục nối hai hạt nhân nguyên tử tương tác, người ta phân biệt các kiểu liên kết cộng hóa trị sau ây:
liên kết xích ma ( ), liên kết pi ( ), liên kết delta ( ). a)
Liên kết xích ma ( )
Liên kết cộng hóa trị ược tạo thành khi sự che phủ giữa các orbital nguyên tử tương tác
xảy ra theo trục nối hai nhân.
Loại liên kết này có thể xuất hiện do sự che phủ giữa tất cả loại orbital nguyên tử : s – s , p
– p , s – p , s – d, p – d , …
Nếu giữa hai nguyên tử chỉ có một liên kết thì liên kết ó là liên kết . lOMoARcPSD| 36625228
Hình II.2: a) Hình dạng các liên kết b) Liên kết pi ( )
Liên kết cộng hóa trị ược tạo thành khi sự che phủ giữa các orbital nguyên tử tương tác
xảy ra ở hai bên của trục nối hai nhân.
Các orbital s có dạng khối cầu nên không thể tạo ra liên kết pi ( )
Trường hợp này tương ứng với sự che phủ lẫn nhau giữa các cặp electron p – p, d – d, p – d,
Mức ộ che phủ các orbital trong trường hợp tạo thành liên kết nhỏ hơn so với trường hợp
tạo thành liên kết và các vùng che phủ cũng nằm ở xa hạt nhân hơn. Tất cả những ều này làm
cho liên kết kém bền hơn liên kết .
Hình II.2: b) Hình dạng các liên kết
Khi giữa hai nguyên tử có từ hai liên kết trở lên thì chỉ có một liên kết còn lại là các liên kết . Ví dụ 1: –
Trong phân tử H2 có 1 liên kết do sự che phủ của hai orbital s.(Hình II.1b) –
Phân tử HCl ược hình thành nhờ sự che phủ giữa obital 1s của nguyên tử hi ro và
obital 3p có 1 electron ộc thân của nguyên tử clo tạo thành 1 liên kết . lOMoARcPSD| 36625228 –
Tương tự: trong phân tử Cl2 có 1 liên kết do sự che phủ của hai orbital p. Trong
phân tử O2 có 1 liên kết do sự che phủ của hai orbital px – px và 1 liên kết do sự che phủ hai
orbital py─py của hai nguyên tử oxy.
Ví dụ 2: Trong dãy Li2, Na2, K2 do kích thước các orbital che phủ tăng lên, ưa ến giảm ộ
che phủ và kết quả ộ bền liên kết giảm.
=> Muốn cho liên kết cộng hóa trị tạo thành bền vững thì mức ộ che phủ các orbital nguyên
tử tương tác phải cực ại. Sự che phủ cực ại xảy ra theo những hướng nhất ịnh ối với các orbital
nguyên tử tương tác. Từ ó các liên kết cộng trị sẽ ược tạo thành theo những hướng nhất ịnh trong
không gian. Đó chính là tính ịnh hướng của liên kết cộng hóa trị.
II.1.4. Cộng hóa trị của nguyên tố và tính bão hòa của liên kết cộng hóa trị
Cộng hóa trị là hóa trị của các nguyên tử ã kết hợp với nhau tạo thành hợp chất có liên kết cộng hóa trị.
Ví dụ : Trong hợp chất cộng hóa trị CH4 : cộng hóa trị của C là 4 và của H là 1.
Trong thuyết VB, cộng hóa trị (hóa trị) của một nguyên tố bằng số electron ộc thân của
nguyên tố ó ở trạng thái cơ bản hay trạng thái kích thích.
Ví dụ 1: Các nguyên tố ở chu kỳ hai:
Be, B, C nhận năng lượng ( un nóng, chiếu sáng …) ể chuyển sang trạng thái kích thích.
Cặp electron 2s sẽ tách ôi và một electron sẽ chuyển lên orbital 2p còn trống – sự tiêu tốn năng
lượng này ược bù lại khi nguyên tử ược tạo thành các liên kết hóa học.
Cộng hóa trị của các nguyên tố trong các hợp chất có liên kết phối trí cũng ược giải thích tương tự.
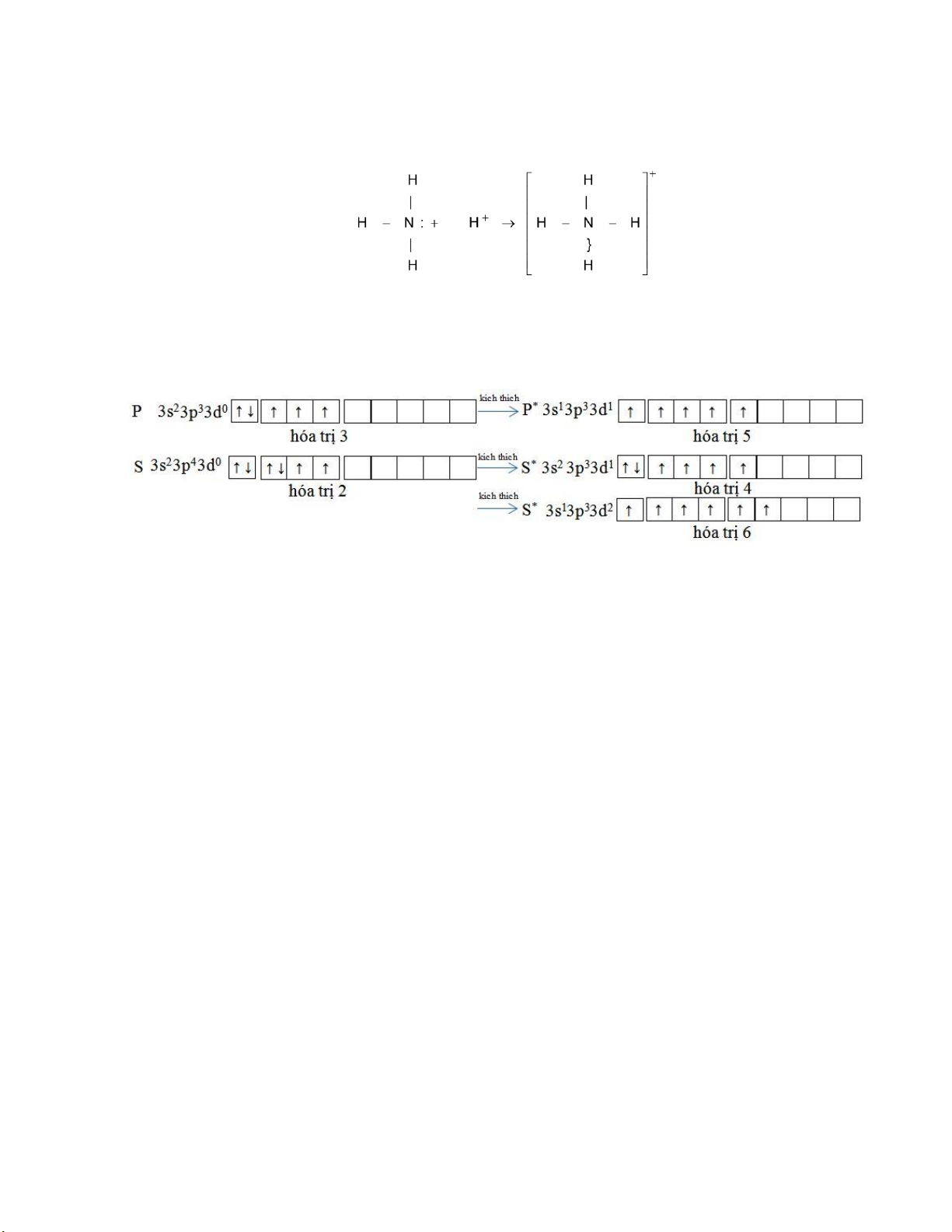
Ví dụ 2: Nguyên tử N sau khi tạo thành ba liên kết N-H trong phân tử NH3, nitơ còn một
orbital chứa ôi iện tử tự do có thể liên kết với ion H+ có một orbital 1s trống. lOMoARcPSD| 36625228
Ion H+ và ôi iện tử tự do trên N bây giờ chuyển ộng trong trường hai hạt nhân nguyên tử
tương tác tạo nên một liên kết cho – nhận (phối trí).
Các nguyên tố ở chu kỳ 3 do có thêm orbital 3d nên số liên kết cộng hóa trị cực ại tăng lên
và bằng số electron hóa trị ộc thân ở trạng thái kích thích. Ví dụ 3:
Tổng quát: Khả năng tạo thành số liên kết cộng hóa trị cực ại của một nguyên tố ược
xác ịnh bằng số orbital nguyên tử hóa trị của nguyên tố.
Ví dụ: các nguyên tố chu kỳ II có số orbital hóa trị là 4 (1 của 2s và 3 của 2p) nên chúng
có thể tạo thành tối a 4 liên kết cộng hóa trị.
Khả năng tạo thành liên kết cộng hóa trị của các nguyên tố hạn chế như vậy ược gọi
là tính bão hòa của liên kết cộng hóa trị.
Chính tính chất này làm cho các phân tử có thành phần xác ịnh và có cấu trúc nhất ịnh.
II.1.5. Tính có cực và sự phân cực của liên kết cộng hóa trị
Trong những phân tử có cấu tạo từ 2 nguyên tử cùng loại (ví dụ như H2, Cl2 , N2 , …) ám
mây electron liên kết phân bố ối xứng trong không gian giữa hai hạt nhân nguyên tử. Trong trường
hợp này liên kết cộng hóa trị ược gọi là không cực hay ồng cực.
Ngược lại, trong những phân tử tạo thành từ hai nguyên tử khác loại (ví dụ HCl, HF, …)
ám mây electron liên kết phân bố không ối xứng và dịch chuyển về phía một nguyên tử nào ó.
Trường hợp này liên kết cộng hóa trị gọi là có cực hay phân cực. lOMoARcPSD| 36625228
Sự dịch chuyển ám mây electron liên kết xảy ra là do sự khác nhau về ộ âm iện cũng như
kích thước của các nguyên tử tương tác.
Đám mây electron liên kết sẽ dịch chuyển về phía nguyên tử của nguyên tố âm iện lớn hơn
làm cho nguyên tử của nguyên tố này bị phân cực âm, và nguyên tố kia sẽ bị phân cực dương.
Tóm lại, tùy thuộc vào sự phân bố mật ộ electron mà liên kết cộng hóa trị có thể là không cực, có cực.
Từ các ặc iểm trên mà liên kết cộng hóa trị có tính chất ặc trưng là: ịnh hướng, bão hoà và phân cực.
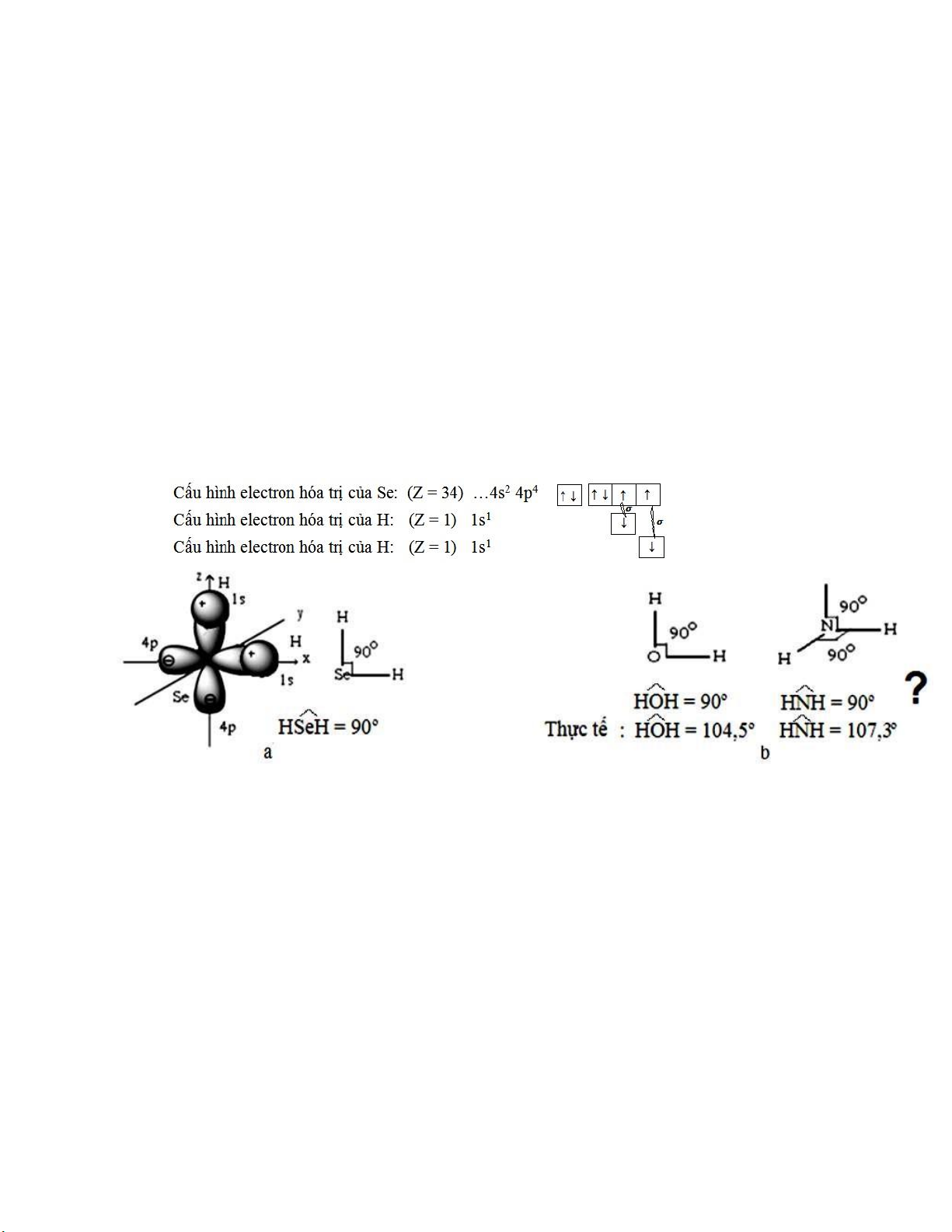
Ví dụ 4: Xét sự hình thành phân tử H2Se theo thuyết VB.
Trong phân tử H2Se, hai liên kết Se-H ược tạo thành do sự phủ của hai orbital ls của hai
nguyên tử hidro với hai orbital 4p (ví dụ 4px và 4py) của nguyên tử Se. Sự che phủ lớn nhất xảy ra
dọc theo trục x và y, do các liên kết Se-H tạo thành phải phân bố dưới góc 900, nghĩa là góc hóa trị
H-Se-H = 900, trùng với thực nghiệm.(Hình II.4.a)
Hình II.4. Mô tả cấu tạo phân tử theo thuyết VB: a) H2Se ; b) H2O, NH3
Nếu áp dụng thuyết VB cho phân tử H2O và NH3 thì các góc hóa trị H-O-H và H-N-H phải
bằng 900. Trong thực tế, kết quả xác ịnh thực nghiệm cho thấy góc H-O-H bằng 1040,5 và góc H-
N-H bằng 1070,3 (Hình II.4.b)
Để giải thích sự không phù hợp giữa suy luận và thực nghiệm trên, năm 1931 Pauling và
Slater ã ề ra lý thuyết lai hóa trong khuôn khổ thuyết VB.
II.2. Thuyết lai hóa các orbital nguyên tử và cấu hình không gian phân tử -
Nguyên tử khi tương tác với nhau có thể không sử dụng những orbital s, p hay d
“thuần túy”, trái lại những orbital này có thể trộn lẫn (hay tổ hợp) với nhau thành những orbital
mới có năng lượng, hình dạng và kích thước giống nhau gọi là orbital lai hóa. -
Trong ó có bao nhiêu orbital nguyên tử tham gia lai hóa sẽ cho bấy nhiêu orbital
lai hóa và chúng phân bố ối xứng trong không gian. lOMoARcPSD| 36625228
Tùy thuộc vào số và loại orbital nguyên tử tham gia lai hóa mà có các kiểu lai hóa như: sp, sp2, sp3, sp3d, sp3d2…
Orbital lai hóa có mật ộ electron dồn về một phía, iều này làm cho khi orbital lai hóa tham
gia tương tác sự che phủ sẽ xảy ra mạnh hơn và do ó liên kết ược tạo thành sẽ bền hơn so với các
orbital nguyên tử thuần túy.
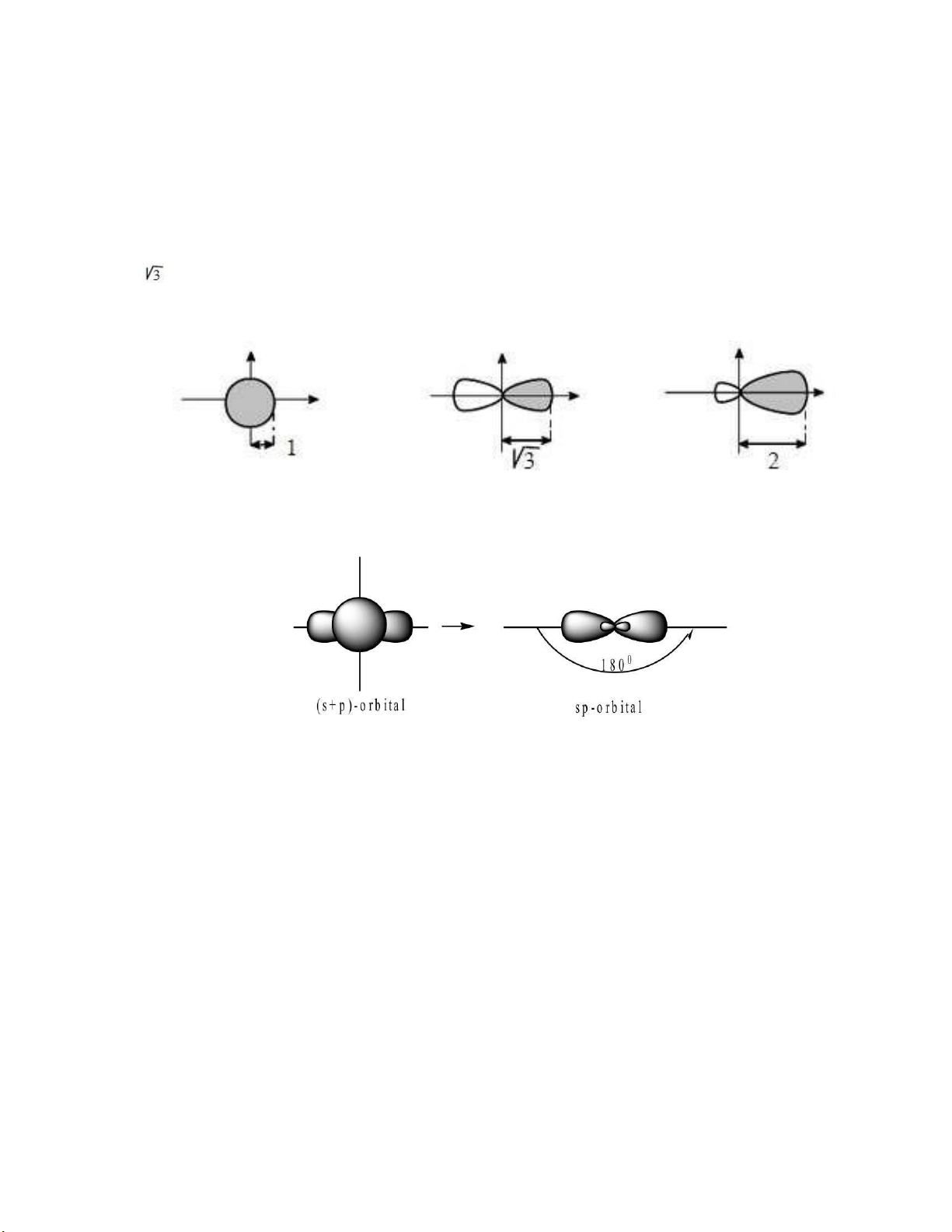
Ví dụ: Các kết quả tính toán cho thấy nếu xem khả năng che phủ của orbital s là 1, orbital p là
thì của orbital lai hóa sp là 2.
Có thể nói: orbital lai hóa sp có dạng hình quả tạ lệch về 1 phía hoặc số tám nổi không cân ối.
II.2.1. Lai hóa sp: Sự tổ hợp một orbital s với một orbital p (của cùng một nguyên tử) cho
hai orbital lai hóa sp phân bố ối xứng có cùng trục nằm trên cùng một ường thẳng.(Hình II.5)
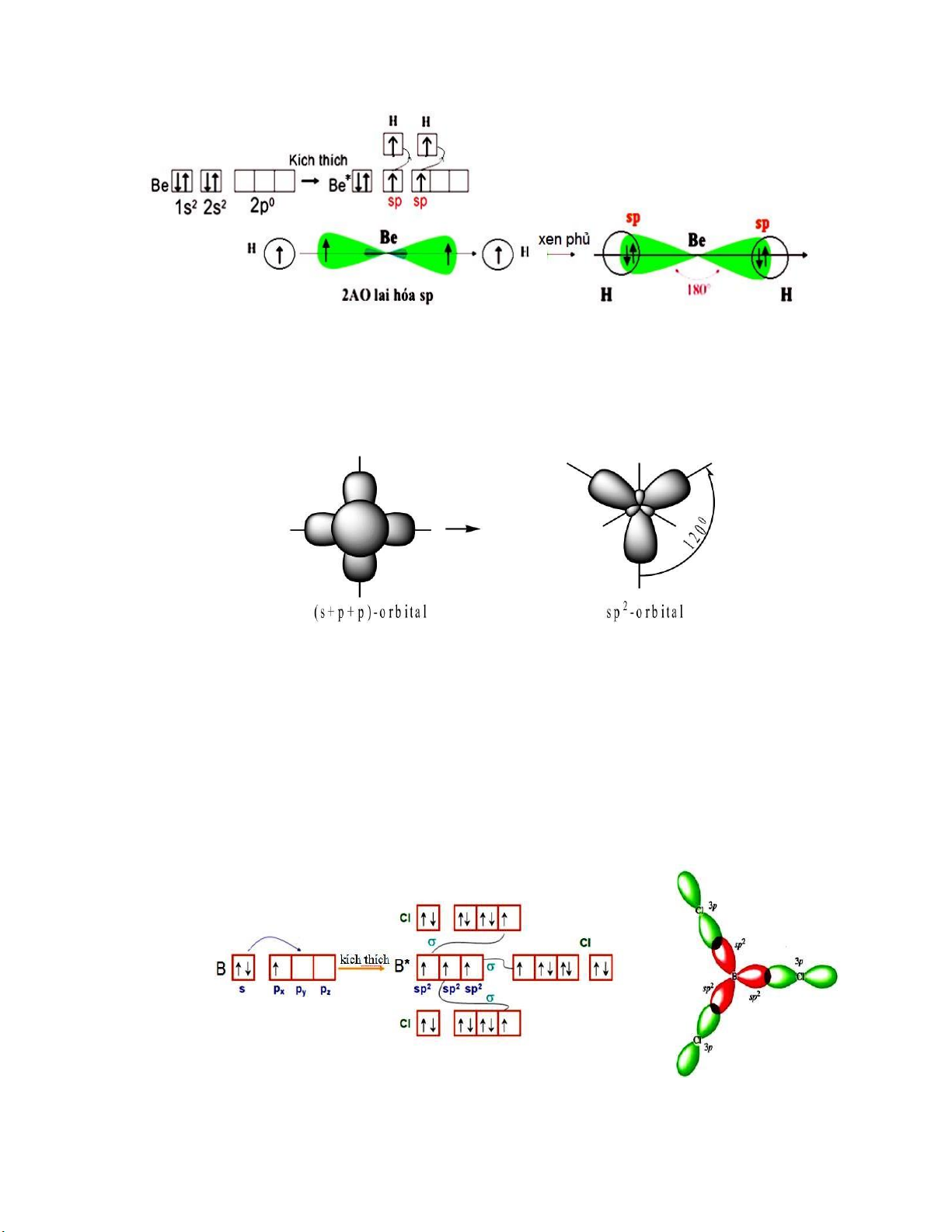
Ví dụ 1: Giải thích sự tạo thành phân tử BeH2
Trước khi tạo liên kết, hai orbital 2s và 2p của Be (Z = 4) lai hóa nhau cho hai orbital lai
hóa sp tương ương có trục nằm trên cùng một ường thẳng và ngược chiều nhau. Sự phủ của hai
orbital lai hóa này với hai orbital ls của hai nguyên tử H ể tạo thành hai liên kết Be – H tương ương thẳng hàng. lOMoARcPSD| 36625228
Phân tử BeH2 có góc hóa trị xác ịnh bằng thực nghiệm H – Be – H = 1800.(Hình II.6) Hình
II.6. Lai hóa sp của phân tử BeH2.
II.2.2. Lai hóa sp2: Sự tổ hợp một orbital s với hai orbital p cho ba orbital lai hóa sp2
tương ương có trục nằm trên cùng mặt phẳng tạo với nhau những góc 1200. (Hình II.7) Hình II.7. Sự lai hóa sp2
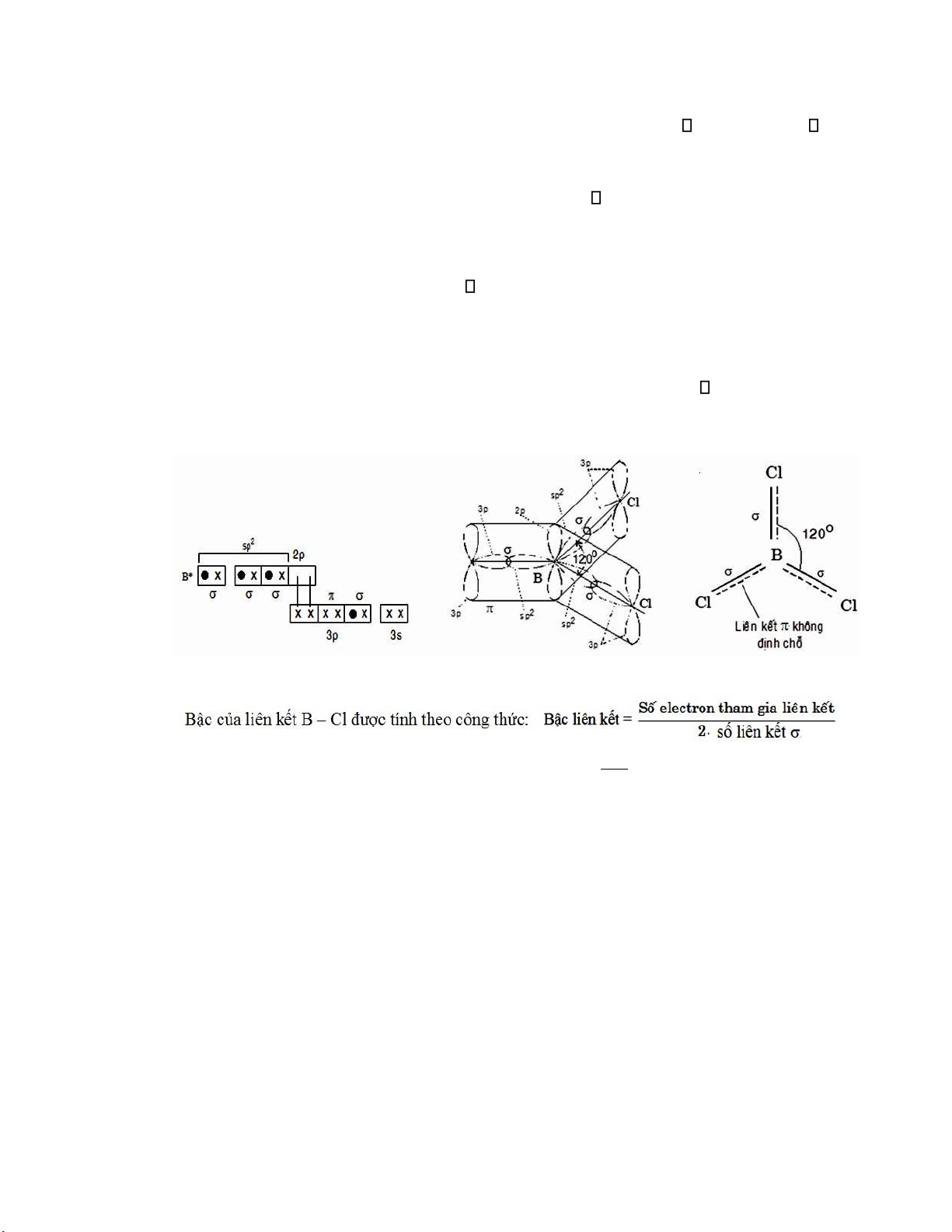
Ví dụ 2: Giải thích sự tạo thành phân tử BCl3
Nguyên tử B (Z = 5) kích thích có cấu hình electron lớp ngoài cùng là 2s12p3 và khi tham
gia tạo liên kết với các nguyên tử clo (Z = 17) nó ở trạng thái lai hóa sp2, tương ương với sự che
phủ lẫn nhau giữa orbital 2s và hai orbital 2p, ví dụ là 2px và 2py của nguyên tử B (Hình II.8).
Các orbital sp2 này ều chứa một electron hóa trị và tham gia che phủ với ba orbital 3px của
các nguyên tử Cl ể tạo thành ba liên kết B-Cl.
Phân tử tam giác BCl3 có góc hóa trị Cl–B– Cl = 1200.
Hình II.8. Phân tử BCl3 có lai hóa sp2 lOMoARcPSD| 36625228
II.2.3. Lai hóa sp3: Sự tổ hợp một orbital s với ba orbital p cho bốn orbital lai hóa sp3 có
trục hướng về 4 ỉnh một tứ diện ều (góc 109028’). (Hình II.9) Hình II.9. Sự lai hóa sp3
Ví dụ 3: Giải thích sự tạo thành phân tử CCl4
Khi tạo thành phân tử CCl4, một orbital 2s lai hóa với ba orbital 2p của C (Z = 6) cho 4
orbital lai hóa sp3. Sự phủ của 4 orbital lai hóa này với 4 orbital 3p của 4 nguyên tử Cl (Z = 17)
cho 4 liên kết tương ương với góc hóa trị 109028’. (Hình II.10)
Phân tử tứ diện ều CCl4 có góc hóa trị Cl-C-Cl = 109028’.
Hình II.10. Phân tử CCl4 có lai hóa sp3
II.2.4. Điều kiện ể có sự lai hóa hữu hiệu •
Các orbital nguyên tử tham gia lai hóa phải có năng lượng xấp xỉ nhau. Các
orbital nguyên tử khi lai hóa phải thuộc cùng lớp hoặc cùng phân lớp sẽ có năng lượng gần bằng nhau.
Ví dụ 1: Các orbital 2s và 2p hoặc các orbital 3s, 3p, 3d lai hóa với nhau.
Ngược lại, nếu hiệu số năng lượng giữa các orbital nguyên tử càng lớn thì sự lai hóa càng kém hữu hiệu.
Ví dụ 2: Đối với các nguyên tố ở chu kỳ II khi i từ trái sang phải hiệu số năng lượng giữa
2 orbital 2p và 2s tăng lên làm cho khả năng lai hóa giảm xuống. X Li Be B C N O F Ne ∆E2p-2s (eV) 1,9 2,8 5,7 8,1 11,4 18,9 22,6 26,8
Do ó: các chất có sự lai hóa sp2 giảm dần là: CO 2- 3 > NO2 > O3. •
Mật ộ electron của các orbital nguyên tử phải ủ lớn. lOMoARcPSD| 36625228
Trong nhóm i từ trên xuống do kích thước nguyên tử tăng lên làm giảm mật ộ electron nên
khả năng tạo lai hóa giảm xuống.
Ví dụ 3: Các nguyên tử thuộc nhóm VA khi i từ N, P, As, Sb bán kính tăng lên, do vậy sự
lai hóa sp3 là ặc trưng cho NH3, mức ộ ặc trưng giảm dần qua PH3, AsH3 ến SbH3 sự lai hóa coi
như không còn nữa. Điều này thấy ược qua ộ lớn của góc hóa trị NH3 bằng 1070, PH3 bằng 1030,
AsH3 bằng 930 SbH3 bằng 920. •
Mức ộ che phủ của các orbital nguyên tử càng tăng.
II.2.5. Dự oán trạng thái lai hóa
Để có thể dự oán trạng thái lai hóa của một số nguyên tố trung tâm A trong hợp chất ABn
trong ó liên kết giữa A và B là liên kết ơn, ta theo qui tắc sau:
+ Hợp chất trung hòa iện ABn:
Ta cộng số iện tử ở lớp ngoài cùng của nguyên tử trung tâm A với n iện tử óng góp bởi n
nhóm nguyên tử biên B, mỗi nhóm ược xem như góp vào một iện tử. Số iện tử tổng cộng sẽ cho
biết trạng thái lai hóa của A.
+ Hợp chất mang iện tích: Ta xác ịnh tổng số iện tử như trong hợp chất trung hòa iện, rồi
cộng thêm số iện tích âm hoặc số iện tích dương có trên ion, sau cùng áp dụng qui tắc như trên.
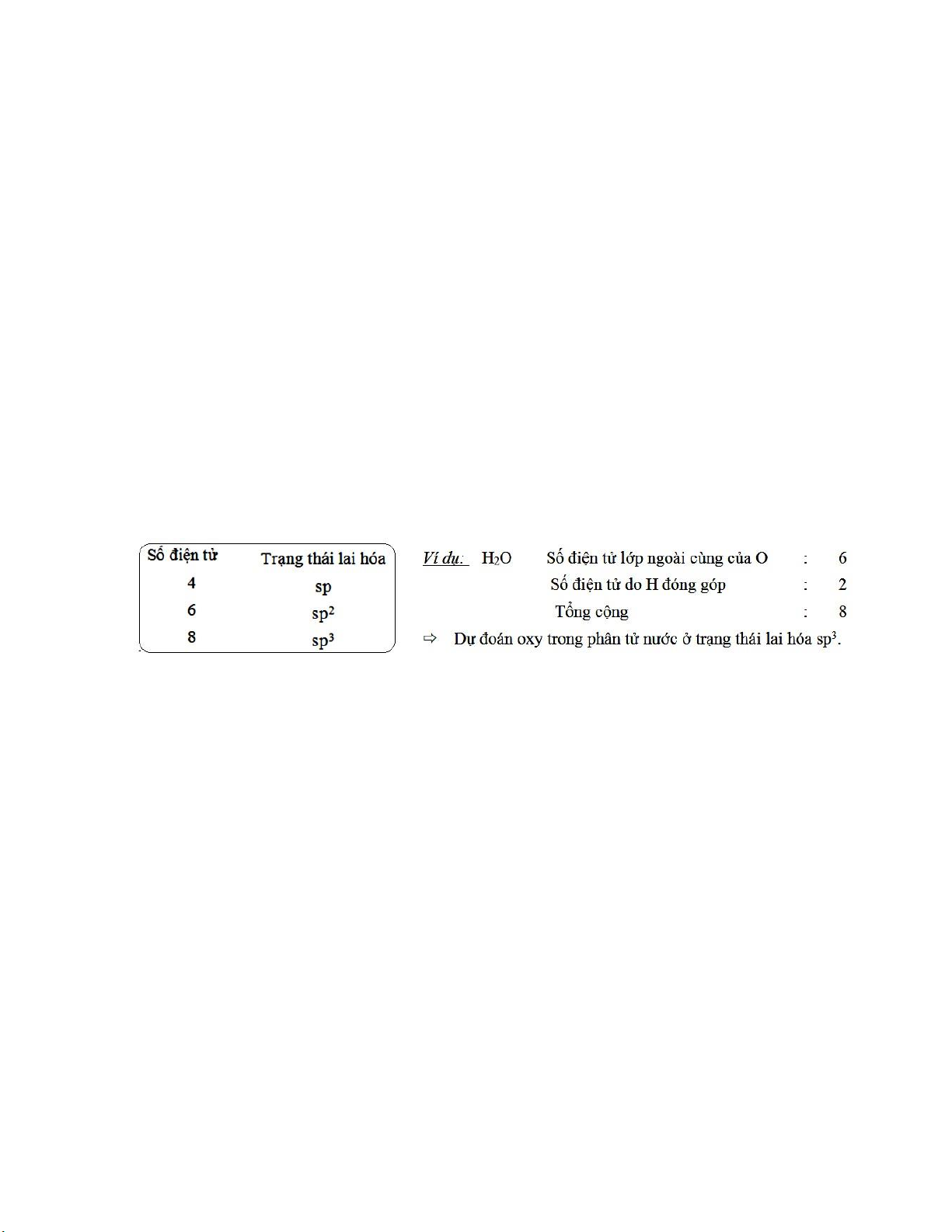
Ví dụ 1 : Dự oán trạng thái lai hóa nguyên tử trung tâm N trong ion NH - + 2 và NH4 • Ion NH -
2 , có tổng số iện tử quanh N = 5 + 2 + 1 = 8 Vậy N ở
trạng thái lai hóa sp3, ion NH -
2 có cấu hình không gian là góc. • Ion NH +
4 ,có tổng số iện tử quanh N = 5 + 4 – 1 = 8.
Vậy N ở trạng thái lai hóa sp3, ion NH +
4 có cấu hình không gian là tứ diện ều.
Lưu ý: Trường hợp B là oxy (hợp chất AOn) hoặc B là lưu huỳnh (hợp chất ASn) ta
chỉ lấy số iện tử ngoài cùng của nguyên tử trung tâm A.
Ví dụ 2: Trong ion SO 2-
4 , S có 6 iện tử ngoài cùng cộng thêm 2 iện tích âm trên ion, tổng
số iện tử bằng 8 vậy dự oán lai hóa sp3.
Trong phân tử CS2, C có bốn iện tử ngoài cùng, vậy C có trạng thái lai hóa sp.
II.2.6. Cấu hình không gian của phân tử theo thuyết VSEPR lOMoARcPSD| 36625228
Dựa vào sự che phủ cực ại và sự lai hóa các orbital nguyên tử chúng ta ã giải thích ược
những phân tử có dạng hình học khác nhau ược ặc trưng bằng những góc hóa trị 180o, 120o, 109o28’...
Tuy nhiên không phải bao giờ các phân tử cũng ều có góc hóa trị như trên, trái lại thực tế
cho thấy ối với nhiều hợp chất góc hóa trị ặc trưng cho chúng có giá trị sai lệch ít nhiều. Chẳng
hạn như ã nói ởtrên, các phân tử H2O và NH3 có góc hóa trị tương ứng là 10405 và 10703, nghĩa là
gần với giá trị 109028’. Sự sai lệch về góc hóa trị như vậy thường ược giải thích bằng lý thuyết ẩy
nhau giữa các cặp electron hóa trị, lý thuyết này còn ược gọi là lý thuyết VSEPR (Valence shell
electron – pair repulsion theory). Theo thuyết này sự sai lệch góc hóa trị nguyên tử xảy ra khi ở
nguyên trung tâm của phân tử có cặp electron hóa trị tự do (cặp eletron không liên kết). Những
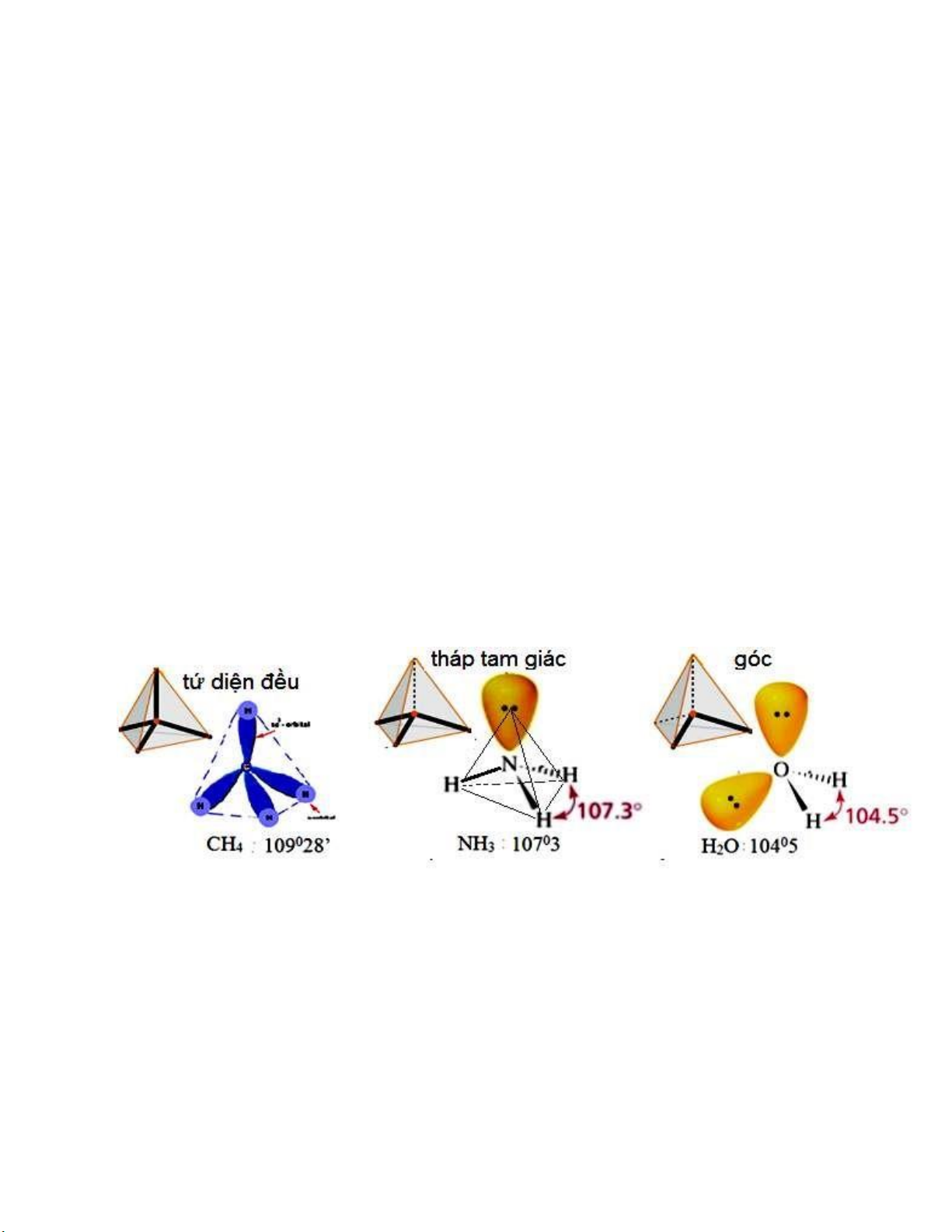
cặp electron này gây nên sự ẩy nhau giữa chúng cũng như giữa chúng với các cặp electron liên kết. Cụ thể: (Hình II.11) -
Trong phân tử CH4 không có cặp electron hóa trị tự do nào ở nguyên tử trung tâm
C, do ó sự phân bố mật ộ electron hoàn toàn ối xứng. -
Trong phân tử NH3, nguyên tử N trung tâm có một cặp electron không liên kết, cặp
này phân bố trên một orbital lai hóa sp3. Do tác dụng ẩy của nó ối với cặp electron liên kết N-H
nên góc hóa trị H-N-H nhỏ hơn 109028 một ít. -
Trong khi ó ối với phân tử H2O, nguyên tử trung tâm có ến hai cặp electron không
liên kết chiếm hai orbital lai hóa sp3 nên tác dụng ẩy của chúng lớn hơn và góc hóa trị H-O-H càng nhỏ hơn so với 109028.
Hình II.11. Sự ẩy nhau của các cặp electron không tham gia liên kết.
Ngoài ra sự có mặt của các cặp electron không liên kết này cũng làm thay ổi cấu hình không
gian của các hợp chất. Chẳng hạn ối với ba phân tử nêu trên, chúng ta thấy CH4 có cấu hình tứ diện
ều, NH3 có dạng khối tháp còn H2O dạng góc mặc dù các nguyên tử trung tâm C, N, O ều có lai hóa sp3 giống nhau.
Cấu hình không gian và góc hóa trị của phân tử có thể ược dự oán bằng thuyết ẩy nhau giữa
các cặp electron (VSEPR). Theo thuyết này: lOMoARcPSD| 36625228 -
Sức ẩy giữa các cặp electron liên kết (LK - LK) nhỏ hơn sức ẩy giữa các cặp electron
liên kết và không liên kết (LK - KLK). -
Sức ẩy giữa các cặp electron liên kết và không liên kết nhỏ hơn sức ẩy giữa các cặp
electron không liên kết (KLK – KLK).
Tóm lại: Sức ẩy các cặp electron giảm dần như sau: KLK – KLK > KLK- LK > LK-LK.
Có thể nói các cặp electron không liên kết có ảnh hưởng lớn ến cấu hình không gian của
phân tử cũng như việc giải thích hình dạng không gian của phân tử.
Bảng: Mối liên hệ giữa cấu hình không gian phân tử ABn và số liên kết
II.2.7. Cấu tạo một số phân tử iển hình và cách tính bậc liên kết
Phân tử N2: trong phân tử N2, liên kết N – N ược hình thành do sự che phủ khác nhau giữa
ba cặp orbital hóa trị 2p của hai nguyên tử tương tác: •
Cặp 2px tạo thành 1 liên kết . •
Hai cặp 2py và 2pz tạo thành 2 liên kết . lOMoARcPSD| 36625228
Do vậy liên kết N-N trong phân tử N2 là liên kết 3, gồm một liên kết và hai liên kết . Phân tử BCl3:
Như ã phân tích trong ví dụ về sự lai hóa sp2, ba liên kết B-Cl trong phân tử BCl3 ược
tạo thành do sự che phủ giữa ba orbital lai hóa sp2 của B với ba orbital 3p của 3 nguyên tử clo, do
vậy phân tử BCl3 có dạng tam giác ều với ba góc hóa trị Cl-B-Cl = 1200.
Tuy nhiên sau khi tạo thành ba liên kết , ở lớp electron ngoài cùng của B chỉ mới có sáu
electron phân bố trên ba orbital lai hóa sp2, trên B còn một orbital hóa trị 2p trống không có iện tử,
chưa ược bão hòa electron.
Trong khi ó ở Cl lại có các cặp electron hóa trị tự do 3p, từ ây ể ạt ược ộ bền cực ại (có thể)
cho các liên kết B-Cl, giữa nguyên tử B và ba nguyên tử Cl xuất hiện liên kết p-p không ịnh chỗ
bổ sung (hay liên kết hai electron – bốn tâm) do sự che phủ giữa orbital 2p còn trống của B với ba
orbital hóa trị 3p của 3 nguyên tử Cl.
Hình II.13. Sự che phủ giữa các orbital và cấu tạo phân tử BCl3. 8
=> Bậc liên kết của phân tử BCl 3 = = 1,33 2.3
Tóm lại phương pháp VB cho phép giải quyết ược nhiều vấn ề của liên kết cộng hóa trị như khả
năng tạo liên kết, các ặc trưng liên kết, giải thích ược cấu trúc và tính chất của nhiều phân tử và
nhất là có tính chất rõ ràng ể hình dung. Tuy nhiên phương pháp VB vẫn chưa ược tổng quát vì có
nhiều sự kiện thực nghiệm không thể giải thích ược bằng phương pháp này. Chẳng hạn tính thuận từ của phân tử O +
2, sự tồn tại của phân tử H2 khá bền…
II.3. Độ phân cực của phân tử
II.3.1. Phân tử có cực và phân tử không có cực
Trong mỗi phân tử ều có các hạt nhân mang iện dương và các mây iện tử mang iện âm:
giữa các hạt nhân mang iện dương có thể tìm thấy một iểm gọi là trọng tâm iện tích dương và giữa
các mây iện tử mang iện tích âm có thể tìm thấy một iểm gọi là trọng tâm iện tích âm. Một phân lOMoARcPSD| 36625228
tử trong ó các hạt nhân mang iện dương và các mây iện tử mang iện âm ược phân bố hoàn toàn ối
xứng, do ó trọng tâm iện tích dương và trọng tâm iện tích âm hoàn toàn trùng với nhau thì ược gọi
là phân tử không có cực.
Trong trường hợp ngược lại hai trọng tâm iện tích dương và âm không trùng nhau thì phân
tử ược nói là có cực.
II.3.2 Momen lưỡng cực
Mỗi phân tử có cực là một lưỡng cực, nghĩa là một hệ gồm hai iện tích bằng nhau nhưng
ngược dấu, ký hiệu là + và - ặt cách nhau một khoảng l, l ược gọi là ộ dài của lưỡng cực.
Độ có cực của phân tử (cũng như của một liên kết) ược ánh giá bằng một ại lượng gọi là
momen lưỡng cực ký hiệu bằng chữ (muy). Momen lưỡng cực bằng tích của ộ dài lưỡng cực (l)
với trị số tuyệt ối của iện tích ( ) trên mỗi cực. = l. •
Trong hệ thống ơn vị CGS, momen lưỡng cực ược o bằng ơn vị ơbay
(debye) ký hiệu D, 1 debye (1D) = 10-18 ( ơn vị tĩnh iện.cm). •
Độ dài lưỡng cực l có giá trị khoảng 10-8 cm. •
ược tính theo iện tích electron là 4,8.10-10 ơn vị tĩnh iện.
Ví dụ 1: Tính momen lưỡng cực của phân tử A-B biết ộ dài lưỡng cực của liên kết A-B o là 0,38 A .
Áp dụng công thức trên, ta có: = 0,38.10-8x 4,8.10-10 = 1,824.10-18 (vt.cm) = 1,824 D.
- Phân tử không có cực thì có = 0.
- Phân tử có cực thì có > 0. Phân tử có cực mạnh thì có càng lớn.
- Các phân tử cộng hóa trị có momen lưỡng cực nằm trong khoảng 0 – 4 D, còn các
phân tử ion có nằm tromg khoảng 4 – 11 D.
- Mỗi momen lưỡng cực thường ược biểu diễn bằng một vectơ hướng từ cực dương
ến cực âm có chiều dài tỉ lệ ộ lớn của momen lưỡng cực.
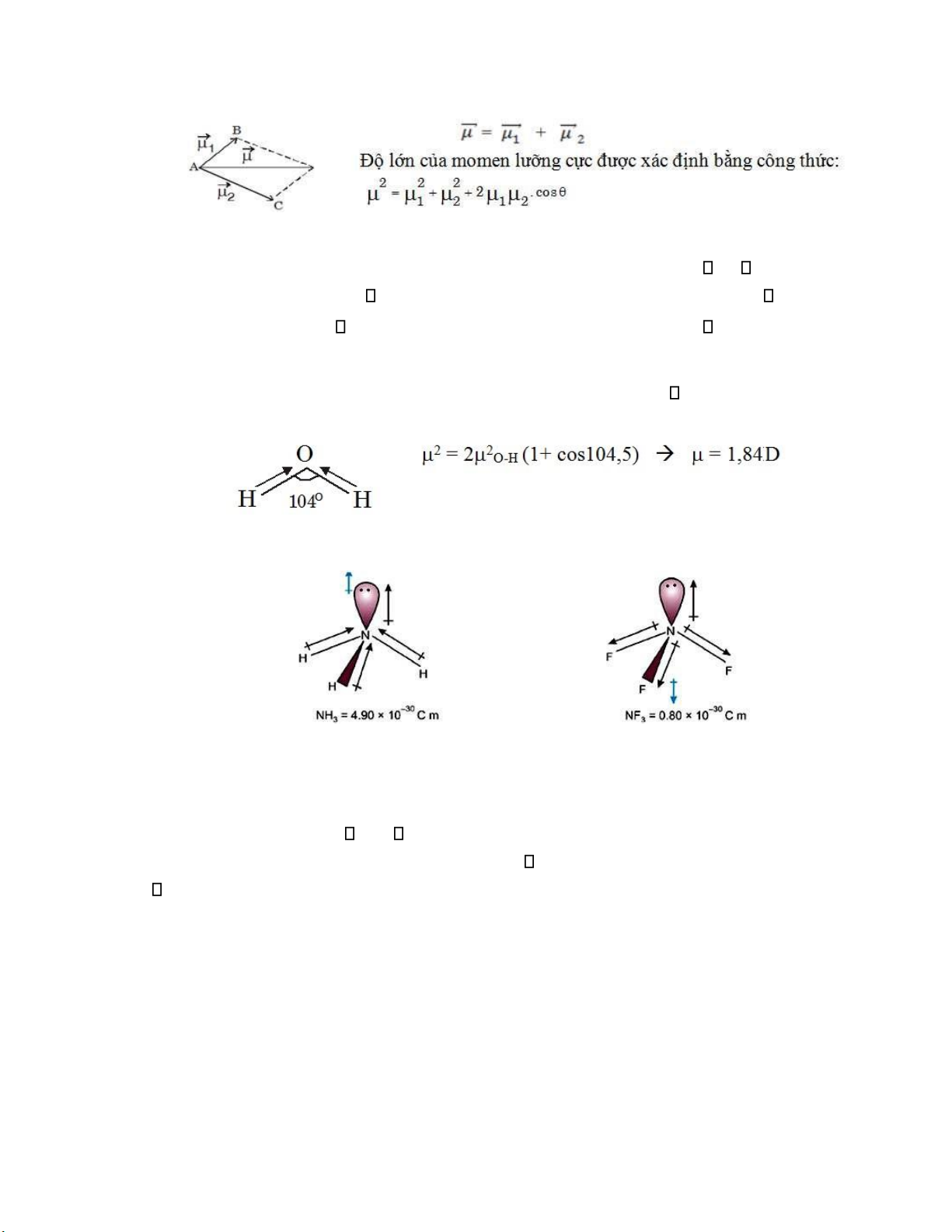
Trong trường hợp phân tử cấu tạo từ nhiều nguyên tử ta có thể coi momen lưỡng cực của
toàn phân tử là tổng vectơ của các momen lưỡng cực của từng mối liên kết. •
Phân tử hai nguyên tử có momen lưỡng cực bằng úng momen lưỡng cực của liên kết.
Đó là trường hợp các phân tử như HCl, HBr, HI… •
Phân tử có cấu tạo ối xứng ều có momen lưỡng cực bằng không. •
Phân tử ba nguyên tử, tổng quát nhất là phân tử dạng ABC với các mối liên
kết A-B và A-C có cực. Gọi 1 và 2 là momen lưỡng của hai mối liên kết A-B, A-C và
là góc giữa hai vectơ momen lưỡng cực 1, 2.
Khi ó momen lưỡng cực của toàn phân tử ược tính bằng tổng vectơ của 1 và 2: lOMoARcPSD| 36625228
Ví dụ 2: Đối với phân tử CO2 có cấu tạo thẳng hàng: O = C = O. Khi ó 1 = 2 , hai vectơ
𝜇⃗⃗⃗ 1 , 𝜇⃗⃗⃗ 2 trực ối nhau (góc = 1800), nên khi cộng lại, hai vectơ triệt tiêu nhau: = 0.
Thực nghiệm cho biết CO2 = 0, mặc dù liên kết C = O phân cực mạnh ( CO = 2,7 D). Như
vậy phân tử CO2 thuộc loại không cực.
Ví dụ 3: Trường hợp phân tử H2O: Hai mối liên kết O-H có cực ( O-H = 1,51 D) tạo với
nhau một góc bằng 1040,5 vì vậy phân tử nước có cực mạnh với momen lưỡng cực phân tử là:
- Ngoài ra các cặp electron hóa trị tự do trong phân tử cũng có ảnh hưởng ến momen lưỡng cực của phân tử.
Hình II.14. Cấu hình không gian phân tử NH3 và NF3
Xét hai phân tử NH3 và NF3 chúng ều có cấu hình không gian là khối tháp và có một cặp
electron hóa trị tự do phân bố trên orbital lai hóa sp3 hướng về một ỉnh của tứ diện. Các liên kết
N-H và N-F ều có cực, trong ó N-H < N-F.
Tuy nhiên momen lưỡng cực của phân tử NH3 ( = 1,48D) lớn hơn momen lưỡng cực của
NF3 ( = 0,2 D) nhiều, vì ối với NH3 momen lưỡng cực của cặp electron hóa trị cùng chiều với
momen lưỡng cực của ba liên kết, do ó tổng momen lưỡng cực của NH3 có giá trị lớn. Trong khi
ó ối với NF3, momen lưỡng cực của ba liên kết N-F ngược chiều với momen lưỡng cực của cặp
electron hóa trị do ó tổng momen lưỡng cực của NF3 phải có giá trị nhỏ.
II.4. Phương pháp orbital phân tử (phương pháp MO)
II.4.1. Các luận iểm cơ bản của phương pháp MO (Molecular orbital) 1927
Có thể nói phương pháp MO hiện nay là phương pháp cơ học lượng tử lý giải tốt nhất, tổng
quát nhất về liên kết hóa học, vì nó cho phép giải quyết các vấn ề ặt ra một cách tự nhiên, nhất lOMoARcPSD| 36625228
quán và cho những kết quả tính toán ngày càng phù hợp tốt hơn so với thực nghiệm. Nội dung của
phương pháp MO bao gồm những luận iểm cơ bản sau: -
Phân tử ược coi như một hạt thống nhất, trong ó electron liên kết chuyển ộng ( tương
tự như ở nguyên tử) trong một iện trường gây ra bởi các hạt nhân và các electron còn lại. -
Trong phân tử trạng thái của electron ược mô tả bằng các MO (tương tự như ở
nguyên tử, trạng thái của electron ược mô tả bằng các AO). -
Khi nguyên tử i vào liên kết, các AO của chúng tổ hợp lại (xen phủ) với nhau tạo ra
các MO. Cứ tổ hợp 2 AO thì tạo ược 2 MO.
Điều kiện ể có sự tổ hợp là:
+ Các orbital nguyên tử phải gần nhau về năng lượng.
+ Các orbital nguyên tử phải che phủ nhau áng kể.
+ Các orbital nguyên tử phải có ối xứng giống nhau ối so với trục liên kết.
Trong phân tử các electron ược phân bố dần vào các MO , *, , *, ∂, φ… cũng theo
một số quy tắc nhất ịnh như nguyên lý ngoại trừ, nguyên lý vững bền và quy tắc Hund như ối với
electron trong nguyên tử.
Ví dụ 1: Tổ hợp hai orbital nguyên tử 1s của hydro cho hai orbital phân tử liên kết và phản liên kết *:
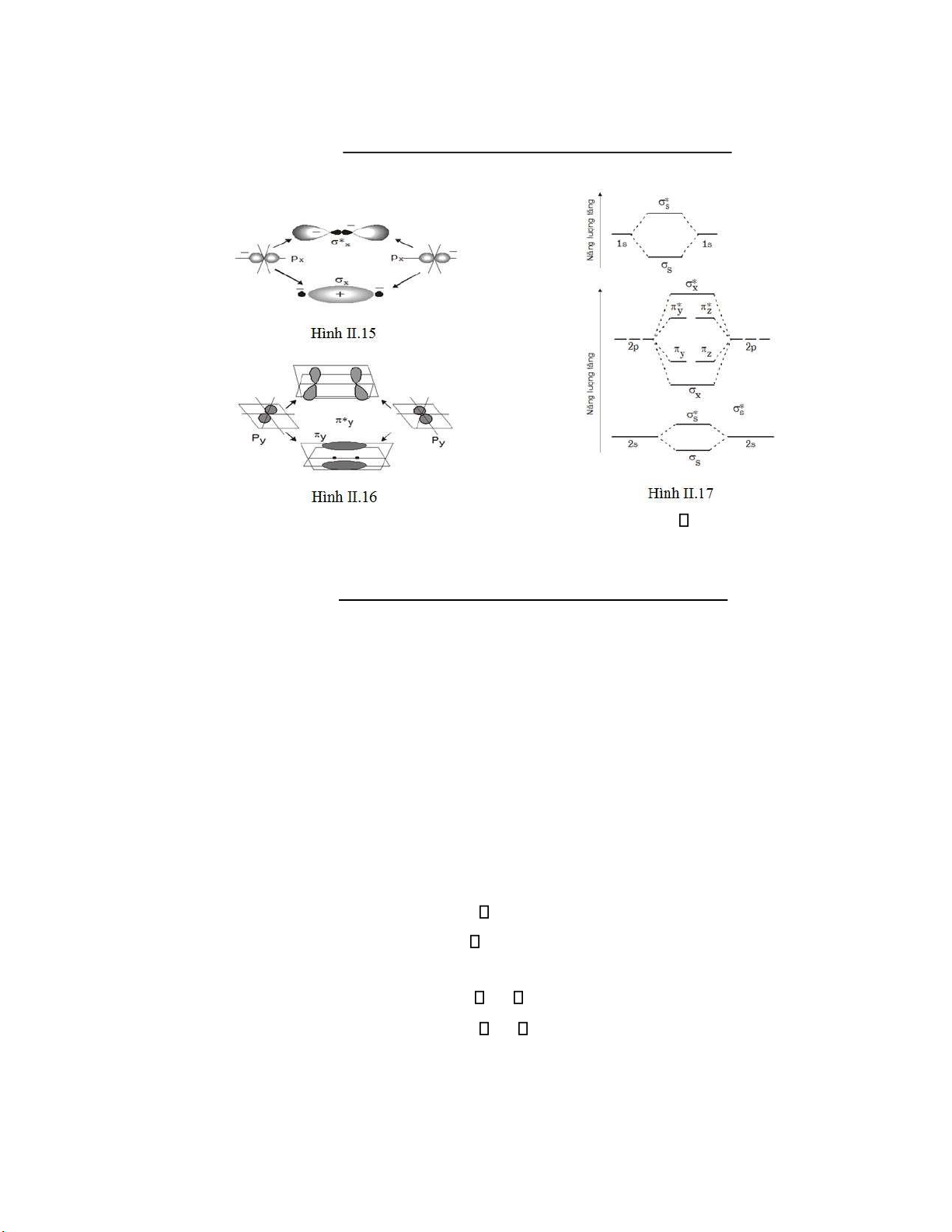
Ví dụ 2: Tổ hợp hai orbital p dọc theo trục liên kết x cho hai MO * x và x (Hình II.15)
Ví dụ 3: Tổ hợp hai orbital py hướng vuông góc trục liên kết px cho hai MO y, *y (Hình II.16)
Các orbital phân tử liên kết và phản liên kết có thể là hai tâm hoặc nhiều tâm.
Ngoài hai loại orbital phân tử trên còn có các loại orbital phân tử thứ ba ược gọi là orbital
phân tử không liên kết. Đó là những orbital phân tử một tâm ược hình thành từ các orbital nguyên
tử không tham gia tổ hợp orbital phân tử. Các orbital nguyên tử này chuyển nguyên vẹn thành các
orbital phân tử không liên kết. Do vậy orbital phân tử không liên kết có năng lượng,hình dạng hoàn
toàn giống với orbital nguyên tử chuyển thành nó.
Để ký hiệu orbital phân tử không liên kết người ta thêm dấu o vào mẫu tự biểu diễn tên
orbital phân tử ( 0, 0). Mức năng lượng của các MO ược phân bố theo giản ồ năng lượng. (Hình II.17)
Theo phương pháp MO trên các orbital phân tử có thể phân bố một hoặc hai electron, nên
óng góp vào liên kết hóa học có thể là các cặp electron ghép ôi cũng như các electron ộc thân. Từ
ây theo phương pháp MO, liên kết trong phân tử ược xác ịnh bằng số electron liên kết không bị
electron phản liên kết triệt tiêu. Và một bậc của liên kết tương ứng hai electron liên kết, nghĩa là
bậc của liên kết nói chung ược xác ịnh bằng công thức: lOMoARcPSD| 36625228
𝑆ố 𝑒𝑙𝑒𝑐𝑡𝑟𝑜𝑛 𝑙𝑖ê𝑛 𝑘ế𝑡 − 𝑠ố 𝑒𝑙𝑒𝑐𝑡𝑟𝑜𝑛 𝑝ℎả𝑛 𝑙𝑖ê𝑛 𝑘ế𝑡
𝐵ậ𝑐 𝑙𝑖ê𝑛 𝑘ế𝑡 =
2. 𝑠ố 𝑙𝑖ê𝑛 𝑘ế𝑡 𝜎
Trong trường hợp ơn giản phân tử gồm hai nguyên tử, số liên kết = 1, công thức trên viết thành:
𝑆ố 𝑒𝑙𝑒𝑐𝑡𝑟𝑜𝑛 𝑙𝑖ê𝑛 𝑘ế𝑡 − 𝑠ố 𝑒𝑙𝑒𝑐𝑡𝑟𝑜𝑛 𝑝ℎả𝑛 𝑙𝑖ê𝑛 𝑘ế𝑡
𝐵ậ𝑐 𝑙𝑖ê𝑛 𝑘ế𝑡 = 2
Khi bậc liên kết bằng không phân tử không ược tạo thành.
Tóm lại việc khảo sát cấu tạo phân tử theo phương pháp MO có thể hình dung gồm những
iều cơ bản sau: xác ịnh các orbital phân tử và trật tự sắp xếp chúng theo năng lượng, xác ịnh sự
phân bố electron trên các orbital phân tử và từ cấu trúc electron phân tử thu ược rút ra cấu hình
electron phân tử, các ặc trưng liên kết hóa học và cũng như các ặc iểm khác nhau về cấu tạo, tính chất.
II.4.2. Cấu hình eletron phân tử của các nguyên tố chu kỳ I và II a
- Đối với các nguyên tố chu kỳ I: Ion phân tử hidro: H + 1 2 1s Bậc liên kết = 0,5 Phân tử hidro: H 2 2 1s Bậc liên kết = 1
Phân tử hidro bền hơn ion hidro vì bậc liên kết lớn hơn Ion phân tử heli : He + 2 *1 2 1s 1s Bậc liên kết = 0,5 Phân tử heli: He 2 *2 2 1s 1s Bậc liên kết = 0
Phân tử heli có bậc liên kết bằng không nên không tồn tại.
b- Đối với các nguyên tố chu kỳ II: lOMoARcPSD| 36625228
Số orbital của mỗi nguyên tử có khả năng tham gia các tổ hợp thành orbital phân tử là 5,
gồm một orbital nguyên tử 1s ở lớp K và bốn orbital nguyên tử hóa trị 2s, 2px, 2py, 2pz ở lớp L
ngoài cùng. Như vậy tổng số orbital nguyên tử tham gia tổ hợp là 10 và sẽ có 10 orbital phân tử tạo thành.
Sự tổ hợp giữa các orbital nguyên tử hóa trị 2s và 2p xảy ra phức tạp hơn. Độ chênh lệch
năng lượng giữa các orbital nguyên tử 2p và 2s ( E 2p – 2s) của các nguyên tố chu kỳ II tăng lên
mạnh từ ầu chu kỳ (1,9 eV) ến cuối chu kỳ (26,8 eV). Điều này ưa ến phải chia các nguyên tố chu
kỳ II thành hai nhóm ( ầu chu kỳ và cuối chu kỳ) ể xét sự tổ hợp của các orbital 2s và 2p lOMoARcPSD| 36625228
tạo thành các orbital phân tử.
Đối với các nguyên tố cuối chu kỳ : (từ O ến Ne) Độ chênh lệch năng lượng E lớn nên
theo iều kiện năng lượng các orbital 2s không tổ hợp ược các orbital 2p mà chỉ xảy ra sự tổ hợp
giữa các orbital 2s với nhau và 2p với nhau mà thôi.
Các orbital 2s che phủ nhau tạo thành các orbital phân tử 2s, *2s.
Đối với các orbital 2p, nếu chọn trục x làm trục liên kết thì các orbital 2px khi che phủ nhau
dọc theo trục x sẽ tạo thành các orbital phân tử 2px, *2px còn các orbital 2py hay 2pz theo iều kiện
ối xứng sẽ che phủ nhau từng ôi một về hai phía trục x tạo thành các cặp orbital phân tử 2py, *2py và 2pz, *2pz.
Tóm lại từ sự tổ hợp tuyến tính tám orbital nguyên tử hóa trị 2s và 2p thu ược tám orbital
phân tử hóa trị 2s và *2s, 2px và *2px, 2py và *2py, 2pz và *2pz.
Trật tự phân bố mười orbital phân tử theo chiều tăng dần năng lượng như sau::
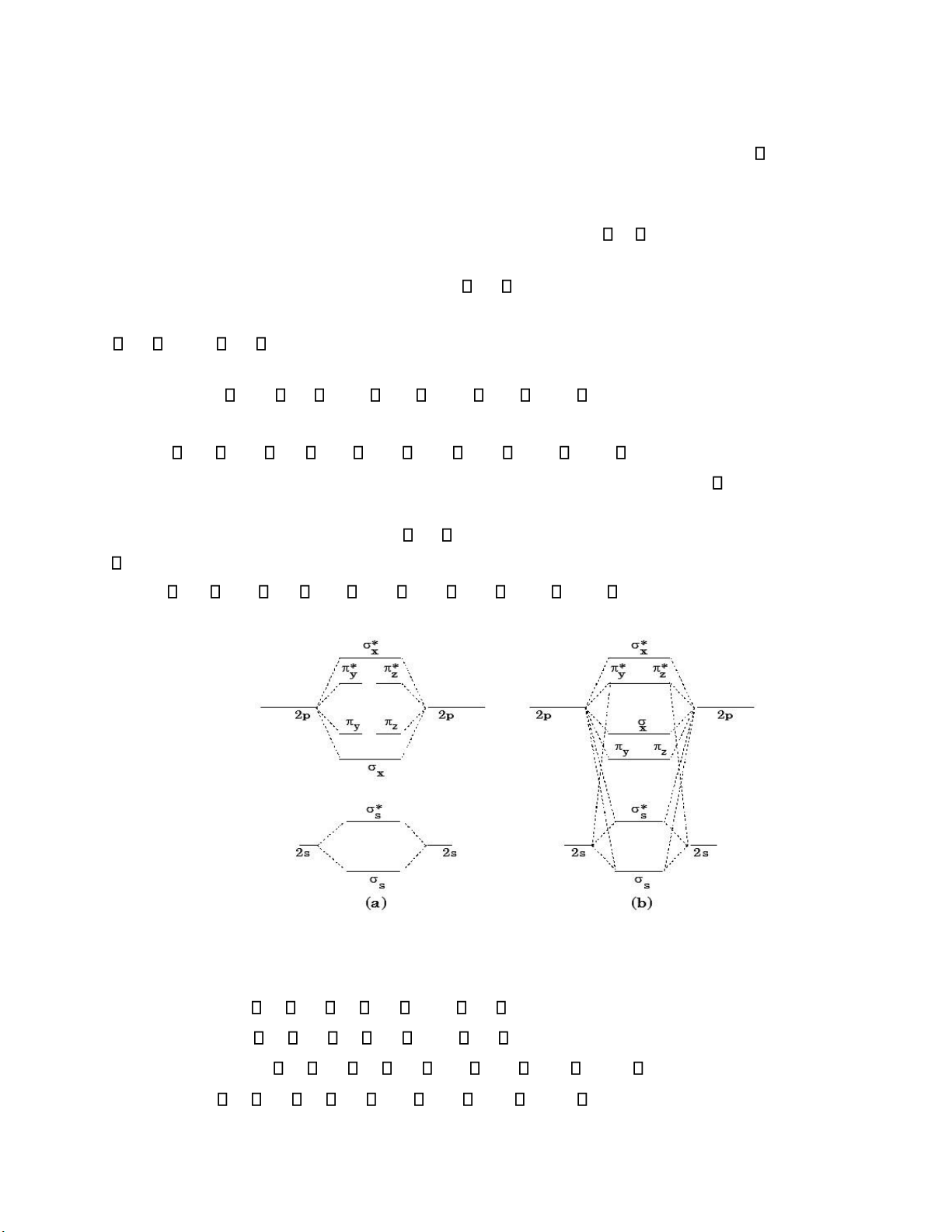
1s < *1s < 2s < *2s < 2px < 2py = 2pz < *2py = *2pz < *2px ( Giản ồ năng lượng a)
Đối với các nguyên tố ầu chu kỳ (từ Li ến N): Độ chênh lệch năng lượng E 2p – 2s nhỏ nên
theo iều kiện năng lượng các orbital 2s tổ hợp ược với các orbital 2p nhưng do xuất hiện lực ẩy
giữa các orbital 2s và 2p mà các orbital 2py, 2pz trở nên thuận lợi hơn về năng lượng so với orbital
2px, vì vậy trật tự phân bố các orbital phân tử nói trên có thay ổi:
1s < *1s < 2s < *2s < 2py = 2pz < 2px < *2py = *2pz < *2px (Giản ồ năng lượng b)Sau
ây là giản ồ năng lượng của sự tổ hợp tạo thành các orbital phân tử tương ứng hai trường hợp trên. Hình II.18
Các phân tử hai nguyên tử ồng hạch chu kỳ hai. –
N2 1s2 1s*2 2s2 2s*2 2py2 = 2pz2 2px2. Bậc liên kết = 3 –
N2+ 1s2 1s*2 2s2 2s*2 2py2 = 2pz2 2px1. Bậc liên kết = 2,5 => N2 bền hơn N2+ – O2+
1s2 1s*2 2s2 2s*2 22px ( 2py = 2pz)4 ( 2py*1 = 2pz*0). Bậc liên kết = 2,5 – O2
1s2 1s*2 2s2 2s*2 22px ( 2py = 2pz)4 ( 2py*1 = 2pz*1). Bậc liên kết = 2,0 lOMoARcPSD| 36625228 – O2-:
1s2 1s*2 2s2 2s*2 22px ( 2py = 2pz)4 ( 2py*2 = 2pz*1). Bậc liên kết = 1,5 –
O22- : 1s2 1s*2 2s2 2s*2 22px ( 2py = 2pz)4 ( 2py*= 2pz*)4. Bậc liên kết = 1,0
=> Độ bền giảm dần theo thứ tự : O + - 2- 2 , O2, O2 , O2
=> Độ dài tăng dần theo thứ tự : O + - 2 2 , O2, O2 , O2
Nhận xét : Từ những kết quả thu ược chúng ta có thể rút ra một số nhận xét sau ây: -
Cấu tạo phân tử N2 với liên kết ba, gồm một liên kết và hai liên kết là hoàn toàn
phù hợp với kết quả phân tích của phương pháp VB và giải thích ược tính bền cao, hoạt tính hóa
học thấp của nitơ ở iều kiện thường. -
Phương pháp MO tỏ ra có hiệu lực trong việc giải thích cấu tạo và tính chất của các
chất ơn giản cũng như các hợp chất phức tạp. Ví dụ: dựa trên cấu hình electron phân tử O2 có chứa
electron ộc thân; ặc iểm cấu tạo này cho phép giải thích hiện tượng oxy (ở thể rắn) bị nam châm hút.
Dựa trên cấu trúc electron phân tử thu ược theo phương pháp MO. Chúng ta có thể giải
thích ược những vấn ề như từ tính, màu sắc… của các chất. -
Chất ược xem là thuận từ khi phân tử của nó chứa electron ộc thân. Ngược lại chất
không chứa electron ộc thân trong phân tử của mình là chất nghịch từ.
Các phân tử hai nguyên tử dị hạch ở chu kỳ II.
Sự tạo thành các orbital phân tử trong trường hợp này không có gì khác so với trường hợp
các phân tử hai nguyên tử cùng loại. Tuy nhiên do các nguyên tử tương tác không giống nhau
nên sự sai lệch về năng lượng giữa các orbital s và p tăng lên ưa ến giản ồ năng lượng của các
phân tử hai nguyên tử dị hạch phải tương ứng trường hợp a trên hình II.14. Trật tự năng lượng giữa các MO như sau:
s < *s < y = z < x < *y = *z < *x Ví dụ: •
Phân tử CN, CO+ (9 electron hóa trị ) 2 *2 4 1 s 2s yz x •
Phân tử NO+, CO, CN- (10 electron hóa trị) 2 *2 4 2 s 2s yz x III. LIÊN KẾT ION III.1. Nguyên tắc
Năm 1916, Kossel ã nhận xét rằng khí trơ trong thiên nhiên rất bền, tồn tại ược ở trạng thái
tự do ơn nguyên tử, chúng có cơ cấu electron ặc biệt giống nhau. Ngoại trừ He có hai electron, các
khí trơ còn lại có 8 electron ở lớp ngoài cùng. Do ó, Kossel ã ề ra nguyên tắc tạo thành liên kết ion như sau :
Khi các nguyên tử liên kết với nhau ể tạo thành hợp chất, chúng có thể mất i hay nhận vào
1 hoặc vài electron ể cơ cấu nguyên tử ạt ược cơ cấu bền của khí trơ gần nó nhất trong bảng hệ thống tuần hoàn. lOMoARcPSD| 36625228
Quá trình tạo liên kết sẽ gồm hai giai oạn : -
Giai oạn 1: các nguyên tử chuyển electron hóa trị cho nhau. Nguyên tử dương iện sẽ
cho electron và trở thành ion dương. Nguyên tử âm iện sẽ nhận electron và trở thành ion âm. -
Giai oạn 2: các ion mang iện tích trái dấu tiến ến gần nhau và hút nhau. Như vậy,
tương tác giữa các ion trong phân tử là tương tác tĩnh iện.
Ví dụ 1: sự hình thành phân tử NaCl từ các ơn chất Na + Cl Na+ + Cl- NaCl
1s22s22p63s1 1s22s22p63s23p5 1s22s22p63s0 1s22s22p63s23p6
Ví dụ 2: Phân tử MgCl2
Cl + Mg + Cl Cl- + Mg++ + Cl- MgCl2 3s23p5 3s2 3s23p5 3s23p6 3s0 3s23p6
Hóa trị ion: hay iện hóa trị của một nguyên tố là số iện tích mà nguyên tử nguyên tố ó mang
khi trở thành ion. Điện hóa trị có trị số dương hay âm.
Ví dụ: Trong NaCl, Na có iện hóa trị +1, Cl có iện hóa trị -1.
Các kim loại kiềm và kiềm thổ là những nguyên tố có khả năng lớn nhất tạo thành cation
vì chúng có năng lượng ion hóa nhỏ nhất. Ngược lại, các phi kim loại (nhất là halogen) là những
nguyên tố dễ tạo thành anion nhất vì chúng có ái lực electron vào loại lớn nhất.
Tóm lại chỉ có những nguyên tố s nhóm IA, IIA và nguyên tố p nhóm VIIA dễ tạo thành
hợp chất ion nhất. Nhưng cả trong trường hợp này cũng không thể có liên kết thuần túy ion, vì như
lý thuyết và thực nghiệm khẳng ịnh, mật ộ electron giữa các ion không bao giờ bằng không. Nói
cách khác trong liên kết ion bao giờ cũng có ộ cộng hóa trị nào ó, tương tự như trong liên kết cộng
hóa trị bao giờ cũng có ộ ion nhất ịnh.
III.2. Lý tính của các hợp chất có liên kết ion:
- Nhiệt ộ nóng chảy cao do liên kết ion tương ối bền. Năng lượng liên kết ion tương ối khá lớn.
- Dẫn iện ở trạng thái nóng chảy và trong dung dịch, ở trạng thái rắn thường không dẫn iện. - Cứng và dễ vỡ.
- Hình thành tinh thể, có dạng rắn.
- Tinh thể ion thường không màu.
III.3. Tính chất của liên kết ion
III.3.1. Tính không ịnh hướng và không bão hòa
Liên kết ion có hai tính chất ặc trưng là không ịnh hướng và không bão hòa. Sở dĩ như
vậy là vì ion ược xem như quả cầu có trường lực iện phân bố ồng ều mọi hướng trong không
gian, nên nó có thể hút ion ngược dấu theo bất kỳ hướng nào. lOMoARcPSD| 36625228
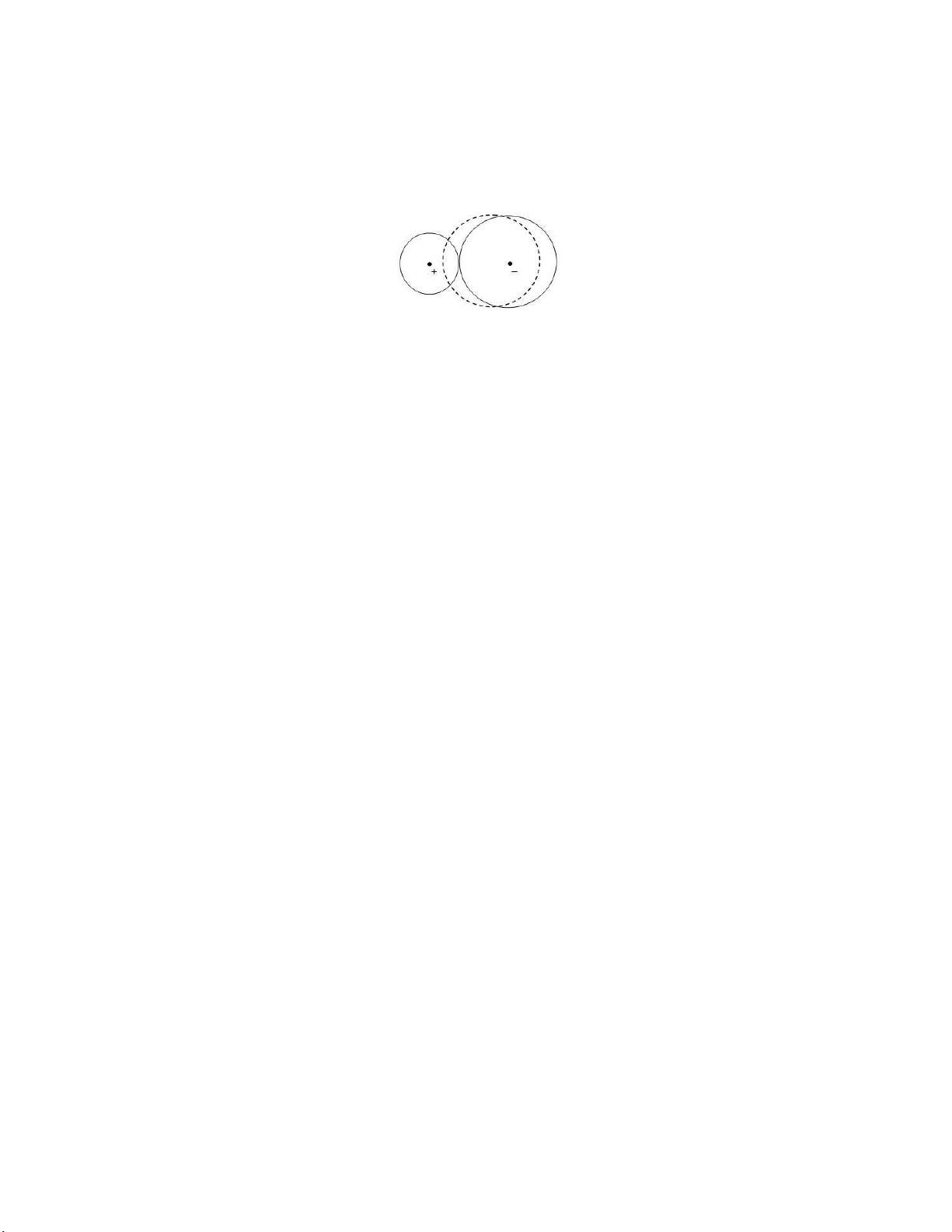
III.3.2. Sự phân cực ion
Sự phân cực ion là sự chuyển dịch ám mây electron ối với hạt nhân của một ion dưới tác
dụng iện trường một ion khác. Ion có ám mây bị biến dạng ược gọi là ion bị phân cực, còn ion có
iện trường tác dụng ược gọi là ion phân cực. (hình II.19) Hình II.19
Hình II.19 trên trình bày sự phân cực lẫn nhau giữa một cation và một anion. Dưới tác
dụng phân cực của cation, ám mây electron của anion bị chuyển dịch về phía cation ( ường chấm
chấm). Điều này làm cho các ám mây electron của cation và anion không hoàn toàn tách rời nhau
mà ngược lại, che phủ lên nhau một phần và vì vậy liên kết tạo thành giữa hai ion này có một
phần tính cộng hóa trị.
Một liên kết ion có tính cộng hóa trị trong những trường hợp sau ây: 1.
Cation có kích thước nhỏ, anion có kích thước lớn.
Ví dụ 1: Tính cộng hóa trị giảm dần trong dãy: Li+ > Na+ > K+ > Rb+ > Cs+
và tăng dần trong dãy: F- < Cl- < Br- < I- 2.
Cation có iện tích dương lớn, anion có iện tích âm lớn.
Ví dụ 2: Tính cộng hóa trị tăng dần trong dãy: Na+ < Mg2+ < Al3+ 3.
Đối với các ion có iện tích giống nhau và kích thước gần nhau thì ộ
phân cực sẽ nhỏ nhất ở những ion có cấu hình electron khí trơ s2p6 (8 electron) và
lớn nhất ở những ion có cấu hình s2p6d10 (18 electron), những ion của các nguyên
tố chuyển tiếp với phân lớp không hoàn chỉnh s2p6dx sẽ có ộ phân cực chiếm vị trí trung gian.
Ví dụ 3: Ion Ca2+ và Cd2+có iện tích và kích thước bằng nhau nhưng Ca2+ ít phân cực
hơn Cd2+ vì Ca2+ có cấu hình khí trơ: 3s23p6 trong khi Cd2+ có cấu hình 4s24p64d10 nên Cd2+
có tác dụng phân cực mạnh hơn Ca2+.
III.3.3. Ảnh hưởng của sự phân cực ến tính chất các hợp chất ion: -
Nhiệt ộ nóng chảy và nhiệt ộ sôi giảm: LiI có tính phân cực nhiều hơn NaCl, nên LiI
nóng chảy ở 4460C, sôi ở 11900C trong khi NaCl nóng chảy ở 8010C, sôi ở 14130C. Tương tự
CaCl2 lại có nhiệt ộ nóng chảy (780oC) cao hơn CdCl2 (560oC). -
Hợp chất có màu: Những hợp chất ion có tính cộng hóa trị thường có nhiều màu sắc
hơn. AgI có tính cộng hóa trị nhiều hơn AgCl, do ó AgI có màu vàng nhạt còn AgCl có màu trắng. -
Độ tan giảm: Độ tan của các muối sunfat giảm dần từ CaSO4, SrSO4, BaSO4 chủ yếu
là do sự giảm mạnh khả năng phân cực của các cation Ca2+ > Sr2+ > Ba2+ (theo chiều tăng kích thước của các ion). lOMoARcPSD| 36625228
Tóm lại: Sự phân cực tương hỗ giữa các ion làm tăng ộ cộng hóa trị của liên kết, làm giảm
lực hút giữa chúng ưa ến ộ bền của tinh thể giảm và do ó, nhiệt ộ phân li, nhiệt ộ nóng chảy của
hợp chất ion cũng giảm xuống.
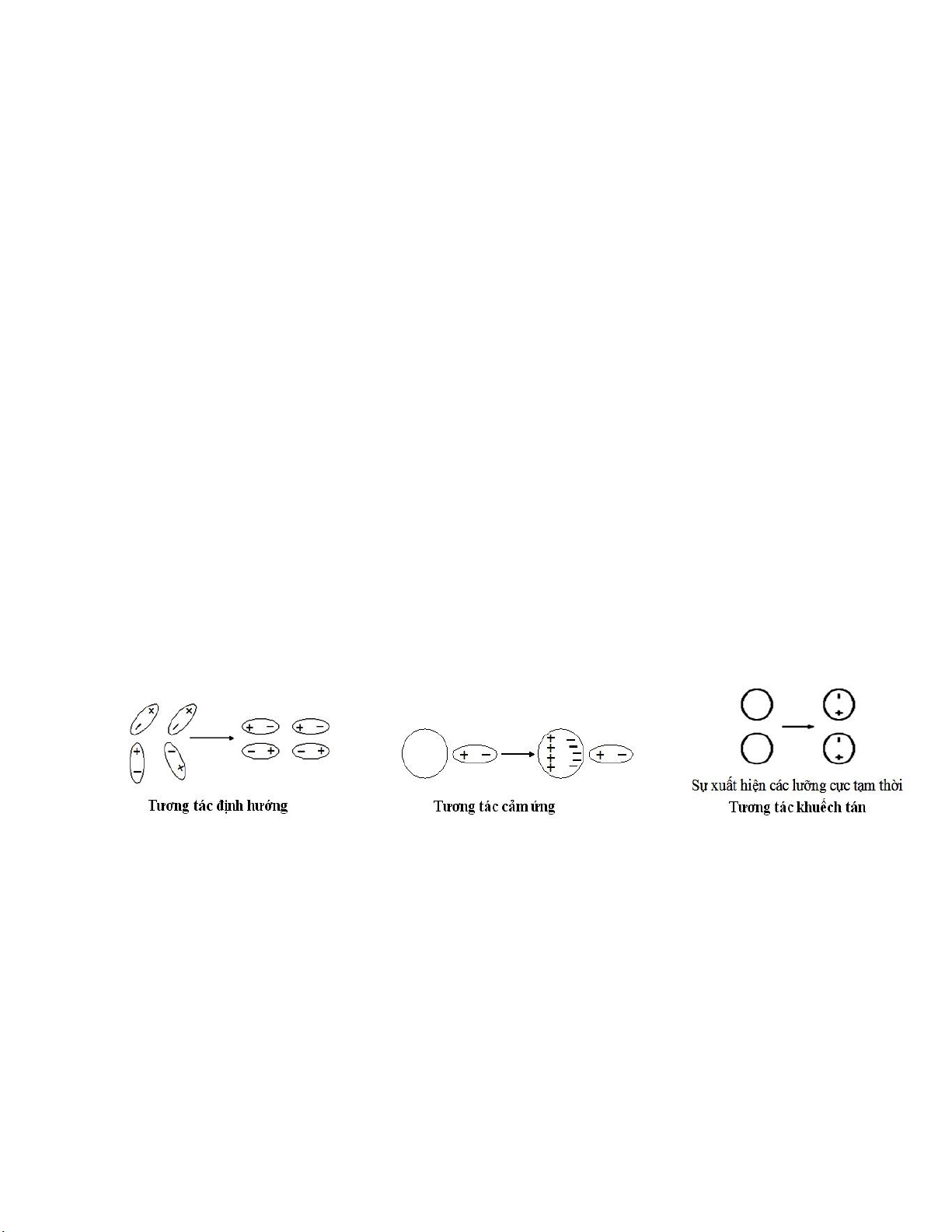
IV. LIÊN KẾT VAN DER WAALS
Liên kết Van der Waals là một loại liên kết phân tử, sinh ra bởi sự phân cực của các phân
tử thành các lưỡng cực iện. Có ba loại lực tương tác IV.1. Tương tác ịnh hướng.
Các phân tử phân cực hút lẫn nhau bằng các lực ngược dấu của lưỡng cực phân tử. Nhờ
vậy mà phân tử này ịnh hướng lại với phân tử kia theo một trật tự xác ịnh.
IV.2. Tương tác cảm ứng.
Khi phân tử không phân cực tiến gần phân tử phân cực thì dưới ảnh hưởng của iện trường
gây ra bởi lưỡng cực, các phân tử không phân cực bị cảm ứng iện và xuất hiện lưỡng cực cảm
ứng. Sau ó các phân tử hút nhau bằng các lực ngược dấu, Lực cảm ứng càng mạnh khi phân tử
phân cực có momen lưỡng cực càng lớn.
IV.3. Tương tác khuếch tán.
Là lực hút xuất hiện nhờ các lưỡng cực tạm thời trong phân tử. Trong phân tử, các iện tử
luôn ở trạng thái chuyển ộng liên tục và các hạt nhân nguyên tử luôn dao ộng quanh vị trí cân
bằng. Do vậy sự phân bố iện tích âm và dương thường xuyên bị lệch khỏi vị trí cân bằng, làm
xuất hiện những lưỡng cực tạm thời trong phân tử. Lưỡng cực tạm thời luôn xuất hiện, triệt tiêu,
ổi dấu... và có tác dụng cảm ứng ối với phân tử bên cạnh. Do ó các phân tử không phân cực cũng
có thể hút lẫn nhau nhờ lưỡng cực tạm thời này. Loại lực này gọi là lực khuếch tán.
Hình II.20. Liên kết Van Der Waals
Chính liên kết Van der Waals là nguyên nhân gây nên các hiện tượng hóa lỏng, hóa rắn,
hòa tan, hấp thụ … của các chất kể cả khí trơ.
Về bản chất, liên kết Van der Waals là tương tác tĩnh iện và liên quan tới sự có mặt hoặc
sự xuất hiện momen lưỡng cực trong phân tử, vì vậy không có tính chất chọn lọc và tính bão hòa.
Năng lượng tương tác nhỏ hơn nhiều so với năng lượng liên kết hóa học.
Qua sự phân tích trên chúng ta thấy sự óng góp của chúng vào việc hình thành liên kết này
lớn hay nhỏ tùy trường hợp và phụ thuộc vào những yếu tố như ộ có cực, ộ bị phân cực của các
phân tử tương tác, nhiệt ộ của hệ. lOMoARcPSD| 36625228 •
Tương tác khuếch tán giữ vai trò quan trọng trong các phân tử không cực và có cực yếu. •
Tướng tác ịnh hướng giữ vai trò chính ối với những phân tử có cực mạnh như H2O, NH3. •
Tương tác cảm ứng nói chung không quan trọng.
Lực tương tác giữa các phân tử luôn luôn gồm ba loại lực trên. Tùy theo bản chất của
các phân tử mà lực này hay lực kia chiếm ưu thế:
E = Eịnh hướng+ Ecảm ứng+ Ekhuếch tán.
IV.4. Ảnh hưởng của liên kết Van Der Waals -
Liên kết VDW càng lớn nhiệt ộ sôi, nhiệt ộ nóng chảy càng cao, chất khí dễ hóa
lỏng và chất lỏng dễ ông ặc.
Ví dụ 1: ICl khó sôi hơn Br2, SO2 dễ hóa lỏng hơn CO2. -
Liên kết VDW tăng theo kích thước và khối lượng của phân tử: do ó từ trên xuống
dưới trong cùng một nhóm của bảng HTTH, nói chung ộ sôi và ộ nóng chảy của hóa chất tăng dần.
Ví dụ 2: Trong nhóm VIIA : F2 và Cl2 là chất khí, Br2 là chất lỏng và I2 là chất rắn. V. Liên kết hidro
V.1.Sự hình thành liên kết hidro
Trong một số hợp chất có hydro và có các nguyên tố phi kim mạnh như F, O, N … ngoài
các liên kết chính tạo thành phân tử, hydro còn có thể thực hiện những liên kết “phụ” với các
nguyên tử có ộ âm iện lớn này gọi là liên kết hydro. Liên kết hydro ược biểu diễn bằng những dấu chấm.
Về bản chất liên kết hydro không thực hiện bằng cách trao ổi iện tử mà là do lực hút tĩnh
iện giữa các “phần” mang iện tích trái dấu. Vì hydro là nguyên tố có ộ âm iện nhỏ khi liên kết
với các nguyên tố có ộ âm iện lớn, thường mật ộ electron dày ặc hơn ở phía nguyên tử âm iện lớn,
phía ó hơi dư iện tích âm, trái lại phía nguyên tử hydro mật ộ iện tích nhỏ, nguyên tử hydro hầu
như là một proton trơ trọi.
Do vậy khi bị nguyên tử của nguyên tố âm iện khác hút, nó có khả năng xâm nhập vào lớp
vỏ electron của nguyên tử này mà không bị ẩy ể tạo thành liên kết hydro.
Như vậy có thể nói liên kết hydro vừa có bản chất iện vừa có bản chất cho – nhận (hydro
là chất nhận, nguyên tố âm iện là chất cho).
Độ bền liên kết hydro chiếm vị trí trung gian giữa liên kết VDW và liên kết cộng hóa trị:
nó bền hơn liên kết VDW và kém hơn liên kết cộng hóa trị. lOMoARcPSD| 36625228
Năng lượng liên kết hydro vào khoảng 8 - 40 kj /mol, và càng bền khi nguyên tố có ộ âm iện càng lớn.
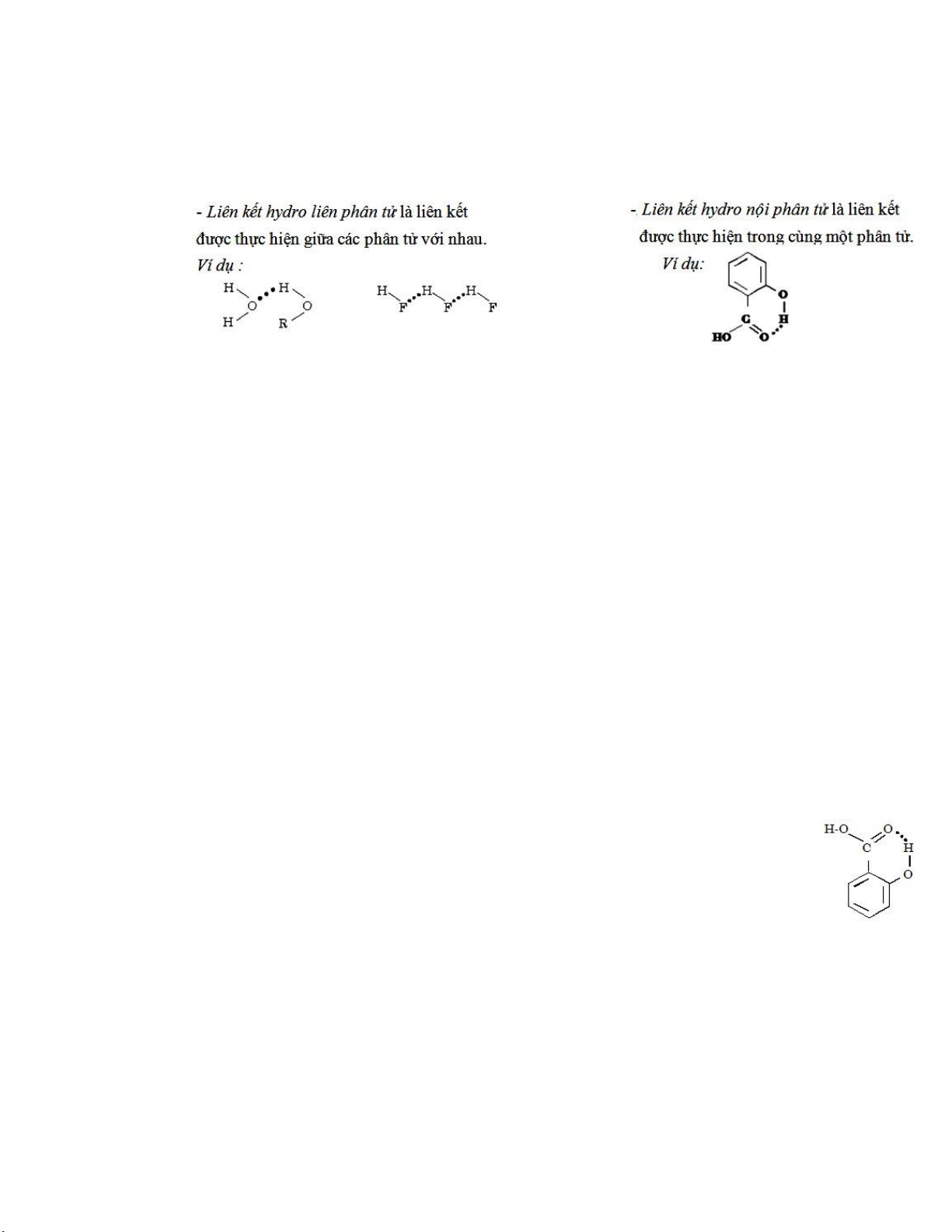
Có thể phân biệt hai loại liên kết hydro:
V.2. Ảnh hưởng của liên kết hydro ến ặc tính của hóa chất
V.2.1. Liên kết hydro liên phân tử: -
Liên kết hydro liên phân tử làm tăng khối lượng của phân tử nên làm tăng
nhiệt ộ sôi, nhiệt ộ nóng chảy của các chất.
Ví dụ 1: H2O có khối lượng phân tử là 18n (thay vì là 18) với n là số phân tử H2O liên kết
hydro với nhau nên mặc dù H2S có khối lượng phân tử lớn hơn nhưng nước lại có nhiệt ộ sôi cao hơn to
= 1000C, trong khi to = - 620C. s,H2O s,H2S -
Liên kết hydro giữa hóa chất và dung môi làm tăng ộ tan của hóa chất trong dung môi.
Ví dụ 2: rượu, glycerin tan vô hạn trong nước là do giữa rượu và nước có liên kết hydro với nhau.
V.2.2. Liên kết hydro nội phân tử:
Có tác dụng làm thu gọn phân tử lại, do ó làm giảm nhiệt ộ sôi và nhiệt ộ nóng chảy của hóa chất.
Ví dụ 3: Phân tử orto-hydroxybenzoic có liên kết hydro nội phân tử nên nhiệt ộ sôi và
nhiệt ộ nóng chảy thấp hơn so với các ồng phân mêta và para. -
Liên kết hydro nội phân tử có thể làm thay ổi tính axit của hóa chất.
Ví dụ 4: Đồng phân orto-hydroxybenzonic có tính axit mạnh hơn các ồng phân mêta và para.
CÂU HỎI TRẮC NGHIỆM 1.
Chọn phát biểu úng:
(1) Độ dài liên kết là khoảng cách giữa 2 hai hạt nhân nguyên tử trong liên kết. lOMoARcPSD| 36625228
(2) Năng lượng liên kết là năng lượng cần tiêu tốn ể phá vỡ liên kết.
(3) Góc hóa trị là một ại lượng ặc trưng cho tất cả loại phân tử.
(4) Mọi loại liên kết hóa học ều có bản chất iện. A. 1, 3, 4. B. 1, 2, 4. C. 3, 4. D. Tất cả ều úng. 2.
Khoảng cách giữa 2 nguyên tử C - C trong C2H6, C2H4, C2H2 tương ứng (Å) là: 1,54; 1,35;
1,21. Vậy bán kính cộng hóa trị Å của C là: A. 0,77. B. 0,675. C. 0,605. D. Tất cả ều úng. 3.
Chọn câu sai: Liên kết Cl-O trong dãy các ion ClO-, ClO2-, ClO3- và ClO4- có ộ dài tương
ứng: 1,7; 1,64; 1,57 và 1,42 A0. Từ ây suy ra theo dãy ion ã cho: A. Độ bền ion tăng dần.
B. Năng lượng liên kết tăng dần.
C. Độ bền ion giảm dần.
D. Bậc liên kết tăng dần. 4.
Theo thuyết liên kết hóa trị, các cộng hóa trị mà Cl (Z = 17) có thể có là: A. 1. B. 1, 3. C. 1, 3, 5. D. 1, 3, 5, 7. 5.
Khả năng tạo số liên kết cộng hóa trị cực ại của nguyên tố ược quyết ịnh bởi: A.
Số orbital nguyên tử hóa trị. B. Số electron hóa trị ộc thân.
C. Số electron hóa trị ở trạng thái kích thích. D. Tất cả ều úng. 6.
Chọn phương án úng: A.
Hidro (Z = 1) có 1 electron hóa trị nên tạo một liên kết cộng hóa trị. B.
Bo (Z = 5) có 4 orbital hóa trị nên có thể tạo 4 liên kết cộng hóa trị. C.
Nitơ (Z = 7) có 5 electron hóa trị nhưng cũng chỉ có tối a 4 liên kết cộng hóa trị. D. Tất cả ều úng. 7.
Chọn phát biểu sai. Theo lý thuyết liên kết cộng hóa trị (thuyết VB): A.
Liên kết cộng hóa trị hình thành do sự kết ôi của 2 electron có spin trái dấu,
ở ây có sự phủ của 2 orbital nguyên tử. B.
Liên kết cộng hóa trị bền khi mức ộ phủ của các orbital nguyên tử càng lớn. C.
Số liên kết cộng hóa trị của một nguyên tử trong một phân tử bằng số orbital
hóa trị của nó tham gia che phủ. D.
Nitơ có 5 liên kết cộng hóa trị trong HNO3 vì có 5 electron ở lớp ngoài cùng. 8.
Chọn phát biểu úng: A.
Liên kết cộng hóa trị ịnh chỗ là liên kết nhiều tâm. B.
Liên kết cộng hóa trị luôn có tính phân cực mạnh. C.
Liên kết cộng hóa trị không ịnh chỗ là liên kết 2 tâm. D.
Liên kết cộng hóa trị không ịnh chỗ là liên kết nhiều tâm. lOMoARcPSD| 36625228 9.
Chọn phát biểu úng. Phân tử NH3 có: A.
Cấu hình tam giác, phân cực.
B. Cấu hình tam giác, không phân cực.
C. Cấu hình tứ diện ều, phân cực.
D. Cấu hình tháp tam giác, phân cực.
10. Phân tử nào dưới ây có momen lưỡng cực bằng 0: A.
CO2, Cl2, BF3. B. SO2, CS2, CH4. C. NO2, SO3, F2. D. CO2, SO2, NO2.
11. Chọn trường hợp úng. Các phân tử có cấu hình ường thẳng là: A. CO +
2, NO2 . B. CO2, SO2 . C. H2S, BeCl2. D. CS2, NO2 .
12. Một trong những iều kiện ể các orbital có thể tham gia lai hóa là các orbital: A. Có năng lượng ủ lớn.
B. Có hình dạng giống nhau.
C. Có mật ộ electron ủ lớn.
D. Thuộc hai nguyên tử tương tác.
13. Xét 2 phân tử H2O và H2S tại sao góc HSH (920) nhỏ hơn góc HOH (10405). A.
Do nguyên tử O còn cặp e tự do. B. Do nguyên tử O lai hóa còn S thì không lai hoá.
C. Do S có bán kính lớn hơn O. D. Do ộ âm iện của O lớn hơn S.
14. Sắp các chất theo thứ tự tăng dần góc liên kết: Cho ZC = 6 A. CH 2- 2- 2- 4 < CO3 < CO2
B. CO3 < CO2 < CH4 C. CO2 < CH4 < CO3 D. CH 2-
4 < CO2 < CO3 15. Các chất HCl, HF, H2, BaCl2 có nhiệt ộ sôi giảm dần trong dãy:
A. BaCl2 > HF > HCl > H2.
B. HCl > HF > BaCl2 > H2.
C. H2 > HCl > HF > BaCl2.
D. HCl > BaCl2 > HF > H2.
16. Trong các chất sau, chất nào không có cơ cấu tứ diện ều: A. SiF + - 4 B. CH3Cl C. NH4 D. BF4
17. Phân tử BF3 phẳng (ZB = 5) trong khi phân tử NH3 có hình tháp (ZN = 7) vì: A. N âm iện hơn B.
B. BF3 là hợp chất ion, NH3 là hợp chất cộng hóa trị.
C. B lai hóa sp2, trong khi N lai hóa sp3.
D. Trên nguyên tử N có một cặp electron chưa liên kết, trên B không có.
18. Phân tử H-CHO có ặc iểm cấu tạo là: (Cho ZC = 6)
A. Dạng tháp, góc hóa trị 109028’. B. Dạng góc, lai hóa sp3.
C. Dạng tam giác, lai hóa sp2.
D. Dạng góc, góc hóa trị 1200.
19. Chất tạo ược liên kết hydro nội phân tử là:
A. Andehit salixilic. B. 1,2- hidroxybenzoic. C. Hydro sunfua D. A, B ều úng. lOMoARcPSD| 36625228
20. Chọn câu úng. Xét hai phân tử CO2 và SO2. Cho C (Z = 6), S (Z = 16) A. C và S trong các
phân tử trên ều ở trạng thái lai hóa sp. B.
CO2 và SO2 có ộ tan trong nước như nhau vì chúng ều là các axit yếu. C.
SO2 sôi ở nhiệt ộ cao hơn CO2 vì SO2 là phân tử phân cực, CO2 là phân tử không phân cực . D.
CO2 sôi ở nhiệt ộ cao hơn vì CO2 nhẹ hơn nên dễ bay hơi hơn SO2 .
21.Chọn các phân tử giữa chúng chỉ có lực ịnh hướng: Cho ZN = 7; ZS = 16; ZC = 6; ZCl = 17 A. SO 2- - 2- 2, CS2. B. SO3, CO3 . C. ClO3 , CH4. D. SO3 , NO2.
22. Sắp xếp các hợp chất: HF, HI, HBr, HCl theo chiều giảm dần tính axit.
A. HF > HCl > HBr > HI.
B. HF > HBr > HI > HCl. C. HF > HBr > HCl > HI.
D. HI > HBr > HCl > HF.
23. Nhóm VIA (theo chiều tăng iện tích hạt nhân) gồm: O, S, Se, Te. Trong các hợp chất H2O,
H2S, H2Se, H2Te, nước là chất có nhiệt ộ sôi cao nhất. Liên kết nào dùng ể giải thích cho hiện tượng ó?
A. Liên kết hidro B. Liên kết cộng hóa trị C. Liên kết ion D. Liên kết Van der Waals
24. Sự lai hóa orbital nguyên tử xảy ra giữa:
A. Các orbital nguyên tử có cùng số lượng tử phụ l.
B. Các orbital nguyên tử có năng lượng bằng nhau.
C. Các orbital nguyên tử có cùng số lượng tử chính n.
D. Các orbital nguyên tử có mức năng lượng khác nhau.
25.Liên kết Van Der Waals là lực tương tác giữa:
A. Các phân tử phân cực.
B. Các phân tử không phân cực.
C. Các phân tử phân cực và phân tử không phân cực. D. Tất cả ều úng.
26.Trong phân tử H2O, oxy ở trạng thái lai hóa sp3, giải thích tại sao góc liên kết HOH o ược là
104,50 lại nhỏ hơn góc lai hóa sp3 (109028’). Cho: ZO = 8.
A.Vì trên oxy còn hai ôi iện tử tự do hút nhau. B.Vì trên oxy còn hai iện tử tự do ẩy nhau.
C.Vì trên oxy còn hai ôi iện tử tự do ẩy nhau. D.Vì trên oxy còn hai iện tử tự do hút nhau.
27. Chất tạo ược liên kết hidro liên phân tử với nhau là: A.
Dimetyl ete. B. Andehit axetic. C. Axit axetic. D. Aceton.
28. Sự hóa lỏng khí SO2 ược giải thích bằng: Cho ZS = 16. A. Liên kết hidro.
B. Liên kết Van Der Waals. C. Liên kết cộng hóa trị. D. Liên kết ion.
29. Chọn câu úng. Sự lai hóa của các nguyên tử C theo thứ tự trong phân tử: HC≡C-CH=CHCH3 là: A. sp, sp, sp2, sp2, sp3. B. sp2, sp, sp2, sp2, sp3. lOMoARcPSD| 36625228 C. sp, sp, sp, sp2, sp3. D. sp, sp2, sp2, sp3, sp3.
30. Chọn phát biểu úng: A.
Liên kết cộng hóa trị kiểu pi (π) là liên kết bền nhất. B.
Liên kết cộng hóa trị kiểu pi (π) ược hình thành theo 2 cơ chế: cho – nhận và ghép ôi. C.
Liên kết cộng hóa trị kiểu pi (π) là liên kết không ịnh chỗ và nhiều tâm. D. B, C úng.
---------------------------------&---------------------------------



