
















Preview text:
ĐẠI CƯƠNG VỀ KIM LOẠI
CẤU TẠO VÀ TÍNH CHẤT VẬT LÍ CỦA KIM LOẠI
KIẾN THỨC CẦN NHỚ
I. Đặc điểm cấu tạo và liên kết kim loại
1. Đặc điểm cấu tạo của nguyên tử kim loại
- Nguyên tử kim loại thường có ít electron (1, 2, 3 e) ở lớp ngoài cùng.
- Bán kính nguyên tử kim loại thường lớn hơn và độ âm điện nhỏ hơn so với nguyên tố phi kim.
Các electron hóa trị ở lớp vỏ ngoài cùng của nguyên tử kim loại chịu lực hút yếu của hạt nhân.
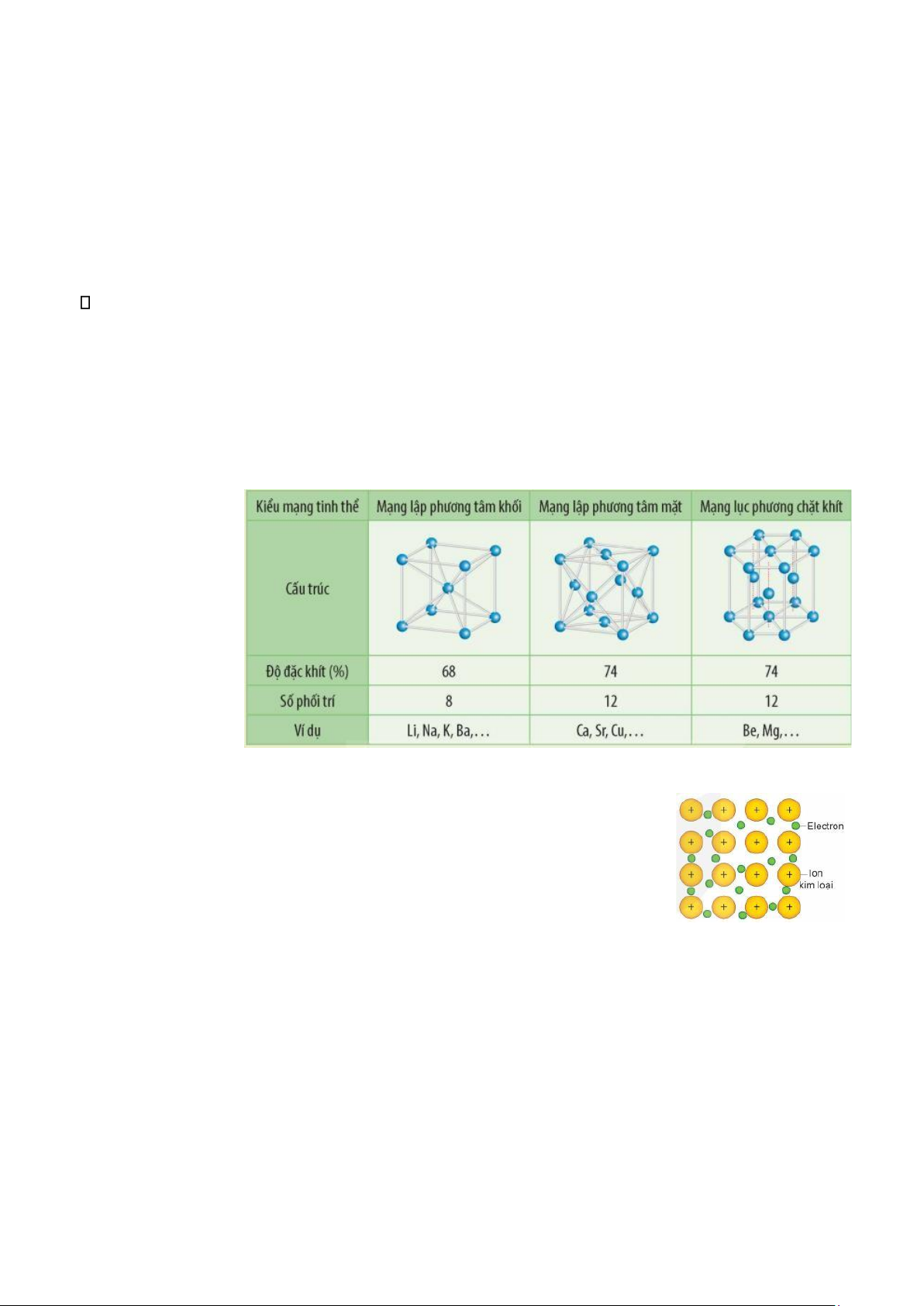
2. Cấu tạo tinh thể kim loại -
Ở nhiệt độ thường, trừ thủy ngân ở thể lỏng, các kim loại khác ở thể rắn và có cấu tạo mạng tinh thể kim loại. -
Trong tinh thể kim loại, các ion dương kim loại nằm ở các nút mạng tinh thể và các electron hóa
trị chuyển động tự do xung quanh.
3. Liên kết kim loại
- Liên kết kim loại là liên kết được hình thành từ lực hút tĩnh điện giữa các ion
dương kim loại và các electron hóa trị tự do trong tinh thể kim loại.
II. Tính chất vật lí và ứng dụng
1. Tính chất vật lí chung của kim loại và ứng dụng
- Tính chất chung: Tính dẻo, tính dẫn điện, dẫn nhiệt, ánh kim do các electron tự do gây ra. -
Kim loại có tính dẻo nên dễ rèn, dễ dát mỏng và dễ kéo thành sợi. -
Kim loại có tính dẻo là do liên kết các lớp mạng trong tinh thể với nhau Tính dẻo
và chúng có thể trượt lên nhau khi chịu tác dụng của một lực cơ học nhưng không tách rời nhau. -
Những kim loại có tính dẻo cao là Au, Ag, Al, Cu, … -
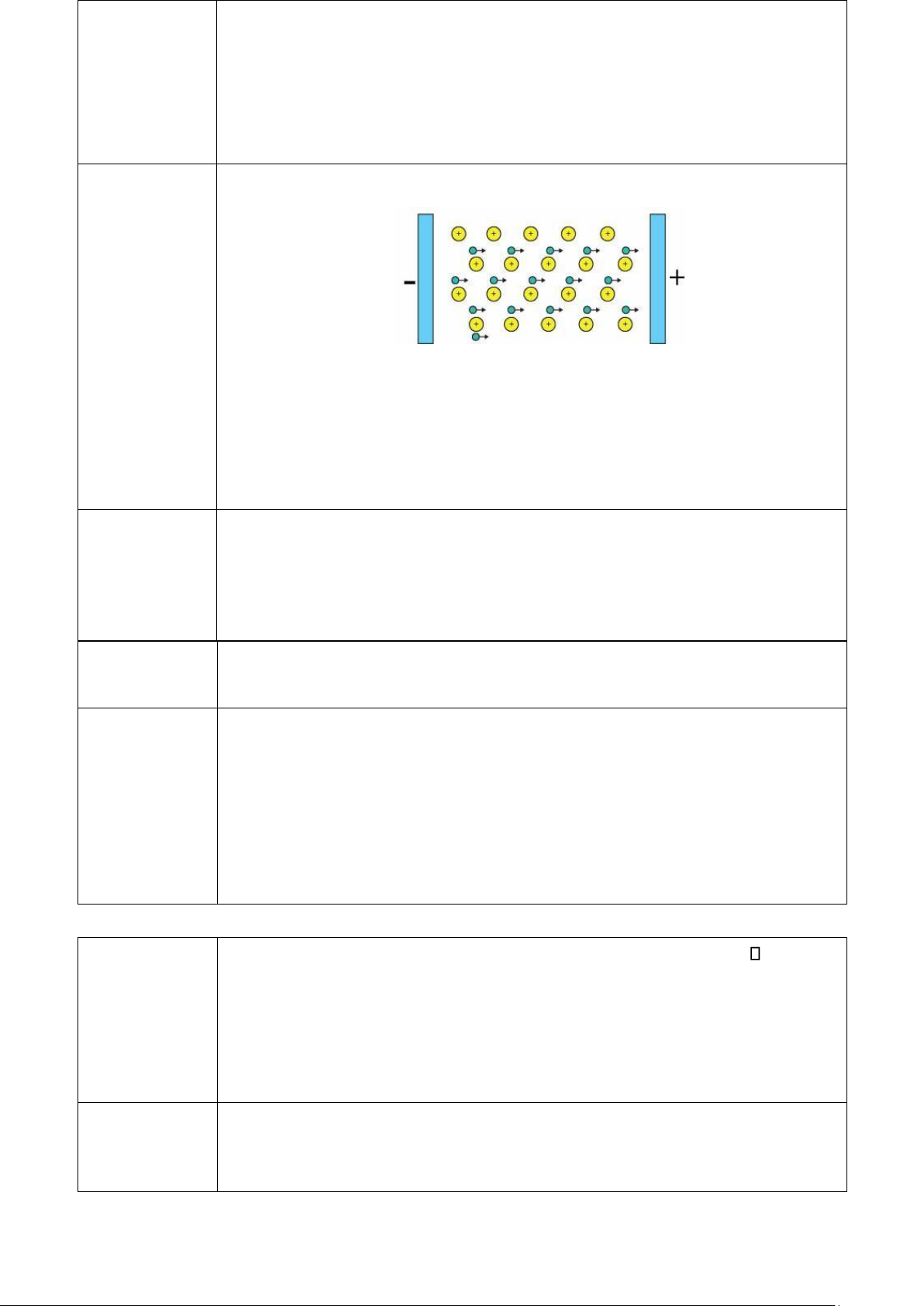
Khi đặt một hiệu điện thế vào thanh kim loại thì các electron tự do trong mạng tinh thể sẽ di chuyển từ cực âm về cực dương tạo thành dòng điện. Tính dẫn điện -
Kim loại dẫn điện tốt nhất là Ag, sau đó đến Cu, Au, Al, Fe, … -
Cu thường được dùng làm dây dẫn điện trong gia đình và sản xuất, Al
thường được dùng làm dây dẫn điện cao thế do nhẹ hơn và rẻ hơn Cu.
- Khi đốt nóng một đầu của thanh kim loại thì động năng của các e vùng đó tăng
lên, các e này truyền động năng của chúng cho ion dương ở các nút mạng và các e
Tính dẫn nhiệt khác trong toàn thanh kim loại thông qua va chạm làm cho nhiệt được lan truyền
trong toàn bộ thanh kim loại.
- Các kim loại dẫn điện tốt thường dẫn nhiệt tốt. Các kim loại dẫn nhiệt tốt được
dùng làm dụng cụ đun nấu hoặc làm vật liệu tản nhiệt trong các thiết bị. -
Các electron trong tinh thể kim loại phản xạ hầu hết những tia sáng nhìn
thấy được do đó kim loại có vẻ sáng lấp lánh, gọi là ánh kim. -
Các kim loại có ánh kim mạnh như vàng, bạc được dùng làm đồ trang sức Ánh kim
hay các vật dụng trang trí. -
Trong thực tế, khi nhìn vào nhiều kim loại không thấy ánh kim vì chúng
thường được bao phủ bởi một lớp oxide.
2. Tính chất vật lí riêng của kim loại và ứng dụng -
Kim loại có khối lượng riêng D < 5 g/cm3 là kim loại nhẹ, D 5 g/cm3 là kim loại nặng. Khối lượng -
Kim loại nhẹ nhất là Li và nặng nhất là Os. riêng -
Kim loại nhẹ như Mg, Al được dùng để chế tạo hợp kim nhẹ; kim loại nặng
như Fe, W (tungsten) được dùng để chế tạo hợp kim nặng. -
Kim loại có nhiệt độ nóng chảy thấp nhất là Hg (-39 oC, thể lỏng điều kiện Nhiệt độ nóng
thường) và cao nhất là W (3410 oC). chảy -
Các kim loại có nhiệt độ nóng chảy thấp như Pb, Cd dùng làm chất chảy
trong cầu trì; kim loại W có nhiệt độ nóng chảy cao được dùng làm dây tóc bóng đèn. -
Kim loại cứng nhất là Cr có thể cắt được kính và thường được mạ bên ngoài
các sản phẩm để bảo vệ sản phẩm và hạn chế sự ăn mòn. Tính cứng -
Các kim loại mềm nhất là kim loại kiềm như Na, K, Rb, Cs có thể cắt dễ dàng bằng dao.
1. Trắc nghiệm nhiều lựa chọn
♦ Mức độ BIẾT
Câu 1. [CTST - SBT] Ở trạng thái cơ bản, cấu hình electron của nguyên tử Mg (Z = 12) là
A. 1s22s22p63s1. B. 1s22s22p63s2.
C. 1s22s32p63s2. D. 1s22s22p73s1.
Câu 2. Cho biết số thứ tự của Mg trong bảng tuần hoàn là 12. Vị trí của Mg trong bảng tuần hoàn là
A. chu kì 3, nhóm IIIA
B. chu kì 3, nhóm IIB.
C. chu kì 3, nhóm IIA
D. chu kì 2, nhóm IIA
Câu 3. [CTST - SBT] Ở trạng thái cơ bản, cấu hình electron lớp ngoài cùng của nguyên tử X là 3s1. Số
hiệu nguyên tử của nguyên tố X là A. 11. B. 12. C. 13. D. 14.
Câu 4. Cho biết số thứ tự của Al trong bảng tuần hoàn là 13. Số electron lớp ngoài cùng của Al là A.1 B.2 C.3 D.4
Câu 5. [KNTT - SBT] Hình vẽ nào sau đây có thể được dùng để mô tả cấu trúc tinh thể kim loại? A. B. C. D.
Câu 6. [KNTT - SBT] Trong tinh thể kim loại A.
các ion dương kim loại nằm ở các nút mạng tinh thể và các electron hóa trị chuyển động tự do xung quanh. B.
các electron hóa trị ở các nút mạng và các ion dương kim loại chuyển động tự do. C.
các electron hóa trị và các ion dương kim loại chuyển động tự do trong toàn bộ mạng tinh thể. D.
các electron hóa trị nằm ở giữa các nguyên tử kim loại cạnh nhau.
Câu 7. [KNTT - SBT] Trong định nghĩa về liên kết kim loại: “ Liên kết kim loại là liên kết hình thành
do lực hút tĩnh điện giữa các electron...(1)... với các ion...(2)... kim loại ở các nút mạng. Các từ cần điền
vào vị trí (1), (2) là
A. ngoài cùng, dương B. tự do, dương.
C. hóa trị, lưỡng cực. D. hóa trị, âm.
Câu 8. [CTST - SBT] Kim loại có những tính chất vât lí chung nào sau đây? A. Tính dẻo, tính dẫn điện,
nhiệt độ nóng chảy cao.
B. Tính dẻo, tính dẫn điện, có khối lượng riêng lớn và có ánh kim.
C. Tính dẻo, tính dẫn điện, tính dẫn nhiệt và có ánh kim.
D. Tính dẻo, có ánh kim, rất cứng.
Câu 9. [CTST - SBT] Kim loại X được sử dụng trong nhiệt kế, áp kế và một số thiết bị khác. Ở điều
kiện thường, X là chất lỏng. Kim loại X là A. W. B. Cr. C. Hg. D. Pb.
Câu 10. Kim loại nào sau đây có khối lượng riêng nhỏ nhất? A. Fe. B. Li. C. Pb. D. W.
Câu 11. [QG.21 - 201] Kim loại nào sau đây có nhiệt độ nóng chảy cao nhất? A. Fe. B. W. C. Al. D. Na.
Câu 12. [QG.21 - 202] Kim loại nào sau đây có nhiệt độ nóng chảy thấp nhất? A. Li. B. Cu. C. Ag. D. Hg.
Câu 13. [QG.21 - 203] Kim loại nào sau đây dẫn điện tốt nhất? A. Au. B. Cu. C. Fe. D. Ag.
Câu 14. [MH - 2022] X là kim loại cứng nhất, có thể cắt được thủy tinh. X là A. Fe. B. W. C. Cu. D. Cr.
Câu 15. Kim loại X là kim loại cứng nhất, được sử dụng để mạ các dụng cụ kim loại, chế tạo các loại
thép chống gỉ, không gỉ…Kim loại X là?
A. Fe. B. Ag. C. Cr. D. W.
♦ Mức độ HIỂU
Câu 16. [KNTT - SBT] Trong mạng tinh thể kim loại, liên kết kim loại được hình thành do A. sự góp
chung electron của các nguyên tử kim loại cạnh nhau.
B. lực hút tĩnh điện giữa các electron hóa trị ở các nút mạng với các ion dương kim loại chuyển động tự do.
C. lực hút tĩnh điện giữa các electron hóa trị tự do với các ion dương kim loại chuyển động tự do
trong toàn bộ mạng tinh thể.
D. lực hút tĩnh điện giữa các electron hóa trị tự do với các ion dương kim loại ở các nút mạng.
Câu 17. [CD - SBT] Phát biểu nào sau đây về liên kết kim loại là đúng?
A. Liên kết kim loại là liên kết được hình thành từ lực hút tính điện giữa các cation kim loại và các
electron hóa trị tự do. Vì vậy, liên kết kim loại cũng chính là liên kết ion.
B. Liên kết kim loại được hình thành do giữa các nguyên tử kim loại có sự dùng chung các electron
hóa trị tự do. Vì vậy, liên kết kim loại cũng chính là liên kết cộng hóa trị.
C. Liên kết kim loại là liên kết được hình thành từ lực hút tính điện giữa các cation kim loại và các
electron hóa trị tự do trong tinh thể kim loại.
D. Liên kết kim loại là liên kết được hình thành do sự xen phủ các orbital chứa electron hóa trị tự do
của các nguyên tử kim loại.
Câu 18. Những tính chất vật lí chung của kim loại (dẫn điện, dẫn nhiệt, dẻo, ánh kim) gây nên bởi A. các
electron tự do trong mạng tinh thể kim loại.
B. kiểu cấu tạo mạng tinh thể kim loại.
C. khối lượng riêng của kim loại.
D. tính chất của kim loại.
Câu 19. [KNTT - SBT] Dãy kim loại nào sau đây sắp xếp theo thứ tự độ dẫn điện giảm dần?
A. Au, Ag, Cu, Al.
B. Ag, Au, Al, Cu.
C. Cu, Al, Ag, Au. D. Ag, Cu, Au, Al.
Câu 20. [KNTT - SBT] Dây điện cao thế thường được dùng làm bằng nhôm là do nhôm A. Là kim loại
dẫn điện tốt và nhẹ.
B. Là kim loại dẫn điện tốt nhất.
C. Có giá thành rẻ.
D. Có tính trơ về mặt hoá học.
Câu 21. Khi lựa chọn kim loại để làm vỏ hộp kim loại nhẹ chứa nước ngọt hoặc bia, tính chất nào sau
đây thường không được xét đến?
A. Tính độc.
B. Khối lượng riêng. C. Tính dễ dát mỏng. D. Nhiệt độ nóng chảy.
Câu 22. [KNTT - SBT] Ứng dụng nào dưới đây là ứng dụng phổ biến của đồng?
A. Làm những bộ phận cấy ghép vào cơ thể người. B. Chế tạo thân máy bay siêu nhanh.
C. Làm đồ trang sức.
D. Làm lõi dây điện.
♦ Mức độ VẬN DỤNG
Câu 23. [KNTT - SBT] Cho các phát biểu sau đây về vị trí và cấu tạo của kim loại: (1)
Hầu hết các kim loại chỉ có từ 1 electron đến 3 electron lớp ngoài cùng. (2)
Tất cả các nguyên tố phân nhóm B (phân nhóm phụ) đều là kim loại. (3)
Ở trạng thái rắn, đơn chất kim loại có cấu tạo tinh thể. (4)
Các kim loại đều có bán kính nhỏ hơn các phi kim thuộc cùng 1 chu kì. (5)
Liên kết kim loại là liên kết được hình thành giữa các nguyên tử và ion dương kim loại
trong mạng tinh thể do sự tham gia của các electron tự do.
Những phát biểu đúng là
A. (1), (2), (3), (5).
B. (1), (2), (3),(4), (5).
C.(1), (2), (3). D.(1), (3), (5).
Câu 24. [CD - SBT] Cho các phát biểu sau về tinh thể kim loại M: (1)
Trong tinh thể kim loại M có các cation Mn+ và các elctron hóa trị tự do. (2)
Trong tinh thể kim loại M có các electron hóa trị tự do chuyển động. (3)
Các cation Mn+ chuyển động tự do trong mạng tinh thể kim loại. (4)
Lực hút giữa cation Mn+ và electron hóa trị tự do trong tinh thể kim loại M phụ thuộc vào
độ âm điện của kim loại M. (5)
Tinh thể kim loại M trung hòa về điện. (6)
Trong tinh thể kim loại M, các cation Mn+ và elctron hóa trị tự do được phân bố theo trật tự nhất định.
Số phát biểu đúng là A. 2. B. 3. C. 4. D. 1.
Câu 25. Xét đặc điểm cấu tạo của nguyên tử kim loại. a.
Nguyên tử kim loại thường có 1, 2 hoặc 3 electron ở lớp ngoài cùng. b.
Bán kính nguyên tử kim loại thường nhỏ hơn bán kính nguyên tử phi kim.
c. Độ âm điện của kim loại thường nhỏ hơn so với độ âm điện của phi kim. d.
Các electron hóa trị ở lớp vỏ ngoài cùng của kim loại chịu lực đẩy yếu của hạt nhân.
Câu 26. [KNTT - SBT] Xét các phát biểu về kim loại. a.
Nguyên tử kim loại thường có 1,2, hoặc 3 electron ở lớp ngoài cùng. b.
Trong bảng tuần hoàn, các nhóm A bao gồm các nguyên tố s và nguyên tố p.
c. Trong 1 chu kì, kim loại có bán kính nhỏ hơn phi kim. d.
Kim loại có ánh kim do các electron tự do phản xạ ánh sáng nhìn thấy được.
Câu 27. [KNTT - SBT] Xét các phát biểu về kim loại.
a. Nguyên tử của hầu hết các nguyên tố kim loại đều có ít electron ở lớp ngoài cùng.
b. Những tính chất vật lí chung của kim loại chủ yếu do các electron tự do trong mạng tinh thể kl gây ra.
c. Tính chất hóa học chung của kim loại là tính oxi hóa.
d. Nguyên tắc điều chế kim loại là khử ion kim loại thành nguyên tử.
Câu 28. Xét cấu tạo tinh thể và liên kết kim loại.
a. Ở điều kiện thường, tất cả các kim loại đều ở thể rắn và có cấu tạo mạng tinh thể.
b. Ở điều kiện thường, thủy ngân có cấu tạo mạng tinh thể kim loại.
c. Trong tinh thể kim loại, các ion dương kim loại nằm ở các nút mạng tinh thể và các electron hóa trị
chuyển động tự do xung quanh.
d. Liên kết kim loại được hình thành do lực hút tĩnh điện giữa nguyên tử kim loại và các electron hóa
trị tự do trong tinh thể kim loại.
Câu 29. ] Xét các phát biểu về liên kết hóa học.
a. Liên kết kim loại là liên kết cộng hóa trị đều có sự tham gia của các electron.
b. Liên kết kim loại khác với liên kết cộng hóa trị ở số electron dùng chung
c. Liên kết kim loại và liên kết ion đều sinh ra bởi lực hút tĩnh điện.
d. Liên kết kim loại khác với liên kết ion ở loại hạt mang điện tham gia.
Câu 30. Xét các phát biểu về tính chất vật lí của kim loại.
a. Kim loại có tính dẫn điện tốt nhất là bạc (Ag).
b. Kim loại có nhiệt độ nóng chảy thấp nhất là lithium (Li).
c. Kim loại có độ cứng lớn nhất là tungsten (W).
d. Kim loại nhôm (Al) có thể kéo dài dát mỏng tốt.
Câu 31. Dựa vào tính chất vật lí, kim loại có nhiều ứng dụng trong đời sống.
a. Chromium thường được mạ bên ngoài một số đồ vật là do kim loại này cứng và có khả năng chống mài mòn tốt.
b. Nhôm được sử dụng nhiều trong sản xuất máy bay là do nhôm có ánh sáng kim loại phản xạ các tia cực tím từ mặt trời.
c. Bạc được dùng phổ biến làm dây dẫn điện vì là kim loại có độ dẫn điện tốt nhất.
d. Bạc được dùng để tráng gương là do bạc là kim loại dẫn nhiệt rất tốt.
Câu 32. Dựa vào tính chất vật lí, kim loại có nhiều ứng dụng trong đời sống. a.
Mỏ neo của tàu thuyền được chế tạo từ các kim loại nhẹ. b.
Hợp kim của các kim loại nặng thường được dùng trong ngành công nghiệp vũ trụ.
c. Tungsten được sử dụng làm dây tóc bóng đèn trong loại đèn sợi đốt do có nhiệt độ nóng chảy thấp. d.
Có thể dùng đoạn dây đồng hoặc thép để làm dây chảy thay thế chì khi cầu chì bị đứt.
Câu 33. [CD - SBT] Xét các phát biểu về kim loại. a.
Kim loại dẻo là nhờ lực hút tĩnh điện giữa các cation kim loại và các electron hóa trị tự do. b.
Ở điều kiện thường, thủy ngân không có cấu trúc tinh thể nên không dẫn điện.
c. Nhôm là kim loại vừa dẫn điện tốt vừa dẫn nhiệt tốt. d.
Kim loại có vẻ sáng lấp lánh là do các cation trong tinh thể phản xả phần lớn các tia sáng nhìn thấy được.
Câu 34. Điện trở suất là đại lượng đặc trưng cho khả năng cản trở dòng điện của mỗi chất. Chất có điện
trở suất càng lớn thì độ dẫn điện của chất đó càng kém. Cho 4 kim loại X, Y, Z, T ngẫu nhiên tương ứng
với Ag, Al, Fe, Cu. Cho bảng giá trị điện trở của các kim loại như sau: Kim loại X Y Z T Điện trở suất 2,82.10-8 1,72.10-8 1,00.10-7 1,59.10-8 (Ωm)
a. Điện trở suất của Cu là 1,72.10-8 Ωm.
b. Kim loại T là Fe.
c. Thứ tự giá trị điện trở suất là Fe > Al > Cu > Ag.
d. Đồng được sử dụng làm dây dẫn điện cao thế.
♦ Mức độ HIỂU
Câu 35. Nguyên tử của nguyên tố Mg (Z = 12) có bao nhiêu electron ở lớp ngoài cùng?
Câu 36. Nguyên tử của nguyên tố K (Z = 19) có bao nhiêu electron ở lớp ngoài cùng?
Câu 37. Kim loại nặng là kim loại nhẹ có khối lượng riêng nhỏ hơn bao nhiêu g/cm3? 5
Câu 38. Cho các tính chất của kim loại: Tính dẻo, tính cứng, tính dẫn điện, ánh kim, khối lượng riêng,
tính dẫn nhiệt. Có bao nhiêu tính chất vật lí chung của kim loại trong các tính chất trên?
♦ Mức độ VẬN DỤNG
Câu 39. Cho các tính chất của kim loại: Tính dẻo, tính cứng, tính dẫn điện, ánh kim, khối lượng riêng,
tính dẫn nhiệt. Có bao nhiêu tính chất của kim loại trong các tính chất trên do electron tự do gây nên?
Câu 40. Cho các phát biểu về kim loại:
(a) Ở điều kiện thường, tất cả các kim loại đều tồn tại ở thể rắn và có cấu tạo tinh thể.
(b) Các cation kim loại và nguyên tử kim loại được sắp xếp trật tự trong tinh thể kim loại. (c) Electron
hóa trị của nguyên tử kim loại chịu lực hút yếu của hạt nguyên tử.
(d) Giống như liên kết ion, liên kết kim loại cũng được hình thành từ tương tác tĩnh điện. (e) Các
electron hóa trị tự do di chuyển trong cấu trúc tinh thể kim loại tạo ra dòng điện. Có bao nhiêu phát
biểu đúng trong các phát biểu trên? ______HẾT_____
TÍNH CHẤT HÓA HỌC CỦA KIM LOẠI KIẾN THỨC CẦN NHỚ
- Các nguyên tử dễ nhường e hóa trị Tính chất hóa học đặc trưng của kim loại là tính khử. M → Mn+ + ne
I. Tác dụng với phi kim
1. Tác dụng với oxygen
♦ Thí nghiệm magnesium tác dụng với oxygen -
Tiến hành: Dùng kẹp sắt gắp dây Mg, đốt nóng trên ngọn lửa đèn cồn. - Hiện tượng: Sợi Mg cháy sáng. -
Hầu hết các kim loại (trừ Au, Ag, Pt) đều tác dụng với oxygen → oxide tương ứng. VD: 2Mg +
O2 ⎯⎯→to 2MgO 4Al + 3O2 ⎯⎯→to 2Al2O3
2. Tác dụng với chlorine
♦ Thí nghiệm sắt tác dụng với chlorine
- Tiến hành: Lấy sợi dây sắt cuốn thành hình lò xo sau đó dùng kẹp sắt kẹp chặt, nung nóng sợi dây sắt
trên ngọn lửa đèn cồn rồi đưa nhanh vào bình chứa khí chlorine.
- Hiện tượng: Sợi dây sắt cháy sáng tạo thành khói mầu nâu.
- Hầu hết các kim loại (trừ Au, Pt) đều tác dụng với chlorine khi đun nóng → muối chlorine. VD: 2Fe +
3Cl2 ⎯⎯→to 2FeCl3 Cu + Cl2 ⎯⎯→to CuCl2
3. Tác dụng với lưu huỳnh (sulfur)
♦ Thí nghiệm nhôm tác dụng với lưu huỳnh
- Trộn đều bột nhôm và lưu huỳnh theo tỉ lệ khối lượng 1 : 2, sau đó lấy một thìa thủy tinh hỗn hợp cho
vào ống nghiệm khô chịu nhiệt, hơ nóng đều ống nghiệm trên ngọn lửa đèn cồn sau đó đun tập trung
vào phần ống nghiệm có chứa hỗn hợp.
- Hiện tượng: Hỗn hợp cháy sáng tạo thành chất bột màu trắng.
- Nhiều kim loại có thể khử được lưu huỳnh khi đun nóng (trừ Hg ở nhiệt độ thường). VD: Fe + S ⎯⎯→to
FeS 2Al + 3S ⎯⎯→to Al2S3 Hg + S → HgS
II. Tác dụng với nước
- Trong nước nguyên chất (pH = 7): 2H2O + 2e ⇌ H2 + 2OH- E =− − 0,414V 2H O/2OH +H 2 2
- Các kim loại có thế điện cực chuẩn Eo n+
< -0,414 V có khả năng phản ứng với H2O giải phóng H2. M /M
♦ Các kim loại Na, K, Ca, Ba, … tác dụng mạnh với nước ở điều kiện thường → hydroxide + H2↑
2Na + 2H2 → 2NaOH + H2↑ Ba + 2H2O → Ba(OH)2 + H2↑
♦ Các kim loại Mg, Zn, Fe, … tác dụng với hơi nước ở nhiệt độ cao → oxide + H2↑ Mg + H2O(hơi) ⎯⎯→to
MgO + H2↑ Fe + H2O(hơi) ⎯⎯⎯→ 570oC FeO + H2↑ (< 570 oC
tạo Fe3O4) ♦ Các kim loại Ni, Sn, Pb, Cu, Ag, Au, … không tác dụng với nước do Eo n+ > - 414 V. M /M
III. Tác dụng với dung dịch acid
1. Tác dụng với dung dịch HCl, H2SO4 loãng
♦ Thí nghiệm kim loại tác dụng với dung dịch acid H2SO4 loãng
- Cho vài hạt kẽm (zinc) vào ống nghiệm (1), vài mẩu đồng (copper) vào ống nghiệm thứ hai sau đó thêm
tiếp khoảng 2 mL dung dịch H2SO4 10% vào từng ống nghiệm
- Hiện tượng: Ống nghiệm (1) hạt kẽm tan dần có hiện tượng sủi bọt khí, ống nghiệm (2) không có hiện tượng gì.
- Ở điều kiện chuẩn, các kim loại có Eo n+
< 0 có thể tác dụng được với dung dịch HCl, H2SO4 loãng tạo M /M thành H2.
TQ: Kim loại + HCl, H2SO4 loãng → Muối + H2↑ (Eo n+
< 0, trước H) (hóa trị thấp) M /M
VD: Fe + 2HCl → FeCl2 + H2↑ Zn + H2SO4 loãng → ZnSO4 + H2 ↑
Ag + HCl → Không phản ứng
Cu + H2SO4 loãng → Không phản ứng
2. Tác dụng với dung dịch H2SO4 đặc/ HNO3
♦ Thí nghiệm kim loại tác dụng với dung dịch acid H2SO4 đặc
- Cho một mẩu đồng vào ống nghiệm, sau đó thêm tiếp khoảng 2 mL H2SO4 98%, dùng bông tẩm NaOH
đậy trên ống nghiệm rồi đun nóng nhẹ ống nghiệm trên ngọn lửa đèn cồn.
- Hiện tượng: Mẩu đồng tan ra và có sủi bọt khí.
- Hầu hết các kim loại (trừ Au, Pt) phản ứng được với dung dịch H2SO4 đặc, HNO3
TQ: Kim loại + H2SO4 đặc ⎯⎯→to
Muối + sản phẩm khử (SO2, S, H2S) + H2O (trừ Au,
Pt) (hóa trị cao) (NO2, NO, N2O, N2, NH4NO3)
Chú ý: Al, Fe, Cr thụ động, không phản ứng với H2SO4 đặc, nguội; HNO3 đặc, nguội.
IV. Tác dụng với dung dịch muối
♦ Thí nghiệm kim loại tác dụng với dung dịch muối
- Cho đinh sắt vào cốc, sau đó thêm tiếp 2 – 3 mL dung dịch CuSO4 1M, sau 5 phút dùng kẹp lấy định sắt ra khỏi dung dịch.
- Hiện tượng: Có lớp chất rắn màu đỏ bám bên ngoài đinh sắt.
- Các kim loại hoạt động mạnh hơn có thể đẩy kim loại hoạt động yếu hơn ra khỏi dung dịch muối của
nó. Phản ứng tuân thep quy tắc alpha.
VD: Fe + CuSO4 → FeSO4 + Cu Fe + ZnSO4 → Không phản ứng
BÀI TẬP TRẮC NGHIỆM
1. Trắc nghiệm nhiều lựa chọn
♦ Mức độ BIẾT
Câu 1. Tính chất hoá học đặc trưng của kim loại là A.
tính oxi hoá và tính khử. B. tính bazơ.
C. tính oxi hoá.
D. tính khử.
Câu 2. Cho phản ứng hóa học: 4Cr + 3O2 ⎯⎯→to 2Cr2O3. Trong phản ứng trên xảy ra
A. sự oxi hóa Cr và sự oxi hóa O2.
B. sự khử Cr và sự oxi hóa O2.
C. sự khử Cr và sự khử O2.
D. Sự oxi hóa Cr và sự khử O2.
Câu 3. Trong số các kim loại Al, Zn, Fe, Ag. Kim loại nào không tác dụng được với O2 ở nhiệt độ thường A. Ag. B. Zn. C. Al. D. Fe.
Câu 4. Ở điều kiện thường, kim loại nào sau đây tác dụng mạnh với H2O? A. Fe. B. Ca. C. Cu. D. Mg.
Câu 5. (QG.19 - 201). Kim loại nào sau đây tan trong nước ở điều kiện thường? A. Cu. B. Fe. C. Na. D. Al.
Câu 6. [MH - 2022] Kim loại nào sau đây tan hoàn toàn trong nước dư? A. Cu. B. Ag. C. K. D. Au.
Câu 7. (B.14): Kim loại nào sau đây tan hết trong nước dư ở nhiệt độ thường? A. Mg. B. Fe. C. Al. D. Na.
Câu 8. Ở điều kiện thường, kim loại nào sau đây không phản ứng với nước? A. K. B. Na. C. Ba. D. Be.
Câu 9. Dãy gồm các kim loại đều phản ứng với nước ở nhiệt độ thường tạo ra dung dịch có môi trường kiềm là A. Na, Fe, K. B. Na, Cr, K. C. Na, Ba, K. D. Be, Na, Ca.
Câu 10. [MH - 2021] Kim loại nào sau đây tác dụng với nước thu được dung dịch kiềm? A. Al. B. K. C. Ag. D. Fe.
Câu 11. [CTST - SBT] Kim loại nào sau đây tan hoàn toàn trong nước? A. Cu. B. Ag. C. K. D. Au.
Câu 12. [KNTT - SBT] Kim loại nào sau đây không phản ứng với dung dịch HCl loãng? A. Đồng. B. Calcium. C. Magnesium. D. Kẽm.
Câu 13. [QG.21 - 201] Kim loại phản ứng với dung dịch HCl loãng sinh ra khí H2 là A. Hg. B. Cu. C. Fe. D. Ag.
Câu 14. [QG.21 - 203] Kim loại nào sau đây tác dụng được với H2O ở nhiệt độ thường? A. Au. B. Cu. C. Ag. D. Na.
Câu 15. [QG.21 - 204] Kim loại nào sau đây tác dụng với dung dịch H2SO4 loãng, thu được khí H2? A. Au. B. Cu. C. Mg. D. Ag.
Câu 16. [QG.22 - 202] Kim loại nào sau đây không phản ứng được với HCl trong dung dịch? A. Ni. B. Zn. C. Fe. D. Cu.
Câu 17. [QG.22 - 202] Kim loại nào sau đây không phản ứng được với dung dịch CuSO4? A. Mg. B. Fe. C. Zn. D. Ag.
Câu 18. Kim loại nào không phản ứng với dung dịch H2SO4 loãng? A. Zn. B. Fe. C. Al. D. Ag.
Câu 19. (QG.19 - 201) Kim loại nào sau đây không tan được trong dung dịch HCl? A. Al. B. Ag. C. Zn. D. Mg.
Câu 20. (QG.19 - 203) Kim loại nào sau đây không tan được trong dung dịch H2SO4 loãng? A. Mg. B. Al. C. Cu. D. Fe.
Câu 21. Kim loại nào sau đây phản ứng với dung dịch H2SO4 loãng? A. Cu. B. Mg. C. Ag. D. Au.
Câu 22. Kim loại phản ứng được với dung dịch HCl loãng là A. Ag. B. Au. C. Cu. D. Al.
Câu 23. (A.14) Kim loại nào sau đây không tác dụng với dung dịch H2SO4 loãng? A. Na. B. Al. C. Mg. D. Cu.
Câu 24. [QG.23 - 201] Khí tạo thành khi cho Mg tác dụng với dung dịch H2SO4 loãng là A. H2. B. SO2. C. O2. D. H2S.
Câu 25. [QG.23 - 203] Kim loại nào sau đây tác dụng với dung dịch H2SO4 loãng sinh ra khí H2? A. Ag B. Au C. Cu D. Zn.
Câu 26. (M.15) Phương trình hóa học nào sau đây là sai?
A. 2Na + 2H2O → 2NaOH + H2.
B. Ca + 2HCl → CaCl2 + H2.
C. Fe + CuSO4 → FeSO4 + Cu.
D. Cu + H2SO4 → CuSO4 + H2.
Câu 27. (B.14) Phương trình hóa học nào sau đây không đúng?
A. 2Fe + 3H2SO4(loãng) → Fe2(SO4)3 + 3H2.
B. Ca + 2H2O → Ca(OH)2 + H2.
C. 2Al + Fe2O3 ⎯⎯→to Al2O3 + 2Fe.
D. 4Cr + 3O2 ⎯⎯→to 2Cr2O3
Câu 28. [CD - SBT] Nhóm những kim loại nào sau đây không phản ứng với dung dịch sulfuric acid đặc, nguội? A. Fe,Al,Ag. B. Fe, Au,Cr. C. Fe,Al,Zn . D. Al,Cr,Zn.
Câu 29. Kim loại Cu phản ứng được với dung dịch A. FeSO4. B. AgNO3. C. KNO3. D. HCl.
Câu 30. (QG.2018) Ở nhiệt độ thường, kim loại Fe phản ứng được với dung dịch A. FeCl2. B. NaCl. C. MgCl2. D. CuCl2.
Câu 31. (QG.2018) Kim loại Fe không phản ứng với dung dịch A. HCl. B. AgNO3. C. CuSO4. D. NaNO3.
Câu 32. [MH2 - 2020] Kim loại nào sau đây không tác dụng với dung dịch CuSO4? A. Ag. B. Mg. C. Fe. D. Al.
♦ Mức độ HIỂU
Câu 33. Thủy ngân dễ bay hơi và rất độc. Nếu chẳng may nhiệt kế thủy ngân bị vỡ thì dùng chất nào
trong các chất sau để khử độc thủy ngân?
A. Bột sắt.
B. Bột lưu huỳnh. C. Bột than. D. Nước.
Câu 34. [KNTT - SBT] Trong trường hợp phải sử dụng kim loại làm đường ống dẫn nước, kim loại nào
sau đây là phù hợp nhất để làm ống dẫn nước? A. Kẽm. B. Sắt. C. Chì. D. Đồng.
Câu 35. Dãy gồm các kim loại đều phản ứng với nước ở nhiệt độ thường tạo thành dung dịch có môi trường kiềm là A. Na, Fe, K. B. Na, Cr, K. C. Na, Ba, K. D. Mg, Na, Ca.
Câu 36. Kim loại nào sau đây phản ứng dung dịch CuSO4 tạo thành 2 chất kết tủa? A. Na. B. Fe. C. Ba. D. Zn.
Câu 37. [CTST - SBT] Kim loại nào sau đây khi tác dụng với HCl và tác dụng với Cl2 (được nung nóng)
tạo thành cùng một sản phẩm muối chloride? A. Fe. B. Ag. C. Zn. D. Cu.
Câu 38. Để hoà tan hoàn toàn hỗn hợp gồm hai kim loại Cu và Zn, ta có thể dùng một lượng dư dung dịch A. HCl. B. AlCl3. C. AgNO3. D. CuSO4.
Câu 39. [CTST - SBT] X là kim loại phản ứng được với dung dịch H2SO4 loãng, Y là kim loại tác dụng
được với dung dịch Fe(NO3)3. Hai kim loại X, Y có thể là A. Ag, Mg. B. Cu, Fe. C. Fe, Cu. D. Mg, Ag.
Câu 40. [KNTT – SBT] Kẽm khử được cation kim loại trong dãy muối nào dưới đây? A. Cu(NO3)2, Pb(NO3)2, Ni(NO3)2.
B. AlCl3, MgCl2, Pb(NO3)2. C. AlCl3, Ni(NO3)2, Pb(NO3)2. D. MgCl2, NaCl, Cu(NO3)2.
Câu 41. [CTST - SBT] Thí nghiệm nào sau đây không sinh ra đơn chất?
A. Cho CaCO3 vào lượng dư dung dịch HCl.
B. Cho kim loại Cu vào dung dịch AgNO3.
C. Cho kim loại Zn vào dung dịch CuSO4. B.
Cho kim loại Mg vào dung dịch HCl.
Câu 42. Thí nghiệm nào sau đây không xảy ra phản ứng?
A. Cho kim loại Ag vào dung dịch HCl.
B. Cho kim loại Cu vào dung dịch HNO3. C.
Cho kim loại Fe vào dung dịch Fe2(SO4)3. D. Cho kim loại Zn vào dung dịch CuSO4.
Câu 43. [CTST - SBT] Phát biểu nào sau đây là đúng?
A. Ở điều kiện thường, các kim loại đều có khối lượng riêng lớn hơn khối lượng riêng của nước.
B. Tính chất hoá học đặc trưng của kim loại là tính khử.
C. Các kim loại đều chỉ có một oxi hoá duy nhất trong các hợp chất.
D. Ở điều kiện thường, tất cả các kim loại đều ở trạng thái rắn.
Câu 44. (QG.19 Đốt cháy hoàn toàn m gam Al trong khí O2 dư, thu được 10,2 gam Al2O3. Giá trị của m là A. 3,6. B. 4,8. C. 5,4. D. 2,7.
Câu 45. Hòa tan hoàn toàn 2,8 gam Fe trong dung dịch HCl dư, thu được V lít khí H2 (ở đkc). Giá trị của V là A. 3,36. B. 1,2395. C. 7,437. D. 4,958.
Câu 46. Hòa tan hoàn toàn 2,4 gam Mg bằng dung dịch HCl dư, thu được V lít khí H2 (đkc). Giá trị của V là A. 2,479. B. 1,2395. C. 3,36. D. 4,958.
Câu 47. Hòa tan m gam Fe bằng dung dịch H2SO4 loãng, dư thu được 2,479 lít khí H2 (đkc). Giá trị của m là A. 5,60. B. 1,12. C. 2,24. D. 2,80.
Câu 48. (204 – Q.17) Cho 11,9 gam hỗn hợp Zn và Al phản ứng vừa đủ với dung dịch dịch H2SO4 loãng,
thu được m gam muối trung hòa và 9,916 lít khí H2 (đkc). Giá trị của m là A. 42,6. B. 70,8. C. 50,3. D. 51,1.
Câu 49. Hòa tan hoàn toàn 2,43 gam hỗn hợp gồm Mg và Zn vào một lượng vừa đủ dung dịch H2SO4
loãng, sau phản ứng thu được 1,2395 lít H2 (đkc) và dung dịch X. Khối lượng muối trong dung dịch X là A. 4,83 gam. B. 5,83 gam. C. 7,33 gam. D. 7,23 gam.
♦ Mức độ VẬN DỤNG
Câu 50. [KNTT - SBT] Cho bột Fe vào dung dịch AgNO3 và Cu(NO3)2. Sau khi các phản ứng xảy ra
hoàn toàn, thu được dung dịch X gồm hai muối và chất rắn Y gồm hai kim loại. Hai muối trong X và hai
kim loại trong Y lần lượt là:
A. Cu(NO3)2; Fe(NO3)2 và Cu; Fe.
B. Cu(NO3)2; Fe(NO3)2 và Ag, Cu.
C. Fe(NO3)2; Fe(NO3)3 và Cu, Ag.
D. Cu(NO3)2; AgNO3 và Cu, Ag.
Câu 51. [KNTT- SBT] Cho 0,02 mol Na vào 1000 mL dung dịch chứa CuSO4 0,05 M và H2SO4 0,005M.
Hiện tượng của thí nghiệm trên là
A. Có bọt khí bay lên và có kết tủa màu xanh lam.
B. Chỉ có khí bay lên.
C. Chỉ có kết tủa xanh lam.
D. Có khí bay lên và có kết tủa sau đó kết tủa tan.
Câu 52. [KNTT – SBT] Tiến hành 2 thí nghiệm sau:
- Thí nghiệm 1: cho m gam bột Fe (dư) vào V1 lít dung dịch Cu(NO3)2 1M.
- Thí nghiệm 2: cho m gam bột Fe (dư) vào V2 lít dung dịch AgNO3 0,1M.
Sau khi các phản ứng xảy ra hoàn toàn, khối lượng chất rắn thu được ở hai thí nghiệm đều bằng nhau.
Giá trị của V1 so với V2 là A. V1 = V2. B. V1 =10V2. C. V1 = 5V2. D. V1 = 2V2.
Câu 53. Nhúng một thanh Zn vào 100 mL dung dịch CuSO4, sau một thời gian phản ứng lấy thanh Zn ra
khỏi dung dịch, làm khô và đem cân thấy khối lượng thanh Zn giảm 0,01 gam. Cho dung dịch NaOH dư vào dung
dịch sau phản ứng thu được 0,49 gam kết tủa. Nồng độ mol của dung dịch CuSO4 ban đầu là A.0,15 M. B. 0,015 M. C. 0,1 M. D. 0,05 M.
Câu 54. [KNTT – SBT] Cho 0,35 mol hỗn hợp X gồm Cl2 và O2 phản ứng vừa đủ với 11,1 gam hỗn hợp
Y gồm Mg và Al, thu được 30,1 gam hỗn hợp Z. Phần trăm khối lượng của Al trong Y là A.75,68%. B. 24,32%. C. 51,35%. D. 48,65%.
2. Trắc nghiệm đúng - sai
Câu 55. [KNTT- SBT] Cho các phát biểu về tính chất hóa học của kim loại.
a. Kim loại sắt (dư) cháy trong khí chlorine chỉ tạo một muối. b.
Kim loại nhôm có thể tan trong dung dịch kiềm.
c. Nhúng thanh Zn vào dung dịch CuSO4 thì khối lượng thanh Zn tăng. d.
Kim loại Al, Fe đều không tan trong dung dịch H2SO4 đặc, nguội.
Câu 56. [CD - SBT] Xét các phát biểu về kim loại. a.
Tính chất hoá học đặc trưng của kim loại là tính khử. b.
Kim loại càng hoạt động hoá học thì tính khử càng mạnh.
c. Những kim loại kém hoạt động hoá học (trơ) như vàng, platinum không thể hiện tính khử. d.
Kim loại bạc có tính khử yếu trong khi cation Ag+ có tính oxi hoá mạnh.
Câu 57. [CD - SBT] Xét các phát biểu về tính chất hóa học của kim loại.
a. Thông thường, kim loại M hoạt động càng mạnh thì giá trị thế điện cực chuẩn của cặp oxi hoá - khử M / Mn càng âm.
b. Kim loại M càng kém hoạt động thì giá trị thế điện cực chuẩn của cặp oxi hoá - khử Mn+ / M càng dương.
c. Trong cặp oxi hoá - khử 2H O/ H ( 2
2 +2OH− )thì H O2 là dạng khử, H2 là dạng oxi hoá.
d. Magnesium là kim loại có độ hoạt động hoá học mạnh hơn nhôm (aluminium), giá trị thế điện
cực chuẩn cặp Mg2+ / Mg âm hơn giá trị thế điện cực chuẩn của cặp Al3+ / Al.
Câu 58. Ở môi trường trung tính, quá trình 2H O2 +2e →H2 +2OH− có giá trị E2H2O/2OH-+H2 = -0,413V.
a. Những kim loại M có thế điện cực chuẩn EMMM+ −0,413 V đều khử được nước ở điều kiện thường.
b. Sodium khử được nước theo phương trình hoá học: 2Na +2H O2 → 2NaOH+H2 nên E Na Na+ −0,413 V.
c. Nước đóng vai trò là chất khử khi phản ứng với kim loại M (như Na,K ) có thế điện cực chuẩn E 0+ −0,413 V . M M
d. Khí hydrogen là sản phẩm khử của nước khi nước phản ứng với kim loại mạnh như Na,K .
Câu 59. Cho một mẩu sodium nhỏ vào cốc nước có chứa vài giọt dung dịch phenolphtalein. a.
Sodium bị hoà tan nhanh chóng và xuất hiện bọt khí không màu. b.
Cốc nước chuyển từ không màu sang màu xanh.
c. Khí thoát ra trong thí nghiệm là một chất khí nhẹ hơn không khí; không cháy. d.
Nếu thay mẩu sodium bằng mẩu potassium thì hiện tượng xảy ra tương tự.
Câu 60. Xét các phát biểu về tính chất của kim loại. a.
Các kim loại Na, K, Ba đều phản ứng mạnh với nước. b.
Kim loại có nhiệt độ nóng chảy cao nhất là W
c. Kim loại Al tan trong dung dịch H2SO4 đặc, nguội. d.
Dùng bột sulfur (S) để xử lý thuỷ ngân rơi vãi khi nhiệt kế bị vỡ.
Câu 61. Cho 3 thí nghiệm sau:
- Thí nghiệm 1: Cho mẩu sodium vào nước đã thêm vài giọt dung dịch phenolphtalein.
- Thí nghiệm 2: Cho một mẩu Aluminium ( nhôm) vào dung dịch hydrochloric acid loãng.
- Thí nghiệm 3: Cho một mẩu đồng vào dung dịch sulfuric acid đặc.
a. Các kim loại bị oxi hoá trong cả ba thí nghiệm trên.
b. Cả ba thí nghiệm trên đều thu được khí không màu, nhẹ hơn không khí.
c. Thí nghiệm 3 có sinh ra khí Z. Tỉ khối hơi của Z so với khí X thoát ra ở thí nghiệm 1 là 32.
d. Tổng hệ số tối giản của các chất trong phương trình hoá học ở thí nghiệm 3 là 8.
Câu 62. Cho các phát biểu về kim loại
a. Kim loại có tính dẫn điện tốt nhất là Ag.
b. Cho Mg dư tác dụng với dung dịch FeCl3 thu được hỗn hợp kim loại.
c. Cho hỗn hợp rắn gồm Cu và Fe2O3 (2: 1) cho vào dung dịch HCl dư thu được dung dịch trong suốt.
d. Cho bột sắt vào lượng dư dung dịch AgNO3, thu được dung dịch chứa hai muối.
Câu 63. Thả một đinh sắt nặng m1 gam đã được đánh sạch bề mặt vào cốc chứa dung dịch copper(II)
sulfate màu xanh. Sau một thời gian thấy toàn bộ lượng đồng sinh ra đã bám vào "đinh sắt" (thực chất là
phần đinh sắt chưa phản ứng). Lấy "đinh sắt" ra khỏi cốc dung dịch, sấy khô, đem cân được m2 gam.
a. Phản ứng diễn ra là: 2Fe( )s +3Cu2+(aq) → 2Fe3+(aq)+3Cu( )s
b. Màu xanh của dung dịch copper(II) sulfate nhạt dần.
c. So sánh, thu được kết quả m m2 1.
d. Nếu thay đinh sắt ban đầu bằng thanh kẽm thì màu xanh của dung dịch không thay đổi.
Câu 64. [CD - SBT] Cho một ít bột nhôm vào muỗng đốt hoá chất rồi đốt trên ngọn lửa đèn cồn. Khi
một phần bột nhôm trong muỗng cháy đỏ thì đưa nhanh muỗng vào bình chứa oxygen dư. Bột nhôm
cháy nhanh và phát ra ánh sáng màu trắng rất mạnh, tạo thành hợp chất#A.
a. Nhôm bị khử tạo thành hợp chất#A.
b. Số oxi hoá của nhôm trong hợp chất A là +3.
c. Biến thiên enthalpy chuẩn của phản ứng giữa nhôm và oxygen có giá trị âm ( rH 298 0) .
d. Phản ứng trên liên quan đến 2 cặp oxi hoá - khử là Al3+ / Al và O /2O 2− 2 .
3. Trắc nghiệm trả lời ngắn
♦ Mức độ HIỂU
Câu 65. Cho dãy các kim loại: Ba, Zn, K, Cu, Ag. Có bao nhiêu kim loại trong dãy phản ứng mạnh với
nước ở điều kiện thường?
Câu 66. Cho dãy các kim loại: Na, Mg, Fe, K, Ag, Ba. Có bao nhiêu kim loại trong dãy phản ứng mạnh
với nước ở điều kiện thường?
Câu 67. Cho dãy các kim loại: Al, Cu, Fe, Ag. Có bao nhiêu kim loại trong dãy phản ứng được với dung dịch H2SO4 loãng?
Câu 68. Cho dãy các kim loại: Al, Cu, Mg, Ag. Có bao nhiêu kim loại trong dãy phản ứng được với dung dịch H2SO4 loãng?
Câu 69. Cho dãy các kim loại: Ag, Zn, Fe, Cu. Có bao nhiêu kim loại trong dãy phản ứng được với dung
dịch Câu 70. Cho dãy các kim loại: Fe, Cu, Mg, Ag, Al, Na, Ba. Có bao nhiêu kim loại trong dãy phản
ứng được với dung dịch HCl?
Câu 71. Cho kim loại Fe lần lượt phản ứng với các dung dịch: FeCl3, Cu(NO3)2, AgNO3, MgCl2. Có bao
nhiêu trường hợp xảy ra phản ứng hoá học?
♦ Mức độ VẬN DỤNG
Câu 72. [KNTT- SBT] Tiến hành các thí nghiệm sau:
(1) Cho Mg vào lượng dư dung dịch FeCl3. (2) Cho Ba vào lượng dư dung dịch CuSO4.
(3) Cho Zn vào dung dịch CuSO4.
(4) Cho dung dịch Fe(NO3)2 vào dung dịch AgNO3. Có bao nhiêu thí nghiệm thu được kim loại?
Câu 73. Cho m gam hỗn hợp X gồm Mg và Zn vào dung dịch H2SO4 loãng, dư thu được 0,7437 lít H2 (
đkc). Khi cho m gam hỗn hợp X vào 200 mL dung dịch CuSO4 0,2M thì thu được bao nhiêu gam kết tủa?
Câu 74. Nung nóng hỗn hợp X gồm 3,36 g bột sắt và 1,28 gam bột sulfur ( không có không khí), thu
được hỗn hợp Y. Hoà tan Y vào dung dịch HCl dư, thu được hỗn hợp khí Z. Đốt cháy Z cần a mol oxygen.
Giá trị của a là bao nhiêu? ( Biết các phản ứng xảy ra hoàn toàn)
Câu 75. Hoà tan hoàn toàn 10,4 gam hỗn hợp Mg, Al và Zn trong dung dịch HCl dư, thu được 7,437 lít khí
H2 (đkc) và dung dịch chứa m gam muối. Giá trị của m là bao nhiêu?
Câu 76. Cho 0,456 gam hỗn hợp Fe và Al vào 250 mL dung dịch AgNO3 0,12 M. Sau khi các phản ứng
xảy ra hoàn toàn, thu được dung dịch X và 3,312 gam chất rắn. Khối lượng Fe trong hỗn hợp ban đầu là bao nhiêu gam?
Câu 77. Nung nóng 11,9 gam hỗn hợp Mg, Al và Fe trong không khí một thời gian, thu được 13,5 gam
hỗn hợp X. Hoà tan vừa đủ X trong V mL dung dịch HCl 1M, thu được 7,437 lít khí H2 (đkc) và dung
dịch chỉ chứa muối. Giá trị của V là bao nhiêu?
Câu 78. Cho hỗn hợp X gồm Al và Mg tác dụng với 200 mL dung dịch gồm AgNO3 a mol/L và Cu(NO3)2
2a mol/L, thu được 9,04 gam chất rắn Y. Cho Y tác dụng với dung dịch H2SO4 đặc, nóng (dư) thu được
1,7353 lít khí SO2 (đkc, là sản phẩm khử duy nhất). Giá trị của a là bao nhiêu? ( Biết các phản ứng xảy ra hoàn toàn). ______HẾT_____
PHƯƠNG PHÁP TÁCH KIM LOẠI
I. Trạng thái tự nhiên của kim loại
- Trong tự nhiên, hầu hết các kim loại tồn tại ở dạng hợp chất (oxide, muối, …) trong quặng, chỉ một số
kim loại hoạt động hóa học yếu như Au, Ag, Pt, … được tìm thấy ở dạng đơn chất. - Một số loại quặng thông dụng: Kim loại Quặng Thành phần chính Al Bauxite Al2O3.2H2O Zn Zinc blende ZnS Fe Hematite Fe2O3 Pyrite FeS2 Cu Chalcopyrite CuFeS2
II. Phương pháp tách kim loại 1. Nguyên tắc
- Khử ion kim loại thành nguyên tử: Mn+ + ne → M
2. Tách kim loại hoạt động hóa học mạnh – Điện phân nóng chảy
- Các kim loại hoạt động hóa học mạnh như K, Na, Ca, Mg, Al, … được điều chế bằng phương pháp điện
phân nóng chảy oxide, muối chloride của chúng.
Điện phân nóng chảy Al2O3
Điện phân nóng chảy MgCl2 Cathode (-): Al3+ + 3e → Al
Cathode (-): Mg2+ + 2e → Mg Anode (+): Anode (+): 2O2- → O2 + 4e 2Cl- → Cl2 + 2e PTHH: 2Al2O3 ⎯⎯⎯→ ®pnc PTHH: MgCl cryolite 4Al + 3O2 2 ⎯⎯⎯→®pnc Mg + Cl2
3. Tách kim loại hoạt động trung bình, yếu Nhiệt luyện Thủy luyện
Điện phân dung dịch
- Dùng C, CO, H2, … khử - Dùng kim loại mạnh hơn đẩy - Cho dòng điện một
oxide kim loại ở nhiệt độ cao. kim loại yếu hơn ra khỏi muối. chiều qua dung dịch muối.
- Thường dùng tách các kim - Thường dùng tách các kim - Thường dùng tách các
loại trung bình và yếu Zn, Fe, loại yếu như Cu, Ag, Au, … Fe kim loại trung bình và yếu Zn, Sn, Pb, Cu, … + CuSO4 → FeSO4 + Cu Fe, C + ZnO ⎯⎯→t Sn, Pb, Cu, … o Zn + CO
CuSO4 + H2O ⎯⎯⎯→®pdd Cu + 3CO + Fe2O3 ⎯⎯→to 2Fe + ½ O2 + H2SO4 3CO2
III. Nhu cầu và thực tiễn tái chế kim loại
1. Nhu cầu tái chế kim loại
- Hiện nay, trữ lượng kim loại ngày càng cạn kiệt, trong khi nhu cầu sử dụng kim loại ngày càng tăng và
lượng phế thải kim loại tạo ra ngày càng nhiều Việc tái chế kim loại là hết sức cần thiết, vừa đảm bảo
nguồn cung, vừa tăng giá trị kim tế, bảo vệ môi trường và thực hiện mục tiêu phát triển bền vững.
2. Thực tiễn tái chế kim loại
- Quy trình tái chế các kim loại phổ biến (sắt, nhôm, đồng) thường trải qua các giai đoạn:
- Nhôm tái chế được sử dụng trong các lĩnh vực xây dựng, sản xuất ô tô, xe máy, xe đạp, thiết bị điện tử,
… - Đồng tái chế được sử dụng trong nhiều lĩnh vực như vật liệu xây dựng, phương tiện giao thông,
dụng cụ nấu ăn, nhạc cụ, dây dẫn điện, …
- Sắt tái chế được sử dụng sản xuất thép dùng trong lĩnh vực xây dựng, sản xuất ô tô, …
BÀI TẬP TRẮC NGHIỆM
1. Trắc nghiệm nhiều lựa chọn
♦ Mức độ BIẾT
Câu 1. [CD - SBT] Trong vỏ Trái Đất, những kim loại nào sau đây tồn tại chủ yếu dưới dạng đơn chất. A. Ag, Au. B. Zn, Fe. C. Mg, Al. D. Na, Ba.
Câu 2. [CTST - SBT] Nguyên tắc tách kim loại là
A. khử ion kim loại.
B. oxi hóa ion kịm loại thành nguyên tử.
C. khử nguyên tử kim loại thành ion.
D. oxi hóa nguyên tử kim loại thành ion.
Câu 3. [CTST - SBT] Kim loại nào sau đây được điều chế bằng phương pháp thủy luyện? A. Cu. B. Na. C. Ca. D. Mg.
Câu 4. (C.12) Kim loại nào sau đây điều chế được bằng phương pháp thủy luyện? A. Mg. B. Ca. C. Cu. D. K.
Câu 5. [QG.20] Kim loại nào sau đây được điều chế bằng phương pháp thủy luyện? A. Na. B. Ba. C. Mg. D. Ag.
Câu 6. (QG.19) Kim loại nào sau đây được điều chế bằng phương pháp điện phân nóng chảy? A. Fe. B. Na. C. Cu. D. Ag.
Câu 7. Trong công nghiệp, kim loại nào sau đây chỉ được điều chế bằng phương pháp điện phân nóng chảy? A. Fe. B. Cu. C. Mg. D. Ag.
Câu 8. Dãy các kim loại đều có thể được điều chế bằng phương pháp điện phân dung dịch muối của chúng là: A. Fe, Cu, Ag. B. Mg, Zn, Cu. C. Al, Fe, Cr. D. Ba, Ag, Au.
Câu 9. (QG.19) Kim loại nào sau đây được điều chế bằng phương pháp nhiệt luyện với chất khử là CO? A. Ca. B. K. C. Cu. D. Ba.
Câu 10. [MH-2020] Trong công nghiệp, kim loại nào sau đây được điều chế bằng phương pháp nhiệt luyện? A. Mg. B. Fe. C. Na. D. Al.
Câu 11. [QG.23] Kim loại Fe được điều chế trực tiếp từ Fe2O3 bằng phương pháp
A. thủy luyện.
B. điện phân dung dịch.
C. nhiệt luyện. Câu 12.
D. điện phân nóng chảy.
[QG.21] Ở nhiệt độ cao, H2 khử được oxide nào sau đây? A. CaO. B. K2O. C. Na2O. D. CuO.
Câu 13. [QG.21] Ở nhiệt độ cao, CO khử được oxide nào sau đây? A. CaO. B. Fe2O3. C. Na2O. D. K2O.
Câu 14. Ở nhiệt độ cao, khí CO khử được các oxit nào sau đây?
A. Fe2O3 và CuO.
B. Al2O3 và CuO.
C. MgO và Fe2O3. D. CaO và MgO.
Câu 15. [CTST] Kim loại nào sau đây được điều chế bằng phương pháp điện phân nóng chảy? A. Fe. B. Na. C. Cu. D. Ag.
Câu 16. [CTST] Phương pháp chung để điều chế các kim loại Na, Ca, Al trong công nghiệp là
A. điện phân dung dịch.
B. điện phân nóng chảy.
C. nhiệt luyện. D. thủy luyện.
Câu 17. [KNTT ] Chất nào dưới đây là thành phần chính của quặng hematite?
A. Iron(II) oxide.
B. Iron(III) oxide. C. Iron. D. Iron(II) sulfide.
Câu 18. [KNTT ] Kim loại nào sau đây thường có ở dạng đơn chất trong tự nhiên? A. Đồng. B. Kẽm. C. Vàng. D. Sắt.
Câu 19. [KNTT] Kim loại nào sau đây có thể được điều chế từ hợp chất của nó bằng cách chỉ dùng nhiệt (đun nóng)? A. Bạc. B. Nhôm. C. Sắt. D. Kẽm.
Câu 20. [KNTT ] Phương pháp thích hợp để điều chế Mg từ MgCl2, là
A. dùng kali khử ion Mg2+ trong dung dịch.
B. điện phân MgCl, nóng chảy.
C. điện phân dung dịch MgCl2.
D. nhiệt phân MgCl2.
Câu 21. [KNTT ] Phương pháp nào sau đây có thể tách được sodium kim loại?
A. Nung nóng mạnh quặng sodium trong không khí.
B. Nung nóng quặng sodium với carbon.
C. Điện phân nước muối. D. Điện phân muối sodium chloride nóng chảy.
Câu 22. Trong công nghiệp, kim loại nào sau đây được điều chế bằng phương pháp nhiệt luyện là A. Mg. B. Fe. C. Na. D. Al.
Câu 23. [CTST ] Dãy gồm các kim loại có thể điều chế được bằng phương pháp nhiệt luyện là A. Al, Na, Ba. B. Ca, Ni, Zn. C. Mg, Fe, Cu. D. Fe, Cr, Zn.
Câu 24. [CTST ] Trong công nghiệp, Mg có thể được điều chế bằng cách nào dưới đây?
A. Điện phân nóng chảy MgCl2.
B. Cho kim loại Zn vào dung dịch MgCl2.



