


Preview text:
SỰ ĂN MÒN KIM LOẠI I. KHÁI NIỆM:
Sự ăn mòn kim loại là sự phá hủy kim loại hoặc hợp kim do tác dụngcủa các chất trong môi trường
Hậu quả là kim loại bị oxi hóa thành các ion dương kim loại nên mất đi tính chất kim loại và giá trị sử dụng M Mn+ + ne
II. CÁC DẠNG ĂN MÒN KIM LOẠI:
Căn cứ vào môi trường và cơ chế của sự ăn mòn kim loại, người ta phân thành 2 dạng: ăn mòn hóa học và ăn
mòn điện hóa. 1. Ăn mòn hóa học
Sự ăn mòn hóa học là quá trình oxi hóa – khử, trong đó các electron của kim loại được chuyển trực tiếp
đến các chất trong môi trường.
Các chi tiết bằng kim loại của máy móc dùng trong các nhà máy hóa chất, những thiết bị của lò đốt, nồi hơi,
các chi tiết của động cơ đốt trong bị ăn mòn do tác dụng trực tiếp với hóa chất hoặc hơi nước ở nhiệt độ cao.
Nhiệt độ càng cao, sự ăn mòn xảy ra càng nhanh Ví dụ: Fe + H2O Fe + Cl2 Fe + O2
2. Ăn mòn điện hóa học
a) Khái niệm: Ăn mòn điện hóa học là quá trình oxi hóa -khử trong đó kim loại bị ăn mòn do tác dụng
của dung dịch chất điện li và tạo nên dòng electron chuyển dời từ cực âm đến cực dương.
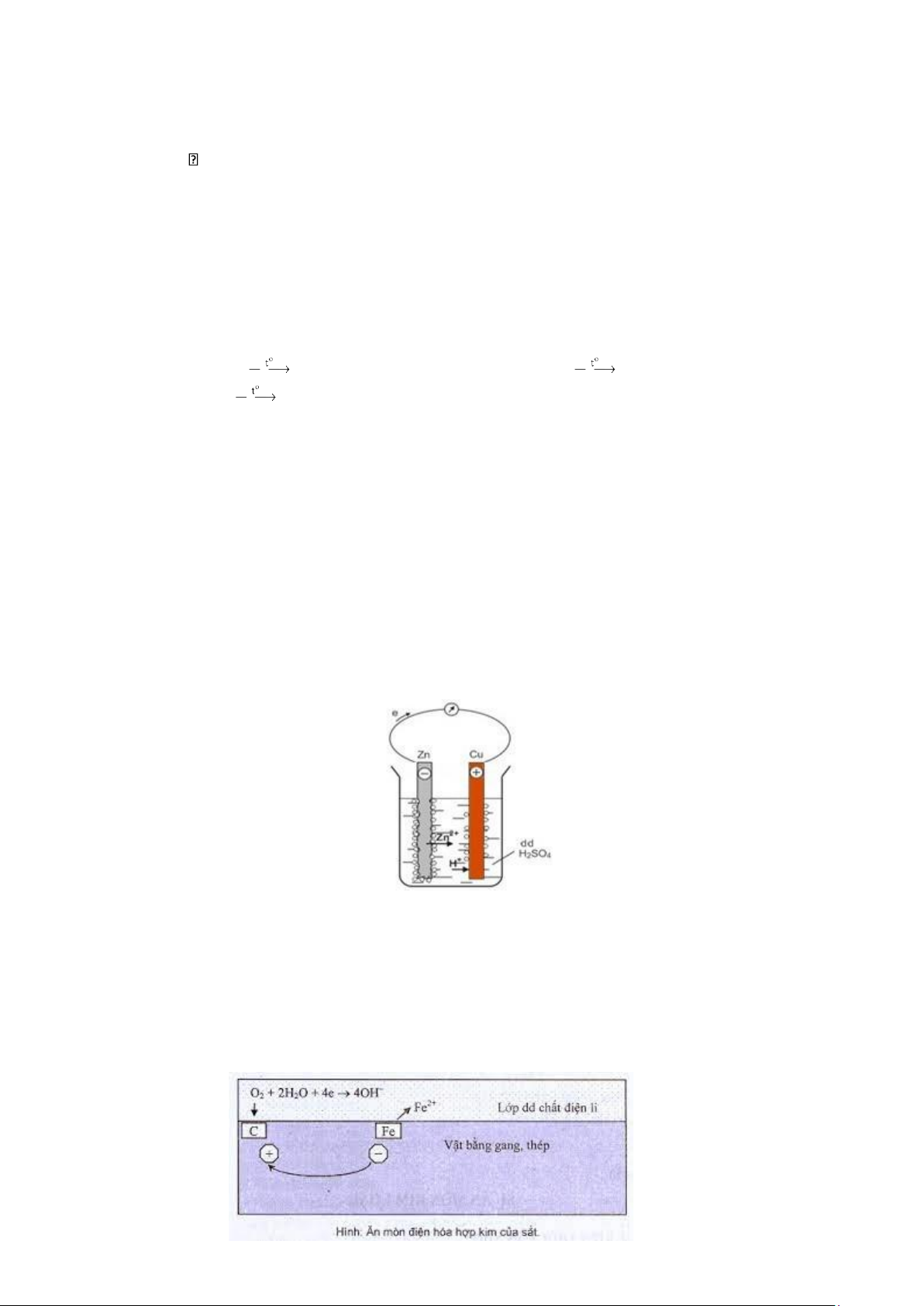
Thí nghiệm: Nhúng thanh Zn và thanh Cu (không tiếp xúc với nhau) vào cốc đựng dung dịch H2SO4 loãng.
Nối thanh Zn với thanh Cu bằng dây dẫn cho đi qua một điện kế . Kim điện kế quay, chứng tỏ có dòng điện
chạy qua. Thanh Zn bị ăn mòn dần, bọt khí H2 thoát ra cả ở thanh Cu.
Giải thích: ở điện cực âm (anot), kẽm bị ăn mòn theo phản ứng. Zn → Zn2+ + H2
Ion Zn2+ đi vào dung dịch , còn electron theo dây dẫn sang điện cực đồng.
Ở điện cực dương (catot), ion H+ của dung dịch H2SO4 nhận electron biến thành nguyên tử H rồi thành phân tử H2 thoát ra. 2H+ + 2e → H2
b) Ăn mòn điện hóa học hợp kim của sắt ( gang – thép ) trong không khí ẩm
Sự ăn mòn điện hóa học các hợp kim của sắt (gang – thép) trong không khí ẩm có ảnh hưởng đặc biết
nghiêm trọng đối với nền kinh tế của các quốc gia. Đây là một quá trình phức tạp, có thể mô tả một cách giản lược là:
Lấy sự ăn mòn gang làm thí dụ. Trong không khí ẩm có hòa tan khí CO2, O2 ...trong khí quyển, tạo thành một
dung dịch chất điện li. Gang có thành phần chính là sắt và cacbon cùng tiếp xúc với dung dịch đó tạo nên vô
số pin rất nhỏ mà sắt là anot và cacbon là catot.
Tại anot, sắt bị oxi hóa thành ion Fe2+: Fe Fe2+ + 2e
Các electron được giải phóng chuyển dịch đến catot
Tại catot, O2 hòa tan trong nước bị khử thành ion OH-: O2 + 2H2O + 4e 4OH-
Ion Fe2+ tan vào dung dịch chất điện li có hòa tan khi oxi nên bị oxi hóa tiếp thành Fe3+, Fe3+ kết hợp với
OH- trong môi trường tạo Fe(OH)3, chuyển hóa dần dần thành gỉ sắt Fe2O3.nH2O
+ Lưu ý: Sự hình thành gỉ sắt không đơn thuần chỉ do quá trình ăn mòn điện hóa mà còn do sự ăn mòn hóa
học xảy ra do phản ứng trực tiếp của Fe và O2, hơi nước trong môi trường chung quanh. c) Điều kiện xảy ra
sự ăn mòn điện hóa học:
Từ thí nghiệm ăn mòn điện hóa, rút ra các điều kiện sau
+ Các điện cực phải khác nhau về bản chất, có thể là cặp hai kim loại khác nhau, hoặc cặp kim loại – phi
kim, hoặc cặp kim loại – hợp chất hóa học, ví dụ ximentit, trong đó kim loại có thế điện cực chuẩn nhỏ hơn là cực âm .
Như vậy kim loại nguyên chất khó bị ăn mòn điện hóa học.
+ Các điện cực phải tiếp xúc trực tiếp hoặc gián tiếp với nhau qua dây
dẫn + Các điện cực cùng tiếp xúc với dung dịch chất điện li.
Thiếu 1 trong 3 điều kiện trên sẽ không xảy ra ăn mòn điện hóa học. Trong thực tế, các quá trình ăn mòn kim
loại diễn ra rất phức tạp, có thể bao gồm cả sự ăn mòn hóa học và ăn mòn điện hóa. Nhưng ăn mòn điện hóa
thường đóng vai trò chủ yếu
III. CHỐNG ĂN MÒN KIM LOẠI:
Sự ăn mòn kim loại gây tổn thất to lớn đến nền kinh tế quốc dân. Hằng năm chúng ta phải sửa chữa, thay
thế nhiều chi tiết của máy móc, thiết bị dùng trong các nhà máy và công trường, các phương tiện giao thông vận tải.
Mỗi năm lượng sắt thép bị gỉ chiếm đến gần ¼ lượng sản xuất ra. Vì vậy chống ăn mòn kim loại là việc rất
quan trọng cần phải làm thường xuyên để kéo dài thời gian sử dụng của máy móc, vật dụng làm bằng kim
loại. Dưới đây là hai phương pháp thường dùng để bảo vệ kim loại, chống ăn mòn kim loại.
1. Phương pháp bảo vệ bề mặt :
Dùng những chất bền vững với môi trường để phủ ngoài mặt những đồ vật bằng kim loại như bôi dầu mỡ, sơn , mạ, tráng men…
Sắt tây là sắt được tráng thiếc, tôn là sắt được tráng kẽm. Các đồ vật bằng sắt thường được mạ crom hay niken.
2. Bảo vệ điện hóa:
Nối kim loại cần được bảo vệ với một kim loại hoạt động hơn để tạo thành pin điện hóa và kim loại hoạt động
hơn bị ăn mòn, kim loại kia được bảo vệ.
Thí dụ: Để bảo vệ vỏ tàu biển bằng thép người ta gắn vào mặt ngoài vỏ tàu (phần chìm dưới nước ) những
khối kẽm (vật hi sinh). Kết quả kẽm bị nước biển ăn mòn thay cho thép
Ống thép (dẫn nước, dẫn dầu, dẫn khí đốt) ở dưới đất cũng được bảo vệ bằng pp điện hóa. Tốc độ ăn mòn kẽm
nhỏ nên kim loại cần bảo vệ sẽ được bảo vệ trong một thời gian dài
+ Ngoài ra người ta có thể điều chế những hợp kim bền vững với môi trường như inox … nhưng giá thành
của những hợp kim nầy khá đắt.
BÀI TẬP SÁCH GIÁO KHOA:
1. Ăn mòn kim loại là gì?
Bản chất của ăn mòn điện hóa và ăn mòn hóa học có gì giống và khác nhau?
1. Trong các trường hợp sau, trường hợp nào xảy ra sự ăn mòn điện hóa, sự ăn mòn hóa học?
- Kim loại Zn trong dung dịch HCl
- Thép C để trong không khí ẩm - Đốt dây Fe trong O2
- Cho kim loại Cu vào dung dịch HNO3
2. Một sợi dây phơi áo quần bằng Cu được nối với một đoạn dây nhôm. Cho biết có hiện tượng gì xảy ra khi
để dây phơi ngoài trời trong không khí ẩm. Giải thích và đưa ra nhận xét.
3. Có những vật bằng sắt được tráng thiếc hoặc tráng Zn
- Giải thích vì sao Sn và Zn có thể bảo vệ được kim loại Fe
- Nếu trên bề mặt của vật có vết sây sát sâu tới lớp sắt bên trong, - Hãy cho biết :
+ Có hiện tượng gì xảy khi để các vật đó trong không khí ẩm
+ Trình bày cơ chế ăn mòn đối với những vật trên
TRẮC NGHIỆM ĂN MÒN KIM LOẠI
1. Có bốn thanh sắt được đặt tiếp xúc với những kim loại khác nhau và nhúng trong các dung dịch HCl như hình vẽ dưới đây.
Thanh sắt bị hòa tan chậm nhất sẽ là thanh được đặt tiếp xúc với : A. Zn. B. Sn. C. Ni. D.Cu.
2. Cho các phản ứng :
(1) Cu + 2Fe3+ Cu2+ + 2Fe2+ Phản (2) Fe + Cu2+ Fe2+ + Cu
ứng nào cho thấy tính khử của Cu mạnh hơn Fe2+ ? A. (1) B. (2) C. cả (1) và (2)
D. không có phản ứng nào
3. Điều kiện nào dưới đây KHÔNG thuộc những điều kiện cần và đủ để xảy ra ăn mòn điện hóa ?
A. Các điện cực là các chất khác nhau
B. Các điện cực phải tiếp xúc với nhau
C. Các điện cực cùng tiếp xúc với một dung dịch điện li
D. Các điện cực đóng vai trò chất oxi hóa và chất khử của pin điện
4. Trường hợp nào sau đây, kim loại bị ăn mòn điện hóa học?
A. Kim loại sắt trong dung dịch HNO3 loãng. B. Thép cacbon để trong không khí ẩm.
C. Đốt dây sắt trong khí oxi khô.
D. Kim loại kẽm trong dung dịch HCl.
5. Trong bốn dung dịch dưới đây, đinh sắt bị ăn mòn nhanh nhất khi ngâm trong dung dịch A. HCl. B. H2SO4 loãng C. CuSO4 D. H2SO4 loãng pha CuSO4
6. Để bảo vệ vỏ tàu biển làm bằng thép người ta không nên gắn kim loại nào dưới đây vào phần vỏ tàu ngâm trong nước biển? A. Mg B. Al. C. Zn D. Cu
7. Có 4 dung dịch riêng biệt: CuSO4, ZnCl2, FeCl3, AgNO3. Nhúng vào mỗi dung dịch một thanh Ni. Số
trường hợp xuất hiện ăn mòn điện hoá là A. 1. B. 4. C. 3. D. 2.
8. Cho 6 dung dịch riêng biệt: AgNO3, HC1, CuSO4, Fe(SO4)3 có lẫn H2SO4, HCl có lẫn CuSO4, Fe(NO3)3
có lẫn AgNO3. Nhúng vào mỗi dung dịch một thanh sắt nguyên chất, số trường hợp xảy ra ăn mòn điện hoá là A. 2. B. 5. C. 3. D. 4.
9. Cho các thí nghiệm sau: (1) Cho hỗn hợp gồm Fe và Al phản ứng với khí Cl2. (2) Cho hợp kim gồm Fe
và Al phản ứng với dung dịch HC1. (3) Để gang, thép trong không khí ẩm. (4) Cho Fe phản ứng với dung
dịch FeCl3. (5) Cho Fe tác dụng với dung dịch HC1 và NaNO3. (6) Cho Fe phản ứng với dung dịch
CuSO4. Trong các thí nghiệm trên, số thí nghiệm xảy ra ăn mòn điện hoá là A. 3. B. 4. C. 5. D. 6.
10. Tiến hành các thí nghiệm sau: (1) Cho hơi nước đi qua ống đựng bột sắt nung nóng. (2) Để thanh thép
(hợp kim của sắt với cacbon) trong không khí ẩm. (3) Cho từng giọt dung dịch Fe(NO3)2 vào dung dịch
AgNO3. (4) Cho lá đồng nguyên chất vào dung dịch AgNO3. (5) Cho lá kẽm vào dung dịch H2SO4 (loãng)
có nhỏ thêm vài giọt dung dịch CuSO4. Trong các thí nghiệm trên, số trường hợp có xảy ra ăn mòn điện hoá là A. 2. B. 3. C. 1. D. 4.
11. Hai lá kim loại Sn và Fe tiếp xúc nhau được nhúng vào cùng một dung dịch HCl. Phát biểu nào sau đây là đúng?
A. Fe bị ăn mòn điện hóa.
B. Sn và Fe đều không bị ăn mòn điện hóa.
C. Sn bị ăn mòn điện hóa.
D. Sn và Fe đều bị ăn mòn điện hóa.
12. Tiến hành bốn thí nghiệm sau:
(1) Nhúng thanh Fe vào dung dịch FeCl3.
(2) Nhúng thanh Fe vào dung dịch CuSO4.
(3) Nhúng thanh Cu vào dung dịch FeCl3.
(4) Cho thanh Fe tiếp xúc với thanh Cu rồi nhúng vào dung dịch HC1. Số trường hợp xuất hiện ăn mòn điện hoá là A. 3. B. 4. C. 1. D. 2.
13. Thực hiện các thí nghiệm sau: (1) Thả một viên Fe vào dung dịch HCl; (2) Thả một viên Fe vào dung
dịch Cu(NO3)2; (3) Thả một viên Fe vào dung dịch FeCl3; (4) Nối một dây Ni với một dây Fe rồi để trong
không khí ẩm; (5) Đốt một dây Fe trong bình kín chứa đầy khí O2; (6) Thả một viên Fe vào dung dịch
chứa đồng thời CuSO4 và H2SO4 loãng. Trong các thí nghiệm trên thì thí nghiệm mà Fe không bị ăn mòn điện hóa học là: A. (2), (3), (4), (6). B. (1), (3), (4), (5).
C. (2), (4), (6). D. (1), (3), (5).
14. Phản ứng điện phân dung dịch CuCl2 (với điện cực trơ) và phản ứng ăn mòn điện hoá xảy ra khi nhúng
hợp kim Zn-Cu vào dung dịch HCl có đặc điểm là:
A. Phản ứng ở cực âm có sự tham gia của kim loại hoặc ion kim loại.
B. Phản ứng ở cực dương đều là sự oxi hoá Cl–.
C. Đều sinh ra Cu ở cực âm.
D. Phản ứng xảy ra luôn kèm theo sự phát sinh dòng điện.
15. Trong sự ăn mòn điện hóa, xảy ra:
A. sự oxi hóa ở cực dương C. sự khử ở cực âm
B. sự oxi hóa ở cực dương và sự khử ở cực âm D. sự oxi hóa ở cực âm và sự khử ở cực dương




