


Preview text:
BÀI 2: XÁC ĐỊNH TỔNG COLIFORMSS, COLIFORMSS CHỊU NHIỆT BẰNG PHƯƠNG PHÁP MPN I. KHÁI NIỆM 1. Coliforms
- Được định nghĩa là vi khuẩn gram âm hình que không có nội bào tử và là vi
khuẩn di chuyển được hoặc không di chuyển được, chúng có thể lên men lactose
với việc sản xuất axit và khí khi ủ ở 35-37℃. Coliform có thể được tìm thấy trong
môi trường đất, nước, thảm thực vật; chúng có mặt phổ biến và số lượng lớn trong
phân của động vật máu nóng. Quy trình Coliform được thực hiện trong điều kiện hiếu khí hoặc kị khí
2. Coliform chịu nhiệt
- Là một loại vi khuẩn gram âm kỵ khí, hình que, không tạo bào tử. Vi khuẩn
Coliform thường có nguồn gốc từ ruột của các động vật máu nóng. Coliform phân
có khả năng phát triển trong môi trường có mặt các muối mật hoặc các chất bề
mặt tương tự, và tạo ra axit và khí từ lactose trong vòng 48 giờ ở nhiệt độ 44 ± 0,5°C.
3. Phương pháp MOST PROPAPLE NUMBER (MPN)
- Most Probable Number – phương pháp pha loãng tới nồng độ tới hạn hay
phương pháp chuẩn độ. Phương pháp ước đoán trên cơ sở thống kê về sự phân bố
vi sinh vật trong các độ pha loãng khác nhau của mẫu. Cho phép định lượng được
mật độ vi sinh vật thấp trong thể tích mẫu lớn.
II. CHUẨN BỊ DỤNG CỤ, HÓA CHẤT 1. Dụng cụ: + Ống nghiệm nhỏ + Đèn cồn + Micropipet + Ống durham + Bình đựng mẫu 2. Môi trường - LSB (Lauryl Sulphate Broth)
Cách pha: cân 2.24g (1L/35.6g) cho 63 mL H2O vào bình Duran Schott sau đó đem đi hấp tiệt trùng.
- BGBL (Brilliant Green Bile Lactos Broth)
Cách pha: cân 2.32g (1L/40g) cho 63 mL H2O vào bình Duran Schott sau đó đem đi hấp tiệt trùng. - EC (E.coli medium)
Cách pha: cân 2.33 g (1L/37g) cho 63 mL H2O vào bình Duran Schott sau đó đem đi hấp tiệt trùng. - Chia thành:
+ 9 ống nghiệm chứa 9ml môi trường LSB và có chứa ống Durham bên trong.
+ 9 ống nghiệm chứa 9ml môi trường BGB và có chứa ống Durham bên trong.
+ 9 ống nghiệm chứa 9ml môi trường EC và có chứa ống Durham bên trong.
Lưu ý: ống Durham phải úp ngược xuống. III. QUY TRÌNH
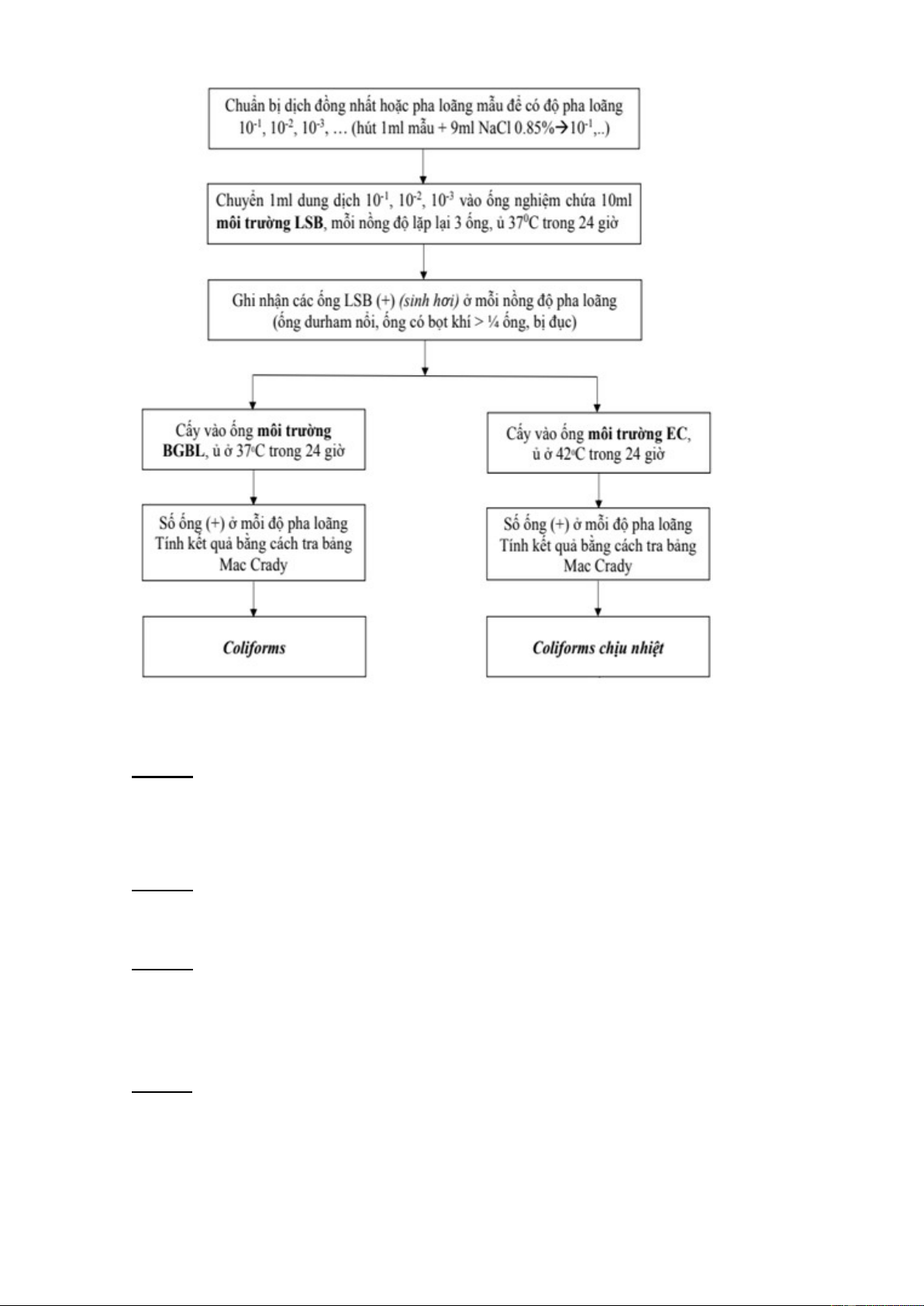
- Thuyết minh quy trình:
Bước 1: Dùng mẫu đã được pha loãng ở bài 1, chọn ba ống có nồng độ pha loãng 10-4,
10-5, 10-6chuẩn bị các ống môi trường LSB, BGBL, EC có chứa ống Durham vô trùng, mỗi môi trường 9 ống.
Bước 2: Hút 1 mL dung dịch 10-4,10-5,10-6 vào ống nghiệm chứa 9mL môi trường LSB,
mỗi nồng độ lặp lại 3 ống, ủ 37οC trong 24 giờ.
Bước 3: Ghi nhận các ống LSB dương tính ở mỗi nồng độ pha loãng.
Lưu ý: các ống được ghi nhận là dương tính phải thỏa mãn hai trong ba điều kiện sau:
ống durham nổi, ống có bọt khí >¼ ống, môi trường bị đục.
Bước 4: Từ những ống dương tính ở mỗi nồng độ, dùng micropipet hút 1mL mẫu cấy vào
môi trường BGBL, mỗi nồng độ 3 ống nghiệm
*Tiến hành tương tự với môi trường EC
Bước 5: Ủ ở 37οC trong 24 giờ đối với môi trường BGBL và ủ ở 42°C trong 24 giờ đối với môi trường EC
Bước 6: Ghi nhận số ống dương tính ở mỗi nồng độ pha loãng. dùng bảng tra Mac Crady
loạt 3 ống nghiệm ở 3 nồng độ pha loãng liên tiếp để tính ra mật độ vi sinh vật trong mẫu
và biểu diễn dưới dạng trị số MPN/g(mL) mẫu ban đầu chưa pha loãng. IV. KẾT QUẢ 1. Môi trường LSB
Hình1: Kết quả sau khi ủ môi trường LSB
- Số ống nghiệm dương tính ở nồng độ pha loãng 10-4: 3 ống
- Số ống nghiệm dương tính ở nồng độ pha loãng 10-5: 1ống
- Số ống nghiệm dương tính ở nồng độ pha loãng 10-6: 0 ống 2. Môi trường EC
Hình 2: Kết quả sau khi ủ môi trường EC
Sau khi cấy các ống LSB (+) vào môi trường EC, thu được kết quả:
- Số ống nghiệm dương tính ở nồng độ pha loãng 10-4: 3 ống
- Số ống nghiệm dương tính ở nồng độ pha loãng 10-5: 1 ống
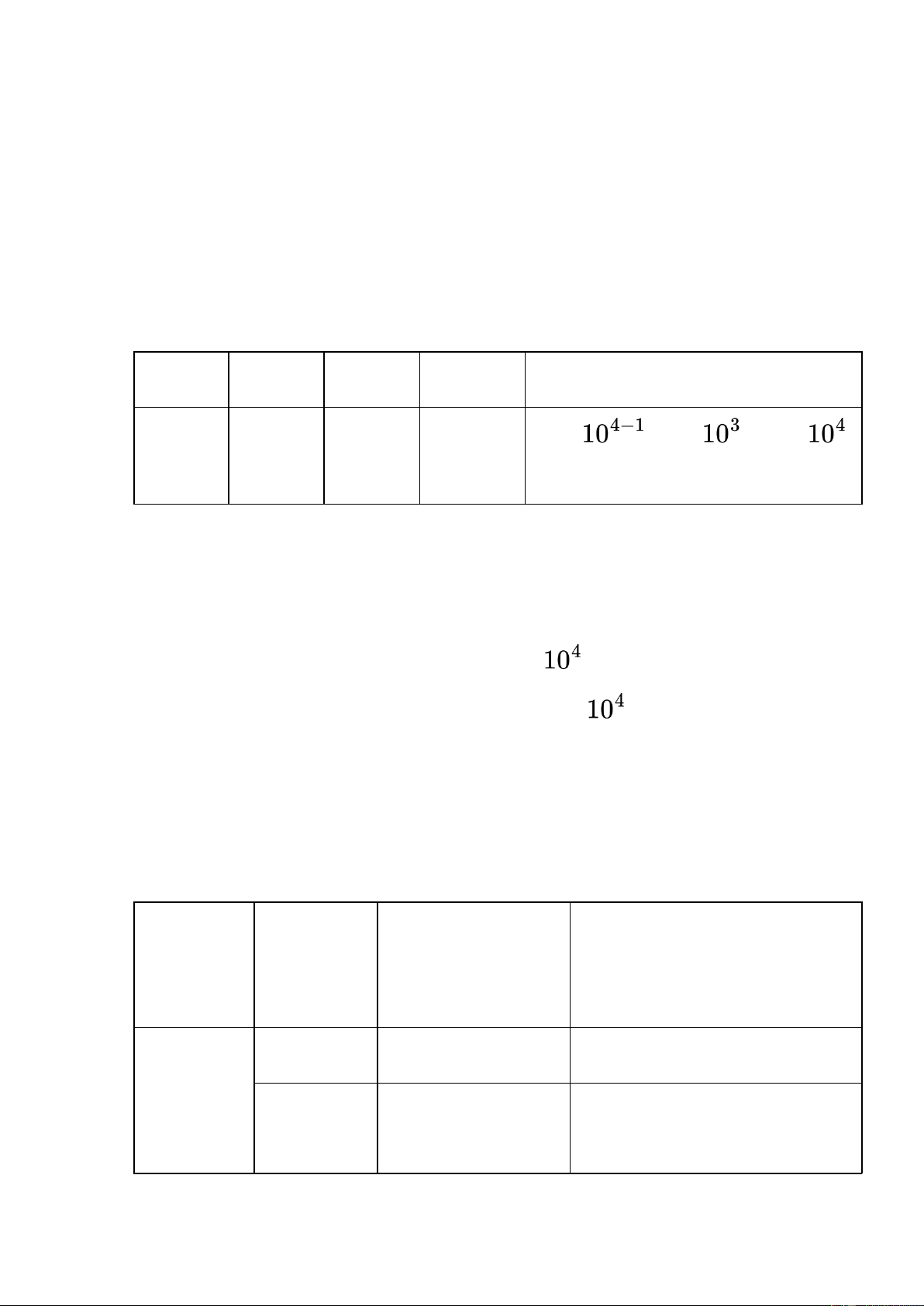
- Số ống nghiệm dương tính ở nồng độ pha loãng 10-6: 0 ống Tra bảng Mac Crady 10-4 10-5 10-6 Tra bảng Kết quả (MPN/ml) 3 1 0 43 43 x = 43 x = 4,3 x MPN/ml thực phẩm
Bảng 1: Số vi sinh vật trong môi trường EC 3. Môi trường BGBL
Hình 3: kết quả sau khi ủ môi trường BGBL
Sau khi cấy các ống LSB (+) vào môi trường BGBL , thu được kết quả:
- Số ống nghiệm dương tính ở nồng độ pha loãng 10-4: 3 ống
- Số ống nghiệm dương tính ở nồng độ pha loãng 10-5: 1 ống
- Số ống nghiệm dương tính ở nồng độ pha loãng 10-6: 0 ống Tra bảng Mac Crady: 10-4 10-5 10-6 Tra bảng Kết quả (MPN/ml) 3 1 0 43 43 x = 43 x = 4,3 x MPN/ml thực phẩm
Bảng 2: Số vi sinh vật trong môi trường BGBL
IV. KẾT LUẬN VÀ GIẢI THÍCH 1. Kết luận
- Số lượng coliforms tổng trong 1 ml mẫu là: 4,3 x MPN/ml thực phẩm
- Số lượng coliforms chịu nhiệt trong 1 ml mẫu là: 4,3 x MPN/ml thực phẩm.
Theo QĐ 46/2007 BYT, thì quy định giới hạn cho phép vi sinh vật có trong nước giải
khát không cồn đối với coliforms là 10 MPN/1g hoặc 1ml thực phẩm.
Bảng 9: So sánh kết quả với quy định giới hạn cho phép vi sinh vật trong nước
khoáng và nước giải khát đóng chai Giới hạn vi sinh vật Nhóm Sản phẩm (trong 1g hay 1mL Kết quả (MNP/mL) vi sinh vật thực phẩm) Nước giải Coliforms 10 290 x 102/10= 2.9 x 102 khát không Coliforms cồn 11 11 x 100 = 1.1 x 101 chịu nhiệt
Bảng 3: quy định giới hạn cho phép vi sinh vật trong nước khoáng và nước giải khát đóng chai
Kết luận: Mẫu phân tích không đạt chỉ tiêu về an toàn vệ sinh thực phẩm theo QĐ 46/2007 BYT 2. Giải thích
Sau khi pha loãng mẫu (nước mía) ta cấy vào môi trường Laury Sulphate Broth (LSB) ủ
ở nhiết độ 37°C trong 24h, quan sát thấy trong các ống nghiệm xuất hiện bọt khí. Hiện
tượng này là do trong nước mía có nhóm vi sinh vật Coliforms, đây là 1 vi khuẩn có khả
năng phân giải nhiều loại cơ chất khác nhau và tiến hành quá trình trao đổi chất. Mà
thành phần trong môi trường LSB cung cấp các chất sinh trưởng cần thiết tạo môi trường
sống giúp tăng sinh vi khuẩn Coliforms. sản sinh năng lượng và các chất metabolites, bao
gồm khí CO2 ở nhiệt độ 37°C, tạo ra bọt khí.
Sau khi cấy vào môi trường BGBL, là một môi trường tăng sinh chọn lọc, ức chế các vi
sinh vật không phải Coliforms. Việc xuất hiện bọt khí trong ống Durham là biểu hiện có
sự hiện diện của Coliformss. Các vi sinh vật Coliforms ức chế sự hoạt động của các vi
khuẩn hiếu khí và vi khuẩn lactose dương tính được chuyển hóa thành khí và được thu thập trong ống Durham.
Ở môi trường EC, các ống có hiện tượng sinh bọt khí vì đây là môi trường chứa thành
phần dinh dưỡng và được ủ ở điều kiện lý tưởng để phát triển nhóm VSV Coliformss
chịu nhiệt, ức chế sự phát triển của các vi khuẩn khác. Trong môi trường này thì
Coliformss sẽ tiếp tục lên men lactose tạo một lượng khí CO2, đây là 1 sản phẩm phụ gây hiện tượng bọt khí.