Preview text:
TRƯỜNG THPT …….
ĐỀ KIỂM TRA HỌC KÌ II NĂM HỌC 2022 – 2023 TỔ HÓA HỌC
MÔN: HÓA HỌC – LỚP 10
Thời gian làm bài: 45 phút
(Đề gồm 21 câu trắc nghiệm, 3 câu tự luận)
A. TRẮC NGHIỆM: (7 ĐIỂM)
Câu 1. Phản ứng kèm theo sự cho và nhận electron được gọi là phản ứng A. trao đổi.
B. oxi hoá – khử.
C. đốt cháy. D. phân huỷ.
Câu 2. Cho giá trị trung bình của các năng lượng liên kết ở điều kiện chuẩn: Liên kết C – H C – C C = C Eb (kJ/mol) 418 346 612
Biến thiên enthalpy của phản ứng C3H8(g) → CH4(g) + C2H4(g) có giá trị là A. +80 kJ. B. – 103 kJ. C. – 80 kJ. D. +103 kJ.
Câu 3. Cho các phản ứng dưới đây:
(1) CO(g) +O2 (9) — CO2 (g) rHo298K= - 283 kJ
(2) C (s) + H2O (g) + CO (g) + H2 (9) rHo298K= + 131,25 kJ
(3) H2 (g) + F2 (g) → 2HF (g) rHo298K= - 546 kJ
(4) H2 (9) + Cl2 (g)— 2HCI (g) rHo298K= - 184,62 kJ
Phản ứng xảy ra thuận lợi nhất là:
A. Phản ứng (4).
B. Phản ứng (2).
C. Phản ứng (1). D. Phản ứng (3).
Câu 4. Trong phản ứng oxi hóa – khử
A. quá trình oxi hóa và quá trình khử xảy ra đồng thời.
B. chất bị oxi hóa nhận electron và chất bị khử cho electron.
C. chất chứa nguyên tố số oxi hóa cực đại luôn là chất khử.
D. quá trình nhận electron gọi là quá trình oxi hóa.
Câu 5. Cho phương trình nhiệt hoá học của phản ứng: 2H 2 (g) + O2 (g) 2H2O (l) 0 H = - 571,68 kJ r 298
Phản ứng trên là phản ứng A. toả nhiệt
B. không có sự thay đổi năng lượng.
C. có sự hấp thụ nhiệt lượng từ môi trường xung quanh. D. thu nhiệt.
Câu 6. Cho phản ứng: Br2 (l) + HCOOH (aq)⟶ 2HBr (aq) + CO2 (s)
Nồng độ ban đầu của Br2 là aM, sau 50 giây nồng độ Br2 còn lại là 0,02M. Tốc độ trung bình của phản
ứng trên là 4.10-5M/s. Giá trị của a là A. 0,02 M B. 0,07 M C. 0,022 M. D. 0,025 M
Câu 7. Biết N thuộc nhóm VA. Số oxi hóa dương cao nhất của N trong các hợp chất sẽ là A. +3. B. +4. C. +1. D. + 5.
Câu 8. Cho phản ứng đơn giản xảy ra trong bình kín: 3H2(g) + N2 (g) ⟶ 2NH3 (g).
Tốc độ phản ứng thay đổi như thế nào nếu nồng độ H2 và N2 đều tăng 3 lần.
A. tăng 81 lần.
B. tăng 9 lần
C. tăng 6 lần D. tăng 3 lần
Câu 9. Phản ứng tổng hợp ammonia: N = − 2(g) + 3H2(g) → 2NH3(g) H 92kJ
Biết năng lượng liên kết (kJ/mol) của N N và H - H lần lượt là 946 và 436. Năng lượng liên kết của N - H trong ammonia là A. 245 kJ/mol. B. 490 kJ/mol. C. 361 kJ/mol. D. 391 kJ/mol.
Câu 10. Cho phản ứng ở 45°C
2N2O5 (g) ⟶ O2 (g) + 2N2O4 (g)
Sau 275 giây đầu tiên, nồng độ của O2 là 0,188 M. Tính tốc độ trung bình của phản ứng theo O2 trong khoảng thời gian trên.
A. 8,6.10−4 M / giây
B. 6,8.10−4 M / giây
C. 6,8.104 M / giây. D. 1463 M / giây
Câu 11. Cho phản ứng: 2CO (g) + O2 (g) ⟶ 2CO2 (g)
Với hệ số nhiệt độ Van’t Hoff γ=2.
Tốc độ phản ứng thay đổi như thế nào khi tăng nhiệt độ phản ứng từ 40°C lên 70°C?
A. giảm 4 lần
B. tăng gấp 2 lần
C. tăng gấp 6 lần. D. tăng gấp 8 lần
Câu 12. Điều kiện nào sau đây không phải là điều kiện chuần?
A. Áp suất 1 bar và nhiệt độ 25 °C hay 298 K.
B. Áp suất 1 bar và nhiệt độ 25 °
C. Áp suất 1 bar và nhiệt độ 298 K.
D. Áp suất 1 bar và nhiệt độ 25 K.
Câu 13. Số oxi hóa của N trong NH3, HNO2, NO− lần lượt là: 3 A. +3, +5, -3 B. +3, -3, +5 C. -3, +3, +5 D. +5, -3, +3
Câu 14. Cho phương trình nhiệt hoá học của phản ứng: CH
3CH2OH (hơi) → CH3-O-CH3 (hơi) 0 H = 11 Kcal r 298
Phát biểu nào sau đây đúng ?
A. Phân tử CH3OCH3 bền hơn CH3CH2OH.
B. Phân tử CH3CH2OH bền hơn CH OCH 3 3 .
C. Cả hai đều kém bền.
D. Không xác định được.
Câu 15. Trong phản ứng Zn + CuCl2 → ZnCl2 + Cu, một mol Cu2+ đã
A. nhận 2 mol e.
B. nhận 1 mol e.
C. nhường 1 mol e. D. nhường 2 mol e.
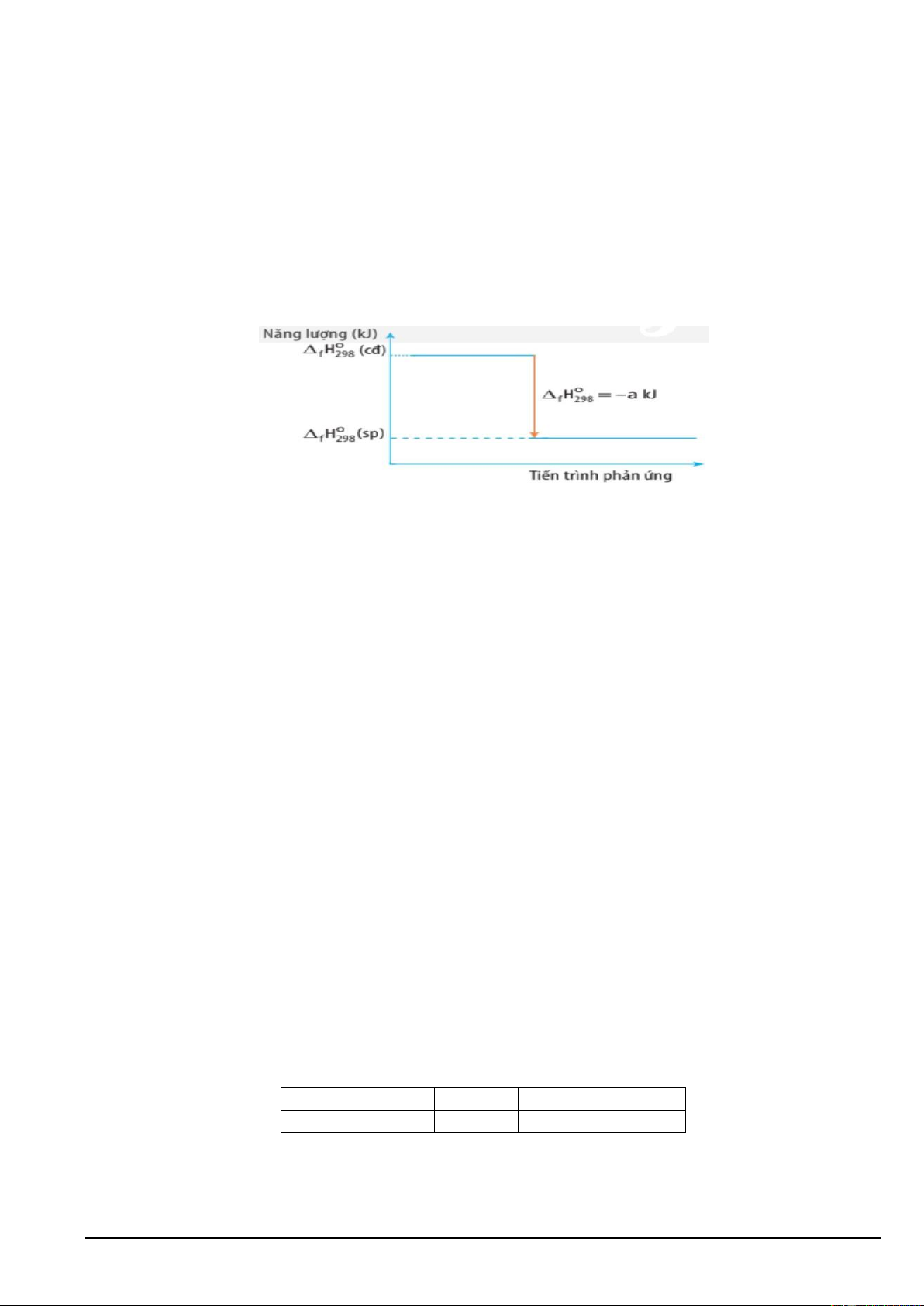
Câu 16. Biến thiên enthalpy của một phản ứng được ghi ở sơ đồ dưới:
Kết luận nào sau đây đúng?
A. Phản ứng thu nhiệt.
B. Biến thiên enthalpy của phản ứng là a kJ/mol.
C. Phản ứng tỏa nhiệt.
D. Năng lượng chất tham gia phản ứng nhỏ hơn năng lượng sản phẩm.
Câu 17. Trong phản ứng: 2FeCl3 + H2S c ⎯⎯→ 2FeCl2 + S + 2HCl. Cho biết vai trò của H2S
A. vừa axit vừa khử.
B. chất oxi hóa. C. Axit. D. chất khử.
Câu 18. Cho phản ứng đơn giản có dạng: aA + bB ⟶ cC + dD
Mối quan hệ giữa nồng độ và tốc độ tức thời của phản ứng hóa học được biểu diễn bằng biểu thức
A. ν = CaA×CbB
B. ν = k×CaA×CbB×CcC×CdD
C. ν = k×CaA×CbB D. ν = k×CA×CB
Câu 19. Cho phương trình nhiệt hoá học của 2 phản ứng: 2NH 3 + 3/2 O2 → N2 + 3H2O (1) 0 H = -628,5 kJ r 298 2NH 3 + 5/2O2 → 2NO + 3H2O(2) 0 H = -447,5 kJ r 298
Phát biểu nào sau đây đúng ?
A. cả hai phản ứng đều dễ xảy ra.
B. phản ứng (2) xảy ra nhanh hơn phản ứng (1).
C. phản ứng (1) dễ xảy ra hơn phản ứng (2).
D. phản ứng (2) dễ xảy ra hơn phản ứng (1).
Câu 20. Chất nào sau đây chỉ có tính khử A. S. B. HCl. C. Fe. D. F2.
Câu 21. Phản ứng tỏa nhiệt là gì?
A. Là phản ứng phóng năng lượng dạng nhiệt.
B. Là phản ứng hấp thụ năng lượng dạng nhiệt.
C. Là phản ứng hấp thụ ion dưới dạng nhiệt.
D. Là phản ứng hấp thụ ion dưới dạng nhiệt TỰ LUẬN: (3 ĐIỂM)
Câu 1: Cân bằng phản ứng oxi hóa- khử theo phương pháp thăng bằng electron
Fe + H2SO4 → Fe2(SO4)3 + S + H2O
Câu 2: Hãy tính biến thiên Enthalpy (∆rH0298) của phản ứng:
4FeS(s) + 7O2(g) → 2Fe2O3(s) + 4SO2(g).
Biết nhiệt tạo thành ∆fH0298 của các chất: FeS(s) Fe2O3(s) SO2(g) ∆fH0298(kJmol-1) -100,0 -824,2 -296,8
Câu 3: Cho phản ứng: 2H2O2 (aq)→2O2 (s) +2H2O (l)
Sau 60 giây thu được 33,6 ml khí O2 . Hãy tính tốc độ trung bình của phản ứng (tính theo H2O2) trong 60 giây



