



Preview text:
ENZYM I. KN:
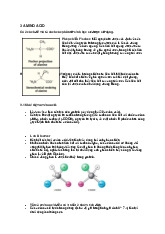
Enzym (hay men tiêu hoá) là các protein có tác dụng làm chất xúc tác sinh học. Chất
xúc tác thúc đẩy phản ứng hóa học. Các phân tử được enzym tác động lên được
gọi chất nền, và các enzym biến đổi các chất nền thành các phân tử khác nhau được gọi là sản phẩm. 1.1 Cách gọi tên:
– Tên thông dụng: pepsin, tripsin…
– Tên quốc tế: thường gồm 2 phần:
• Phần thứ nhất là tên cơ chất (nếu phản ứng lưỡng phân thì phần thứ nhất là
tên gọi của 2 cơ chất viết cách nhau bằng hai chấm).
• Phần thứ hai: tên phản ứng mà enzyme xúc tác cộng thêm “ase” 8
Ví dụ: Enzyme xúc tác cho sự thủy phân ure (carbamid): H2N - CO - NH2 +
H2O → CO2 +2NH3 có tên hệ thống là Carbam id - amidohydrodase (Tên thường dùng là urease)
1.2 Có sáu loại enzyme chính
- Oxidoreductase xúc tác phản ứng oxy hóa-khử.
- Transferase di chuyển các nhóm chức năng giữa các phân tử.
- Hydrolyase cắt liên kết bằng cách thêm nước.
- Lyase loại bỏ các nguyên tử để tạo thành liên kết đôi hoặc thêm
nguyên tử vào liên kết đôi.
- Isomerase di chuyển các nhóm chức năng bên trong một phân tử.
- ligase nối hai phân tử với sự tiêu tốn ATP.
II. Các vị trí hoạt động của Enzym có một số đặc điểm chung
- Vị trí hoạt động là khe hở hoặc khe hở ba chiều (khe hay khe xen kẽ)
được tạo ra bởi các axit amin từ các phần khác nhau của cấu trúc chính.
- Vị trí hoạt động chiếm một phần nhỏ trong thể tích của enzym.
- Các vị trí hoạt động tạo ra các vi môi trường độc đáo.
- Sự tương tác giữa enzym và chất nền tại vị trí hoạt động bao gồm nhiều tương tác yếu.
- Tính đặc hiệu của enzym phụ thuộc vào cấu trúc phân tử tại vị trí hoạt động.
- Enzym không tương tác với chất nền của chúng như ổ khóa và chìa khóa.
- Thay vào đó, enzym thay đổi hình dạng khi chất nền liên kết, một hiện
tượng được gọi là sự phù hợp cảm ứng
***Sơ đồ mô hình khóa và chìa khóa
của Enzyme-Chất nền liên kết
Vị trí hoạt động của enzyme không
liên kết có hình dạng bổ sung cho chất nền
Cơ chế tác dụng của enzyme
(E: enzyme, S: cơ chất, P: sản phẩm, ES: phức hợp trung gian enzyme-cơ chất) • Gồm 3 giai đoạn:
– Giai đoạn 1: E +S bằng liên kết yếu → tạo thành phức enzyme- cơ chất (ES)
không bền (xảy ra rất nhanh, năng lượng hoạt hóa thấp)
– Giai đoạn 2: biến đổi S (Sự kéo căng và phá vỡ các liên kết cộng hóa trị tham gia phản ứng)
– Giai đoạn 3: tạo thành P và E được giải phóng ra dưới dạng tự do
Các loại liên kết trong phức ES
• Khi cơ chất liên kết với enzyme tại vị trí trung tâm hoạt động sẽ hình thành
phức hợp trung gian enzyme – cơ chất (ES)
• Liên kết chủ yếu trong phức ES:
– Tương tác tĩnh điện – Liên kết hydro
– Tương tác Van der Waals Enzyme dị lập thể:
-Trong cấu trúc của các enzyme dị lập thể, ngoài trung tâm hoạt động còn có
một số vị trí khác cũng có thể tương tác với các cơ chất khác gọi là “trung
tâm allosteric” – trung tâm dị thể, trung tâm điều hòa
-Các chất kết hợp với các trung tâm này được gọi là các chất “điều hòa
allosteric” – chất điều hòa dị lập thể.
-Các chất này khi kết hợp với enzyme sẽ làm thay đổi cấu trúc không gian
của enzyme và của trung tâm hoạt động. Do đó enzyme sẽ thay đổi hoạt độ xúc tác.
Trong quá trình kết hợp với enzyme, chất điều hòa allosteric sẽ không bị
chuyển hóa dưới tác động của enzyme.
-Các chất điều hòa allosteric có khả năng làm tăng hoạt độ của enzyme được
gọi là chất điều hòa dương, còn các chất làm giảm hoạt độ của enzyme được
gọi là chất điều hòa âm
Hầu hết các enzyme dị thể có cầu trúc bậc 4, trong phân tử có hai hay có
một số trung tâm hoạt động có khả năng kết hợp với một số cơ chất
-Trong trường hợp cơ chất có khả năng thực hiện chức năng của chất điều
hòa thì ta có điều hoà đồng hướng – homotropic
-Trong trường hợp chất điều hòa có cấu trúc khác với cơ chất thì ta có điều
hòa dị hướng – heterotropic
-Thông thường các enzyme allosteric được điều hòa theo kiểu hỗn hợp bao
gồm cả homotropic và heterotropic
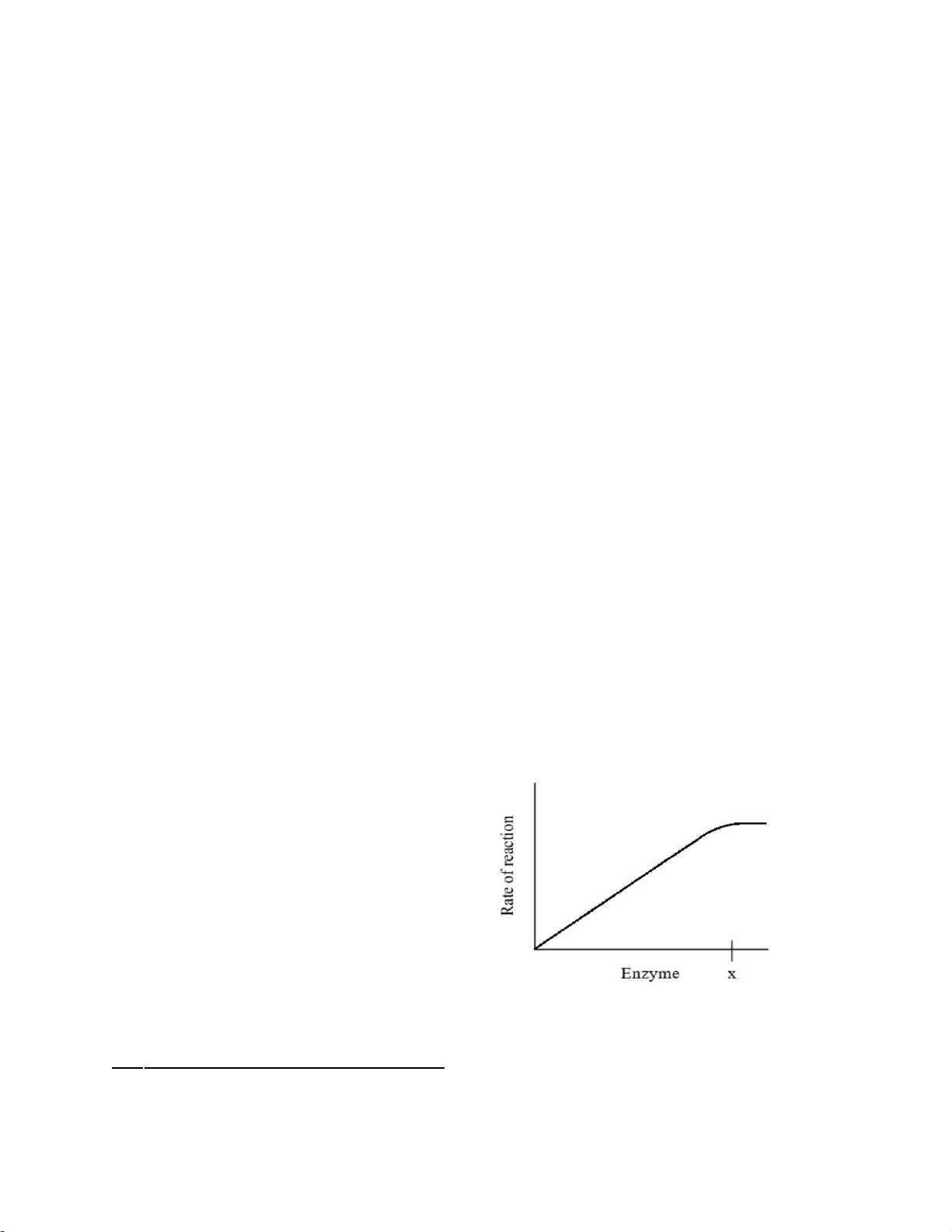
III Ảnh hưởng của nồng độ Enzyme:
Trong điều kiện thừa cơ chất và ở nồng
độ enzyme thấp, có nhiều phân tử cơ
chất hơn trung tâm hoạt động.
→Tăng số lượng trung tâm hoạt động
bằng cách tăng nồng độ của enzyme
giúp tăng hiệu quả tốc độ của phản ứng.
-Cuối cùng, tại điểm x, việc tăng nồng
độ enzym không ảnh hưởng đến tốc độ phản ứng
3.1 Ảnh hưởng nồng độ cơ chất:
-Ở nồng độ cơ chất thấp, phản ứng diễn ra chậm. Điều này là bởi vì không có
đủ phân tử cơ chất để chiếm tất cả các vị trí hoạt động trên enzyme.
-Khi nồng độ cơ chất tăng, tốc độ tăng vì có nhiều phức hợp cơ chất enzyme được hình thành.
-Tuy nhiên, tại điểm x, việc tăng nồng độ cơ chất sẽ không ảnh hưởng gì đến tốc độ phản ứng.
3.2 Ảnh hưởng của chất kìm hãm 2 nhóm chính:
–Ức chế không thuận nghịch: enzyme và chất ức chế được liên kết với nhau
bằng liên kết đồng hóa trị và gây nên sự thay đổi cấu hình có hoạt tính của enzyme
–Ức chế thuận nghịch: giữa enzyme và chất ức chế được liên kết với nhau
bằng liên kết thứ yếu nào đó tạo nên thế cân bằng thuận nghịch. Sau khi
chất ức chế bị loại trừ, hoạt tính enzyme lại được hồi phục.
Có ba loại ức chế thuận nghịch phổ biến (kiềm thuận lợi):
1. Chất ức chế cạnh tranh: Chất ức chế có cấu trúc tương tự như chất nền
và có thể liên kết với vị trí hoạt động, ngăn chặn sự chất nền khỏi sự ràng buộc.
Ức chế cạnh tranh (competitive inhibition)
E + S → ES → E + P E + I → EI + S → EI + S (I là chất ức chế cạnh tranh)
Chất ức chế có cấu trúc tương tự như cơ chất gắn ngay vào trung tâm hoạt
động của enzyme, chiếm chỗ cơ chất.
→phụ thuộc vào tỷ lệ [S]/[I]
→ giảm tác động ức chế bằng cách tăng nồng độ cơ chất.
(B) Một cuộc cạnh tranh của chất ức chế liên kết
ở hoạt động site và do đó ngăn ngừa chất nền khỏi sự ràng buộc.
Vmax của enzyme là không thay đổi vì sự ức chế
có thể được khắc phục bằng cách đủ cao nồng độ chất nền.
Tuy nhiên, giá trị biểu kiến của KM được tăng lên
trong sự hiện diện của chất ức chế.
2. Uncompetitive inhibition (ức chế không cạnh tranh trên phức hợp) : Chất ức
chế chỉ liên kết với phức hợp cơ chất enzyme.
- (C) Không có tính cạnh tranh chất ức chế
chỉ liên kết với enzym-cơ chất tổ hợp.
- Trong sự ức chế không cạnh tranh, phức
hợp enzyme-chất ức chế-cơ chất không
tạo thành sản phẩm. Do đó, Vmax thấp
hơn khi có mặt chất ức chế. - KM cũng thấp hơn.
- Sự ức chế phi cạnh tranh không thể được
thực hiện khắc phục bằng cách bổ sung dư thừa chất nền.
3. Noncompetitive inhibition (Ức chế không cạnh tranh trên thụ thể) : Chất ức
chế liên kết với enzyme hoặc phức hợp enzym-cơ chất.
-(D) chất ức chế không ngăn chặn chất nền từ ràng buộc
- Trong sự ức chế không cạnh tranh, chất ức chế
có thể liên kết với enzyme tự do hoặc thành
phức hợp enzym-cơ chất.
-Trong cả hai trường hợp, sự liên kết của chất ức
chế ngăn chặn sự hình thành sản phẩm.
- Vmax thấp hơn khi có mặt chất ức chế không cạnh tranh.
- KM không bị thay đổi bởi sự có mặt của một chất ức chế không cạnh tranh.
- Sự ức chế không cạnh tranh không thể được khắc phục bằng cách tăng chất nền
3.3 Ảnh hưởng của các chất hoạt hóa
• Chất hoạt hóa là những chất có khả năng làm tăng hoạt tính xúc tác của enzyme.
• Chất hoạt hóa có thể là các anion, các ion kim loại nằm ở ô thứ 11 đến ô
thứ 55 của bảng tuần hoàn Mendelev hoặc những chất hữu cơ có cấu tạo
phức tạp hơn làm nhiệm vụ chuyển nhóm, chuyển hydro hoặc những chất có
khả năng phá vỡ một số liên kết trong phân tử tiền enzyme hoặc các chất có
tác dụng phục hồi những nhóm chức của trung tâm hoạt động của enzyme.
• Tuy nhiên, tác dụng hoạt hóa chỉ giới hạn ở những nồng độ xác định, vượt
quá giới hạn này có thể làm giảm hoạt độ của enzyme
3.4 Ảnh hưởng của nhiệt độ
• Enzyme có nhiệt độ tối ưu (optimum temperature)
• Dưới nhiệt độ tối ưu, việc tăng nhiệt độ sẽ làm tăng tốc độ phản ứng → tăng
động năng → tăng số va chạm giữa cơ chất và vị trí hoạt động của enzyme.
• Nhiệt độ trên mức tối ưu sẽ dẫn đến sự biến tính. Nhiều tương tác yếu,
không cộng hóa trị (liên kết hydro, lực van der Waals, v.v.) giữ cấu trúc ba
chiều của enzyme) bị phá vỡ.
→ Phức hợp cơ chất enzyme không còn có thể được hình thành.
• Nhiệt độ mà enzyme bị mất hoàn toàn hoạt tính xúc tác gọi là nhiệt độ tới hạn 70 độ C
• Ở nhiệt độ tới hạn, enzyme bị biến tính, ít khi có khả năng hồi phục lại được hoạt độ
• Ngược lại, ở nhiệt độ dưới 0 độ C, hoạt độ enzyme tuy bị giảm nhưng lại có
thể tăng lên khi đưa về nhiệt độ bình thường
• Độ bền nhiệt của enzyme thường tăng lên khi có cơ chất, coenzyme, Ca2+ …
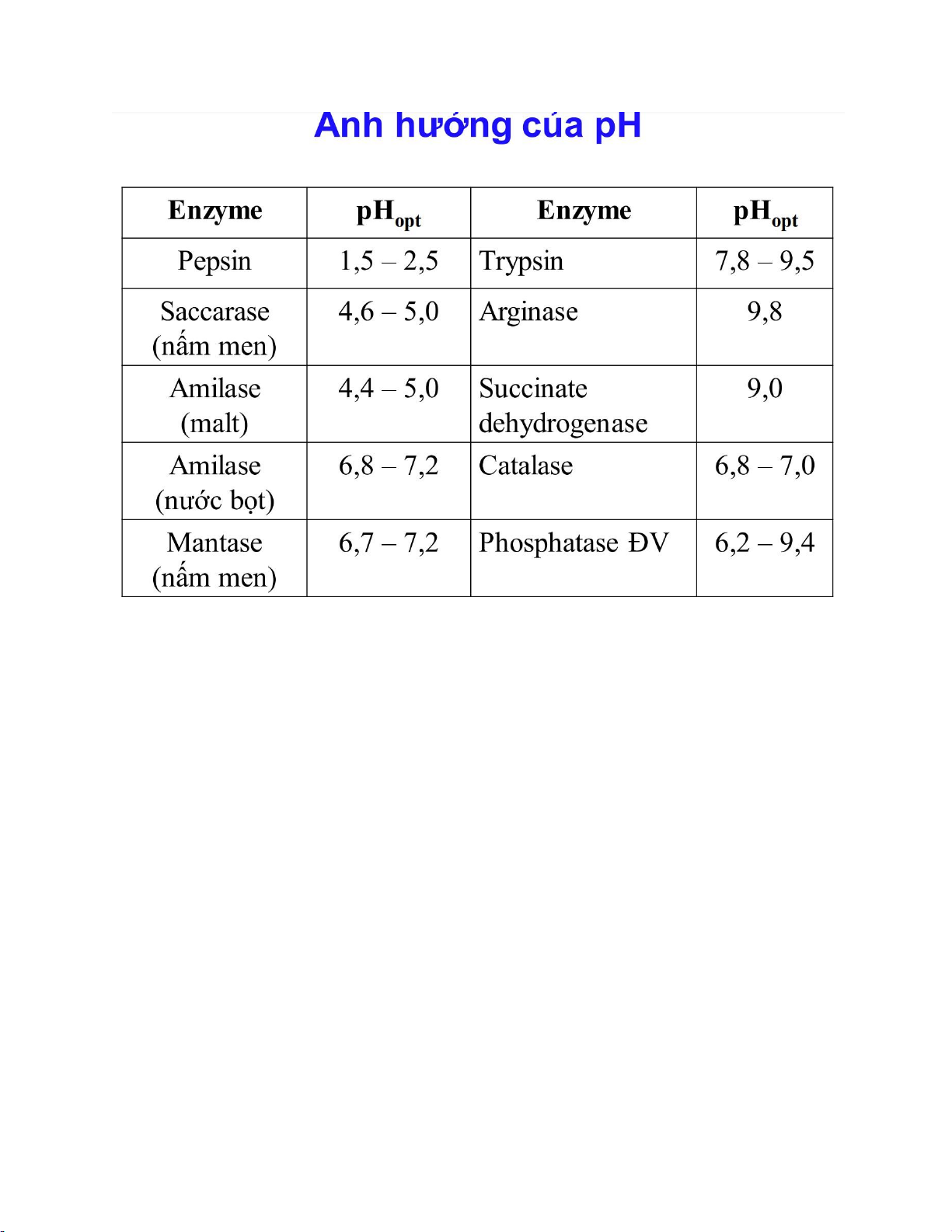
3.5 Ảnh hưởng của pH
• Mỗi enzym có một pH tối ưu (optimum pH).
• Nếu pH tăng hoặc giảm nhiều hơn mức tối ưu này, sự ion hóa của các
nhóm tại vị trí hoạt động và trên cơ chất có thể thay đổi, làm chậm hoặc
ngăn chặn sự hình thành phức hợp cơ chất enzyme một cách hiệu quả.
• Sự thay đổi nhỏ của pH so với giá trị tối ưu dẫn đến hoạt động giảm do
thay đổi độ ion hóa của các nhóm tại vị trí hoạt động của enzyme.
• Sự thay đổi lớn về pH dẫn đến sự biến tính của enzyme. Các liên kết duy trì
cấu trúc bậc ba (do đó là vị trí hoạt động) bị phá vỡ.
IV Ứng dụng của enzyme trong thực phẩm
- Pectinase thường được dùng trong sản xuất rượu vang, nước quả và nước uống không có rượu.
Ví dụ: pectinase tác dụng giúp nước quả trong suốt, dễ lọc, từ đó làm tăng hiệu suất.
- Lipase được dùng làm tăng hương trong sản xuất pho mát.
- Glucose isomerase thường được sử dụng trong sản xuất dịch syrup glucose
- fructose có hàm lượng fructose cao từ tinh bột bắp.
- Hemicellulase được sử dụng trong công nghiệp sản xuất bánh, sản xuất
cồn, sản xuất rượu vang, sản xuất nước giải khát từ quả.
- Amylase được sử dụng trong chế biến thức ăn gia súc: Enzyme amylase tác
động giúp phân giải tinh bột tạo thành đường → chuyển hóa tinh bột tốt hơn