
















Preview text:
ĐUỔI HÌNH BẮT CHỮ (gồm 11 chữ cái) Thuận nghịch ĐUỔI HÌNH BẮT CHỮ (gồm 8 chữ cái) Một chiều ĐUỔI HÌNH BẮT CHỮ (gồm 8 chữ cái) Thạch nhũ ĐUỔI HÌNH BẮT CHỮ (gồm 13 chữ cái) Cân bằng hóa học
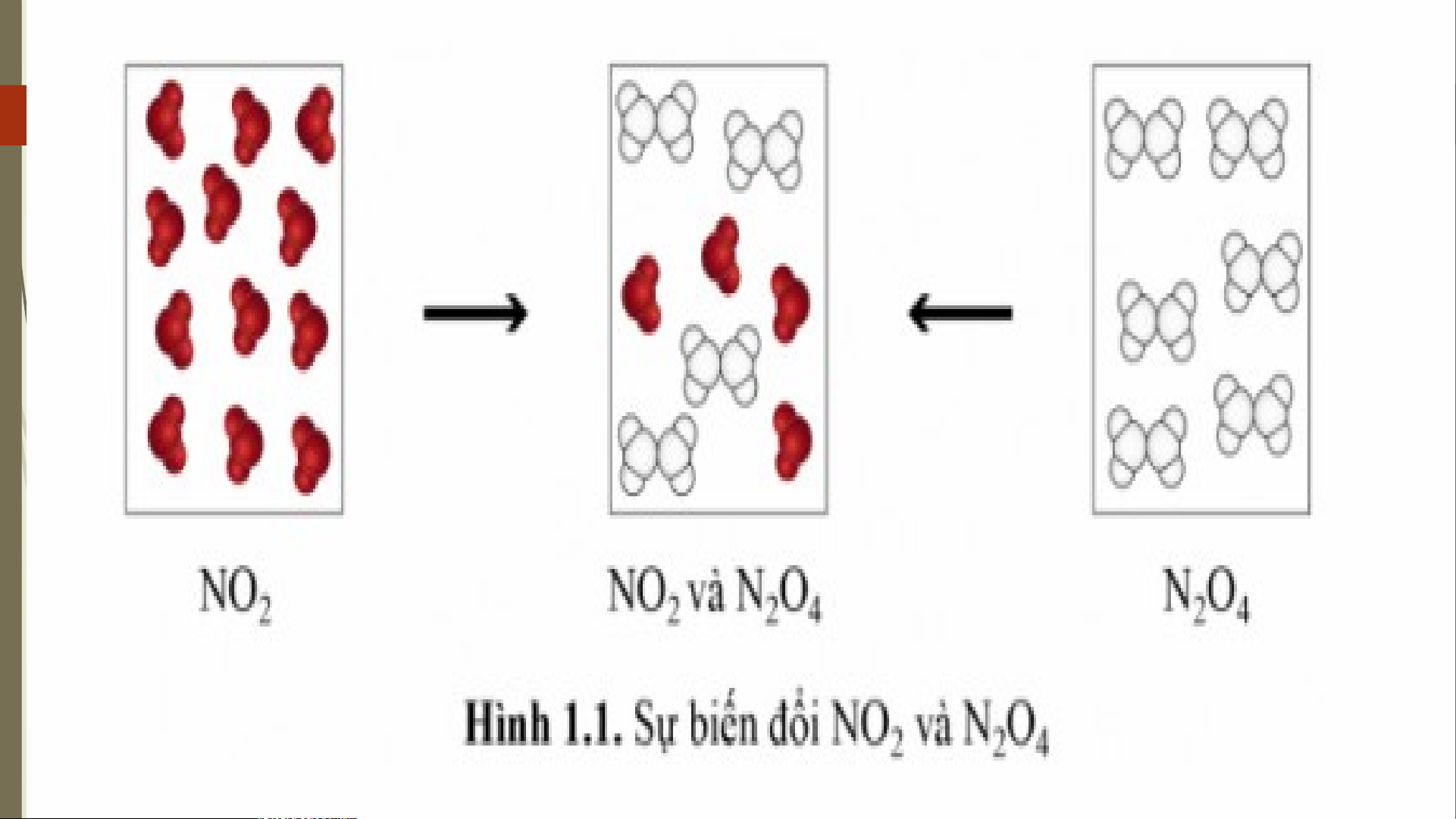
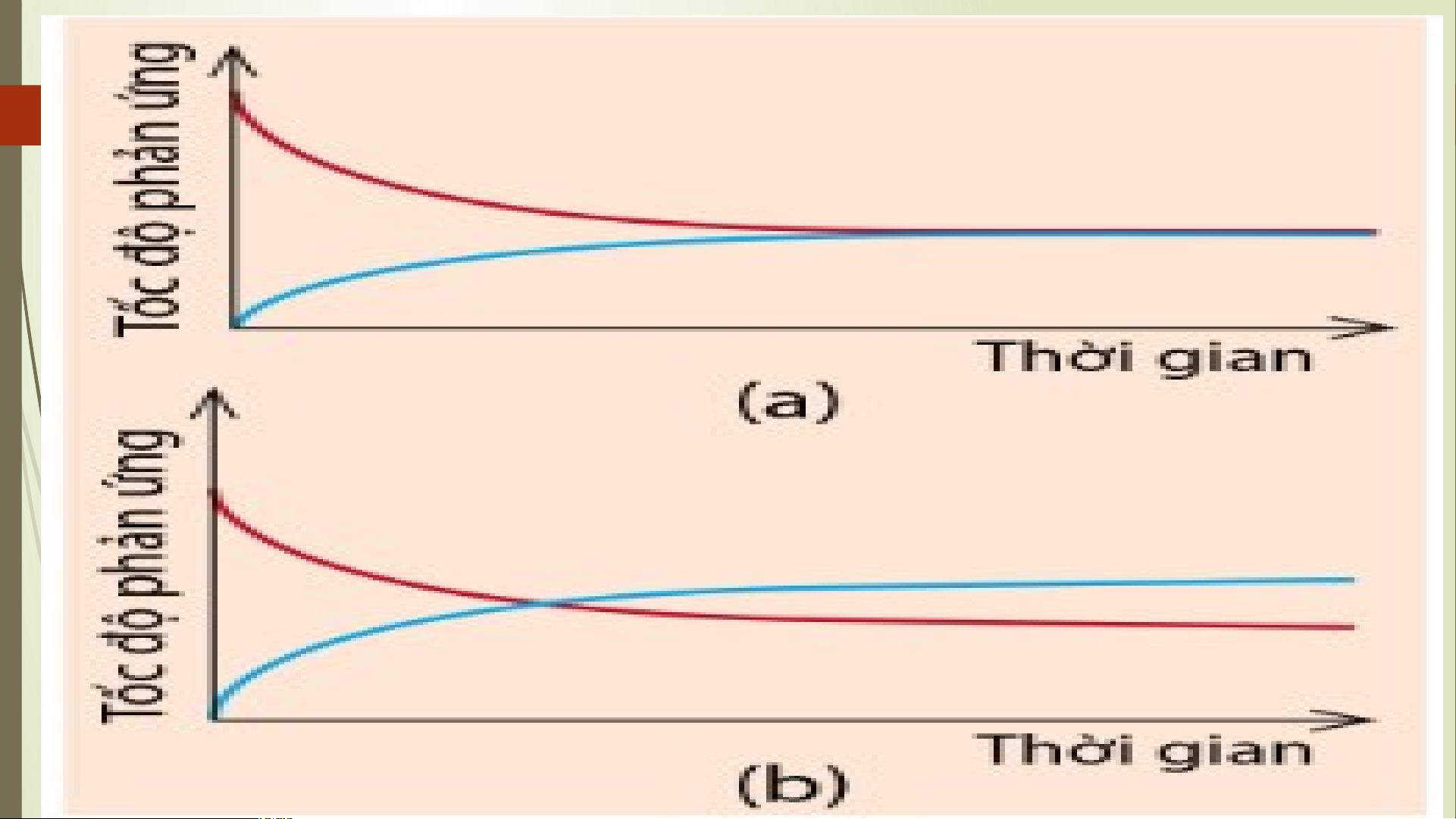
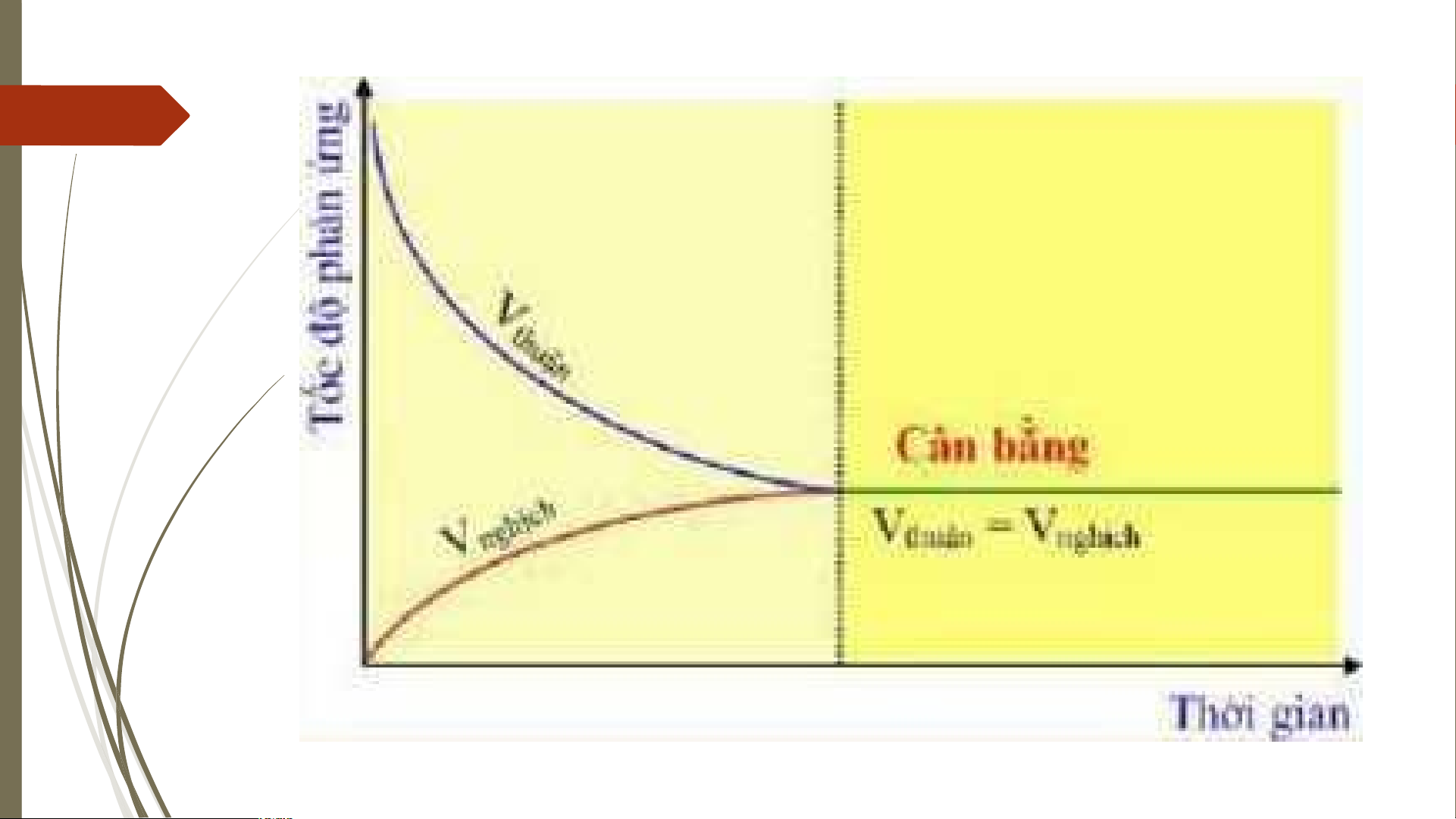
0 KHÁI NIỆM PHẢN ỨNG THUẬN NGHỊCH VÀ
1 TRẠNG THÁI CÂN BẰNG
02 BIỂU THỨC HẰNG SỐ CÂN BẰNG VÀ Ý NGHĨA
0 ẢNH HƯỞNG CỦA NHIỆT ĐỘ, NỒNG ĐỘ, ÁP SUẤT
3 TỚI CÂN BẰNG HÓA HỌC
PHIẾU BÀI TẬP SỐ 1
Hoàn thành các phương trình hóa học sau và điền thông tin vào chỗ trống: 1. H + Cl 2 2 2. N + H 2 2 3. H + I 2 2 4. Mg + Cl 2
Trong các phản ứng trên, phản ứng ………………… là các phản ứng một
chiều. Phản ứng ………………… là các phản ứng thuận nghịch.
số 1, thời gian là 5 phút. HỘP QU HỘP À B Í ẨN Í 8 9 điểm điểm 1 cái kẹo 9 điểm START
Câu 1:Cân bằng hóa học là một trạng thái 12 3 9
của phản ứng thuận nghịch mà: 6 Hết Giờ
A: Tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
B: Tốc độ phản ứng thuận bằng hai lần tốc độ phản ứng nghịch.
C: Tốc độ phản ứng thuận bằng nửa tốc độ phản ứng nghịch.
D: Tốc độ phản ứng thuận bằng k lần tốc độ phản ứng nghịch. CHÚC MỪNG START
Câu 2: Sự chuyển dịch cân bằng hóa học là sự dịch chuyển từ trạng thái cân bằng 12
này sang trạng thái cân bằng khác do: 3 9 6 Hết Giờ
A: không cần có tác động của các yếu tố từ bên ngoài lên cân bằng.
B: tác động từ các yếu tố bên ngoài lên cân bằng.
C: tác động từ các yếu tố bên trong lên cân bằng.
D: CBHH tác động lên các yếu tố bên ngoài. CHÚC MỪNG START
Câu 3: Cho cân bằng sau: N (g) + O (g) 2NO (g); ∆H > 0. Cặp yếu 2 2 12
tố nào sau đây đều ảnh hưởng đến sự chuyển dịch cân bằng: 3 9 6 Hết Giờ
A: Nhiệt độ và chất xúc tác.
B: Áp suất và nồng độ.
C: Nhiệt độ và nồng độ.
D: Chất xúc tác và nhiệt độ. CHÚC MỪNG START
Câu 4: Cho phản ứng N (g) + 3H (g) 2NH (g). Khi 2 2 3
cân bằng được thiết lập thì [N ] = 0,65M; [H ] = 1,05M; 12 2 2 3 9
[NH ] = 0,3M. Nồng độ ban đầu của H là: 3 2 6 Hết Giờ A: 0,45M CHÚC MỪNG B: 0,95M C:1,05M D: 1,5M
II. BIỂU THỨC HẰNG SỐ CÂN BẰNG VÀ Ý NGHĨA
1. Biểu thức hằng số cân bằng
Phản ứng thuận nghịch: aA+bB mM+nN
Ta có biểu thức hằng số cân bằng:
Lưu ý: + k phụ thuộc vào bản chất của các chất trong cân bằng và nhiệt độ C
+ Nồng độ các chất phải là nồng độ mol ở trạng thái cân bằng
+ Chỉ xét những chất ở thể khí hoặc chất tan trong dung dịch
Viết biểu thức hằng số cân bằng cho phản ứng thuận nghịch sau: a) N + 3H 2NH 2(g( 2(g) 3(g) b) CaCO CaO + CO 3 (s) (s) 2(g)
2. Ý nghĩa của biểu thức hằng số cân bằng
Dựa vào độ lớn của hằng số cân bằng có thể biết được nồng độ của chất
tham gia phản ứng hay chất sản phẩm là chiếm ưu thế, cũng như phản
ứng thuận có xảy ra thuận lợi không
k rất lớn so với 1: PƯ thuận xảy ra thuận lợi, các chất ở TTCB C chủ yếu là sản phẩm
k rất nhỏ so với 1: PƯ thuận xảy ra kém thuận lợi, các chất ở C
TTCB chủ yếu là chất ban đầu
Lưu ý: hằng số cân bằng lớn hay nhỏ chỉ cho biết PƯ thuận diễn
ra thuận lợi hay không thuận lợi mà không cho biết thời gian đạt
đến trạng thái cân bằng là nhanh hay chậm
CẢM ƠN CÁC EM ĐÃ LẮNG NGHE!
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- 03
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20




