























Preview text:
CHÀO MỪNG CÁC EM
ĐẾN VỚI BÀI HỌC MỚI! KHỞI ĐỘNG
Phản ứng hóa học là quá trình biến đổi
các chất đầu thành sản phẩm.
Tuy nhiên, có nhiều phản ứng, các chất
sản phẩm sinh ra lại có thể phản ứng với
nhau tạo thành chất đầu. KHỞI ĐỘNG
Đối với những phản ứng thế
này, làm thế nào để thu được
nhiều sản phẩm hơn và làm
tăng hiệu suất phản ứng ?
CHƯƠNG 1. CÂN BẰNG HÓA HỌC
BÀI 1: KHÁI NIỆM VỀ CÂN BẰNG HÓA HỌC NỘI DUNG BÀI HỌC 02 Cân bằng hóa học Phản ứng một chiều và phản 01 ứng thuận nghịch 03
Các yếu tố ảnh hưởng đến sự chuyển dịch cân bằng hóa học
PHẢN ỨNG MỘT CHIỀU VÀ
01 PHẢN ỨNG THUẬN NGHỊCH
1. Phản ứng một chiều
Hình ảnh phản ứng đốt cháy kh
khí methane hoặc đốt cháy than.
Đặc điểm của phản ứng (1):
Các chất sản phẩm không
phản ứng được với nhau để
tạo thành các chất đầu. CH + 2O CO + 2H O (1)
Phản ứng một chiều 4 2 2 2 Ghi nhớ
Phản ứng một chiều là Các chất sản phẩm
phản ứng chỉ xảy ra một không phản ứng lại
chiều từ chất phản ứng được với nhau tạo
tạo thành chất sản phẩm. thành chất đầu. Ghi nhớ
PTHH của phản ứng một chiều được biểu diễn bằng
mũi tên chỉ chiều phản ứng ⟶
Ví dụ : NaOH + HCl NaCl + H O 2
Vậy có phản ứng nào mà các
chất sản phẩm lại phản ứng
được với nhau để tạo thành chất đầu không?
2. Phản ứng thuận nghịch
Xét 2 thí nghiệm cùng thực hiện ở 445oC, trong bình kín dung tích 10 lít. Ban đầu Sau phản ứng Thí ín ghiệm ệ 1 m 1 mol khí H 0,2 mol khí H 2 445oC, bình kín 2 1 mol khí I 0,2 mol khí I 2 2 1,6 mol khí HI Ban đầu Sau phản ứng Thí ín ghiệm ệ 2 m 2 mol khí HI 445oC, bình kín 0,2 mol khí H2 0,2 mol khí I2 1,6 mol khí HI
a) Viết phương trình hóa học
của các phản ứng xảy ra trong
Hoạt động mục I.2
thí nghiệm 1 và thí nghiệm 2. SGK trang 6 – 7:
b) Trong cả hai thí nghiệm trên,
dù thời gian phản ứng kéo dài
bao lâu thì các chất đầu đều còn
lại sau phản ứng. Giải thích. a) PTHH:
Thí nghiệm 1: H (g) + I (g) 2HI(g) 2 2
Thí nghiệm 2: 2HI(g) H (g) + I (g) 2 2 b)
Ở thí nghiệm 1: khí H tác dụng với I tạo thành HI, đồng thời lại xảy 2 2 Trả lời
ra phản ứng HI phân hủy tạo thành I và H nên dù thời gian phản 2 2
ứng kéo dài bao lâu thì sau phản ứng các chất đầu H , I vẫn còn. 2 2
Ở thí nghiệm 2 : khí HI phân hủy tạo thành H và I , đồng thời lại xảy 2 2
ra phản ứng khi H và I tạo thành HI nên dù thời gian phản ứng kéo 2 2
dài bao lâu thì sau phản ứng chất đầu HI vẫn còn.
Phản ứng thuận nghịch là phản ứng xảy ra KẾT LUẬN
theo hai chiều ngược nhau trong cùng điều kiện.
PTHH của phản ứng hai chiều được biểu diễn
bằng hai nửa mũi tên ngược chiều nhau .
Chiều từ trái sang phải là chiều phản ứng
thuận, chiều từ phải sang trái là chiều phản ứng nghịch. Ví dụ: 3O 2O 2 3
Trả lời CH1, CH2 mục I.2 SGK trang 7 - 8:
1. Quá trình hình thành hang động, thạch nhũ là một ví dụ điển hình về
phản ứng thuận nghịch trong tự nhiên.
Nước có chứa CO chảy qua đá vôi, bào mòn đá tạo thành Ca(HCO ) 2 3 2
(phản ứng thuận) góp phần hình thành các hang động. Hợp chất
Ca(HCO ) trong nước lại bị phân hủy tạo ra CO và CaCO (phản ứng 3 2 2 3
nghịch), hình thành các thạch nhũ, măng đá, cột đá.
Viết phương trình hóa học của các phản ứng xảy ra trong hai quá trình trên.
CaCO (s) + H O(l) + CO (aq) Ca(HCO ) (aq) 3 2 2 3 2
Hình ảnh một số thạch nhũ, hang động
Hình ảnh một số thạch nhũ, hang động
Trả lời CH1, CH2 mục I.2 SGK trang 7 - 8:
2. Phản ứng xảy ra khi cho khí Cl tác dụng với nước là một phản 2
ứng thuận nghịch. Viết phương trình hóa học của phản ứng, xác
định phản ứng thuận, phản ứng nghịch.
• PTHH của phản ứng: Cl + H O HCl + HClO 2 2
• Phản ứng thuận: Cl + H O HCl + HClO 2 2
• Phản ứng nghịch: HCl + HClO Cl + H O 2 2 TỔNG KẾT Phản ứng một
Phản ứng thuận nghịch chiều Chỉ xảy ra một Chiều phản ứng
Xảy ra theo hai chiều trái ngược nhau. chiều.
• Các chất sản phẩm phản ứng được với Không phản ứng lại
nhau để tạo thành chất đầu.
Các chất sản phẩm được với nhau tạo • Dù chất đầu là chất phản ứng của phản thành chất đầu.
ứng thuận hay nghịch thì cuối cùng đều
thu được các chất giống nhau. TỔNG KẾT
Phản ứng một chiều
Phản ứng thuận nghịch Biểu diễn PTHH Phản ứng Hoàn toàn Không hoàn toàn xảy ra 2Mg + O 2MgO 2 2SO + O 2SO 2 2 3 Ví dụ Na CO + 2HCl 2NaCl 2 3
CH COOH + C H OH CH COOC H + H O 3 2 5 3 2 5 2 + CO + H O 2 2 CÂN BẰNG HÓA HỌC 02
1. Trạng thái cân bằng
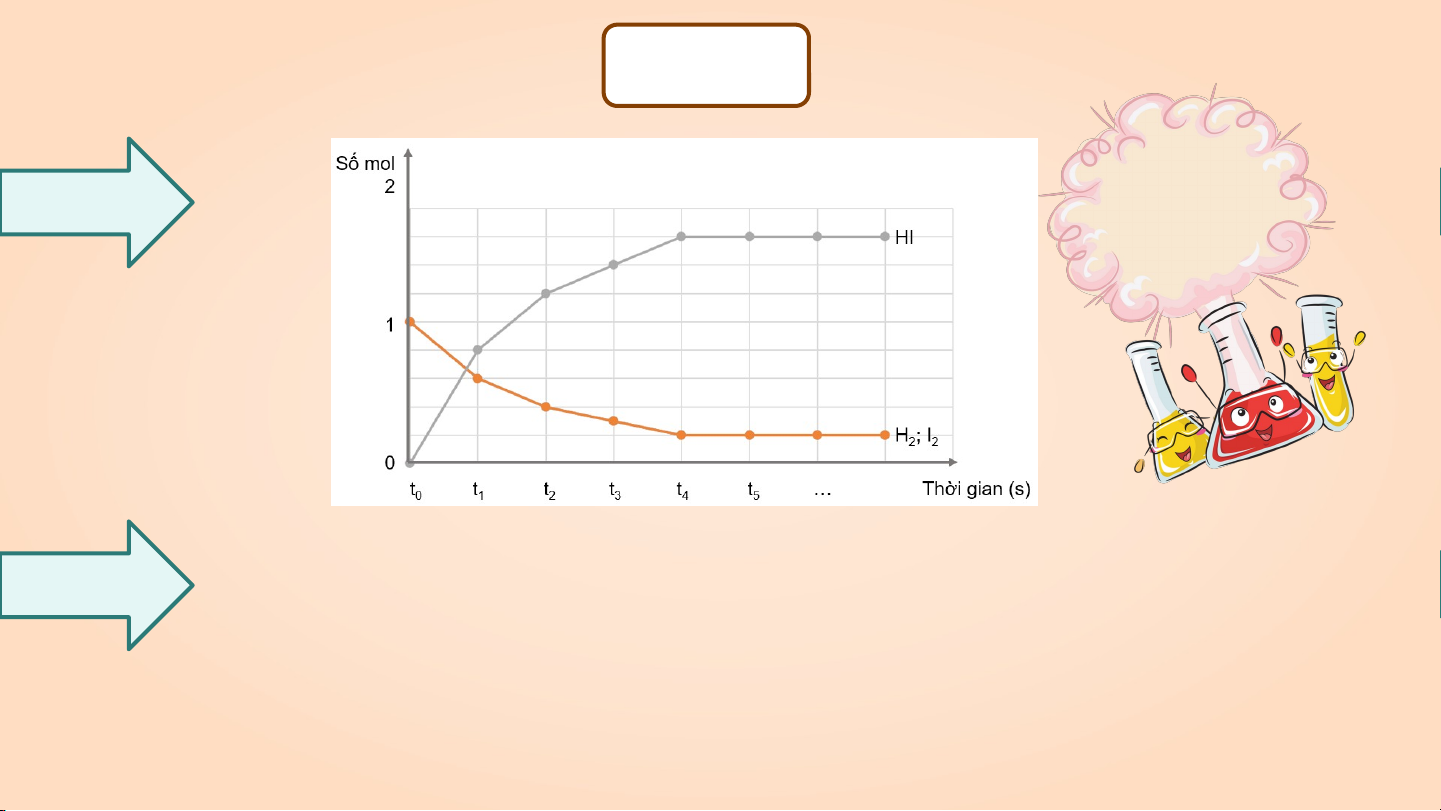
Tìm hiểu về trạng thái cân bằng hóa học thông qua H (g) + I (g) 2HI (g) 2 2 phản ứng:
a) Vẽ đồ thị biểu diễn sự thay đổi số mol các chất Thảo luận nhóm theo thời gian.
b) Từ đồ thị, nhận xét sự thay đổi số mol của các chất theo thời gian.
c) Viết biểu thức định luật tác dụng khối lượng với
phản ứng thuận và phản ứng nghịch, từ đó dự đoán
sự thay đổi tốc độ của mỗi phản ứng theo thời gian
(biết các phản ứng này đều là phản ứng đơn giản).
d) Bắt đầu từ thời điểm nào thì số mol các chất trong
hệ phản ứng thay đổi nữa? Trả lời a)
• Theo thời gian, số mol H và I giảm dần và từ thời điểm t , số 2 2 4 b)
mol của H và I không thay đổi nữa. 2 2
• Theo thời gian, số mol HI tăng dần và từ thời điểm t , số mol HI 4
cũng không thay đổi nữa. Trả lời
Biểu thức định luật tác dụng khối lượng đối với phản ứng thuận: v = k [H ].[I ] t t 2 2 c)
Biểu thức định luật tác dụng khối lượng đối với phản ứng nghịch: v = k [HI]2 n n
Từ hai biểu thức cho thấy:
• Theo thời gian, số mol H , I giảm dần nên [H ] và [I ] giảm, tốc 2 2 2 2
độ phản ứng thuận giảm.
• Theo thời gian, số mol HI tăng dần nên [HI] tăng dần, tốc độ phản ứng nghịch tăng. d)
Từ thời điểm t thì số mol các chất trong hệ phản ứng không thay đổi. 4
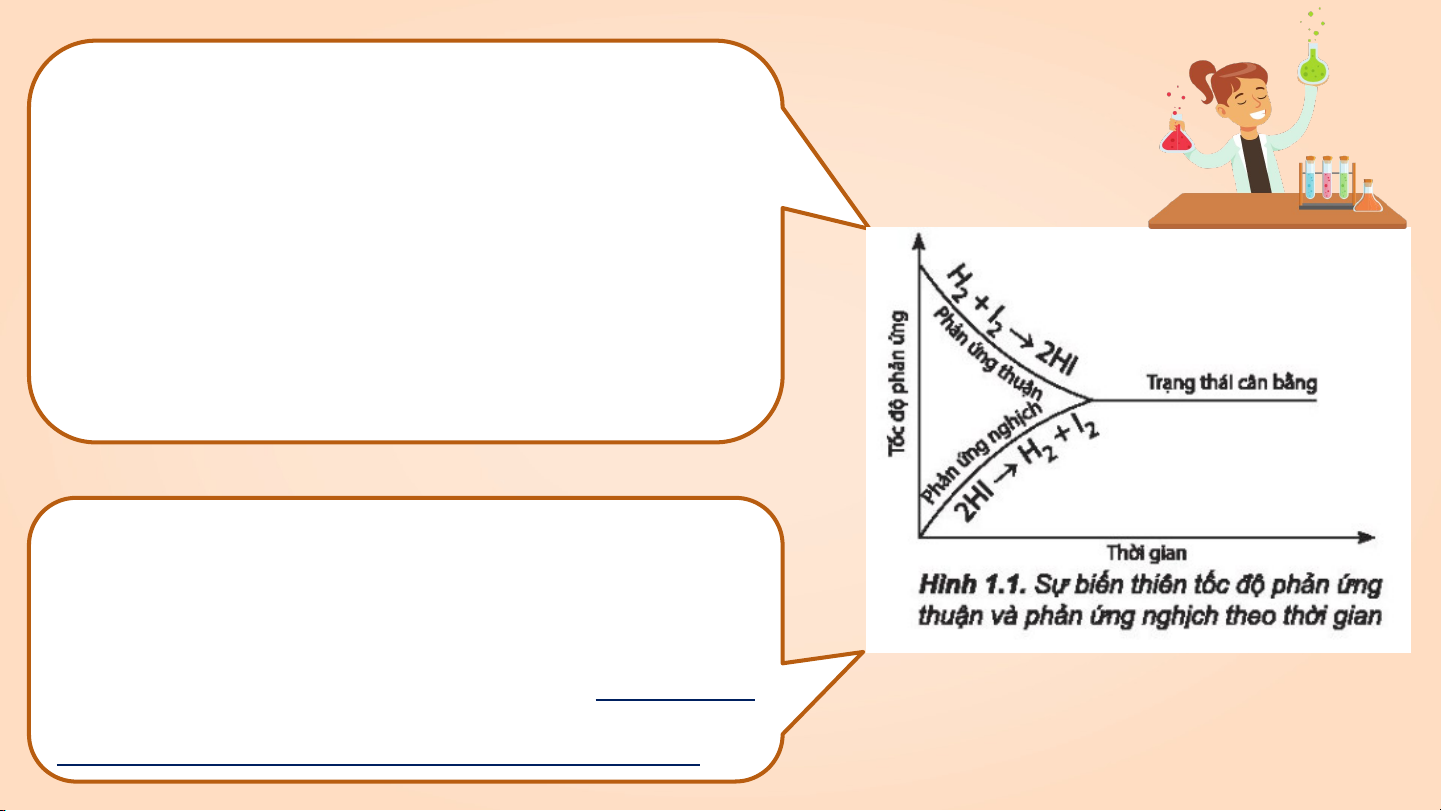
Trong thí nghiệm trên, lúc đầu phản ứng
thuận có tốc độ lớn hơn phản ứng nghịch
và ưu tiên tạo ra hydrogen iodine. Theo
thời gian, tốc độ phản ứng thuận giảm
dần, tốc độ phản ứng nghịch tăng dần đến
khi tốc độ hai phản ứng bằng nhau.
Tại thời điểm này, số mol của các chất
hydrogen, iodine, hydrogen iodine không
thay đổi nữa. Đây là thời điểm phản ứng
thuận nghịch đạt tới trạng thái cân bằng. Nêu khái niệm và Đặc điểm: đặc điểm trạng
• Cân bằng hóa học là một cân thái cân bằng của Khái niệm bằng : độ T
ngrạng thái cân bằng của phản ứng thuận phản • C ứ ác ng c thu hất tận nghị ham gi ch a là phả tr n ạng ứn g/thái sản nghịch. tại đó tốc phẩm li độ ên tphản ục ph ứng ản thuậ ứng v n ới bằng nhau tốc độ để phản tạo t ứn hà g n nh ghị sả ch. n phẩm/chất đầu
nhưng với tốc độ bằng nhau.
Ở trạng thái cân bằng, nồng độ các chất không đổi.
2. Hằng số cân bằng Thảo luận nhóm Thiết lập biểu thức hằng số cân bằng của phản ứng: H (g) + I (g) 2HI(g) 2 2
• Thí nghiệm 1: K = 64,00. C
• Thí nghiệm 2: K = 63, 99; C • Thí nghiệm 3: K = 64,08 C
Nhận xét: giá trị biểu thức K = thay đổi không đáng C
kể mặc dù nồng độ ban đầu và nồng độ các chất tại
thời điểm cân bằng khác nhau.
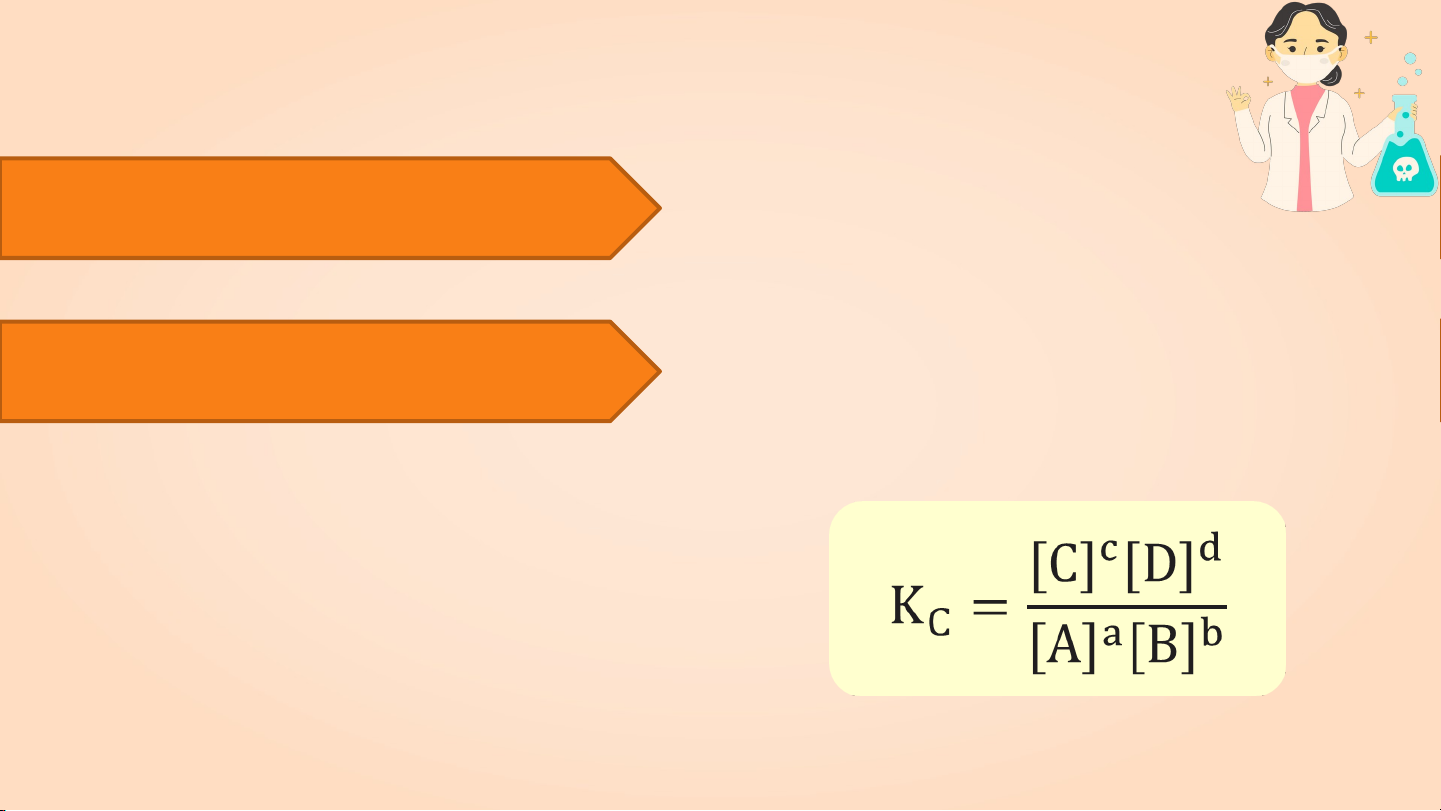
a) Biểu thức của hằng số cân bằng
Phản ứng thuận nghịch tổng quát: Aa + Bb Cc + dD
Hằng số cân bằng (KC) của phản ứng
Ở trạng thái cân bằng
được xác định theo biểu thức: Trong đó:
• [A], [B], [C], [D]: nồng độ mol của các chất
A, B, C, D ở trạng thái cân bằng
• a, b, c, d: hệ số tỉ lượng của các chất trong
phương trình hóa học của phản ứng.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- 01
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- 02
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30




