























Preview text:
Bài 1 CÂN B CÂN ẰNG Ằ HÓA HỌC HÓA Nội dung bài học
PHẢN ỨNG MỘT CHIỀU VÀ PHẢN ỨNG THUẬN NGHỊCH CÂN BẰNG HÓA HỌC
CÁC YẾU TỐ ẢNH HƯỞNG ĐẾN
SỰ CHUYỂN DỊCH CÂN BẰNG HÓA HỌC Phả Ph n ứn ứ g m g ộ m t ch t i ch ều ề v à p hản ả ứn ứ g t g h t uận ậ ng n hị h ch 1.Phản ả ứn ứ g m g ột ộ 2.Phản ứn ản g ứn th t uận ậ chiều i . ều ngh g ịch ịc
Phản ứng một chiều và phản ứng thuận nghịch
Các đặc điểm của phản ứng một chiều và phản ứng thuận nghịch Phản ứng một chiều Phản ứng thuận nghịch A + B C + D A + B C + D
Phản ứng chỉ xảy ra 1 chiều từ chất phản
Trong cùng điều kiện, phản ứng xảy ra đồng
ứng tạo thành chất sản phẩm
thời theo 2 chiều trái ngược nhau: ( thuận 01 02 ( chiều nghịch
Phản ứng xảy ra hoàn toàn, sau phản ứng
Phản ứng xảy ra không hoàn toàn, sau phản
chỉ còn lại các chất C và D
ứng tồn tại đủ các chất A,B,C,D Ví dụ: (trên bảng) Ví dụ: (trên bảng) 03 04 Phả Ph n ứn ứ g m g ộ m t ch t i ch ều ề v à p hản ả ứn ứ g t g h t uận ậ ng n hị h ch 1.Ph 1.P ản ứ ng n mộ m t c hiều h . 2.P . hản h ứn ứ g t g h t uậ u n n n g n h g ịch Là phản Là ph ản ứng ứ ng xảy r x a a theo ha th i chi eo ha ều t i chi rái r • Là ph L ản ứ à ph ng ản ứ ng chỉ xảy ra một ch chiề ch u iề ngư ng ợc nh ư au trong ợc nh au trong cùng cù ng điều đi ều kiện ki CÂN Â BẰ N N BẰ G H N Ó G H A Ó H A Ọ H C Ọ 1. T 1. r T ạn r g th t ái cân ái câ bằn ằ g. 2. 2. Hằn g số cân c bằng ằn CÂN Â BẰ N N BẰ G H N Ó G H A Ó H A Ọ H C Ọ 1. Tr T ạng ạn t g hái c ân ân bằng b .
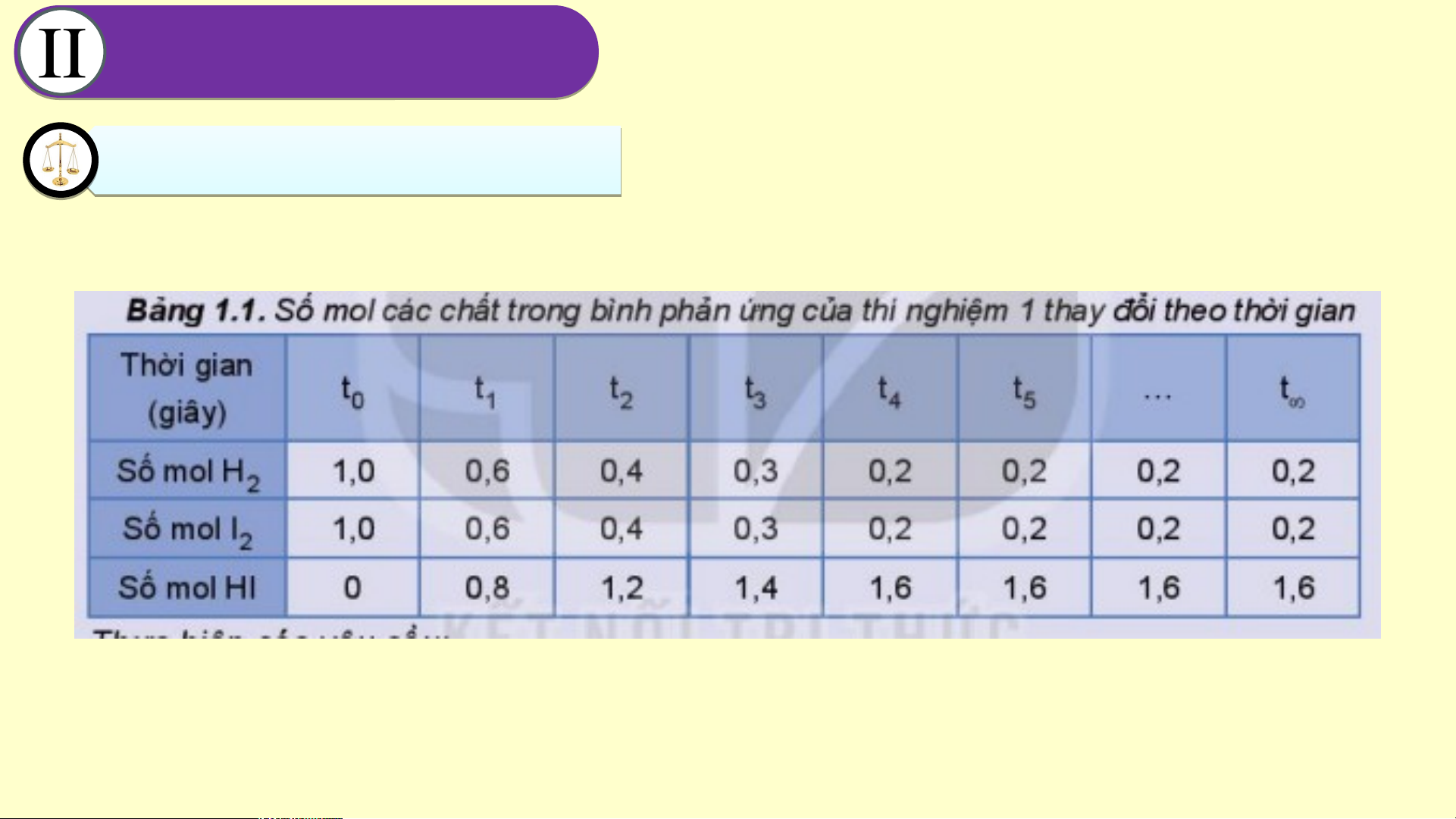
Cho bảng số liệu về phản ứng H (g) + I (g) 2 2
Hãy thực hiện nhiệm vụ 02 đã nêu trong vở ghi bài CÂN Â BẰ N N BẰ G H N Ó G H A Ó H A Ọ H C Ọ 1. Tr T ạng ạn t g hái c ân ân bằng b .
Đáp án nhiệm vụ 2
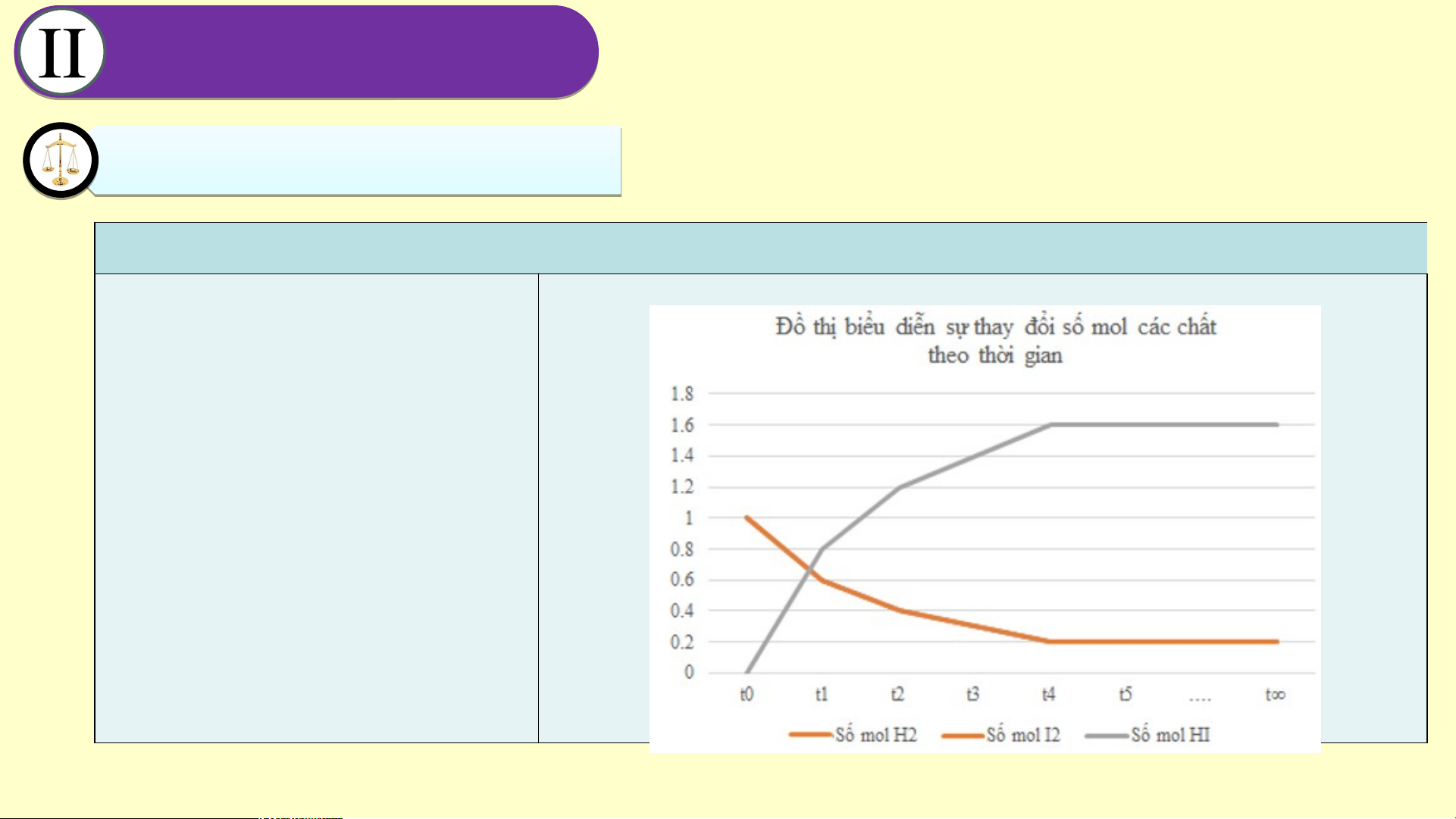
a. Vẽ đồ thị thay đổi số mol các chất theo thời gian. CÂN Â BẰ N N BẰ G H N Ó G H A Ó H A Ọ H C Ọ 1. Tr T ạng ạn t g hái c ân ân bằng b .
Đáp án nhiệm vụ 2
b. Từ đồ thị, nhận xét về b. Từ đồ thị ta thấy: Lúc đầu số mol HI = 0, theo thời
sự thay đổi số mol của
gian, số mol H và I giảm dần, số mol HI tăng dần, đến 2 2 các chất theo thời gian.
khi số mol của H , I , HI không đổi. 2 2
c. Viết biểu thức định luật
tác dụng khối lượng đối
với phản ứng thuận và
phản ứng nghịch, từ đó
dự đoán sự thay đổi tốc
- Ban đầu tốc độ phản ứng thuận giảm dần, sau một thời gian
độ của mỗi phản ứng
tốc độ phản ứng thuận không thay đổi theo thời gian. theo thời gian
- Ban đầu tốc độ phản ứng nghịch tăng dần, sau một thời gian
tốc độ phản ứng nghịch không thay đổi theo thời gian. CÂN Â BẰ N N BẰ G H N Ó G H A Ó H A Ọ H C Ọ 1. Tr T ạng ạn t g hái c ân ân bằng b .
Đáp án nhiệm vụ 2
d. Bắt đầu từ thời điểm
d. Tại thời điểm phản ứng thuận nghịch đạt tới trạng
nào thì số mol các chất
thái cân bằng thì số mol các chất trong hệ phản ứng
trong hệ phản ứng không không thay đổi nữa. thay đổi nữa?
Kết luận: trạng thái cân bằng của phản ứng thuận nghịch là trạng thái
tại đó tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch CÂN Â BẰ N N BẰ G H N Ó G H A Ó H A Ọ H C Ọ 2. H ằng H ằng số số cân bằn b g ằn
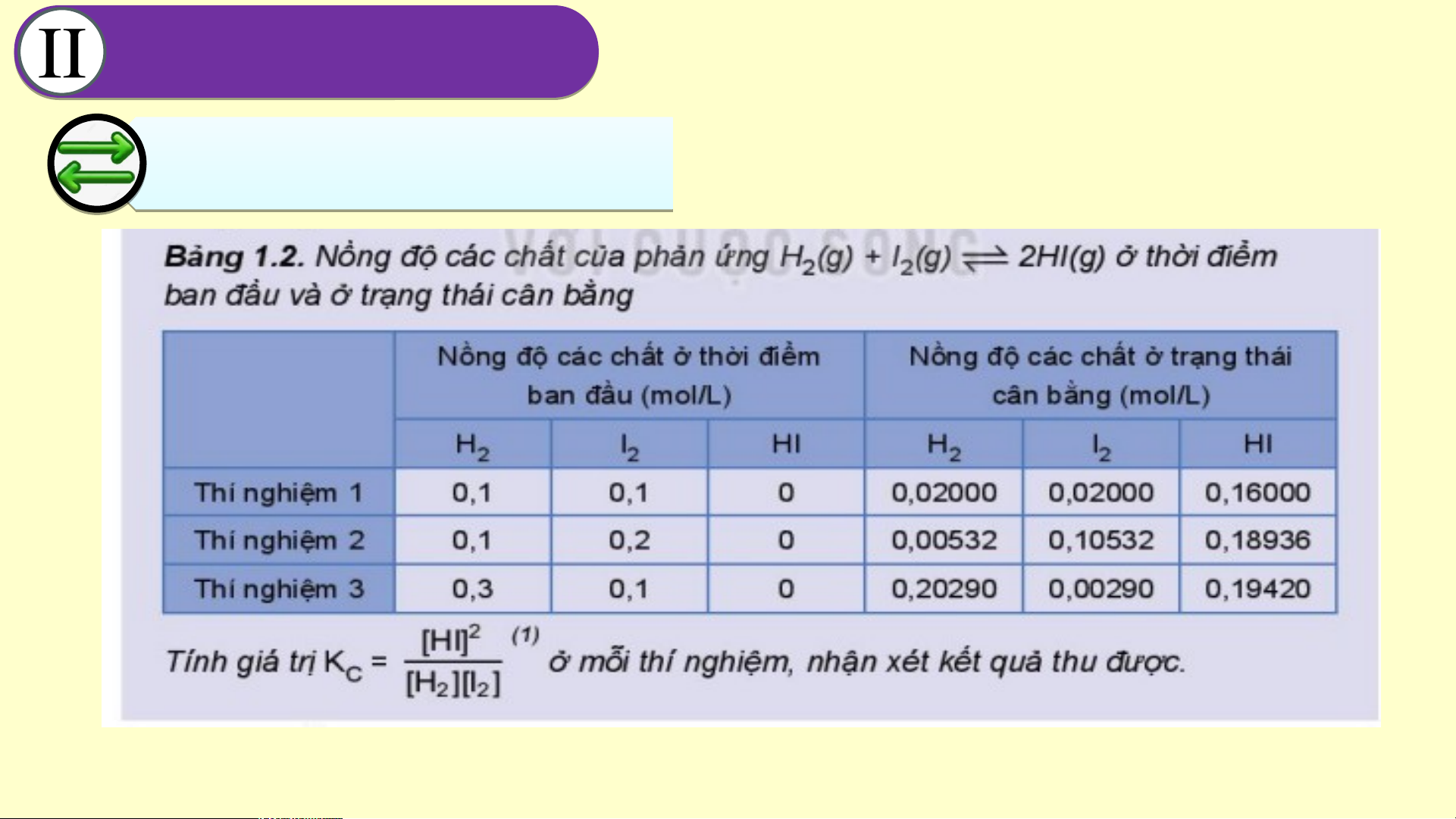
Hãy thực hiện nhiệm vụ 03 đã nêu trong vở ghi bài CÂN Â BẰ N N BẰ G H N Ó G H A Ó H A Ọ H C Ọ 2. H ằng H ằng số số cân bằn b g ằn
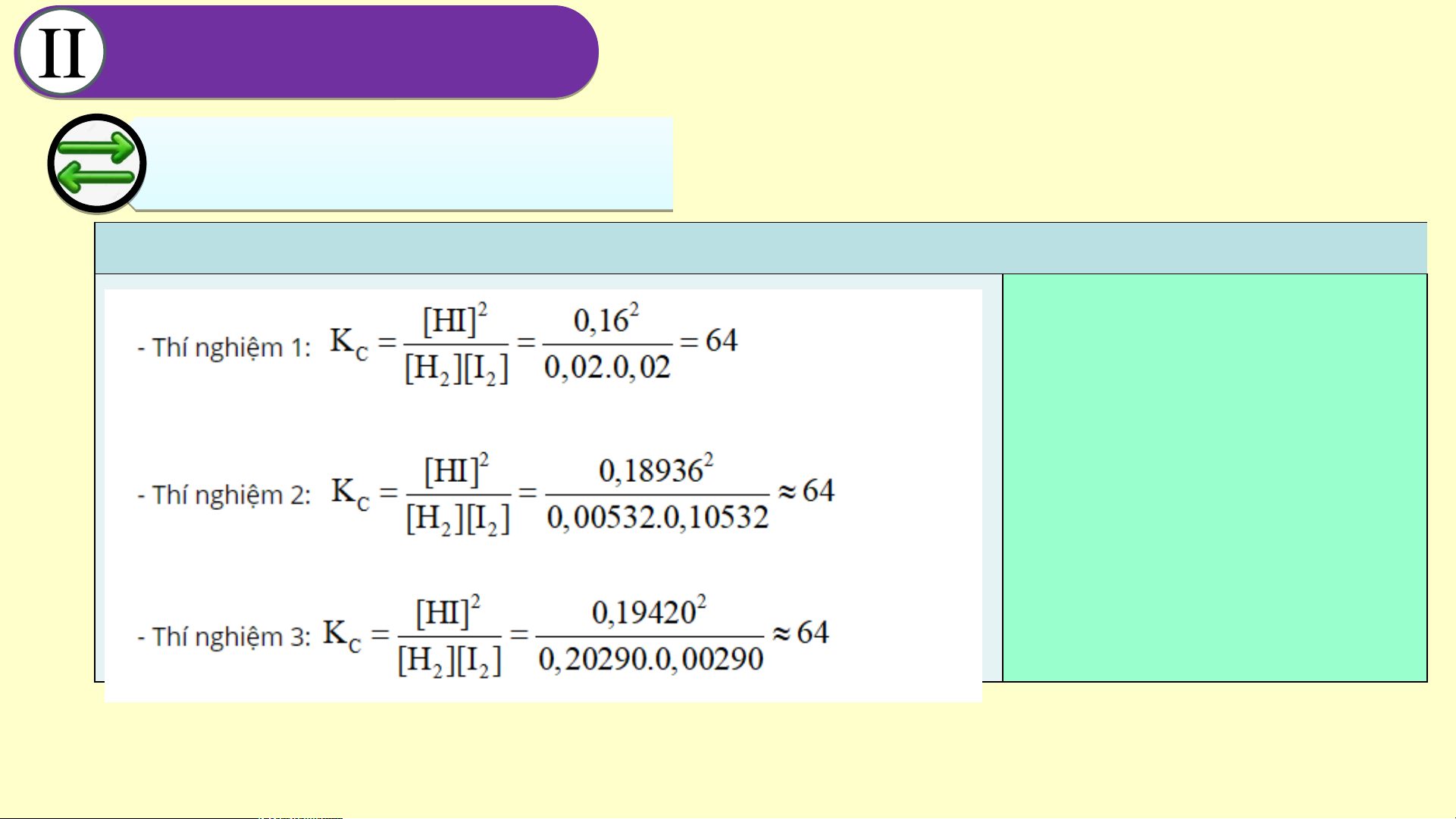
Đáp án nhiệm vụ 3 Nhận xét kết quả:
hằng số cân bằng Kc gần như
không đổi (không phụ thuộc vào nồng độ) CÂN Â BẰ N N BẰ G H N Ó G H A Ó H A Ọ H C Ọ 2. H ằng H ằng số số cân bằn b g ằn KẾT LUẬN
Phản ứng tổng quát: aA + bB + dD
Kc không phụ thuộc vào nồng độ mà phụ thuộc vào nhiệt độ và bản chất của phản ứng
Không biểu diễn nồng độ của chất rắn trong Kc
Kc càng lớn thì phản ứng thuận càng chiếm ưu thế hơn và ngược lại.
Xét hệ cân bằng sau trong một bình kín ở nhiệt độ cao và không đổi: C(r)+CO (k) 2CO(k) 2 KC = [CO]2 [CO ] 2
Ở 8000C, hằng số cân bằng KC không biến đổi và bằng 9,2.10-2.
Nhận xét: khi tăng hoặc giảm nồng độ một chất trong
cân bằng, thì cân bằng bao giờ cũng chuyển dịch theo
chiều làm giảm tác động của việc tăng hoặc giảm nồng độ của chất đó.
1. Ảnh hưởng của nồng độ
Xét một hệ cân bằng sau trong một bình kín ở nhiệt độ cao và không đổi: C + CO 2CO (1) (r) 2(k) (k) • Khi K ở trạn
ạ g thái cân bằng : v = v , nồng độ của các chất không t
n , nồng độ của các chất k t n đổ đ i. • Thê T m CO m
vào hỗn hợp phản ứng ,nồng độ CO tăng làm v > v
2 vào hỗn hợp phản ứng ,nồng độ CO2 tăng làm v > v t n 2 2 t ph p ản ản ứng t ứ ạo ạ n hiều CO u C hơn. O nồng độ C O
nồng độ C giảm, nồng độ CO tăng 2 giảm, nồng độ CO tă 2 v
giảm, v tăng đến một lúc nào đó v = v thì phản ứng đạt đến t
ảm, vn tăng đến một lúc nào đó v = t
v nthì phản ứng đạt đế t n t n trạng t ạ hái câ
c n bằng mới có nồng độ CO c
nhỏ hơn, nồng độ CO lớn hơn 2 , nồng độ CO lớn hơ 2 so s v ới trạng t ạ hái câ c n bằng đầu. Câ n bằ Câ
ng đã chuyển dời theo phản ứng t n ứ huậ hu n
• Tương tự khi lấy bớt CO ra khỏi hỗn hợp: cân bằng
chuyển dời theo chiều thuận.
Thêm CO vào: cân bằng chuyển dời theo chiều nghịch.
Kết luận: Khi tăng hoặc giảm nồng độ của một
chất trong cân bằng thì cân bằng bao giờ cũng
chuyển dịch theo chiều làm giảm tác dụng của
việc tăng hoặc giảm nồng độ của chất đó . Chú ý : C Khi K thêm hê hoặc hoặ bớt lượng c ư hất rắn không ả ắ nh hưởng đến c hưởng đế ân bằng (cân bằng không chuyển dịch) 2.Ảnh hưởng của áp suất Video thí nghiệm
Quan sát hiện tượng thí nghiệm
1.Khi nén(tăng) áp suất màu hỗn hợp khí như thế nào n h?ạ t ..d.(ầ1 n )(tạo N O ) 2 4
2.Khi giảm áp suất màu hỗn hợp khí như thế nào đ ? ậ .m. .(d2 ầ ). n (tạo NO ) 2 Cơ sở lý thuyết
1.Viết về một phương trình vật lý hay hóa học đã biết về mối PV=nR
quan hệ giữa số mol và á T p suất…(3)
2.Từ phương trình trên cho biết mối tương quan (tỷ lệ thuận
hay nghịch ) giữa hai đại lượng số mol và áp t ỉ l s ệ u t ấ hut? ậ . n ...(4)
3. Từ phương trình phản ứng : N O NO 2 4(k) 2(k)
Phản ứng thuận :số molt…(5 ăng ) áp stuăấ n tg…(6).
Phản ứng nghịch:số molg… iả ( m 7) áp su gi ấ ả t…( m 8).
2. Ảnh hưởng của áp suất
• Kết luận: Khi tăng hoặc giảm áp suất chung của
hệ cân bằng thì bao giờ cũng chuyển dịch theo
chiều làm giảm tác dụng của việc tăng hay giảm áp suất đó.
• Chú ý : Nếu phản ứng có số mol khí ở hai vế
bằng nhau hoặc phản ứng không có chất khí thì
áp suất không ảnh hưởng đến cân bằng. Hằng số lí tưởng
1.Cân bằng trong hệ đồng thể
Khái niệm :Hệ đồng thể là hệ không có bề
mặt phân chia trong hệ. Xét hệ cân bằng sau: N O (K) 2NO (K) 2 4 2
(Xét hệ cân bằng ở 25oC)
Hệ cân bằng N O (K) 2NO2 (K) Ở 25OC 2 4 Nồng độ ban đầu,
Nồng độ ở trạng thái Tỉ số nồng mol/l cân bằng, mol/l độ luc cân bằng [N O ]0 [NO ] [N O ] [NO ] [NO ] 2 4 2 O 2 4 2 2 [N O ] 2 4 0,6700 0,0000 0,6430 0,0574 4,65.10-3 0,4460 0,0500 0,4480 0,0457 4,66.10-3 0,5000 0,0300 0,4910 0,0475 4,60.10-3 0,6000 0,0400 0,5940 0,0523 4,60.10-3 0,0000 0,2000 0,0898 0,0204 4,63.10-3
1: CÂN BẰNG TRONG HỆ SỐ ĐỒNG THỂ K [ ( N *) O = ]2 2 C [N O ] 2 4
Hằng số cân bằng Kc của phản ứng
xác định chỉ phụ thuộc vào nhiệt độ.
Phương trình tổng quát: [C]c[D]d [A] a[aA B]b + bB Cc+dD K = c
2.Cân bằng trong hệ dị thể Khái n h iệm ái n :Hệ dị th Hệ d ể là ị th hệ ể là c hệ ó bề ó mặ bề t p mặ hân t p hân chia h tron ia g h tron ệ , g h qu ệ , a bề qu m a bề ặt m này ặt c ó s ó ự thay ự th đổi độ đổ t n i độ gột t n tính gột c tính hất. h
2: Cân bằng trong hệ dị thể • Xét hệ cân bằng : C(r) + CO2 (k) 2CO(k)
Nồng độ của chât rắn được coi là hằng số, nên nó không có mặt trong biểu thức hằng số
cân bằng Kc. Đối với cân bằng trên ta có : Kc = [CO]2 [CO ] 2
Gía trị hằng số cân bằng có ý nghĩa rất lớn, vì nó cho biết lượng chất phản ứng còn lại và
lượng sản phẩm thu được tạo thành ở vị trí cân bằng, do đó biết được hiệu suất của phản ứng. Thhis dụ :
CaCO3 (r) CaO (r) +CO2(k) ; KC=[CO2]
Ở 8200C, KC = 4,28.10-3, do đó [CO ] = 4,28.10-3 mol//l 2
Ở 8800C, KC = 1,06.10-2, nên [CO ] = 1,06.10-2mol/l 2
Vậy ở nhiệt độ cao hơn, khi phản ứng ở trạng thái cân
bằng, lượng CO ( đồng thời lượn 2
CaO) tạo thành theo phản
ứng nhiều hơn nghĩa là ở nhiệt
độ cao hơn hiệu xuât chuyển hóa CaCO thành CaO và CO 3 2 lớn hơn
3. Ảnh hưởng của nhiệt độ • • Đậm lên thuận thu Nhạt đi Nghịch Toả nhiệt thu tăng tỏa giảm
Nêu điểm giống nhau của chiều
chuyển dịch cân bằng khi chịu tác
dụng của nồng độ, áp suất, nhiệt độ.
Từ đó phát biểu nguyên lí chuyển dịch cân bằng?
Nguyên lý chuyển dịch cân bằng (nguyên lí lơ sa –tơ –li-ê ) le chatelier
Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi
chịu một tác động bên ngoài như biến đổi nồng độ, nhiệt độ,
áp suất sẽ chuyển dịch cân bằng theo chiều làm giảm tác động bên ngoài đó.
4. Vai trò của chất xúc tác:
• Chất xúc tác làm tăng tốc độ phản ứng thuận và tốc
độ phản ứng nghịch với số lần bằng nhau nên không
làm ảnh hưởng đến cân bằng hóa học.
• Chất xúc tác làm cho phản ứng nhanh đạt đến trạng thái cân bằng.
IV. Ý nghĩa của tốc độ phản ứng và cân
bằng hóa học trong sản xuất hóa học:
VD1: Xét quá trình sản xuất axit sunfuric có phản ứng:
2SO2(k) + O2(k) 2SO3(k) , ΔH= -198kJ< 0
Ở nhiệt độ thường phản ứng này thường xảy ra rất chậm.
Làm thế nào để cân bằng phản ứng
chuyển dịch theo chiều thuận thu được nhiều SO ? 3
2SO2(k) + O2(k) 2SO3(k) , ΔH= -198kJ< 0
Để tăng tốc độ của phản ứng thì: - Tăng nhiệt độ. - Dùng chất xúc tác.
Nhưng đây là phản ứng tỏa nhiệt nên khi tăng nhiệt độ, cân bằng
chuyển dịch theo chiều nghịch làm giảm hiệu suất của phản ứng.
Để hạn chế tác dụng này thì người ta đã dùng một lượng dư oxi,
nghĩa là tăng nồng độ oxi nên sẽ làm cho cân bằng chuyển dịch theo chiều thuận.
VD2: Xét quá trình tổng hợp amoniac: N + 3H 2NH 2(k) 2(k) 3(k) ΔH =-92kJ
Ở nhiệt độ thường phản ứng này thường xảy ra rất chậm.
Làm thế nào để cân bằng phản ứng chuyển
dịch theo chiều thuận thu được nhiều NH ? 3
N2(k) + 3H2(k) 2NH3(k) ΔH =-92kJ
Để tăng tốc độ của phản ứng thì phải thực hiện: - Ở nhiệt độ cao. - Ở áp suất cao. - Dùng chất xúc tác.
Ở áp suất cao, cân bằng sẽ chuyển dịch sang phía tạo ra NH3,
nhưng ở nhiệt độ cao cân bằng chuyển dịch theo chiều ngược lại,
nên chỉ thực hiện phản ứng ở nhiệt độ thích hợp. THE END
Document Outline
- Slide 1
- Nội dung bài học
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- 1. Ảnh hưởng của nồng độ
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- 2. Ảnh hưởng của áp suất
- Hằng số lí tưởng
- Hệ cân bằng N2O4 (K) 2NO2 (K) Ở 25OC
- 1: CÂN BẰNG TRONG HỆ SỐ ĐỒNG THỂ
- Slide 26
- 2: Cân bằng trong hệ dị thể
- Slide 28
- Slide 29
- 3. Ảnh hưởng của nhiệt độ
- Slide 31
- Slide 32
- Slide 33
- 4. Vai trò của chất xúc tác:
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39




