








Preview text:
LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 1 1
Chương 1: CÂN BẰNG HÓA HỌC Bài 1
CÂN BẰNG TRONG DUNG DỊCH NƯỚC I
Sự điện li, chất điện li, chất không điện li II
Thuyết Bronsted – Lowry về acid, base III
Khái niệm pH, chất chỉ thị acid - base IV
Chuẩn độ acid - base V
Ý nghĩa thực tiễn cân bằng trong dung dịch nước của ion Al3+, Fe3+, CO 2- 3 LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 1 1
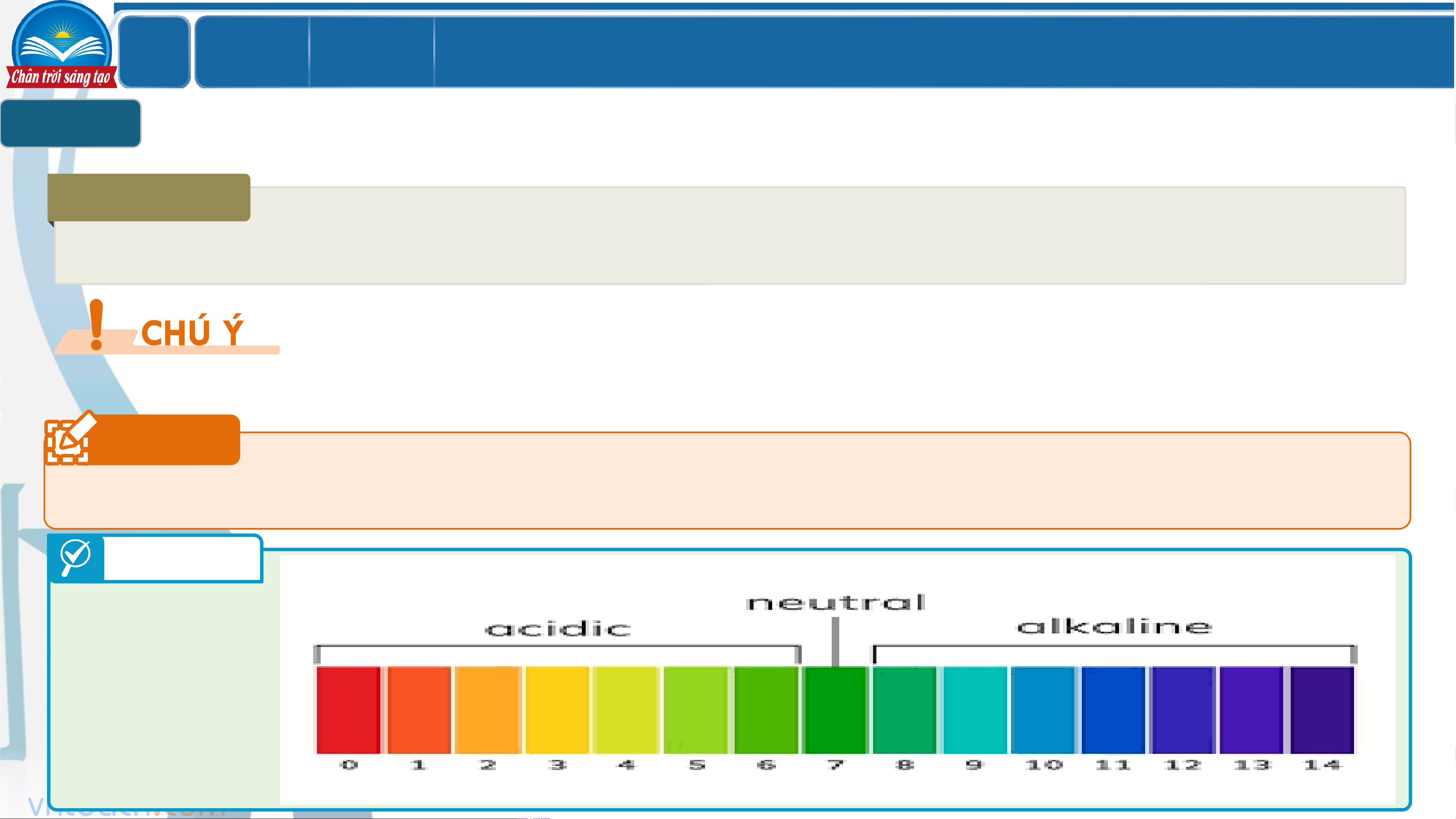
Quan sát hình thang đo pH, cho biết giá trị pH của một số chất
thường gặp trong đời sống. LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 1 1
PHIẾU HỌC TẬP SỐ 1
Câu 1: Giải thích vì sao nước nguyên chất có môi trường trung tính.
Câu 2: Giải thích vì sao khi thêm HCl vào nước nguyên chất thì dung dịch thu được
có [H+] > 10.10-7M; khi thêm NaOH vào nước nguyên chất thì dung dịch thu được có [H+] < 10.10-7M.
Câu 3: Nêu khái niệm của pH, công thức tính pH, giá trị của thang đo pH.
Câu 4: Nêu ý nghĩa của pH trong thực tiễn.
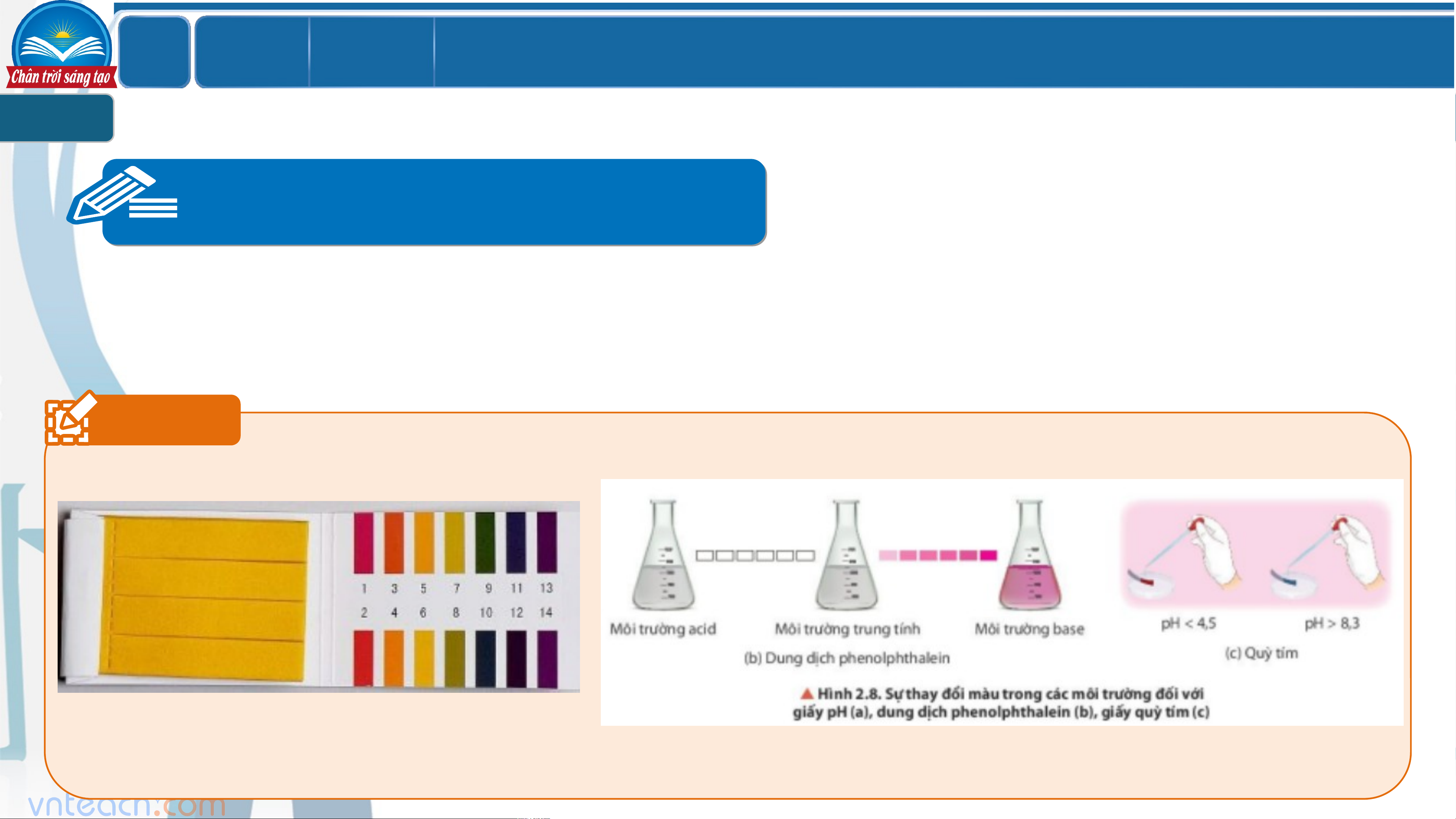
Câu 5: Quan sát hình 2.8, trình bày sự thay đổi màu trong các môi trường đối với
giấy pH (a), dung dịch phenolphtalein (b), giấy quỳ tím (c). Hãy nêu khái niệm chất chỉ thị acid - base.
(a) Giấy chỉ thị pH vạn năng LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 III 1
Khái niệm pH, chất chỉ thị acid - base 1 Khái Câu Câu 1: 2: Giả Giả i i thí thí ch ch v vì ì s saaoo k n hiướ c thê ngu m yê HCl n ch vào ất nư có ớc mô ng i uy trư ên ờ c ng hất niệm trun thì g d tín ungh.
dịch thu được có [H+] > 10.10-7M; khi thêm NaOH
vào nước nguyên chất thì dung dịch thu được có [H+] < 10.10- H 7M O . ⇌ H+ + OH- 2
Ở 250 C, [H+] = [OH-] = 1,0.10-7M
Ở 250 C: K = [H+].[OH-] = 1,0.10-14 (K : tích số ion của W W nước)
Khi thêm HCl, [H+] tăng ⇒ [H+] > [OH-]; [H+] > 1,0.10-7M
Khi thêm NaOH, [OH-] tăng ⇒ [H+] < [OH-]; [H+] < 1,0.10-
7M - Môi trường trung tính: [H+] = [OH-] = 1,0.10-7M
- Môi trường acid: [H+] > 1,0.10-7M
- Môi trường base: [H+] < 1,0.10-7M LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 1 III
Khái niệm pH, chất chỉ thị acid - base 1 Định nghĩa
pH là chỉ số đánh giá độ acid, độ base của một dung dịch.
Công thức: pH = -lg[H+]
Nếu [H+]= aM thì pH = a hay [H+]= 10-pH
Thang đo pH có giá trị `từ 1 đến 14: môi trường acid: pH < 7
môi trường kiềm: pH >7; môi trường trung tính pH = 7 LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 III 1
Khái niệm pH, chất chỉ thị acid - base 1
Ý nghĩa của pH trong thực tiễn
Độ pH là một trong những yếu tố rất quan trọng để đánh giá
các tiêu chí liên quan đến môi trường cũng như sức khỏe của con người. Ví dụ 1
Dịch dạ dày của con người có chứa acid HCl với pH dao động khoảng 1,5-3,5.
Đây là khoảng pH phù hợp để các enzyme tiêu hóa hoạt động hiệu quả. Ngoài
ra, HCl còn làm nhiệm vụ sát khuẩn, tiêu diệt các loại vi khuẩn có trong thức `
ăn. Trong dịch vị dạ dày còn có pepsin, một chất giúp chuyển hóa protein
trong thức ăn thành các chất đạm mà cơ thể có thể hấp thu được. Pepsin hoạt
động tốt nhất ở khoảng pH là 2,0 – 3,0; do vậy điều kiện pH thấp hơn hoặc cao
hơn đều gây ảnh hưởng không tốt đến quá trình chuyển hóa chất đạm bằng pepsin. LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 III 1
Khái niệm pH, chất chỉ thị acid - base 1
Ý nghĩa của pH trong thực tiễn
Độ pH là một trong những yếu tố rất quan trọng để đánh giá
các tiêu chí liên quan đến môi trường cũng như sức khỏe của con người. Ví dụ 2
Mỗi loại cây trồng sẽ phát triển tốt nhất trong một khoảng pH của đất xác
định: cà chua, xà lách cần giá trị pH khoảng 6,0 – 7,0; cải bắp cần giá trị
pH khoảng 6,5 – 7,0; khoai tây cần g `iá trị pH khoảng 5,0 – 6,0; khoai lang
cần giá trị pH khoảng 5,5 – 6,8; … Việc theo dõi và điều chỉnh pH thích hợp
có ý nghĩa quan trọng trong việc nâng cao năng suất cây trồng. LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 III 1
Khái niệm pH, chất chỉ thị acid - base 1
Chất chỉ thị acid - base
Chất chỉ thị acid – base là chất có màu sắc biến đổi theo giá trị pH của dung dịch. Ví dụ 1 ` LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 1
PHIẾU HỌC TẬP SỐ 2 1
Câu 1: Giá trị pH của dung dịch có [H+] = 10-2M là A. 2. B. 12. C. 4. D. 10.
Câu 2: Giá trị pH của dung dịch có [OH-] = 10-4M là A. 2. B. 12. C. 4. D. 10.
Câu 3: Nồng độ H+ của dung dịch có giá trị pH = 2 là A. 2M. B. 0,01M. C. 1,0.10-12M. D. 0,02M.
Câu 4: Nồng độ OH- của dung dịch có giá trị pH = 9,4 là A. 3,98.10-10M. B. 4,0.10-9M. C. 2,51.10-5M. D. 9,0.10-4M.
Câu 5: pH của dung dịch nào sau đây có giá trị nhỏ nhất? A. Dung dịch HCl 0,1M.
B. Dung dịch CH COOH 0,1M. 3
C. Dung dịch NaCl 0,1M.
D. Dung dịch NaOH 0,01M.
Câu 6: Một học sinh làm thí nghiệm xác định độ pH của đất như sau: Lấy một lượng đất cho
vào nước rồi lọc lấy phần dung dịch. Dùng máy pH đo được giá trị pH là 4,52.
a. Hãy cho biết môi trường của dung dịch là acid, base hay trung tính.
b. Loại đất trên được gọi là đất chua. Hãy đề xuất biện pháp để giảm độ chua, tăng độ pH của đất. LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 1 1
Câu 1 Giá trị pH c ủ a dung d ịch c ó [H+] = 10 −2M là A 2 B 12 C 4 D 𝟏𝟎 Lời giải
pH = − lg [ H + ] = − lg (10−2) = 2 LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 1 1
Câu 2 Giá trị pH c ủ a dung d ịch c ó [OH −] = 10−4 M là A 2 B 12 C 4 D 𝟏𝟎 Lời giải [H+].[OH-]=1,0.10-14 ⇒ [H+] = = = 1,0.10-10M LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 1 1
Câu 3 N ồng độ H+ của dung dịch có giá tr ị pH = 2 là A 2M B 0,01M C 1,0.10- D 0,02M 12M Lời giải [H+] = 10-pH ⇒ [H+] = 10-2M = 0,01M LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 1 1
Câu 4 Nồng độ OH− của dung dịch có giá trị pH = 9,4 là A 3,98.10- B 4,0.10-9M. C 2,51.10- D 9,0.10-4M. 10M. 5M. Lời giải
[H+] = 10-pH ⇒ [H+] = 10-9,4M [H+].[OH-]=1,0.10-14
⇒ [OH-] = = = 3,98.10-10M LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 1 Câu1
5 pH c ủa dung d ịch nà o sau đâ y c ó giá trị nh ỏ nhấ t? A Dung dịch HCl B
Dung dịch CH COOH 0,1M. 3 0,1M.
C Dung dịch NaCl 0,1M.
D Dung dịch NaOH 0,01M. Lời giải
[H+] lớn ⇔ giá trị pH nhỏ LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 Câ 1 u 6: 1
Một học sinh làm thí nghiệm xác định độ pH của đất như sau: Lấy một
lượng đất cho vào nước rồi lọc lấy phần dung dịch. Dùng máy pH đo được ` giá trị pH là 4,52.
a. Hãy cho biết môi trường của dung dịch là acid, base hay trung tính.
b. Loại đất trên được gọi là đất chua. Hãy đề xuất biện pháp để giảm độ
chua, tăng độ pH của đất. Bài giải
a. pH = 4,52 < 7 ⇒ Môi trường acid.
b. Loại đất trên được gọi là đất chua. Để giảm độ chua,
tăng độ pH của đất, người ta thường bón vôi. LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 1 IV
Chuẩn độ acid - base 1
PHIẾU HỌC TẬP SỐ 4
Quan sát video thí nghiệm chuẩn độ acid – base:
https://www.youtube.com/watch?v=3F5y3J-zpMY
Câu 1: Nêu dụng cụ và hóa chất cần thiết để tiến thành thí nghiệm.
Câu 2: Nêu các bước tiến hành thí nghiệm. Nhận xét hiện tượng của thí nghiệm.
Câu 3: Nêu 1 số điểm cần lưu ý khi tiến hành thí nghiệm.
Câu 4: Viết phương trình phản ứng và tính nồng độ của dung dịch
NaOH, giả sử khi kết thúc chuẩn độ thể tích dung dịch NaOH đã dùng là 12,5mL.
Câu 5: Trình bày nguyên tắc chuẩn độ acid – base. LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 1 IV
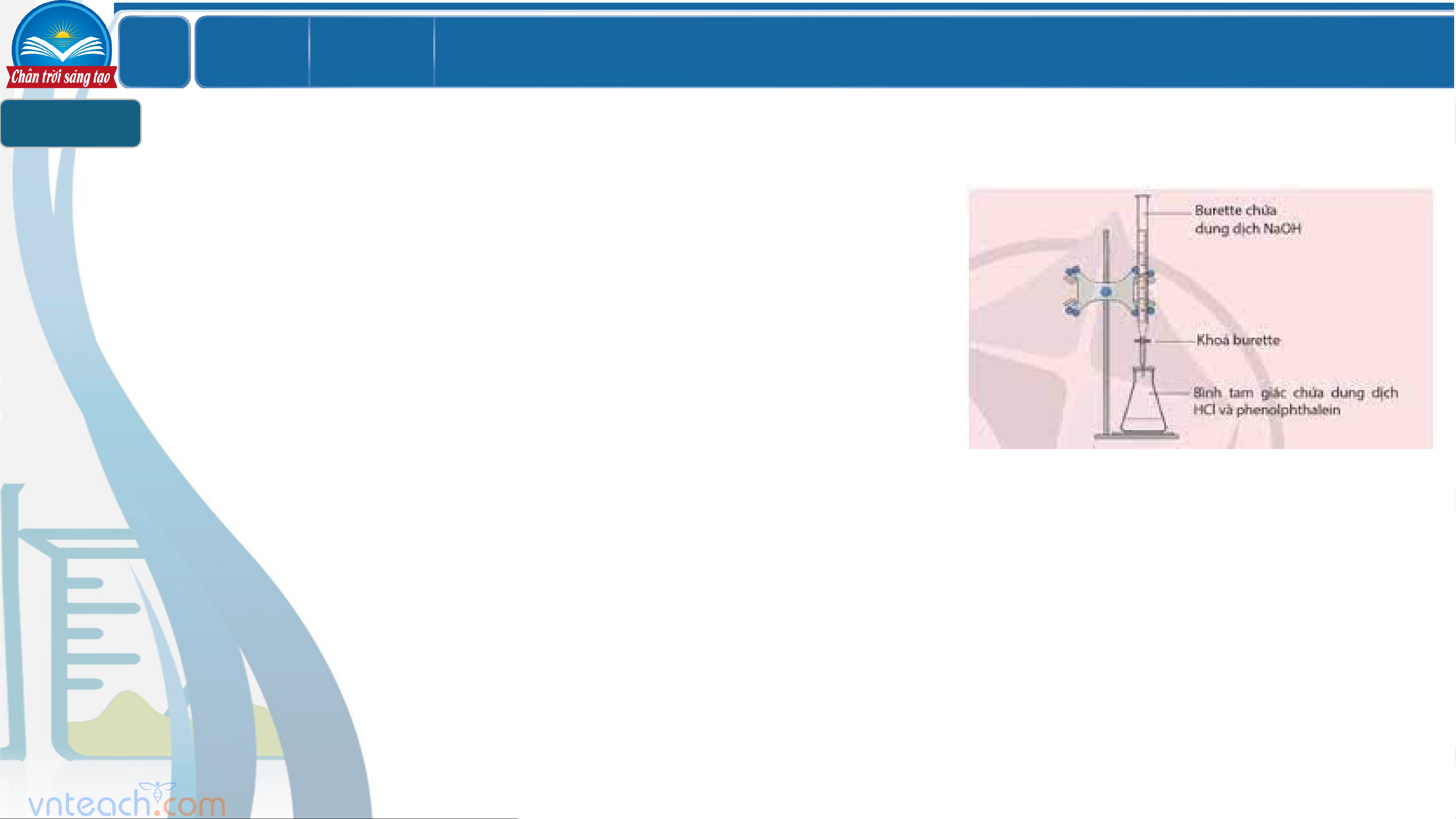
Chuẩn độ acid - base 1 LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 1 IV
Chuẩn độ acid - base 1
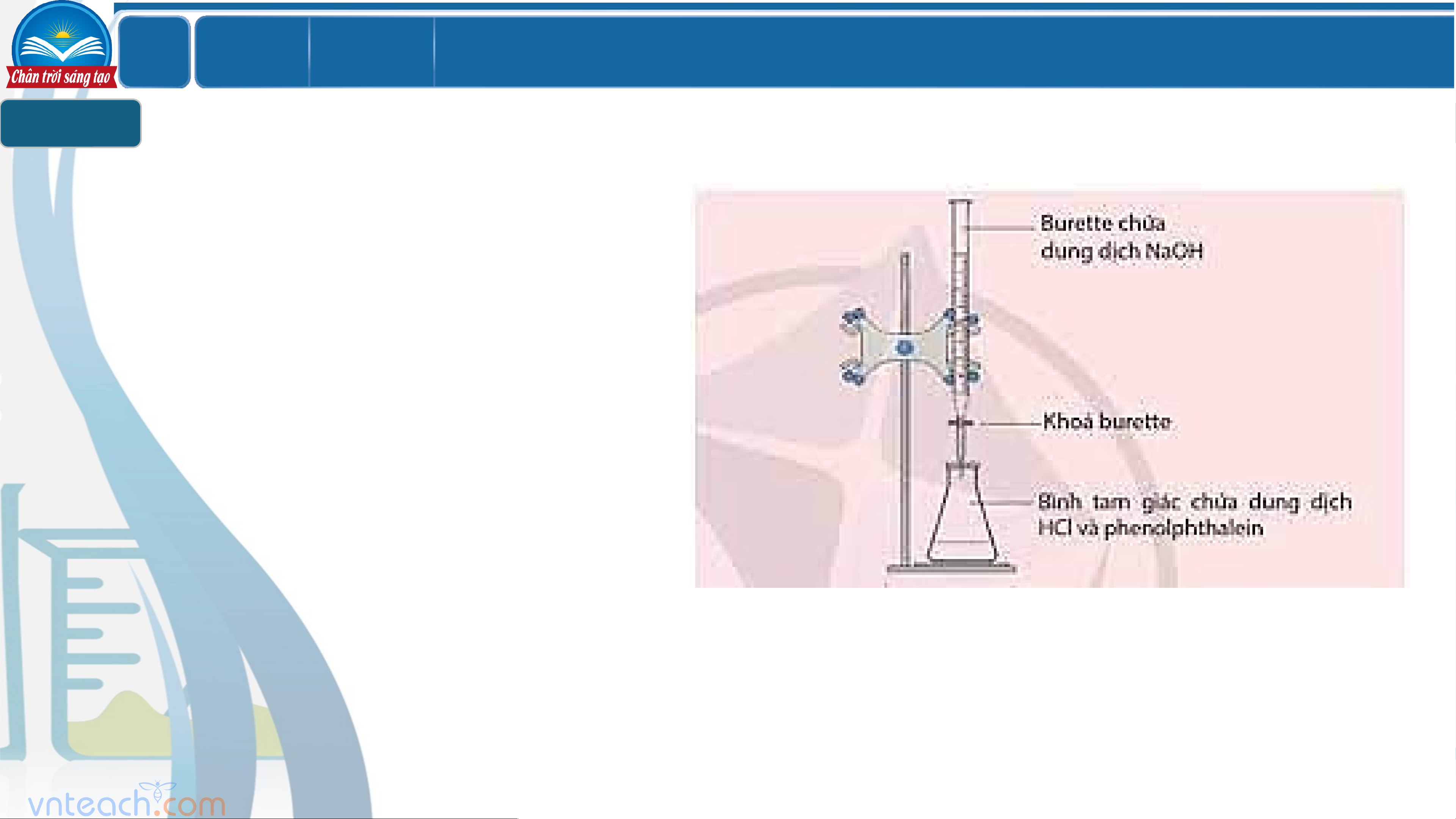
Dụng cụ: Burette, pipette (10ml, 25ml), erlen (bình tam giác), cốc thủy tính, ống hút nhỏ giọt.
Hóa chất: Nước cất, dung dịch NaOH cần xác định nồng độ, dung dung dịch HCl
0,01M, dung dịch phenolphtalein.
Dụng cụ: Burette, pipette (10ml, 25ml), erlen (bình tam giác), cốc thủy tính, ống hút nhỏ giọt.
Hóa chất: Nước cất, dung dịch NaOH cần xác định nồng độ, dung dung dịch HCl
0,01M, dung dịch phenolphtalein.
Dụng cụ: Burette, pipette (10mL, 25mL),
erlen (bình tam giác), cốc thủy tính, ống hút nhỏ giọt.
Hóa chất: Nước cất, dung dịch NaOH cần
xác định nồng độ, dung dung dịch HCl
0,01M, dung dịch phenolphtalein. LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 1 IV
Chuẩn độ acid - base 1
Dụng cụ: Burette, pipette (10ml, 25ml), erlen (bình tam giác), cốc thủy tính, ống hút nhỏ giọt.
Hóa chất: Nước cất, dung dịch NaOH cần xác định nồng độ, dung dung dịch HCl
0,01M, dung dịch phenolphtalein.
Dụng cụ: Burette, pipette (10ml, 25ml), erlen (bình tam giác), cốc thủy tính, ống hút
- Rửa sạch pipet và buret 2 lần: Lần 1 bằng nhỏ giọt.
Hóa chất: Nước cất, dung dịch NaOH cần xác định nồng độ, dung dung dịch HCl
0,01M, dung dịch phenolphtalein.
nước cất, Lần 2: Buret: dung dịch NaOH, pipet: dung dịch HCl 0,01M.
- Đổ đầy buret bằng dung dịch chuẩn NaOH và đưa đến vạch 0.
- Hút 10 ml dung dịch HCl 0,01M vào bình
tam giác, thêm vài giọt dung dịch phenolphtalein.
- Chuẩn độ: cho từ từ từng giọt dung dịch
NaOH xuống bình tam giác, lắc đều đến khi
chất chỉ thị đổi màu thì dừng lại
Ghi lại thể tích NaOH đã dùng.
Hiện tượng: Dung dịch dung dịch ở bình tam giác xuất hiện màu hồng nhạt. LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 1 IV
Chuẩn độ acid - base 1
Nguyên tắc chuẩn độ
Trong phương pháp chuẩn độ acid – base, người ta dùng dung dịch
acid hoặc base (kiềm) đã biết chính xác nồng độ làm dung dịch chuẩn
để xác định nồng độ của dung dịch base hoặc acid chưa biết nồng độ. LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 1 V
Ý nghĩa thực tiễn cân bằng trong dung dịch nước của ion Al3+, Fe3+, 1CO 2- 3
PHIẾU HỌC TẬP SỐ 5 Trong dung dịch nước:
Cho các dung dịch sau: Na CO , AlCl , FeCl Al3+ + 3H O ⇌ Al(OH) + 2 3H 3 + ⇒ 3môi trư 3 ờng acid 2 3
Câu 1: Dùng giấy pH xác định giá trị pH gần đúng của các dung
Fe3+ + 3H O ⇌ Fe(OH) + 3H+ ⇒ môi trường acid 2 3 dịch trên.
CO 2- + H O ⇌ HCO - + OH- ⇒ môi trường kiềm 3 2 3
Câu 2: Nhận xét và giải thích môi trường của các dung dịch trên LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 1 1
Câu 1 Trong chuẩn độ acid – base, ví dụ chuẩn độ HCl bằng dung dịch NaOH, tại điểm kết húc thí nghiệm, giá trị pH thuộc khoảng nào? A pH>7. B pH<7. C pH = 7. D pH = 14. Lời giải
Dung dịch sau chuẩn độ có màu hồng ⇒ môi trường base, pH > 7 LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 1 Câu1
2 Trong mộtphép chuẩn độ, burette chứadung dịchNaOH 0,1M, bình tamgiác hứadung dịchHCl và2 giọt dungdịch phenolphtalein. Chuẩn độ cho dếnkhi dungdịch trongbình tamgiác huyển màunhư thế nào?
A Không màu – hồng. B Hồng – không màu. C Đỏ - Vàng. D Vàng – Đỏ. LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 Câ 1 u 3: 1
Để xác định nồng độ của một dung dịch HCl, người ta tiến hành chuẩn độ
bằng dung dịch NaOH 0,1M. Để chuẩn độ 10 ml dung dịch HCl này cần 20 `
ml dung dịch NaOH. Xác định nồng độ của dung dịch HCl trên. Bài giải C (HCl) = = = 0,2M M LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 Câ 1 u 4: 1
Ở các vùng quê, người dân thường dùng phèn chua để làm trong nước nhờ
ứng dụng của phản ứng thủy phân ion Al3+. Giải thích. Chất hay ion nào là `
acid, là base trong phản ứng thủy phân Al3+? Bài giải
Phèn chua: K SO .Al (SO ) .24H O 2 4 2 4 3 2 Al3+ + 3H O ⇌ Al(OH) + 3H+ 2 3
Al(OH) không tan, dạng keo, kéo theo các chất bẩn lơ lửng trong 3 nước ⇒ nước trong.
Al3+ là acid; H O là base. 2 LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 1 1
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26




