





Preview text:
LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 1 1
Chương 1: CÂN BẰNG HÓA HỌC Bài 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC 0 Khởi động I
Sự điện li. Chất điện li. Chất không điện li II
Thuyết Bronsted – Lowry về acid – base III
Khái niệm pH. Chất chỉ thị acid – base IV
Chuẩn độ acid – base V
Ý nghĩa thực tiễn cân bằng trong dung dịch nước của ion Fe3+, Al3+ và CO 2- 3 LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 0 1KHỞI ĐỘNG 1 Cho các chất sau:
Đường saccharose (C H O , s), NaCl (s), HCl (g), NaOH (s), acetic acid 12 22 11
(CH COOH, l), cồn (C H OH, l), HBr (g), NH (g), NaHCO (s), HNO (l), 3 2 5 3 3 3 Ca(OH) (s), BaCl (s). 2 2
Câu 1: Bằng hiểu biết của mình, hãy liệt kê các chất ở trên thành 2
Nhóm các chất khi tan trong nưnhóm:
ớc Nhóm các chất khi tan trong nước
tạo ra dung dịch có thể dẫn điện
tạo ra dung dịch không dẫn được điện
NaCl (s), HCl (g), NaOH (s), acetic Đường saccharose (C H O , s), 12 22 11
acid (CH COOH, l), HBr (g), NH 3 3 cồn (C H OH, l) 2 5
(g), NaHCO (s), HNO (l), Ca(OH) 3 3 2 (s), BaCl (s). 2 LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 0 1KHỞI ĐỘNG 1 Cho các chất sau:
Đường saccharose (C H O , s), NaCl (s), HCl (g), NaOH (s), acetic acid 12 22 11
(CH COOH, l), cồn (C H OH, l), HBr (g), NH (g), NaHCO (s), HNO (l), 3 2 5 3 3 3 Ca(OH) (s), BaCl (s). 2 2
Câu 2: Liệt kê các chất ở trên thành 4 nhóm: Nhóm không Nhóm các acid Nhóm các base Nhóm các muối phải acid, base, muối. HCl (g), acetic NaOH (s) NaHCO (s), 3 Đường acid (CH COOH, NH (g), 3 3 BaCl (s) 2 saccharose l), Ca(OH)2 (C H O , s), 12 22 11 HBr (g) cồn (C H OH, l) HNO (l), 2 5 3 LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 I 1
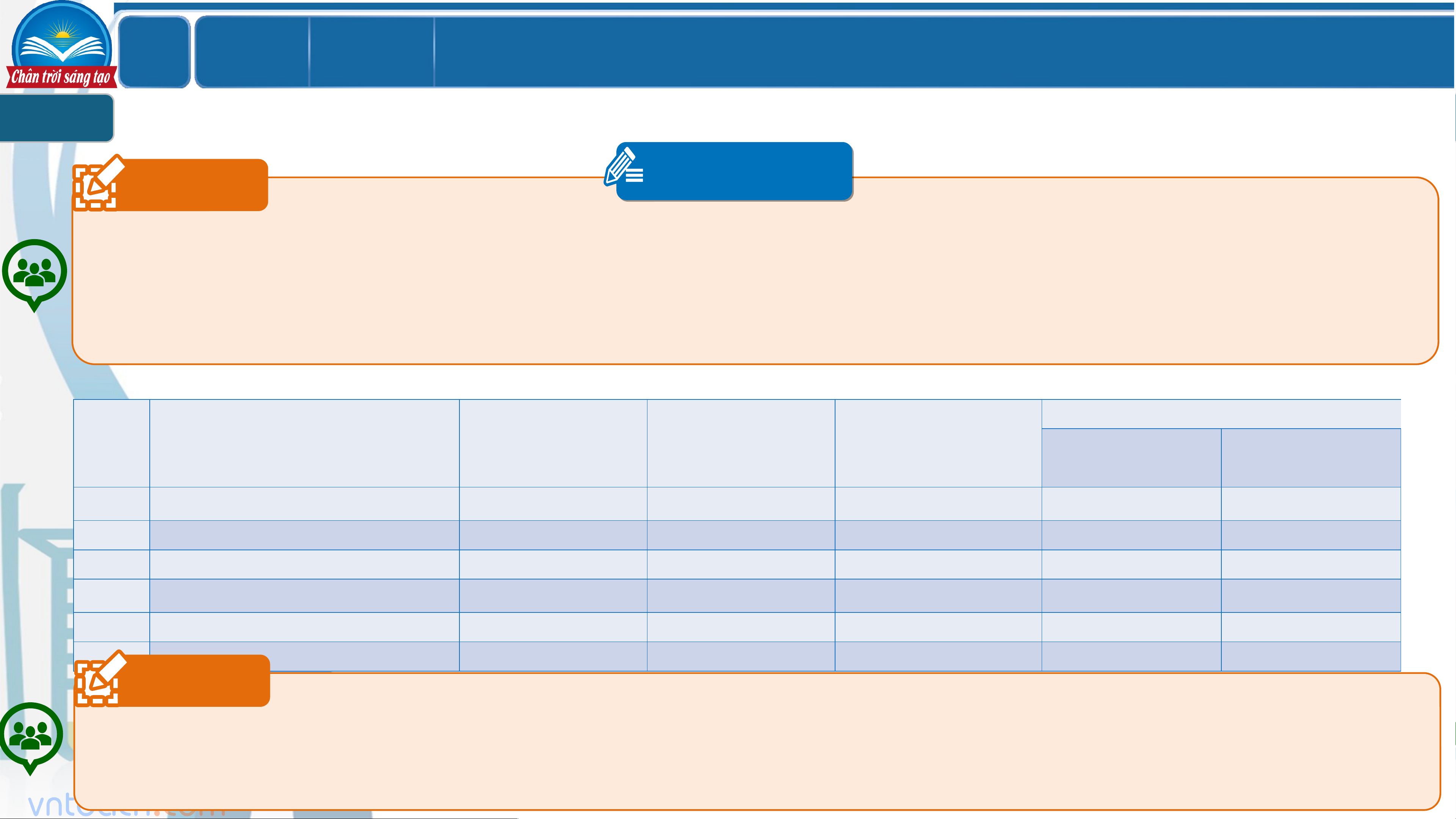
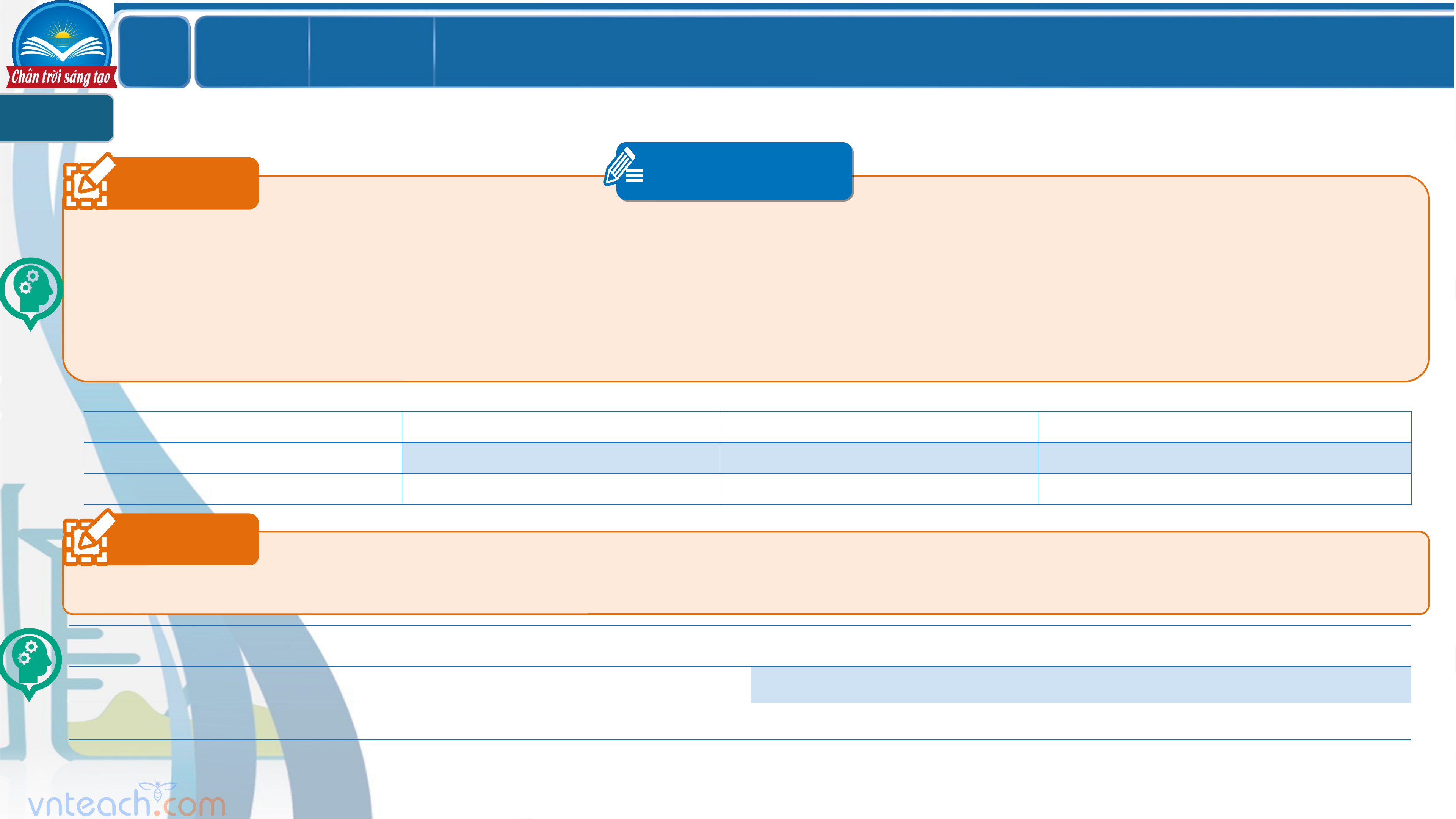
SỰ ĐIỆN LI. CHẤT ĐIỆN LI. CHẤT KHÔNG ĐIỆN LI 1 Câu 1 PHT 1
Tiến hành thí nghiệm thử tính dẫn điện của nước cất và một số dung dịch: saccharose, NaCl, HCl, CH COOH, NaOH (nồng ` 3
độ các dung dịch giống nhau là 0,1M).
a. HS tiến hành dùng dụng cụ thử tính dẫn điện (cầm tay) và tiến hành thử tính dẫn điện với lần lượt từng dung dịch.
b. Ghi lại hiện tượng của từng trường hợp vào phiếu.
Dung dịch dẫn điện? Đèn không STT Dung dịch Đèn sáng mờ Đèn sáng rõ sáng Có Không 1 H O cất 2 2 NaOH 3 HCl 4 CH COOH 3 5 Saccharose 6 NaCl Câu 2
Từ kết quả ở trên, cho biết nguyên nhân tại sao có dung dị `
ch dẫn được điện có dung dịch không dẫn điện? Có dung dịch
dẫn điện yếu, có dung dịch dẫn điện tốt? LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 I 1
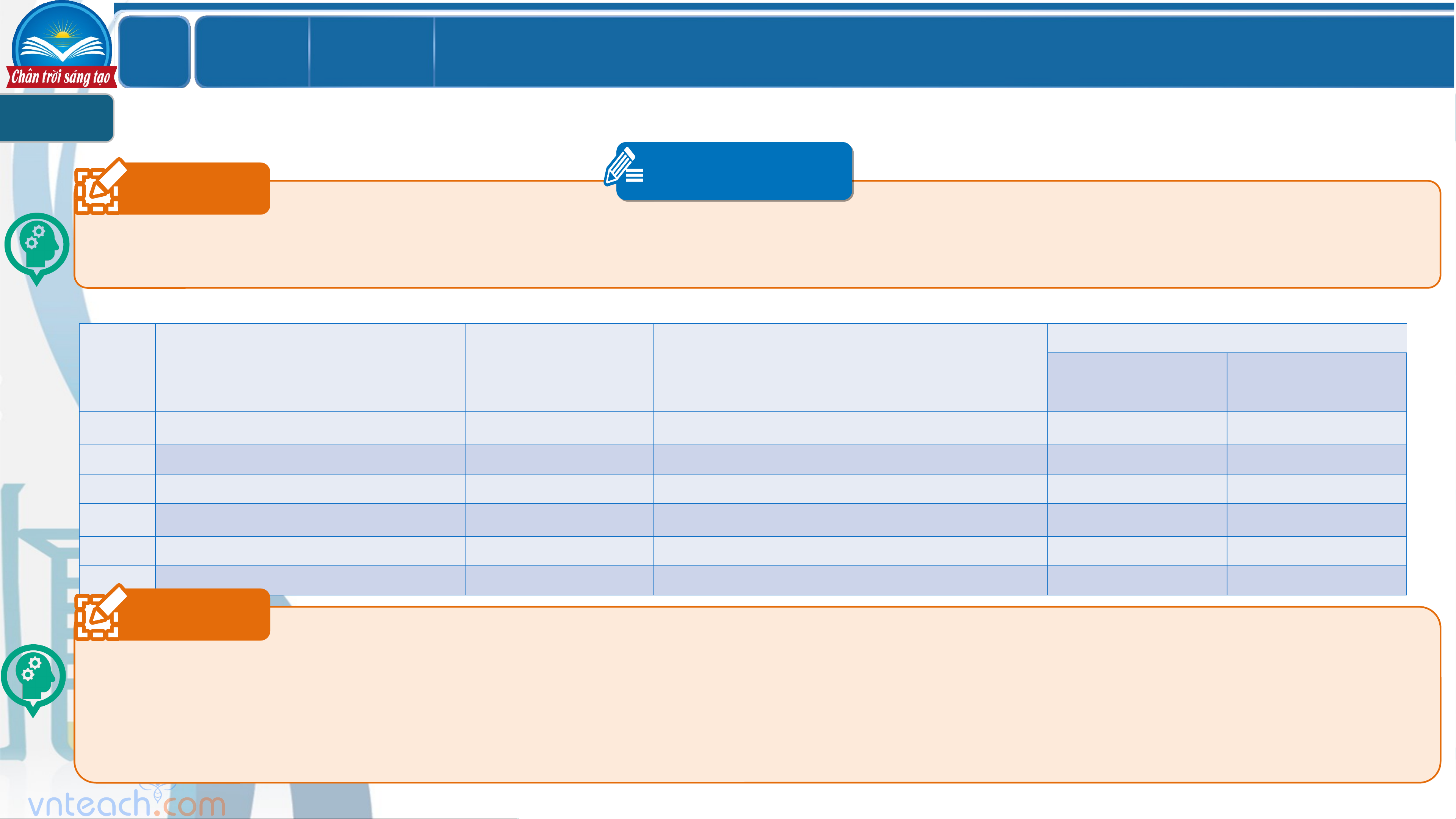
SỰ ĐIỆN LI. CHẤT ĐIỆN LI. CHẤT KHÔNG ĐIỆN LI 1 PHT 1 Câu 1 `
KẾT QUẢ THÍ NGHIỆM
Dung dịch dẫn điện? Đèn không STT Dung dịch Đèn sáng mờ Đèn sáng rõ sáng Có Không 1 H O cất 2 2 NaOH 3 HCl 4 CH COOH 3 5 Saccharose 6 NaCl Câu 2
- Các dung dịch dẫn điện là vì trong dung dịch có các hạt m `ang điện chuyển động tự do. Còn trong các dung dịch không
dẫn điện thì không chứa các hạt mang điện này.
- Các dung dịch dẫn điện tốt vì trong dung dịch số hạt mang điện nhiều hơn trong các dung dịch dẫn điện yếu. LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 I 1
SỰ ĐIỆN LI. CHẤT ĐIỆN LI. CHẤT KHÔNG ĐIỆN LI 1 - Qu Đ á tr ịnh n ình
ghĩ pahân li các chất trong nước tạo thành các ion được gọi là sự điện li.
- Dung dịch của các chất điện li dẫn được điện vì trong dung dịch của chúng có các tiểu
phân mang điện (các ion dương và âm). Các acid – base, muối được gọi là các chất điện li.
- Chất điện li mạnh: là những chất khi tan trong nước, các phân tử hòa tan đều phân
li thành ion. Các chất điện li mạnh gồm: acid mạnh, base mạnh và hầu hết các muối tan.
- Chất điện li yếu: là các chất khi tan trong nước chỉ có một số phân tử hòa tan phân
li thành ion, số phân tử còn lại vẫn tồn tại ở dạng phân tử trong dung dịch.
Chất điện li yếu gồm: acid yếu, base yếu.
- Chất không điện li: là chất khi hòa tan vào trong nước, các phân tử không phân li thành ion. LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 I 1
SỰ ĐIỆN LI. CHẤT ĐIỆN LI. CHẤT KHÔNG ĐIỆN LI 1 Câu 1 PHT 2
Tại sao các chất như NaCl, HCl, NaOH… khi tan trong nước l `
ại phân li thành các ion?
Các ion đơn/đa nguyên tử nào có thể tìm thấy trong công thức phân tử các chất trên? NaCl HCl NaOH Ion dương Ion âm Câu 2
Quá trình NaCl phân li trong nước có thể được mô tả như sau: NaCl (s) + (n+m)H O → Na+.nH O + Cl-.mH O 2 2 2
Để đơn giản, người ta thường viết là: NaCl → Na+ + Cl- (1) `
Phương trình (1) được gọi là phương trình điện li của NaCl.
Hãy dựa vào nội dung trên, viết phương trình điện li của HCl, CH COOH, HNO , Ca(OH) , BaCl . 3 3 2 2 HCl → CH COOH (2) 3 HNO → Ca(OH) → 3 2 BaCl → 2 Câu 3
Khi viết phương trình điện li cần chú ý điều gì (những yếu t `
ố nào được bảo toàn, mức độ phân li mạnh hay yếu của các chất điện li)? LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 I 1
SỰ ĐIỆN LI. CHẤT ĐIỆN LI. CHẤT KHÔNG ĐIỆN LI 1 Câu 1 PHT 2
Các chất như NaCl, HCl, NaOH… khi tan trong nước lại phân li thành các ion vì nước là dung môi phân cực (dạng lưỡng cực
gồm 1 đầu mang điện âm và 1 đầu mang điện dương) và các chất tan ở trên cũng là các chất phân cực. Dưới tác dụng của
các lưỡng cực H O, các chất trên bị các lưỡng cực này từ từ `
tách ra thành các ion. Các ion này bị “bọc” xung quanh bởi 2
nhiều lưỡng cực theo quy tắc ion âm bị đầu mang điện dương của lưỡng cực hút và ngược lại.
Các ion đơn/đa nguyên tử có thể tìm thấy trong công thức phân tử các chất trên NaCl HCl NaOH Ion dương Na+ H+ Na+ Ion âm Cl– Cl– OH– Câu 2 ` Phương trình điện li HCl → H+ + Cl– CH COOH CH COO– + H+ (2) 3 3 HNO → H+ +
Ca(OH) → Ca2+ + 2OH– 3 2 BaCl → Ba2+ + 2Cl– 2 LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 I 1
SỰ ĐIỆN LI. CHẤT ĐIỆN LI. CHẤT KHÔNG ĐIỆN LI 1 Câu 3 PHT 2
Khi viết PT điện li cần chú ý bảo toàn nguyên tố và bảo toàn điện tích 2 vế.
Phương trình điện li của các chất điện li mạnh sẽ được biểu diễn bằng mũi tên 1
chiều (→); trong khi đó phương trình điện `li của các chất điện li yếu sẽ dùng 2 nửa
mũi tên ngược chiều nhau để mô tả đây là một cân bằng hóa học, tuân theo đầy đủ
các yếu tố ảnh hưởng như nhiệt độ, nồng độ, áp suất… LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 I 1
SỰ ĐIỆN LI. CHẤT ĐIỆN LI. CHẤT KHÔNG ĐIỆN LI 1 Câu 1 PHT 3
Viết phương trình điện li của CH COONa? Nếu ta cho 1 ít CH COONa vào dung dịch 3 ` 3
CH COOH thì cân bằng (2) - PHT2 sẽ chuyển dịch như thế nào? 3 Câu 2
Sắp xếp các dung dịch (có cùng nồng độ 0`,1M) sau đây theo thứ tự tăng dần độ dẫn
điện: CH COOH, K SO , NaCl và giải thích? 3 2 4 LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 I 1
SỰ ĐIỆN LI. CHẤT ĐIỆN LI. CHẤT KHÔNG ĐIỆN LI 1 Câu 1 PHT 3
Phương trình điện li: CH COONa → CH COO– + Na+. Khi thêm CH COONa vào dung 3 3 ` 3
dịch CH COOH thì sẽ làm tăng nồng độ ion CH COO– nên cân bằng (2) sẽ chuyển dịch 3 3 theo chiều nghịch. Câu 2
CH COOH < NaCl < K SO 3 2 4
Dung dịch acetic acid dẫn điện yếu nhất vì đây là dung dịch chất điện li yếu nên
lượng ion có trong dung dịch là nhỏ nhất. `
Dung dịch NaCl và K SO là dung dịch điện li mạnh nên sẽ dẫn điện tốt hơn vì trong 2 4
dung dịch có nhiều ion hơn. Mặt khác, vì dung dịch mỗi phân tử K SO có thể cho 3 2 4
ion, trong khi mỗi phân tử NaCl chỉ cho 2 ion nên dung dịch K SO có nhiều ion nhất 2 4
(trong cùng 1 thể tích) nên dung dịch K SO dẫn điện tốt nhất. 2 4 LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 I 1
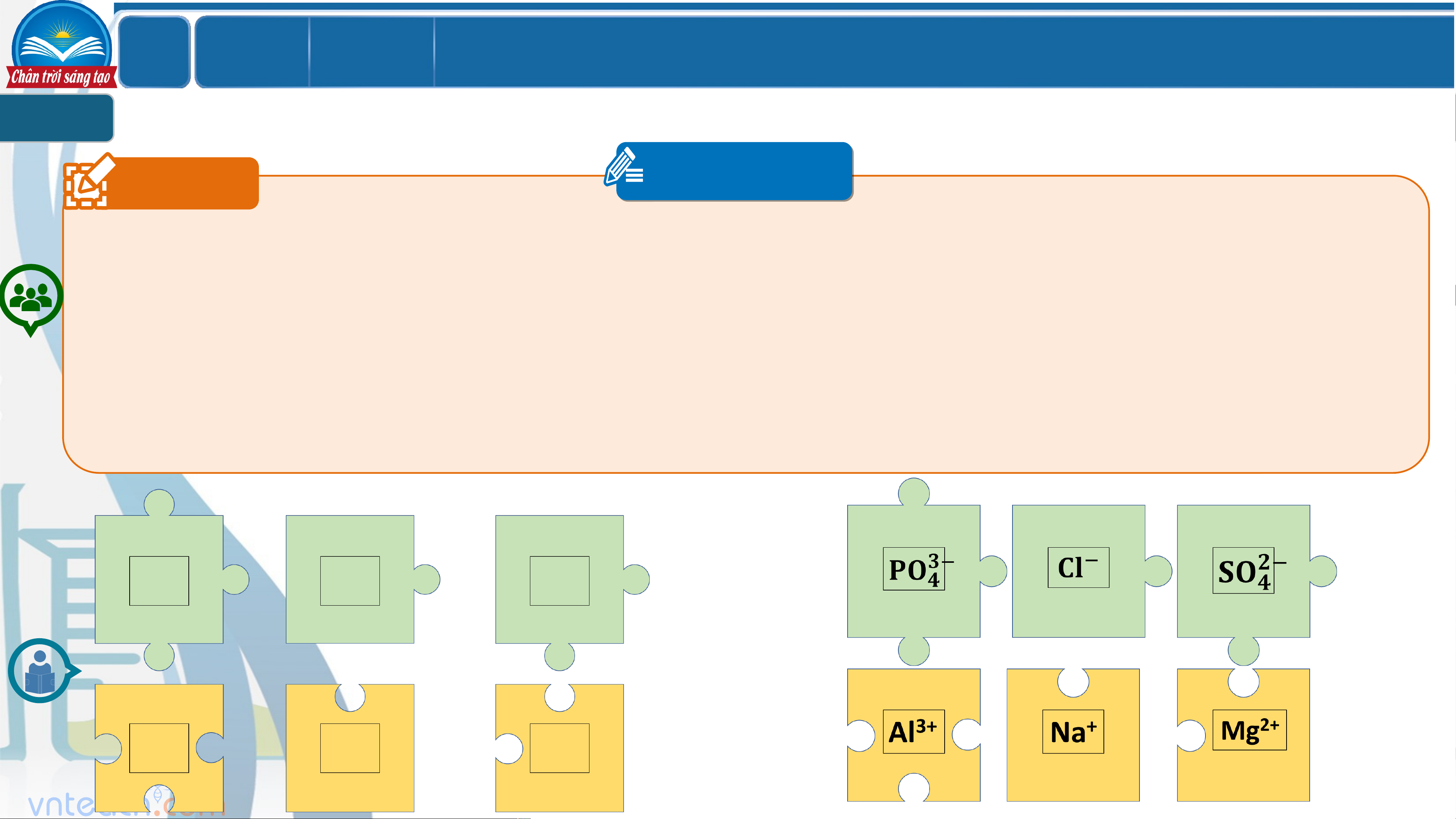
SỰ ĐIỆN LI. CHẤT ĐIỆN LI. CHẤT KHÔNG ĐIỆN LI 1 Câu 1 PHT 4
Làm việc theo nhóm, mỗi nhóm từ 5-6 HS. Sử dụng mẫu dưới đây để tạo các “mảnh ghép”. Trong đó, mảnh ghép có phần
lồi sẽ là các ion âm, mảnh ghép có phần lõm là các ion dương. Số phần lồi/lõm sẽ tương ứng với điện tích âm/dương của ion.
Mỗi nhóm sẽ sử dụng vật liệu phù hợp như bìa nhựa, bìa cart `
on, xốp…để tạo thành các bộ mảnh ghép của mình. Sử dụng
màu phù hợp cho từng loại ion. Các mảnh ghép phải khít nhau khi lắp ghép và cũng dễ tháo rời. Ký hiệu của các ion sẽ
được ghi vào phần ô vuông ở trong mảnh ghép.
Mỗi nhóm sẽ tiến hành làm 20 mảnh ghép, gồm 10 mảnh lồi, 10 mảnh lõm. Tương ứng với đó là 5 ion dương/âm điện tích
+1/-1; 3 ion dương/âm điện tích +2/-2; 2 ion dương/ âm điện tích +3/-3. Mẫu mảnh ghép: LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 II 1
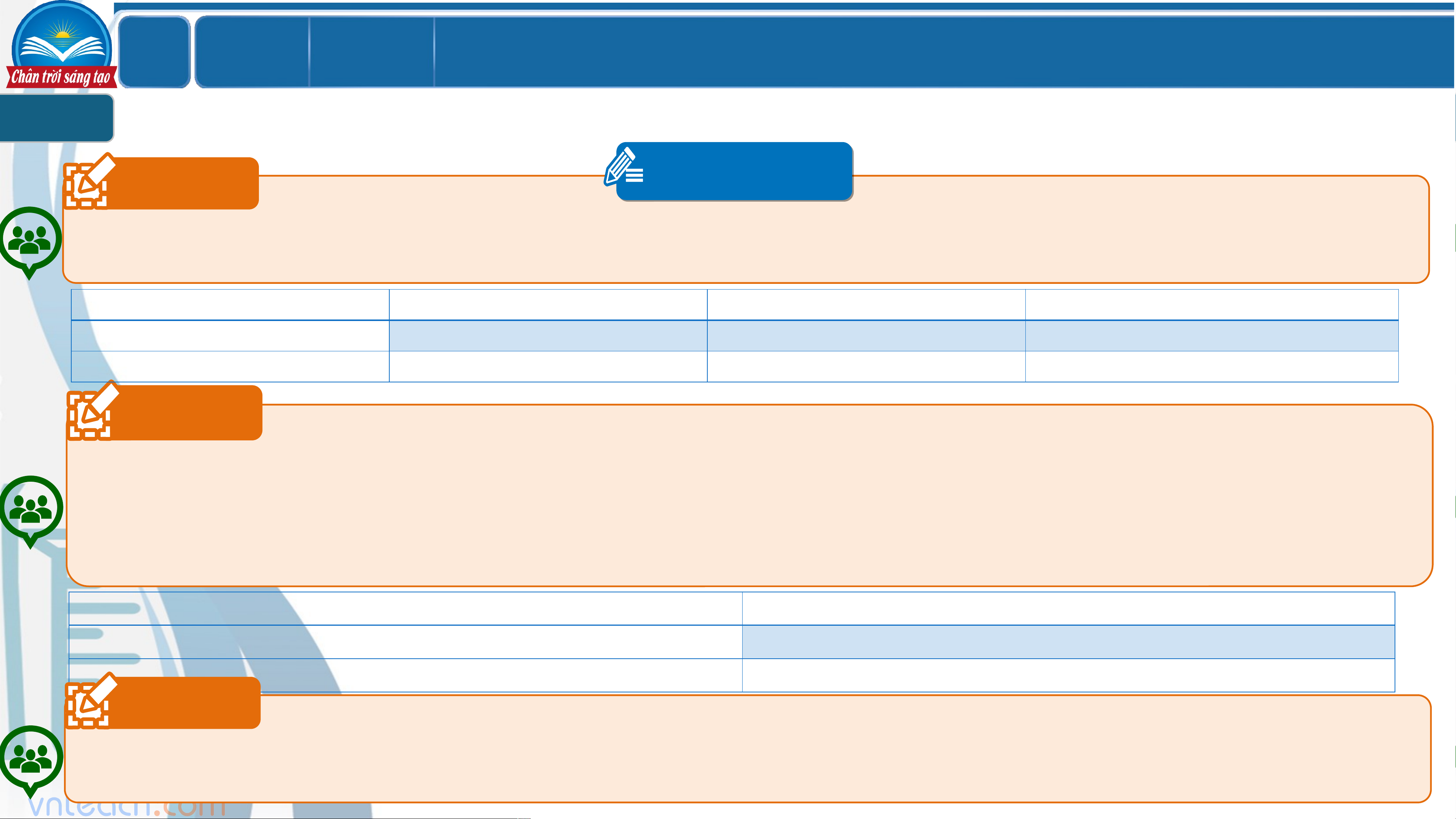
THUYẾT BRONDSTED – LOWRY VỀ ACID – BASE 1 Câu 1 PHT 5 `
Viết phương trình điện li của các chất sau: a. HCl → b. NaOH → c. CH COOH d. NH → 3 3 e. AlCl → g. Na CO → 3 2 3 Câu 2 `
Dựa vào khái niệm về acid-base đã được học (ở lớp 8), hãy cho biết các chất ở trên chất nào là acid, chất nào là base? Câu 3
Tiến hành thực nghiệm hóa học, sử dụng giấy chỉ thị màu v `
à xác định xem dung dịch của chất nào có môi trường acid,
dung dịch nào có môi trường base. Từ đó đưa ra nhận xét về kết quả thực nghiệm so với nhận định ở câu 2. LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 II 1
THUYẾT BRONDSTED – LOWRY VỀ ACID – BASE 1 Câu 1 PHT 5 `
Viết phương trình điện li của các chất sau: a. HCl → H+ + Cl– b. NaOH → Na+ + OH–
c. CH COOH CH COO– + H+ d. NH + H O + OH– 3 3 3 2
e. AlCl → Al3+ + 3Cl– g. Na CO → 2Na+ + 3 2 3 Câu 2 Acid: HCl, CH COOH 3 ` Base: NaOH Câu 3
- Acid: HCl, CH COOH, AlCl 3 3 `
- Base: NaOH, NH , Na CO . 3 2 3 LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 II 1
THUYẾT BRONDSTED – LOWRY VỀ ACID – BASE 1 Nội dung
- Thuyết Bronsted – Lowry: Acid là chất cho proton (H+), base là chất nhận proton.
+ Proton là hạt nhân nguyên tử hydrogen (
+ Acid, base có thể là các phân tử hoặc ion.
+ Thuyết acid-base của Bronsted – Lowry tổng quát hơn của Arrhenius cho các dung
môi không nhất thiết là nước, phân tử base không nhất thiết phải có nhóm OH như NH , 3 LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 II 1
THUYẾT BRONDSTED – LOWRY VỀ ACID – BASE 1 Câu 1 PHT 6
Xác định vai trò (acid/base) của phân tử H O trong các quá trình sau: 2 ` a.NH + H O + OH– 3 2
b.CH COOH + H O CH COO– + H O+ 3 2 3 3 Câu 2
Dựa vào khả năng của H O vừa chứng minh ở câu 1, hãy hoàn thành các quá trình sau: 2
a. (H O đóng vai trò là acid) 2 `
b. (H O đóng vai trò là base) 2 Câu 3
Người ta gọi những phân tử như H O, hay ion như là “chất lưỡng tính”. Hãy cho biết, chất lưỡng tính là “chất” như thế 2 ` nào? LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 II 1
THUYẾT BRONDSTED – LOWRY VỀ ACID – BASE 1 Câu 1 PHT 6
Xác định vai trò (acid/base) của phân tử H O trong các quá trình sau: 2 `
a. NH + H O + OH– → H O là chất nhường proton → H O là acid 3 2 2 2
b. CH COOH + H O CH COO– + H O+
→ H O là chất nhận proton → H O là base 3 2 3 3 2 2 Câu 2
Dựa vào khả năng của H O vừa chứng minh ở câu 1, hãy hoàn thành các quá trình sau: 2 `
(H O đóng vai trò là acid) 2
b. (H O đóng vai trò là base) 2 Câu 3
- “Chất lưỡng tính” là chất vừa có thể nhường proton (đóng vai trò là acid) vừa có thể nhận proton (đóng vai trò base)
+ VD: là những chất lưỡng tính. `
+ “Chất” lưỡng tính có thể là phân tử hoặc ion LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 II 1
THUYẾT BRONDSTED – LOWRY VỀ ACID – BASE 1 Câu 1 PHT 7
Viết các quá trình nhường, nhận proton củ `a các phân tử/ion dưới đây, cho biết phân
tử/ion nào là acid/base, chất lưỡng tính? a. b. HNO + H O → 3 2
c. HS– + H O H S + …
d. HS– + H O S2– + … 2 2 2 a.
b. HNO + H O → H O+ + 3 2 3
c. HS– + H O H S + OH–
d. HS– + H O S2– + H O+ 2 2 2 3 LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 II 1
THUYẾT BRONDSTED – LOWRY VỀ ACID – BASE 1 Câu 1 PHT 8
Để xác định môi trường của 1 dung dịch là acid/base hay trung tính người ta có nhiều phương pháp, một trong những
phương pháp đơn giản và dễ làm nhất là sử dụng các chất chỉ thị màu. Các em có thể tự “chế tạo” ra các chất chỉ thị màu
này để có thể sử dụng tại nhà hoặc sử dụng trên lớp vào tiết học sau.
Hãy chế tạo các chất chỉ thị màu từ các nguồn nguyên liệu tự nhiên tại nhà.
1.Nguyên liệu: lựa chọn 1 trong các loại nguyên liệu sau: bắp cải tím; hoa đậu biếc; củ dền đỏ; hoa dâm bụt; ruột
thanh long ruột đỏ; quả mồng tơi…
2.Rửa sạch, loại bỏ các phần thô (như hạt, vỏ, nhụy, đài hoa…), để ráo. Với ruột thanh long ruột đỏ có thể rây qua rây
bằng kim loại để loại bỏ hạt. `
3.Xay hoặc giã nhỏ các nguyên liệu tươi ở trên.
4.Hòa phần nguyên liệu đã xay ở trên vào trong 200 mL nước lọc (hoặc nước đun sôi để nguội), khuấy đều, sau đó để
nguội, lọc lấy phần dung dịch.
5.Bây giờ, có thể sử dụng dung dịch này để thử nghiệm với các dung dịch ở gia đình như: nước sinh hoạt, nước xà phòng, nước chanh, giấm…
(Chuẩn bị tất cả các dung dịch này ra cốc nhựa dùng 1 lần, ghi nhãn bằng giấy dán ở ngoài, thử nghiệm bằng cách nhỏ
vài giọt chất chỉ thị màu, quan sát sự đổi màu, ghi lại màu và kết luận về môi trường của dung dịch. Chụp lại từ 3-5 tấm
ảnh về quá trình tiến hành chế tạo và 1 tấm ảnh về kết quả thử nghiệm sản phẩm. Báo cáo sản phẩm bằng hình ảnh
hoặc video hoặc powerpoint) LỚ Chươ BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC P ng 1 II 1
THUYẾT BRONDSTED – LOWRY VỀ ACID – BASE 1 Câu 2 PHT 8
Hãy tìm ra phương pháp để biến dung dịc`h chất chỉ thị ở trên thành “giấy chỉ thị”.
Làm 10 tờ giấy chỉ thị, mỗi tờ kích thước 1 cm x 5 cm.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20




