





Preview text:
HÓA HỌC 11 BÀI 2: CÂN BẰNG TRONG DUNG DỊCH NƯỚC
GV: HỒ PHẠM THANH PHƯỚC
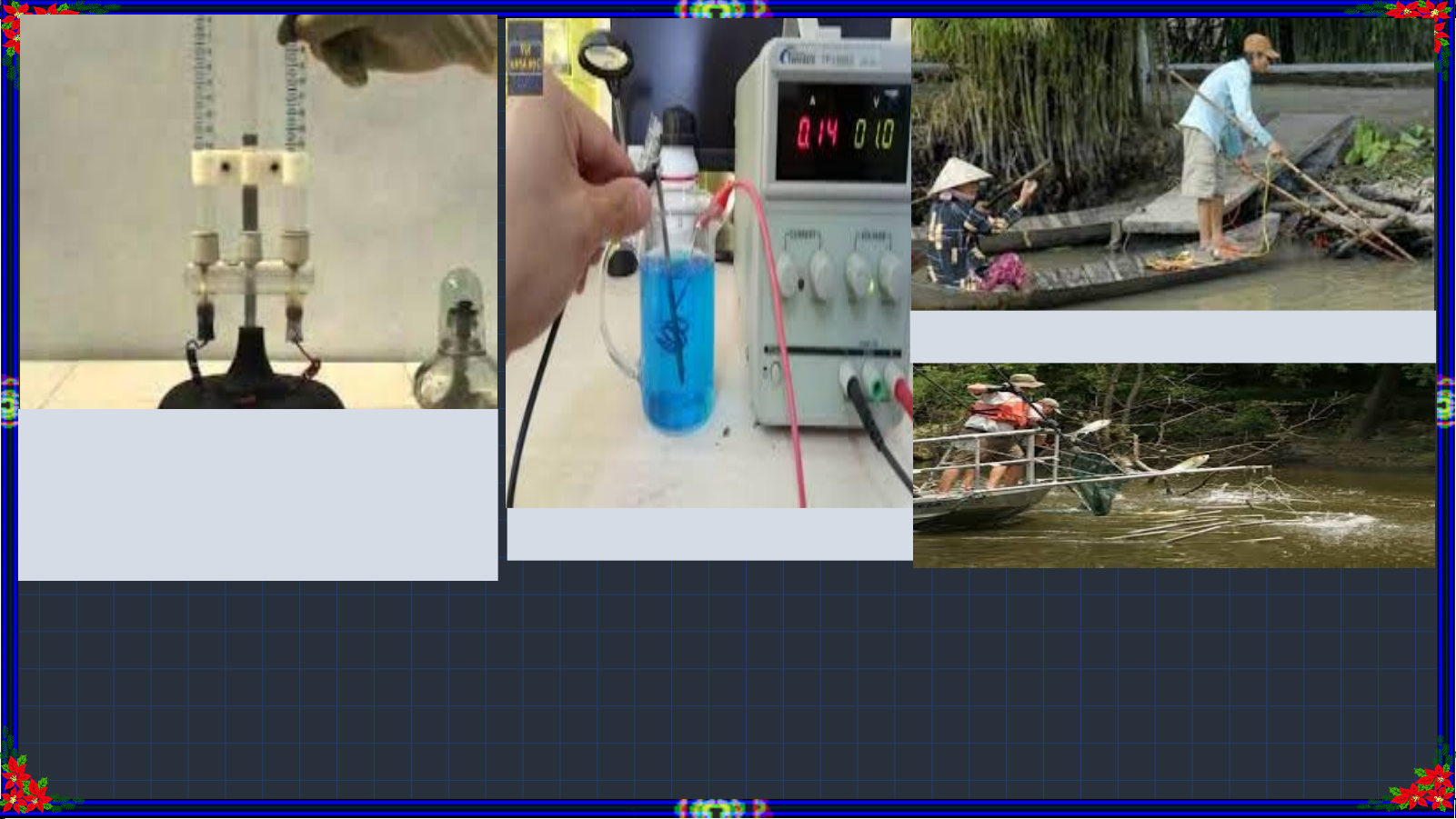
Dùng điện đánh bắt cá Khi điện phân H O, 2
thường thêm vài ml dung dịch H SO hoặc NaOH Mạ kim loại 2 4
Bạn có suy nghĩ gì?
Bài 2: CÂN BẰNG TRONG DUNG DỊCH NƯỚC I. SỰ ĐIỆN LI:
1. Hiện tượng điện li: 2. Chất điện li:
Bài 2: CÂN BẰNG TRONG DUNG DỊCH NƯỚC I. SỰ ĐIỆN LI:
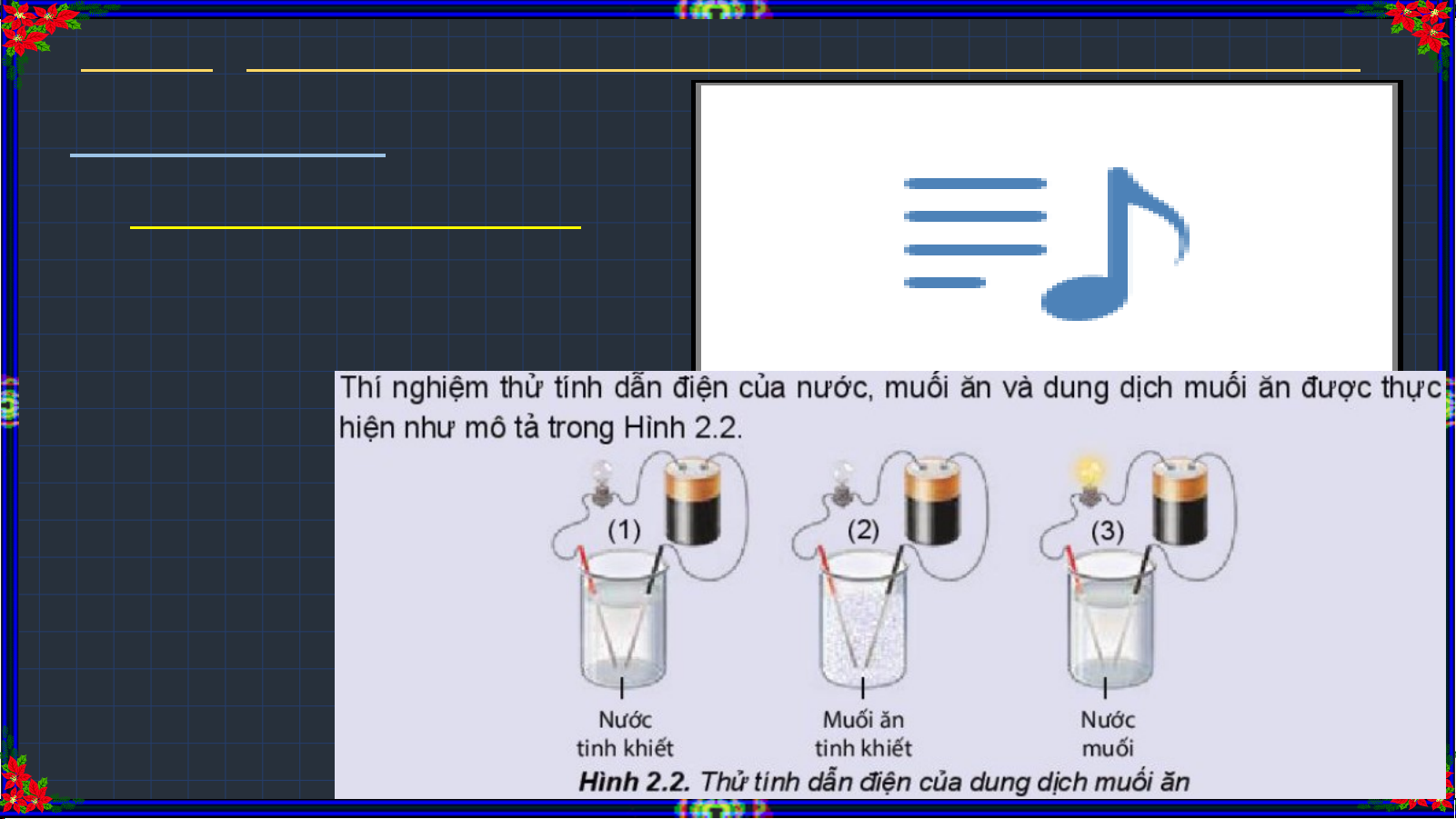
1. Hiện tượng điện li: Quan sát thí nghiệm và nêu nhận xét?
Bài 2: CÂN BẰNG TRONG DUNG DỊCH NƯỚC I. SỰ ĐIỆN LI:
1. Hiện tượng điện li:
- Sự phân li một chất thành các ion mang điện tích trái dấu
được biểu diễn bằng phương trình điện li. VD: NaCl Na+ + Cl – HCl H+ + Cl – KOH K+ + OH – Na SO 2 Na+ + SO 2– 2 4 4 Al (SO ) 2 Al3+ + 3 SO 2– 2 4 3 4
Bài 2: CÂN BẰNG TRONG DUNG DỊCH NƯỚC I. SỰ ĐIỆN LI:
1. Hiện tượng điện li:
Quan sát thí nghiệm và 2. Chất điện li:
hoàn thành bảng sau: Dd HCl
Dd NaOH Nước đường Dd ethanol (Saccarose) Hiện tượng
Dung dịch dẫn điện/ không dẫn điện
Có / không các ion trái dấu trong dung dịch
Chất điện li / chất không điện li Nước đường Dd HCl Dd NaOH (Saccarose) Dd ethanol Hiện tượng Đèn sáng Đèn sáng Đèn không Đèn không sáng sáng
Dung dịch dẫn điện/ Dung dịch Dung dịch
Dung dịch Dung dịch không dẫn điện không dẫn không dẫn dẫn điện dẫn điện điện điện
Có / không các ion trái Có các ion Có các ion Không có Không có dấu trong dung dịch trái dấu trái dấu
các ion trái các ion trái dấu dấu
Chất điện li / chất
Chất điện Chất điện Chất không Chất không không điện li li li điện li điện li
Bài 2: CÂN BẰNG TRONG DUNG DỊCH NƯỚC I. SỰ ĐIỆN LI:
1. Hiện tượng điện li: 2. Chất điện li:
a. Chất điện li mạnh:
- Chất điện li mạnh là chất khi tan trong nước, hầu hết các
phân tử chất tan đều phân li ra ion. VD: HCl H+ + Cl – 0,02 M 0,02 M 0,02 M NaOH Na+ + OH – K SO 2 K+ + SO 2– 2 4 4
- Chất điện li mạnh bao gồm:
+ Các acid mạnh như: HNO , H SO , HCl, HBr, ... 3 2 4
+ Các base mạnh như: NaOH, Ba(OH) , KOH,... 2
+ Hầu hết các muối.
VD: Viết phương trình điện li của các chất và tính
nồng độ mol của từng ion trong các dung dịch sau: a. Ba(NO ) Ba2+ + 2 NO – 3 2 3 0,1 M 0,1 M 0,2 M b. HNO H+ + NO – 3 3 0,2 M 0,2 M 0,2 M c. KOH K+ + OH– 0,02 M 0,02 M 0,02 M d. Na PO 3Na+ + PO 3– 3 4 4 0,1 M 0,3 M 0,1 M
b. Chất điện li yếu:
- Chất điện li yếu là chất khi tan trong nước chỉ có một
phần số phân tử chất tan phân li ra ion, phần còn lại tồn tại
ở dạng phân tử trong dung dịch. VD: CH COOH H+ + CH COO – 3 3 HCN H+ + CN–
- Chất điện li yếu bao gồm:
+ Các acid có độ mạnh trung bình và yếu như: H PO , 3 4
H SO , HCN, CH COOH, H S, HClO, ... 2 3 3 2
+ Các base yếu như: Mg(OH) , Bi(OH) ... 2 3
+ Một số muối của thuỷ ngân như: Hg(CN) , HgCl ... 2 2
- Sự điện li là quá trình phân li các chất trong nước ra ion. I
- Chất điện li là những chất khi tan trong nước L phân li ra ion. N
- Các axit, bazơ và muối là những chất điện li. IỆ
- Chất điện li mạnh là chất khi tan trong nước Đ
các phân tử hoà tan đều phân li ra ion. Ự S
- Chất điện li yếu là chất khi tan trong nước một
phần các phân tử hoà tan phân li ra ion, phần
còn lại tồn tại dạng phân tử trong dung dịch. LUYỆN TẬP:
Câu 1: Hợp chất nào không phân li ra ion khi hòa tan trong nước
A. MgCl . B. HClO . C. C. C
H O . D. Ba(OH) . 2 3 66 12 12 66 2
Câu 2: Dung dịch chất điện li dẫn điện được là do
A. sự chuyển dịch của các electron.
B. sự chuyển dịch của các cation.
C. sự chuyển dịch của các phân tử hòa tan. D. sự sự chuy chuyển dị ển dịch ch của c của ác các ca c t ation và n và ani anion on.
Câu 3: Chất nào sau đây không dẫn điện được? A. A K . C K l C lr ắ r n, kh ắn, k an. han. B. CaCl nóng chảy. 2 C. NaOH nóng chảy.
D. HBr hòa tan trong nước. LUYỆN TẬP:
Câu 4: Dung dịch nào dưới đây dẫn điện tốt nhất? A. NaI 2.10 – 3 M. B. NaI 1.10 – 2 M. C. C N . aI N 1.10 – – 1 1.10 M. M. D. NaI 1.10 – 3 M.
Câu 5: 1lít dung dịch chứa 0,1 mol FeCl , tổng số mol ion Fe3+ và 3 Cl– của dung dịch là: A. 0,1. B. 0,3. C. 0,2. D. 0,4. D. 0,4.
Câu 6: Dãy chất nào dưới đây chỉ gồm những chất tan và điện li mạnh?
A. HNO , Cu(NO ) , Ca (PO ) , H PO . 3 3 2 3 4 2 3 4 B. CaCl , CuSO , CaSO , HNO . 2 4 4 3 C. C H . H SO SO , NaCl, KNO , Ba(NO ) . 2 ,4 NaCl, KNO ,3 Ba(NO ) 3 . 2 2 4 3 3 2 D. KCl, H SO , H O, CaCl ; 2 4 2 2
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16




