




















Preview text:
BÀI 5: AMMONIA . MUỐI AMMONIUM NỘI DUNG BÀI HỌC I. AMMONIA 4. Ứng dụng
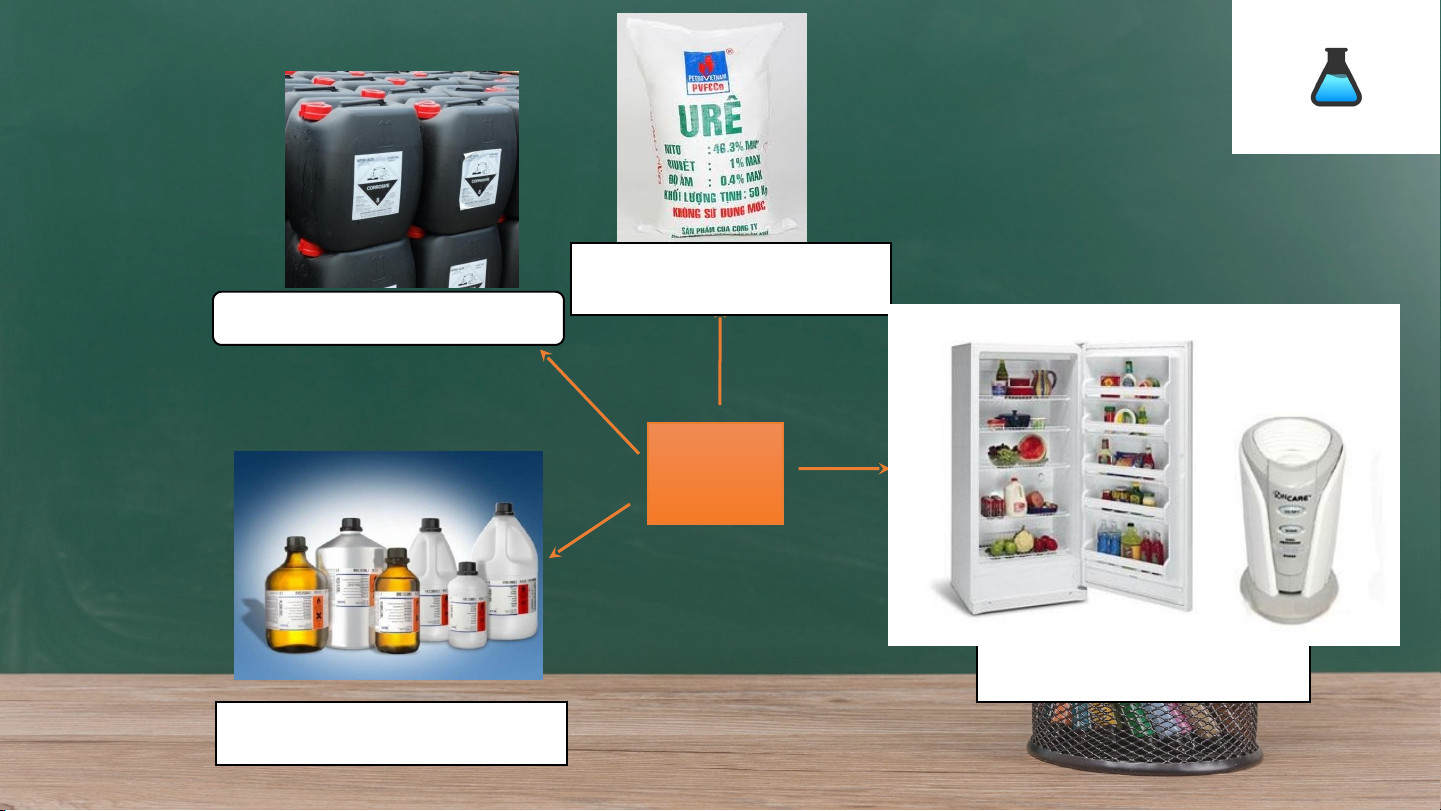
Sản xuất phân đạm
Sản xuất nitric acid NH3 Tác nhân làm lạnh Dung môi
Xe chạy bằng ammonia AMMONIA MÔI TRƯỜNG Ảnh hưởng của THỦY TRIỀU AXIT HÓA Ô NHIỄM KHÍ ammonia CON NGƯỜI ĐỎ ĐẤT QUYỂN TRỰC TIẾP HÍT PHẢI TIẾP XÚC TRỰC GIÁN TIẾP NUỐT PHẢI TIẾP OXI HÓA THÀNH NO - 2 Bỏng niêm mạc Gây bỏng, mù - Bỏng miệng, đau VÀ NO 3 mũi, họng mắt dạ dày - NO - NO 2 3 - Gây thiếu vitamin - Giảm oxi trong máu, gây - Tạo nitrosamin ngạt, nôn. (gây ung thư)
- Nồng độ cao gây tử vong.
Các biện pháp sơ cứu khi bị ngộ độc ammonia
• Trong trường hợp hít phải ammonia có nồng độ cao, cần nhanh chóng
đưa nạn nhân khỏi khu vực bị ô nhiễm, hô hấp nhân tạo hoặc cho thở
oxy. Nạn nhân cần được nằm ấm và yên tĩnh.
• Nếu nuốt phải khí hóa lỏng Ammonia, chúng ta cần phải cho nạn nhân
súc miệng nhiều lần bằng nước lạnh, sau đó cho nạn nhân uống 1-2 chén sữa.
Nhà vệ sinh của hầu hết các trường hiện
nay đang trở thành nỗi ám ảnh của các
HS vì mùi nó rất nặng. Theo em cần làm
gì để có thể xử lý vấn đề này?
Vào những ngày mưa, các em nhỏ tè
nhiều, quần áo thường có mùi khai khó
chịu. Em hãy cho biết phương pháp
dân gian nào có thể hỗ trợ để giải
quyết vấn đề trên? (Không dùng nước
ngâm áo quần Comfort hay Downy)
Hệ thống làm lạnh hiện nay đang được
sử dụng bằng ammonia, em hãy tìm hiểu
quy trình làm lạnh ở tủ lạnh, máy điều hòa trong gia đình.
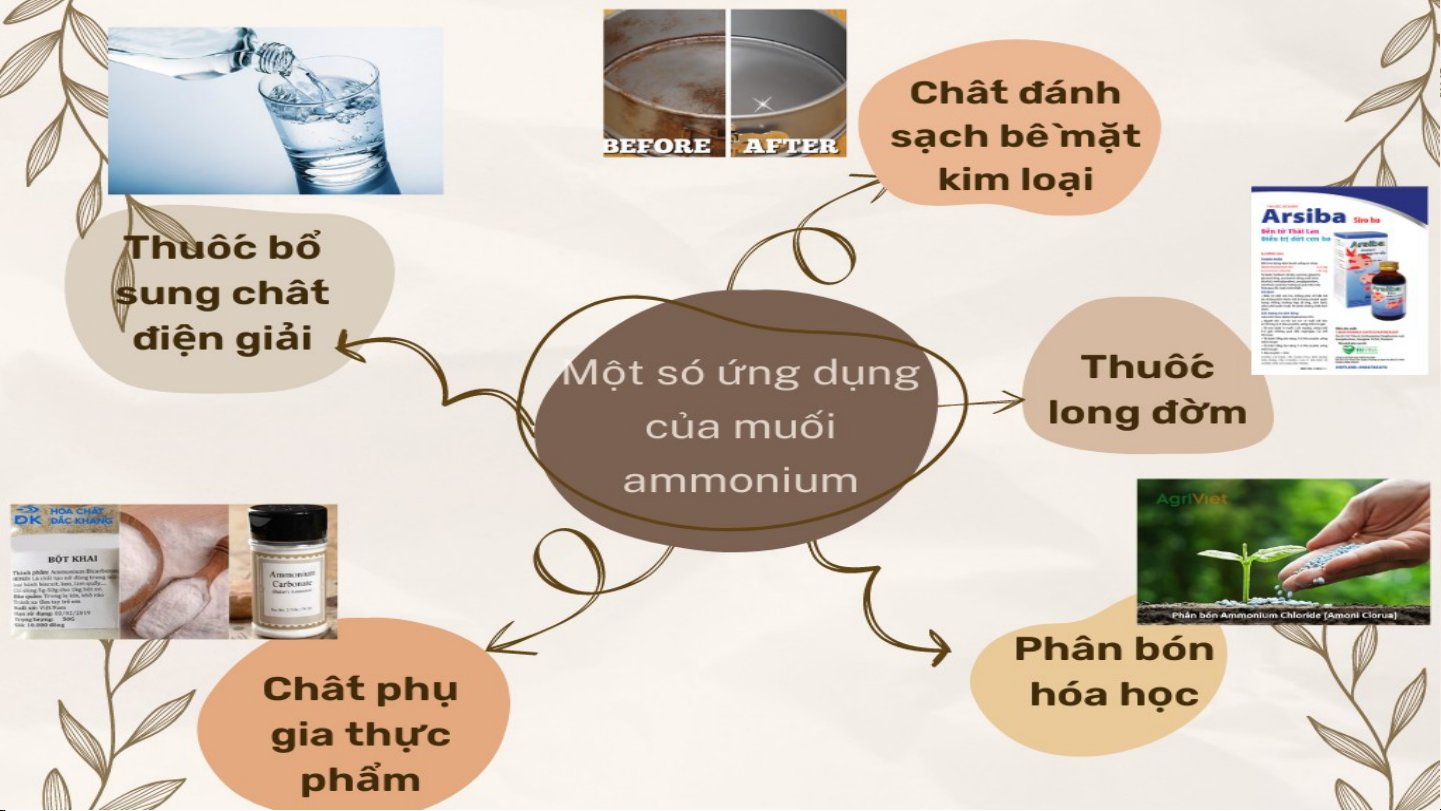
Ammonia có rất nhiều ứng dụng quan
trọng, tuy nhiên ammonia cũng rất
nguy hiểm khi tiếp xúc với người và
động vật. Em hãy nêu lên sự nguy
hiểm và cách sơ cứu khi con người,
động vật tiếp xúc với ammonia, từ đó
đưa ra khuyến cáo với người dân. II. MUỐI AMMONIUM
1. Tính tan, sự điện li
Hầu hết các muối ammonium đều dễ
tan trong nước và phân li hoàn toàn ra ion. VD: NH Cl -> NH + + Cl- 4 4
Một số muối phổ biến: NH Cl, 4 NH NO , (NH ) SO , NH H PO , 4 3 4 2 4 4 2 4 (NH ) HPO , NH HCO … 4 2 4 4 3 II. MUỐI AMMONIUM
2. Tác dụng với dung dịch kiềm – Nhận biết ion ammonium
- Khi đun nóng hỗn hợp muối amonium với dd kiềm, sinh ra khí
amonia có mùi khai đặc trưng. t0
(NH ) SO + 2NaOH → Na SO + 2NH + 2H O 4 2 4 2 4 3 2
PT ion thu gọn: NH + + OH- → NH + H O 4 3 2
→ Điều chế NH trong PTN và nhận biết muối ammonium 3 II. MUỐI AMMONIUM
2. Tác dụng với dung dịch kiềm – Nhận biết ion ammonium II. MUỐI AMMONIUM 3. Tính kém bền nhiệt
- Các muối amonium đều kém bền với nhiệt và dễ bị phân hủy khi đun nóng.
* Muối ammonium chứa gốc acid không có tính oxi
hóa khi đun nóng tạo ra NH . 3 t0 NH Cl (r) NH + HCl 4 3 (k) (k).
(NH ) CO (r) t0 NH (k) + NH HCO (r). 4 2 3 3 4 3
NH HCO (r) t 0 NH (k) + CO (k) + H O 4 3 3 2 2 II. MUỐI AMMONIUM
3. Tính kém bền nhiệt
* Muối ammonium tạo bởi acid có tính oxi hoá như (HNO , HNO ), khi 2 3 đun nóng tạo ra N , N O 2 2 t0 NH NO N + 2H O 4 2 2 2 t0 NH NO N O + 2H O 4 3 2 2
Phản ứng này dùng điều chế N N O trong phòng 2 , 2 thí nghiệm. II. MUỐI AMMONIUM 4. Ứng dụng
Củng cố: Học sinh chia 4 nhóm hoạt động nội
dung bài tập vào bảng phụ:
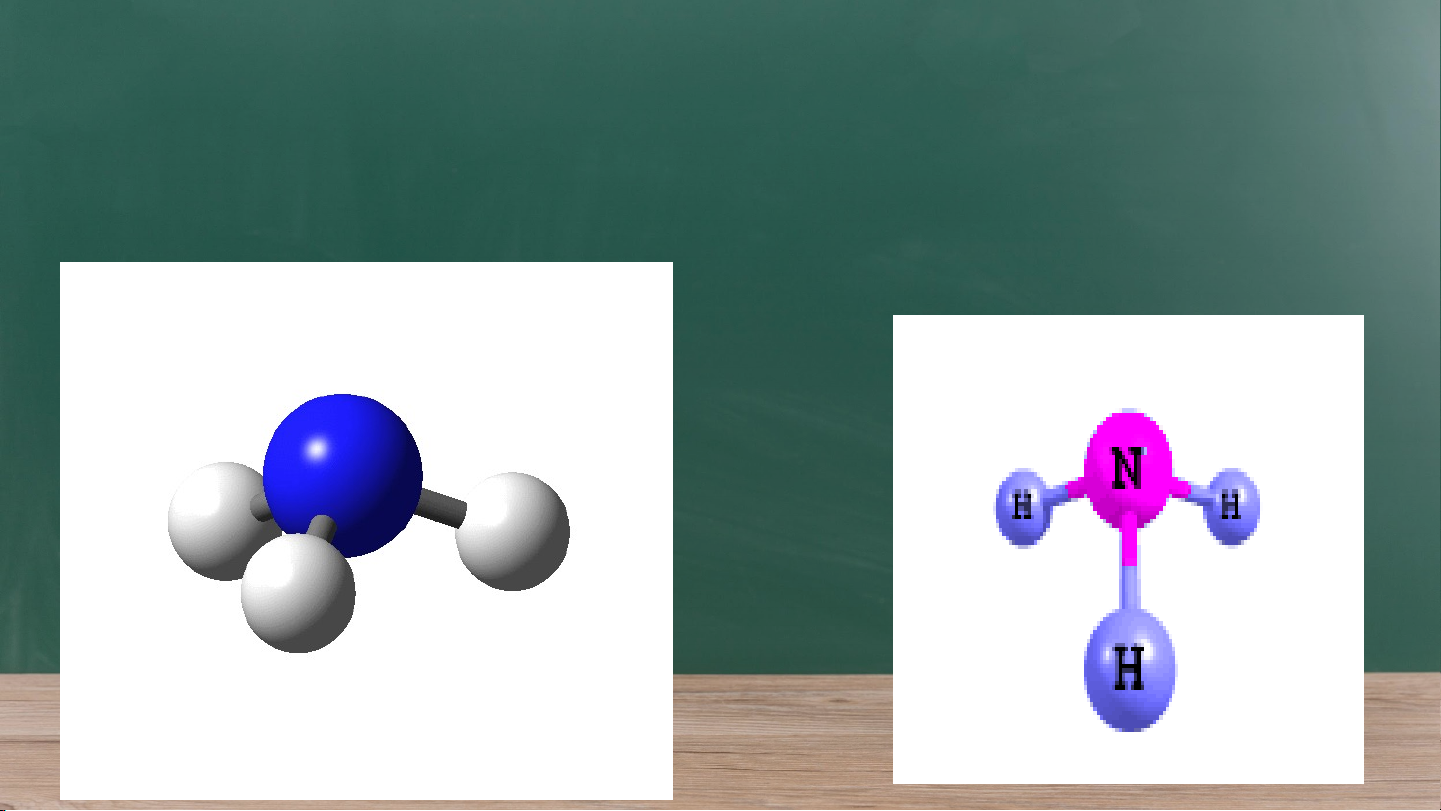
- So sánh phân tử amonia và ion amonium về
dạng hình học, số liên kết cộng hóa trị, số oxi
hóa của nguyên tử nitrogen.
- Viết phương trình hóa học minh họa tính
acid/ base của amonia và amonium. Phân tử/ Ion Dạng hình học Số liên kết Số oxi hoá của cộng hoá trị nitrogen của nitrogen Ammonia (NH ) Chóp tam giác 3 -3 3 Ammonium Tứ diện 4 -3 (NH +) 4 b)
- NH có tính base. Một số phương trình hoá học minh 3 hoạ: NH + HCl → NH Cl 3 4 2NH + H SO → (NH ) SO . 3 2 4 4 2 4
- NH + có tính acid. Một số phương trình hoá học minh 4 hoạ:
NH NO + NaOH → NaNO + NH + H O 4 3 3 3 2
NH Cl + NaOH → NaCl + NH + H O 4 3 2
Phương trình ion rút gọn: NH + + OH− → NH + H O. 4 3 2
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24




