























Preview text:
BÀI GIẢNG HÓA HỌC 11
S Á C H : C H Â N T R Ờ I S Á N G T Ạ O
Quan sát video sau và trả lời câu hỏi:
1. Nguyên tố được nhắc đến trong video là gì?
2. Vì sao nó được đặt tên là “Vàng Của Quỷ”? 2 3 BÀI 6
SULFUR VÀ SULFUR DIOXIDE 4 5 ĐƠN CHẤT SULFUR • NỘI Trạng thái tự nhiên
• Cấu tạo, TCVL cơ bản của đơn chất S • TCHH • DUNG Ứng dụng SULFUR DIOXIDE
• TCHH và ứng dụng của sulfur dioxide
• Sự hình thành sulfur dioxide do tác động của con người, tự nhiên
• Tác hại của sulfur dioxide và một số biện
pháp làm giảm thiểu lượng SO thải vào 2 không khí 01 ĐƠN CHẤT SULFUR 6
TRẠNG THÁI TỰ NHIÊN
Quan sát video ở đầu bài kết hợp
Trong tự nhiên, sulfur lắng đọng
với các hình 6.1, 6.2 (sách giáo
khoa), hãy cho biết lưu huỳnh có
thành những mỏ lớn, nằm giữa lớp đá
S thể tồn tại những dạng chất nào sâu hàng trăm mét trong lòng đất.
trong tự nhiên?
Sulfur ở dạng hợp chất cũng được
tìm thấy trong nhiều khoáng vật trong tự nhiên.
Đơn chất hoặc hợp chất 7
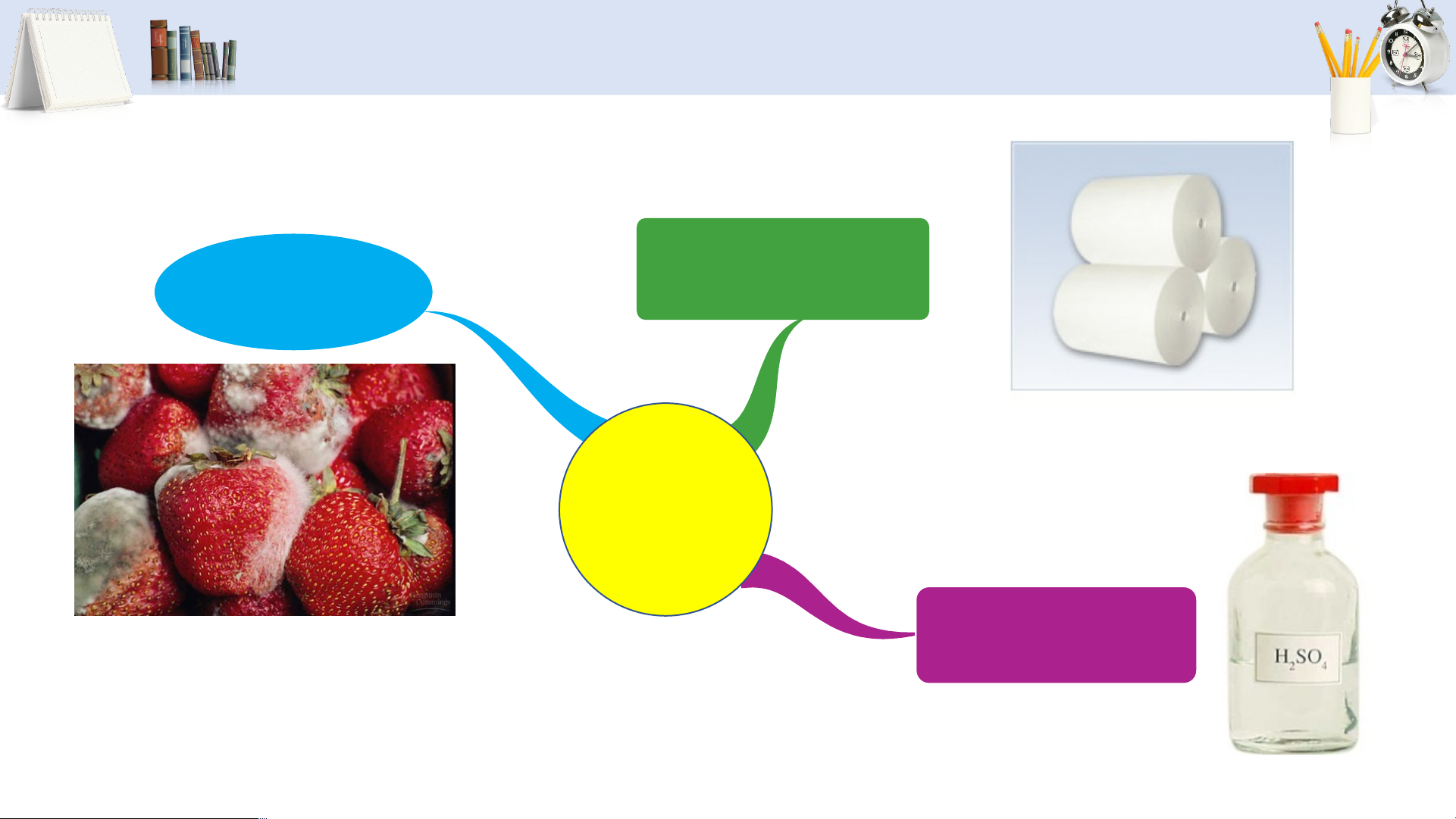
CẤU TẠO, TÍNH CHẤT VẬT LÍ CỦA SULFUR
1. Quan sát hình 6.3, hãy nêu
một số TCVL của sulfur.
2. Quan sát hình 6.4, mô tả
cấu tạo phân tử sulfur. Ở điề i u kiệ i n thường, sulfu
l r là chất trắn, màu vàng, không tan trong nước, ta t n nhiều tro
tr ng dung môi hữu cơ như benzene, carbon disu is lfid lfi e (C ( S ),… 2 8
VỊ TRÍ, CẤU HÌNH ELECTRON NGUYÊN TỬ 9 Tính khử +4 +6 Các số 0 oxi hoá thườngS S gặp của S: S -2 -2 0 +4 +6 S Tính oxi hóa -2 0 +4 +6 oxi hóa oxi hóa oxi hóa S S S S khử khử khử 10 TÍNH CHẤT HÓA HỌC Hãy quan sát video sau, viết PTPƯ và xác định vai trò của các chất trong PƯ. 11 TÍNH CHẤT HÓA HỌC 1) Tính oxi hoá:
Tác dụng với kim loại: tạo muối sulfide 0 0 to +2 -2 Fe + S FeS
(iron (II) sulfide) Hg + S HgS
(mercury sulfide)
=> Phản ứng dùng thu hồi thuỷ ngân trong phòng thí nghiệm. 12 TÍNH CHẤT HÓA HỌC
Thủy ngân rất độc. Hít phải hơi thủy ngân
có thể gây hại cho hệ thần kinh, hệ tiêu
hóa và hệ miễn dịch, gây nhiễm độc phổi
và thận, nguy cơ dẫn đến tử vong. Nêu
cách xử lí thủy ngân khi nhiệt kế thủy ngân không may bị vỡ. 13 TÍNH CHẤT HÓA HỌC
Thông gió và ra khỏi phòng ít nhất 15’
Đi găng tay cao su hoặc nilon, thay
quần áo cũ trước khi dọn dẹp
Sử dụng băng dính để gom các hạt thủy ngân rơi vãi
• Bỏ băng dính, các mảnh vỡ vào chai NÊN
• Lau dọn chỗ bị đổ bằng 1 miếng giẻ ẩm rồi
cho giẻ vào trong chai và đậy nắp kĩ
• Ghi chú bên ngoài chai để người thu gom
nhận biết đó là rác thải nguy hiểm 14 TÍNH CHẤT HÓA HỌC
Không dùng tay trần chạm vào thủy ngân KHÔNG
Không dùng chổi/ máy hút bụi NÊN
Không đổ thủy ngân xuống bồn rửa/cống
Không giặt quần áo dính thủy ngân trong máy
giặt – hãy cho chúng vào túi dán kín và vứt bỏ 15 TÍNH CHẤT HÓA HỌC
2) Tính khử: Tác dụng với phi kim: 0 0 to +4-2 S(r) + O (g) SO (g) ∆ 𝑯𝒐 2
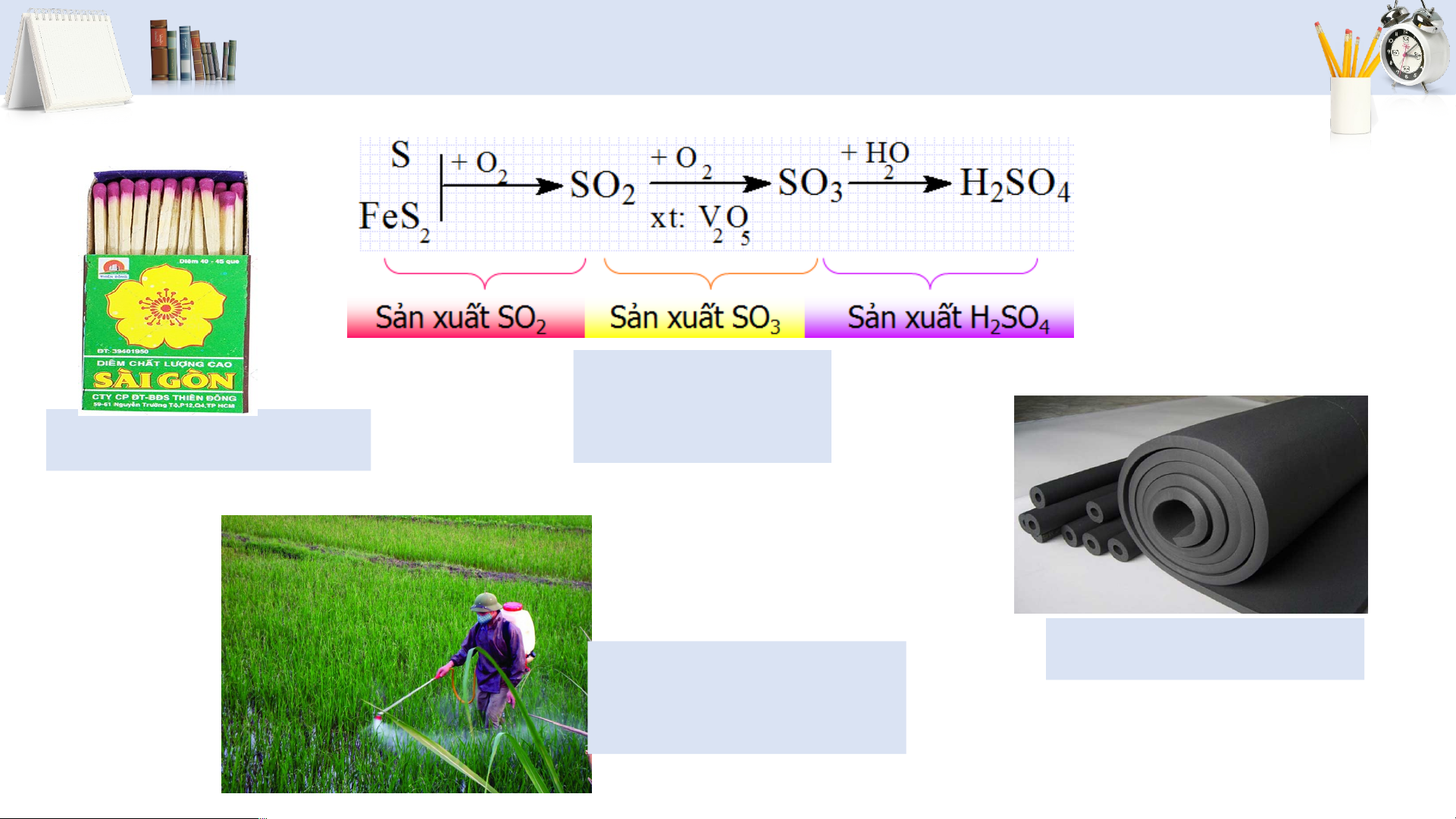
=−𝟐𝟗𝟔 ,𝟖 𝒌𝑱 2 𝒓 𝟐𝟗𝟖 (sulfur dioxide) 16 ỨNG DỤNG Sản xuất Sản xuất diêm sulfuric acid Sản xuất thuốc Lưu hóa cao su trừ sâu 17 02 SULFUR DIOXIDE 18
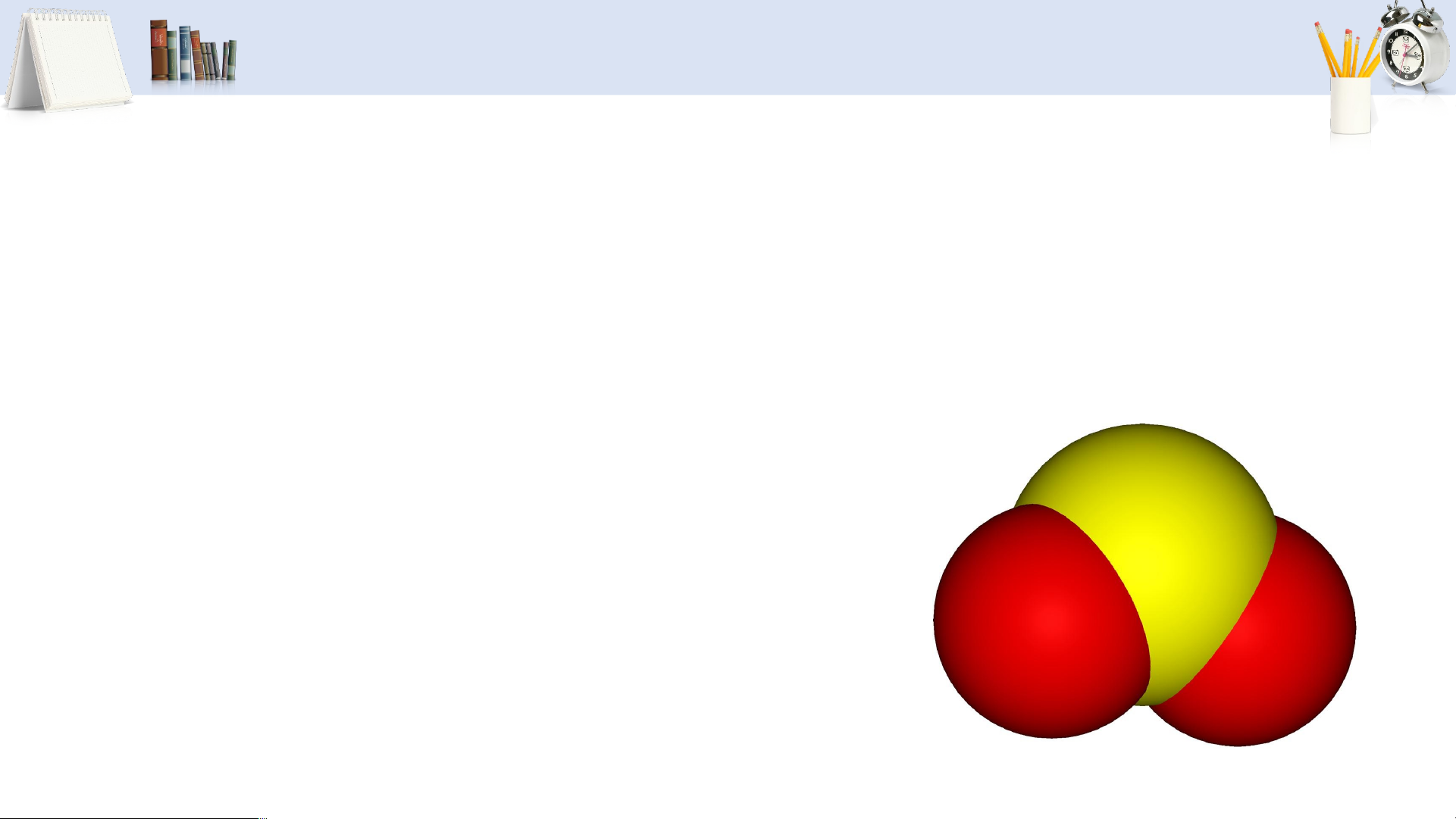
TÍNH CHẤT VẬT LÍ CỦA SULFUR DIOXIDE
• Sulfur dioxide (SO ) là chất khí, không màu, mùi xốc, rất độc. 2
• Nặng hơn không khí khoảng hai lần ( )
• Lưu huỳnh đioxit tan nhiều trong nước. 19
TÍNH CHẤT HÓA HỌC CỦA SULFUR DIOXIDE
Các số oxi hoá thường gặp của S: -2 0 +4 +6
SO vừa có tính khử, vừa có tính oxi hóa 2 -2 0 +4 +6 oxi hóa oxi hóa oxi hóa S S S S khử khử khử 20
TÍNH CHẤT HÓA HỌC CỦA SULFUR DIOXIDE
SO là có thể tác dụng với các chất oxi hóa mạnh: 2 halogen, KMnO , NO … 4 2 ? Xác định số oxi +4 +4 +6 +2 hóa, xác định vai SO + NO SO + NO 2 2 3 trò của SO 2 trong PT bên. SO là chất khử 2 21
TÍNH CHẤT HÓA HỌC CỦA SULFUR DIOXIDE
SO là có thể tác dụng với các chất khử mạnh: H S, Mg, … 2 2 +4 -2 0 ? Xác định số oxi SO + 2H S 3S + 2H O 2 2 2 hóa, xác định vai trò của SO 2
SO là chất oxi hóa 2 trong PT bên. 22
ỨNG DỤNG CỦA SULFUR DIOXIDE Tẩy trắng Chống giấy, bột giấy nấm mốc SO2 Sản xuất sulfuric acid 23
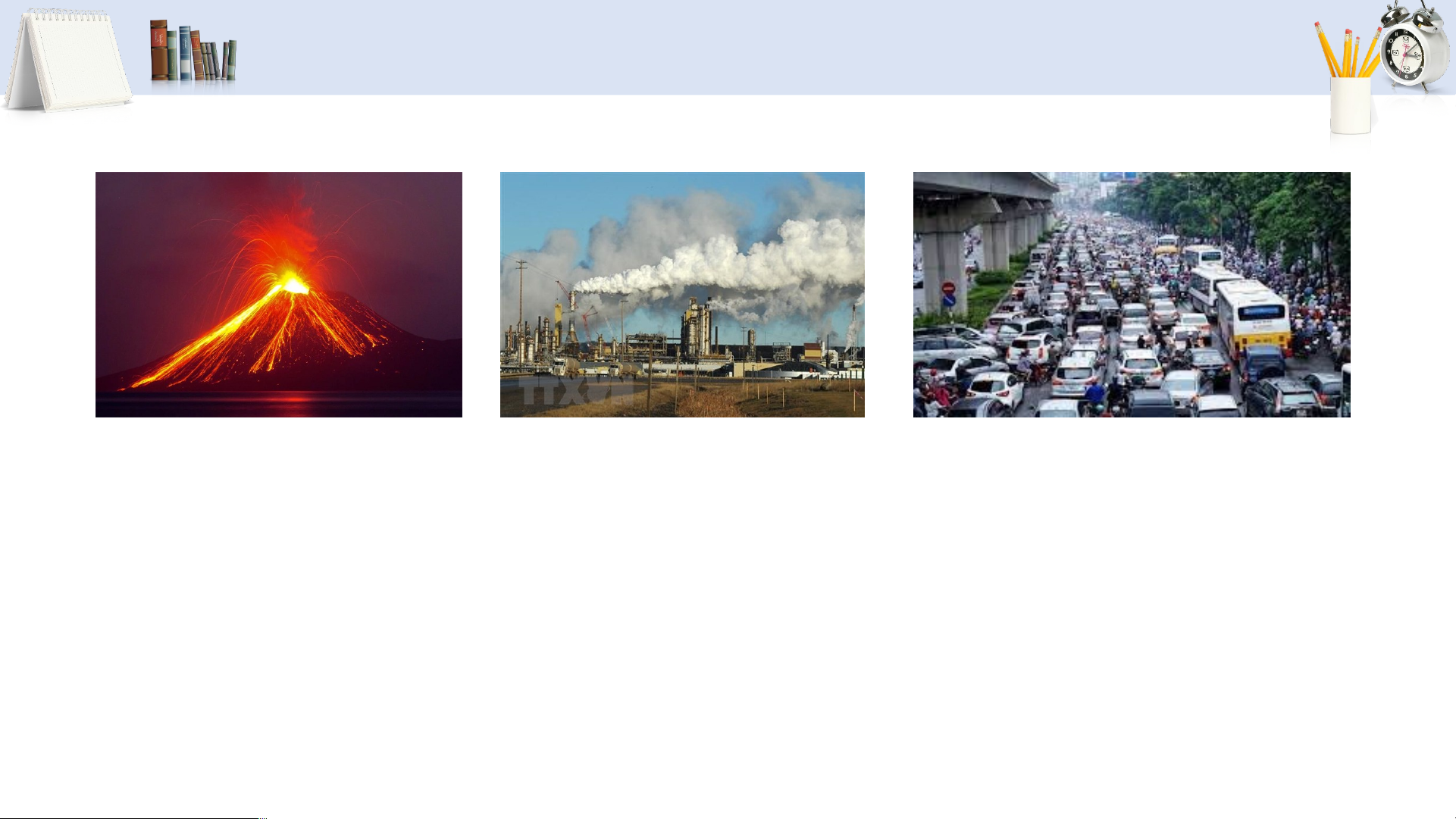
SỰ HÌNH THÀNH SO DO CON NGƯỜI VÀ TỰ NHIÊN 2 Núi lửa phun trào Nhà máy điện sử dụng Phương tiện giao thông nhiên liệu hóa thạch
Hãy quan sát các hình ảnh trên và cho biết hoạt động nào
Do con người / do tự nhiên sản sinh ra SO ? 2 24
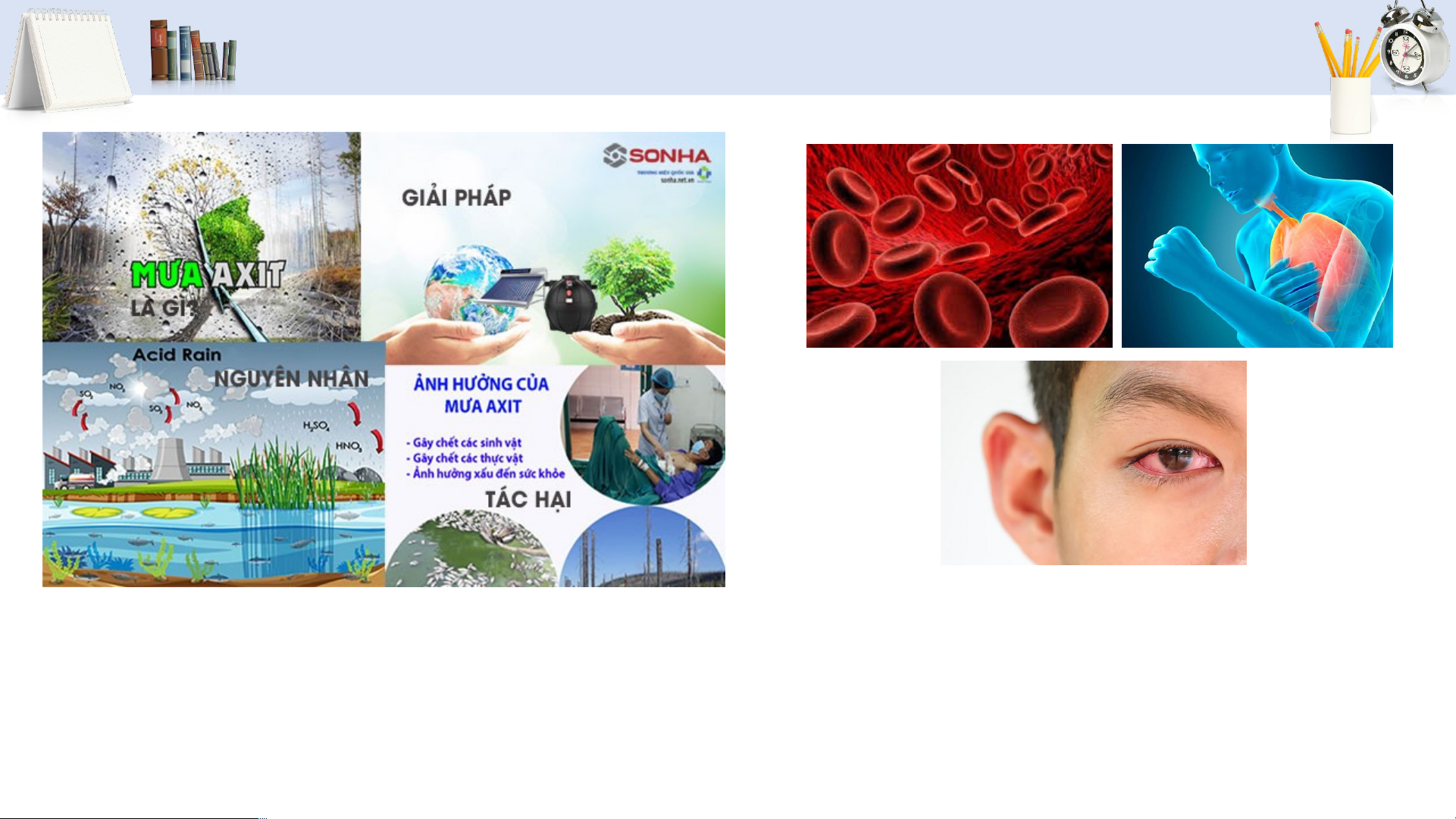
TÁC HẠI CỦA SULFUR DIOXIDE
• Tạo cảm giác khó thở, gây viêm hô hấp, đau mắt. Mưa acid
• Kết hợp với nước trong cơ thể tạo acid làm giảm
pH của máu, gây rối loạn chuyển hóa, giảm khả năng vận chuyển oxygen. 25
MỘT SỐ BIỆN PHÁP LÀM GIẢM THIỂU LƯỢNG
SO THẢI VÀO KHÔNG KHÍ 2
Thay thế nhiên liệu hóa thạch bằng nguồn
nhiên liệu thân thiện với môi trường Khai thác ngồn năng lượng tái tạo
Xử lý khí thải trước khi thải ra môi trường 26 TÓM TẮT BÀI HỌC S8
Trạng thái tự nhiên, khai thác + kim loại TCVL + H Tính khử 2 S Công nghiệp Tính oxi hóa S: 1s2 2s2 2p6 3s2 3p4 16 Đời sống Số oxh: -2; 0; +4, +6 + phi kim TÓM TẮT BÀI HỌC Chất khí không màu, mùi xốc, rất độc. tấ ch h ín t lí T vậ Acidic với bazơ Sự hình thành SO2 SO T 2 ín oxide h
Biện pháp giảm thiểu chấ h t óa với NO , Br h 2 2 ọc Tính khử Tính với H S 2 oxi hóa với KMnO4 LUYỆN TẬP
CÂU 1. Tính chất nào không phải tính chất vật lí của sulfur?
A. Màu vàng ở điều kiện thường.
B. Thể rắn ở điều kiện thường.
C. Không tan trong benzene. D. Không tan trong nước. LUYỆN TẬP
CÂU 2. Số oxi hóa của sulfur trong phân tử SO là 2 A. +4. B. +6. C. -2. D. 0. 30 LUYỆN TẬP
CÂU 3. Cho các phản ứng sau: a) S + O SO b) Hg + S HgS 2 2
c) S + 6HNO H SO + 6NO + 2H O 3 2 4 2 2 d) Fe + S FeS
Có bao nhiêu pư trong đó sulfur đóng vai trò là chất khử? A. 1. B. 2. C. 3. D. 4. 31 LUYỆN TẬP
CÂU 4. Khí SO do các nhà máy thải ra là nguyên nhân chính 2
trong việc gây ô nhiễm môi trường. Theo quy chuẩn kĩ thuật
quốc gia về chất lượng không khí xung quanh (QCVN
05:2013/BTNMT) thì nếu lượng SO vượt quá 350 g/m3 không 2
khí đo trong 1 giờ ở một thành phố thì coi như không khí bị ô
nhiễm. Nếu người ta lấy 50 lít không khí trong 1 giờ ở một thành
phố và phân tích thấy có 0,012 mg SO thì không khí ở đó có bị ô 2 32 nhiễm không? LUYỆN TẬP HƯỚNG DẪN GIẢI Đổi 0,012 mg = 0,012.103 = 12 g
1 m3 = 1000 dm3 = 1000 lít 50 lít = 0,05 m3
Lượng SO trong 50 lít không khí là: 2 = 240 g/m3 350 g/m3
=> Lượng SO này chưa vượt quá nồng độ bị ô 2 nhiễm 33
Vậy không khí trong thành phố này không bị ô nhiễm SO . 2 THANK YOU 34
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34




