




Preview text:
LỚ Chươ BÀI 7 P ng 2
SULFURIC ACID VÀ MUỐI SULFATE 1 1 TRÒ CHƠI Ô CHỮ 1 S U L F U R 2 S U L F U R D I O X I D E 3 T I N H A C I D 4 T I N H O X I H O A S U L F U R I C A C I D
Từ khóa: Đây là hợp chất của nguyên tố sulfur, là hóa Câu Câu Câu 1 . Ở đ 2. 3. 4. ... T..riều ... Khí .. on k ... hg iện ... p .. ydr hả t og n h ..là ườ en ứn n ch ch g g,. ấts a .. ku... h lorid : .. í, eS.là ch kth a
O + 2H S 3S + 2H O. Vai trò 2 ô n n tấrt g rắn, mà 2 u ong màu , n mù ước và i tạon g, xốc,t 2 kh đ hàn ông ộc, h n dặung
chất hàng đầu được dùng trong nhiều ngành công nghiệp. dịch của làm SO qu tro ỳ t n ím g p h h óa đ ản ứnỏ, ch
g là?ứng tỏ dung dịch thu được có .......... tan h t ơn ron kh2g ô nnước g kh í hơn hai lần. LỚ Chươ BÀI 7 P ng 2
SULFURIC ACID VÀ MUỐI SULFATE 1
I-Tính chất vật lí, cách bảo quản, sử dụng, nguyên tắc xử lí sơ bộ khi bỏng acid và 1
cấu tạo phân tử của sulfuric acid
PHIẾU HỌC TẬP SỐ 1
Câu 1. HS quan sát video thí nghiệm và trình bày:
- Tính chất vật lí của sulfuric acid: màu sắc, trạng thái tồn tại ở điều kiện thường.
- Nguyên tắc pha loãng sulfuric acid.
- Giải thích vì sao phải pha loãng theo nguyên tắc trên?
Câu 2. Nêu cách bảo quản sulfuric acid và
lưu ý khi sử dụng sulfuric acid?
Câu 3. Nêu nguyên tắc chung trong việc xử lí sơ bộ khi bỏng acid?
Câu 4. Mô tả cấu tạo phân tử của H SO . 2 4
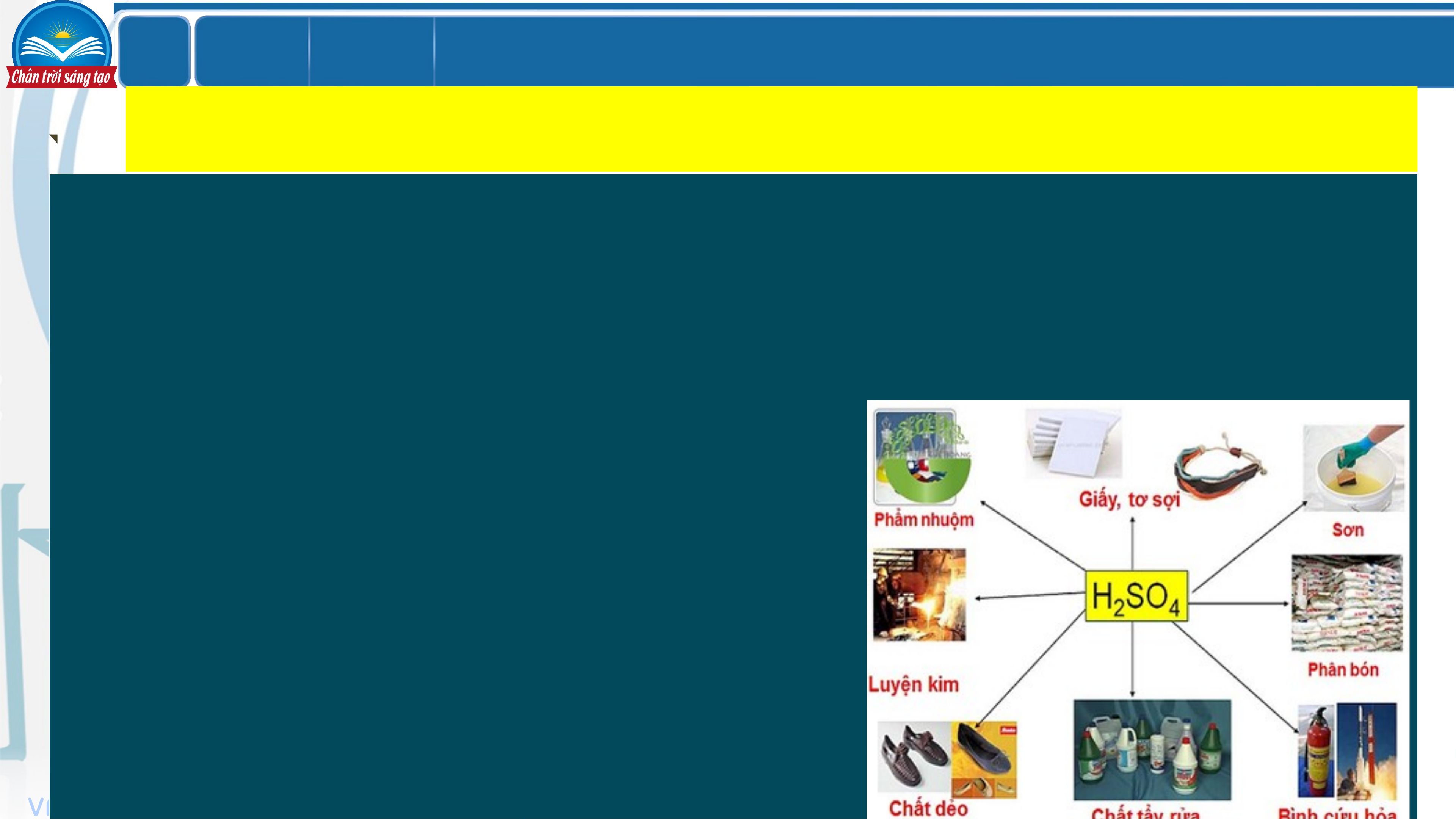
Câu 5. Trình bày tóm tắt ứng dụng của
sulfuric acid thông qua xem hình ảnh về
ứng dụng của sulfuric acid. LỚ Chươ BÀI 7 P ng 2
SULFURIC ACID VÀ MUỐI SULFATE 1 1 LỚ Chươ BÀI 7 P ng 2
SULFURIC ACID VÀ MUỐI SULFATE 1
I-Tính chất vật lí, cách bảo quản, sử dụng, nguyên tắc xử lí sơ bộ khi bỏng acid và 1
cấu tạo phân tử của sulfuric acid
TRẢ LỜI PHIẾU HỌC TẬP SỐ 1 Câu 1.
- H SO là chất lỏng không màu, sánh như dầu, không bay hơi, nặng gần gấp hai 2 4
lần nước (H SO 98% có D=1,84 g/cm3). 2 4
- H SO đặc dễ hút ẩm, tính chất này dùng để làm khô khí ẩm. 2 4
- Nguyên tắc pha loãng: rót từ từ H SO theo đũa thủy tinh vào nước và khuấy 2 4
đều, tuyệt đối không được làm ngược lại vì khi H SO tan trong nước, tạo thành 2 4
những hydrate H SO .nH O và tỏa một lượng nhiệt lớn. Nếu rót nước vào H SO 2 4 2 2 4
đặc, nước sôi đột ngột kéo theo những giọt H SO bắn ra xung quanh gây nguy 2 4 hiểm.
Ngược lại khi cho axit vào nước thì axit sẽ dần chìm xuống nước, sau đó phân bố
đều trong toàn bộ dung dịch như vậy khi có phản ứng xảy ra thì lượng nhiệt sẽ
được phân bố trong dung dịch. LỚ Chươ BÀI 7 P ng 2
SULFURIC ACID VÀ MUỐI SULFATE 1
I-Tính chất vật lí, cách bảo quản, sử dụng, nguyên tắc xử lí sơ bộ khi bỏng acid và 1 TRẢ LỜI cấu t P ạo ph HIẾU HỌC ân tử củ TẬP a sulfur SỐ 1 ic acid Câu 1.
- H SO là chất lỏng không màu, sánh như dầu, không bay hơi, nặng gần gấp hai lần 2 4
nước (H SO 98% có D=1,84 g/cm3). 2 4
- H SO đặc dễ hút ẩm, tính chất này dùng để làm khô khí ẩm. 2 4
- Nguyên tắc pha loãng: rót từ từ H SO theo đũa thủy tinh vào nước và khuấy đều, 2 4
tuyệt đối không được làm ngược lại vì khi H SO tan trong nước, tạo thành những 2 4
hydrate H SO .nH O và tỏa một lượng nhiệt lớn. Nếu rót nước vào H SO đặc, nước 2 4 2 2 4
sôi đột ngột kéo theo những giọt H SO bắn ra xung quanh gây nguy hiểm. 2 4
Ngược lại khi cho axit vào nước thì axit sẽ dần chìm xuống nước, sau đó phân bố
đều trong toàn bộ dung dịch như vậy khi có phản ứng xảy ra thì lượng nhiệt sẽ được
phân bố trong dung dịch. LỚ Chươ BÀI 7 P ng 2
SULFURIC ACID VÀ MUỐI SULFATE 1
I-Tính chất vật lí, cách bảo quản, sử dụng, nguyên tắc xử lí sơ bộ khi bỏng acid và 1
cấu tạo phân tử của sulfuric acid
TRẢ LỜI PHIẾU HỌC TẬP SỐ 1
Câu 2. Cách bảo quản sulfuric acid: đựng trong bình kín, để nơi khô ráo, tránh tiếp
xúc với kim loại, chất khử. Khi sử dụng sulfuric acid cần phải cẩn thận, tuân thủ đúng nguyên tắc an toán
Câu 3. Nguyên tắc chung trong việc xử lí sơ bộ khi bỏng acid:
- Cắt bỏ quần áo vùng bị dính acid;
- Rửa với nước sạch khoảng 20 phút;
- Nhanh chóng chuyển người bị bỏng đến cơ sở y tế gần nhất để theo dõi và điều trị. Câu 4. - CTPT: H SO . 2 4 - CTCT: LỚ Chươ BÀI 7 P ng 2
SULFURIC ACID VÀ MUỐI SULFATE 1
II-Tính chất hóa học của sulfuric acid 1
PHIẾU HỌC TẬP SỐ 2
Với những dụng cụ và hóa chất đã có sẵn, hãy làm các TN sau:
Thí nghiệm 1: H SO loãng 2 4
- Nhỏ vài giọt dung dịch H SO loãng vào giấy quỳ tím. 2 4
- Cho viên Zn vào ống nghiệm chứa 2 mL dung dịch H SO loãng 2 4
- Cho lá Cu vào ống nghiệm chứa 3 mL dung dịch H SO loãng, đun nóng. 2 4
- Nhỏ dung dịch BaCl vào ống nghiệm chứa 3mL dung dịch H SO loãng. 2 2 4
Thí nghiệm 2: H SO đặc 2 4
- Cho lá Cu vào ống nghiệm chứa 3mL dung dịch H SO đặc, đun nóng, dẫn khí thu 2 4
được vào dung dịch KMnO .4
- Rót 3 mL dung dịch H SO đặc vào cốc đựng đường tinh luyện (saccharose). 2 4
Quan sát hiện tượng xảy ra, viết các PTHH, xác định vai trò của sulfuric acid trong
từng phản ứng. Từ đó nêu tính chất hóa học của sulfuric acid loãng và đặc. LỚ Chươ BÀI 7 P ng 2
SULFURIC ACID VÀ MUỐI SULFATE II-1
Tính chất hóa học của sulfuric acid 1
TRẢ LỜI PHIẾU HỌC TẬP SỐ 2
Thí nghiệm 1: H SO loãng 2 4
- Nhỏ vài giọt dung dịch H SO loãng vào giấy quỳ tím. 2 4
Hiện tượng: Quỳ tím hóa đỏ. (sulfuric acid là acid mạnh, làm quỳ tím hóa đỏ)
- Cho viên Zn vào ống nghiệm chứa 2 mL dung dịch H SO loãng. 2 4
Hiện tượng: Khí thoát ra mạnh: Zn + H SO ZnSO + H 2 4 4 2
(Sulfuric acid loãng tác dụng với kim loại mạnh tạo muối và H ) 2
- Cho lá Cu vào ống nghiệm chứa 3 mL dung dịch H SO loãng, đun nóng. 2 4
Hiện tượng: Không có hiện tượng.
(Sulfuric acid loãng không tác dụng với kim loại yếu đứng sau H trong dãy hoạt động hóa học)
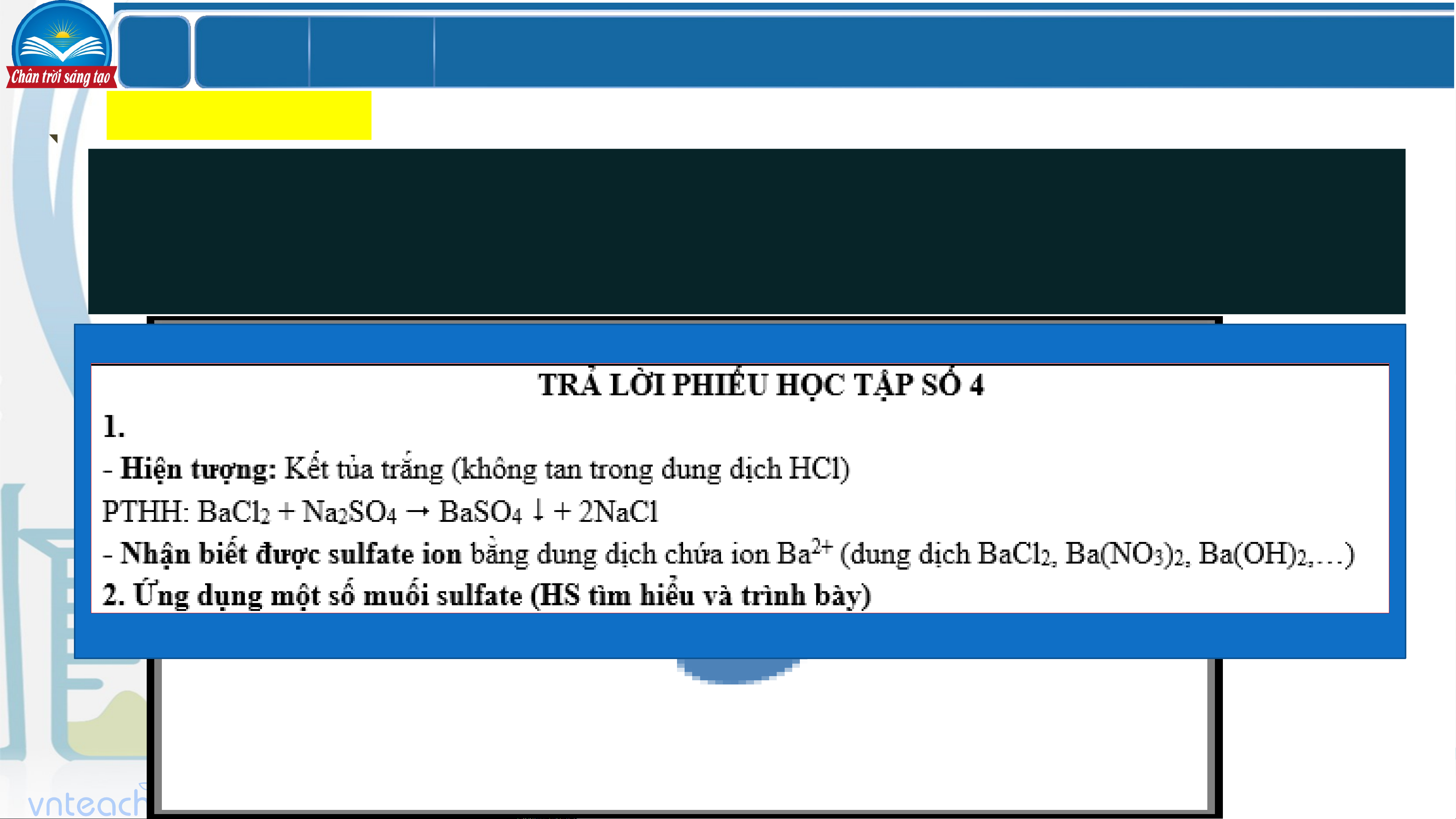
- Nhỏ dung dịch BaCl vào ống nghiệm chứa 3mL dung dịch H SO loãng. 2 2 4
Hiện tượng: Có kết tủa màu trắng tạo thành: H SO + BaCl → BaSO +2HCl 2 4 2 4
(Nhận biết gốc sulfate ta dung dịch chứa ion Ba2+) LỚ Chươ BÀI 7 P ng 2
SULFURIC ACID VÀ MUỐI SULFATE II-1
Tính chất hóa học của sulfuric acid 1
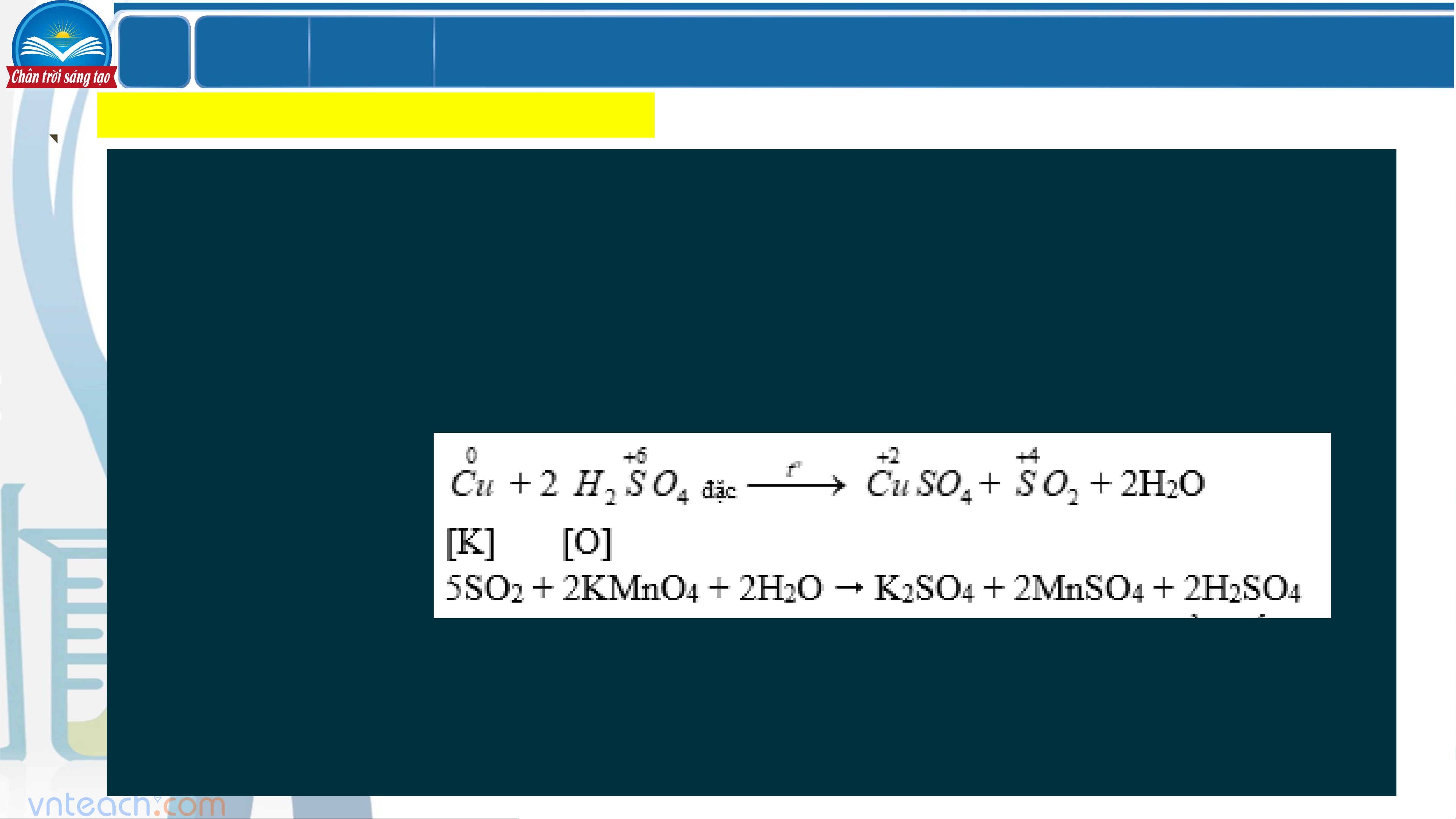
Thí nghiệm 2: H SO đặc 2 4
- Cho lá Cu vào ống nghiệm chứa 3mL dung dịch H SO đặc, đun nóng, dẫn khí thu 2 4
được vào dung dịch KMnO .4 Hiện tượng:
+ Có khí thoát ra làm nhạt màu dung dịch KMnO và dung dịch chuyển thành màu 4 xanh (màu của muối Cu2+)
(H SO đặc có tính oxi hóa mạnh, oxi hóa được hầu hết các kim loại (trừ Au, Pt) và 2 4
nhiều phi kim như C, S, P,… và nhiều hợp chất có tính khử; khi đó tạo sản phẩm khử là SO , S, H S) 2 2 LỚ Chươ BÀI 7 P ng 2
SULFURIC ACID VÀ MUỐI SULFATE II-1
Tính chất hóa học của sulfuric acid 1
Thí nghiệm 2: H SO đặc 2 4
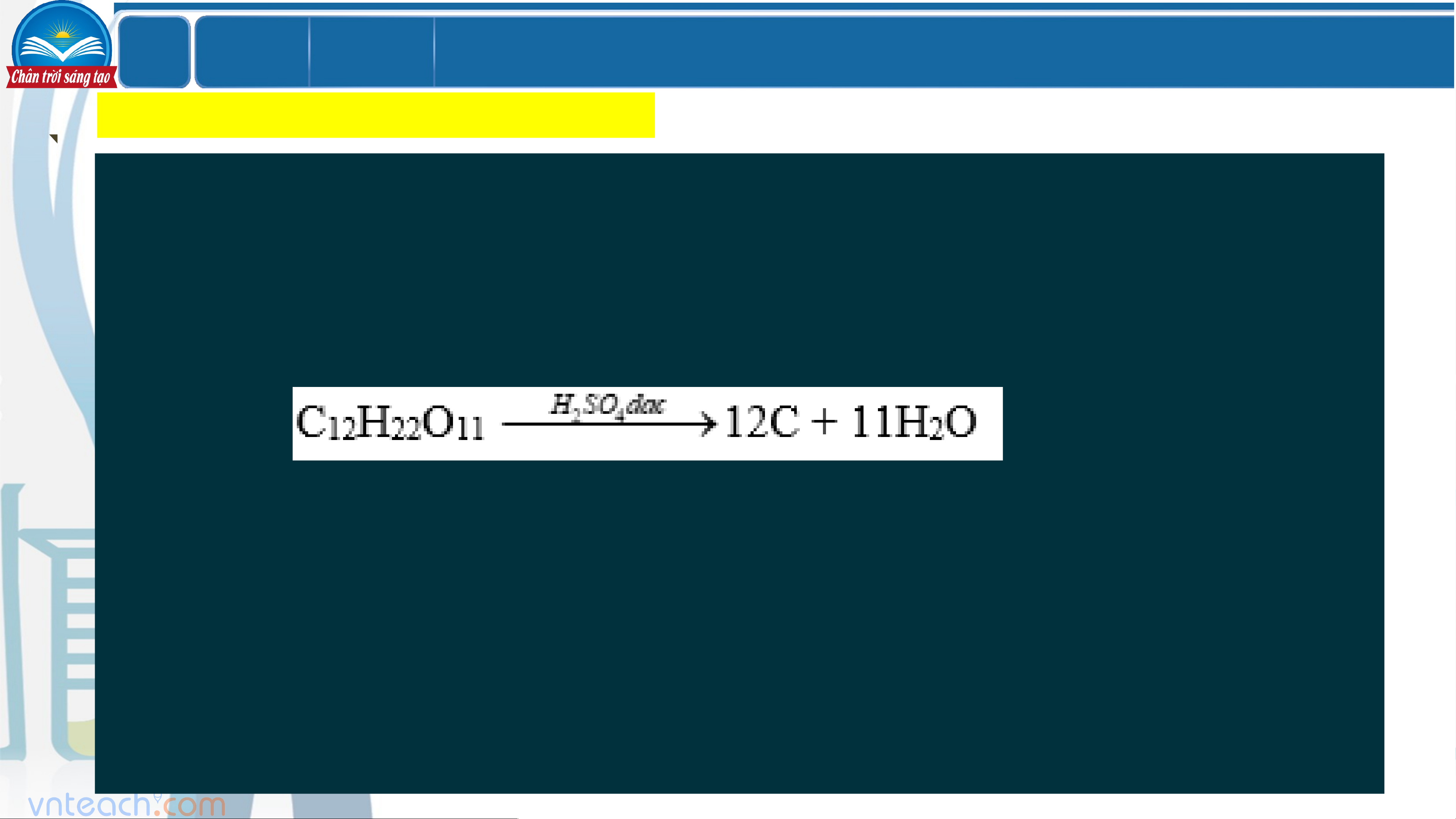
- Rót 3 mL dung dịch H SO đặc vào cốc đựng đường tinh luyện 2 4 (saccharose).
Hiện tượng: đường hóa than, trào lên miệng cốc
(H SO đặc có tính háo nước nên được dùng làm khô những khí không 2 4
tác dụng với H SO đặc như Cl , CO , SO ,…) 2 4 2 2 2 Vậy:
+ Sulfuric acid loãng là một acid mạnh, có đầy đủ tính chất chung của acid.
+ Sulfuric acid đặc có tính oxi hóa mạnh và có tính háo nước. LỚ Chươ BÀI 7 P ng 2
SULFURIC ACID VÀ MUỐI SULFATE I 1
II-Quy trình sản xuất sulfuric acid theo phương pháp tiếp xúc 1
PHIẾU HỌC TẬP SỐ 3 1. HS xem hình ảnh
2. “ Các công đoạn sản xuất
3. sulfuric acid trong công nghiệp”. Trình bày:
+ Nguyên liệu sản xuất sulfuric acid? + Phương pháp sản xuất?
+ Phương trình phản ứng từng giai đoạn?
2. Giải thích điều kiện phản ứng giai
đoạn tạo SO ở nhiệt độ 3 cao (450 oC – 500 oC)? LỚ Chươ BÀI 7 P ng 2
SULFURIC ACID VÀ MUỐI SULFATE I 1
II-Quy trình sản xuất sulfuric acid theo phương pháp tiếp xúc 1
TRẢ LỜI PHIẾU HỌC TẬP SỐ 3 1.
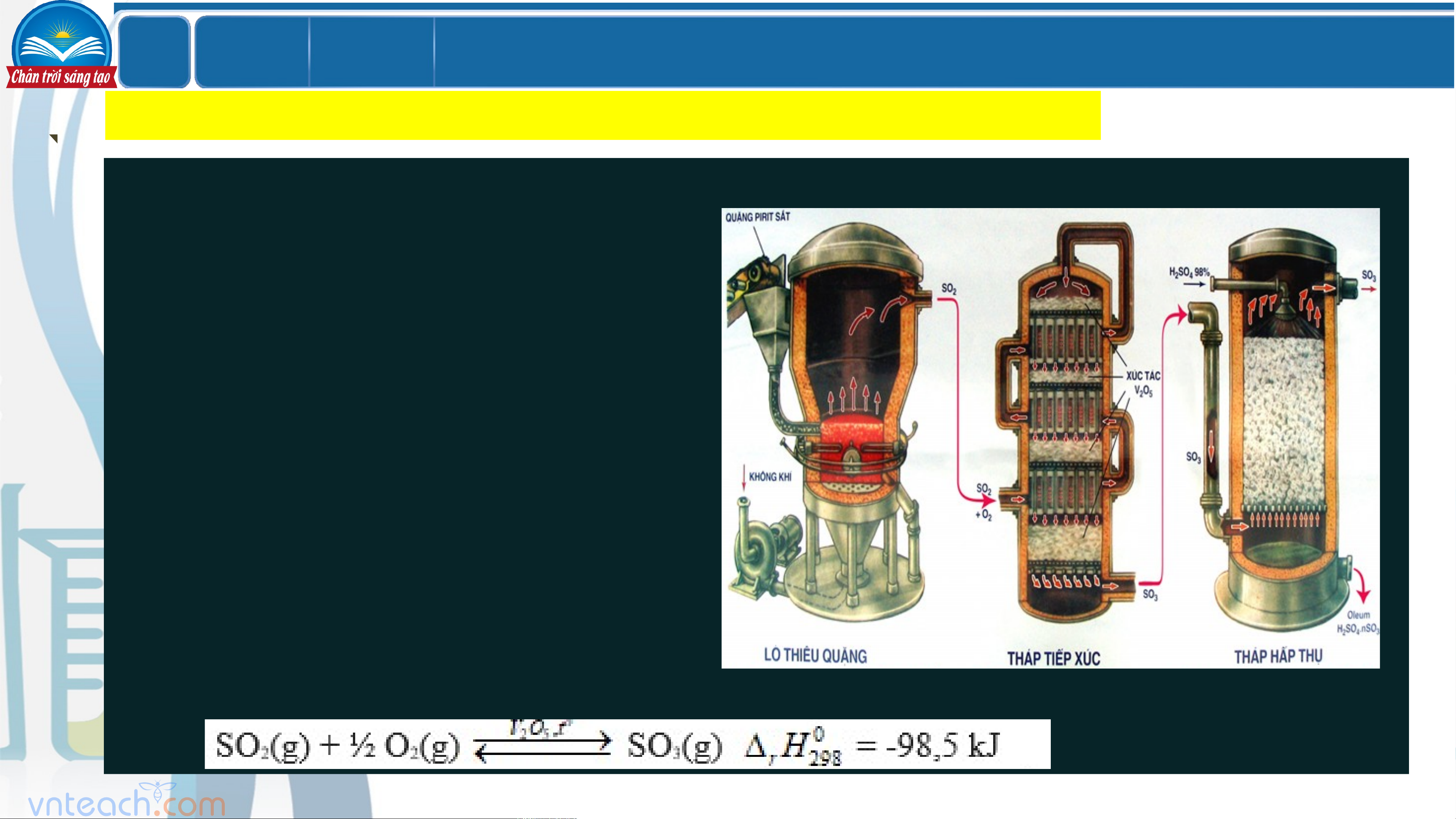
+ Nguyên liệu sản xuất sulfuric acid: quặng pirit sắt hoặc sulfur
+ Phương pháp sản xuất: Phương pháp tiếp xúc.
+ Phương trình phản ứng từng giai đoạn:
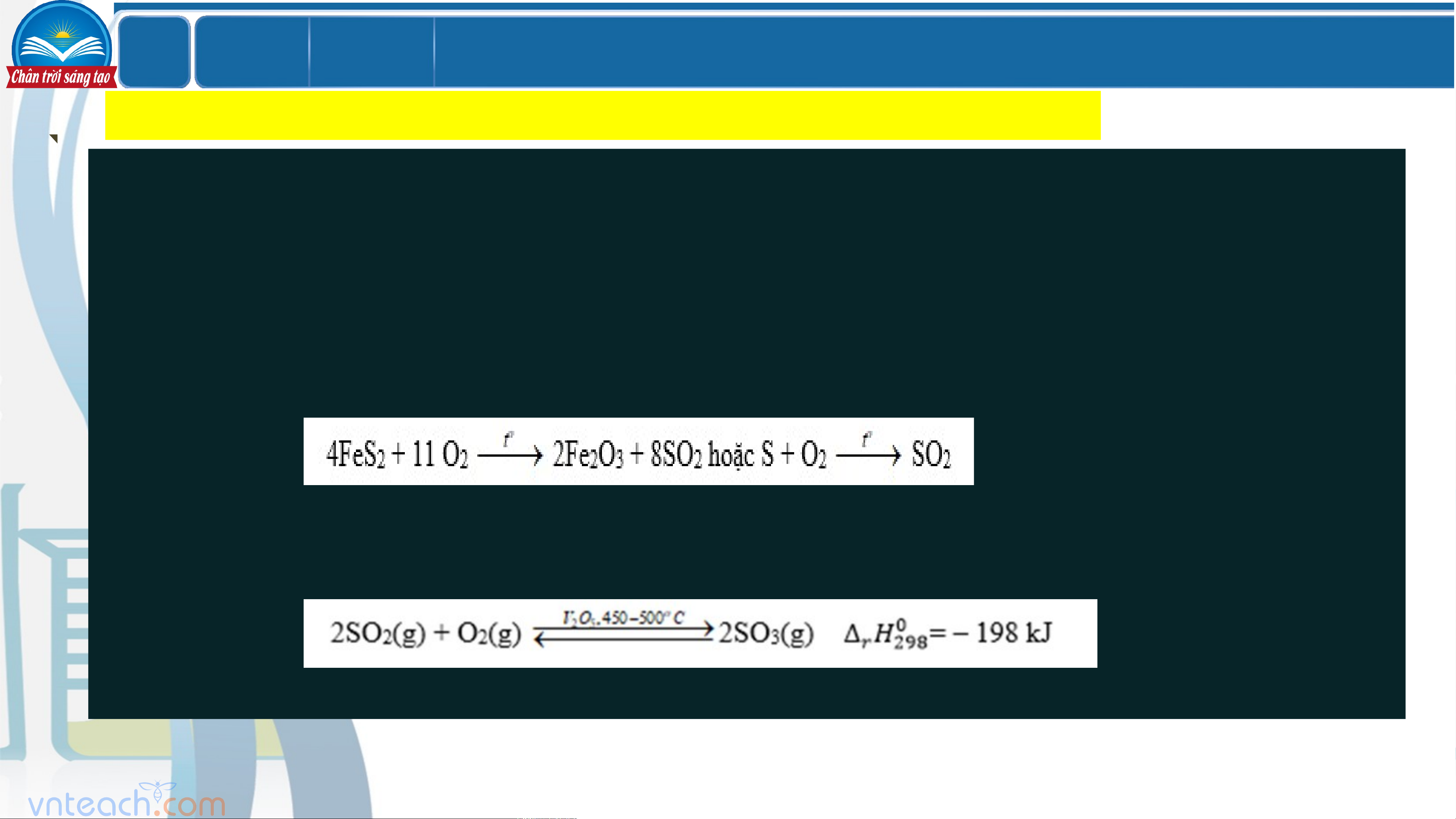
(1) Sản xuất sulfur dioxide: Thiêu quặng pirit sắt hoặc đốt cháy sulfur
(2) Sản xuất sulfur trioxide: Oxi hóa SO bằng oxygen hoặc lượng dư không khí 2
ở 450 - 500oC, xúc tác V O . 2 5 LỚ Chươ BÀI 7 P ng 2
SULFURIC ACID VÀ MUỐI SULFATE I 1
II-Quy trình sản xuất sulfuric acid theo phương pháp tiếp xúc 1
TRẢ LỜI PHIẾU HỌC TẬP SỐ 3
(3) Sản xuất sulfuric acid:
- Dùng dung dịch H SO 98% hấp thụ SO , thu được oleum 2 4 3 (H SO .nSO ) 2 4 3
- Pha loãng oleum bằng lượng nước thích hợp thu được dung dịch H SO đặc 2 4
2. Do phản ứng có phản ứng toả nhiệt
Nhưng nếu hạ nhiệt độ quá thấp thì sự chuyển động của các phân tử
khí giảm thực tế người ta phải chọn điều kiện phản ứng ở nhiệt độ cao
450oC – 500oC và có chất xúc tác. LỚ Chươ BÀI 7 P ng 2
SULFURIC ACID VÀ MUỐI SULFATE 1 IV-Muối sulfate 1
PHIẾU HỌC TẬP SỐ 4
1. HS xem video thí nghiệmMô tả hiện tượng thí nghiệm, viết phương trình hóa
học của phản ứng và kết luận về cách nhận biết sulfate ion.
2. Tìm hiểu và trình bày ứng dụng một số muối sulfate. LỚ Chươ BÀI 7 P ng 2
SULFURIC ACID VÀ MUỐI SULFATE 1 1 VẬN DỤNG LỚ Chươ BÀI 7 P ng 2
SULFURIC ACID VÀ MUỐI SULFATE 1 Làm quỳ tím hóa đỏ 1 Sulfuric acid loãng ACID
Tác dụng với base, basic oxide tạo muối sulfate và nước MẠNH Tác dụng với muối
Tác dụng với kim loại trước hydrogen (trong dãy HĐHH) Sulfuric acid đặc OXI
Oxi hóa hầu hết kim loại (trừ Au, Pt) TÍNH CHẤT HÓA Oxi hóa nhiều phi kim MẠNH HÓA HỌC
Oxi hóa nhiều hợp chất có tính khử Sulfuric acid đặc Làm khô nhiều khí HÁO NƯỚC
Gây bỏng nặng nên cẩn thận khi thí nghiệm với Sulfuric acid đặc LỚ Chươ BÀI 7 P ng 2
SULFURIC ACID VÀ MUỐI SULFATE 1 1
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18




