


















Preview text:
The largest lake of acid on the Earth. What is the lake’s name? And what is the acid? SULFURIC ACID VÀ MUỐI SUNFATE KẾT NỐI TRI THỨC 1. CẤU TẠO PHÂN TỬ I. SULFURIC CTPT : H SO M = 98 dvC 2 4 ACID H O O S H O O O HO S HO O Lk PHỐI TRÍ LK CHT 2. TÍNH CHẤT VẬT LÝ I. SULFURIC ACID Trạng Cách Ứng thái dụng pha tính tự loãng chất vật nhiên lý của sulfuric acid
a. Trạng thái tự nhiên I. SULFURIC
- Lỏng, đặc, sánh như dầu, không màu, không bay hơi. ACID
-CÓ nồng độ 98%, D=1,84 g/cm3 và nặng gấp hai lần nước. -Tan vô hạn trong nước b. Pha loãng sulfuric acid
Nguyên tắc: khi cần pha loãng dd axit H2SO4đ ta phải đổ từ từ ACID vào NƯỚC và khuấy đều. Không được làm ngược lại
c. Ứng dụng tính chất vật lý I. SULFURIC
- Hút ẩm để làm khô nhiều chất ACID
-Tách hơi nước có lẫn trong các chất khí như chlorine, carbon dioxide….. 3. Quy tắc an toàn I. SULFURIC ACID a. Bảo quản b. Sử dụng c. Sơ cứu khi bỏng acid 3a. Bảo quản I. SULFURIC Bảo quản trong ACID chai lọ, có nút đậy chặt đặt ở vị trí chắc chắn, cách xa các chất dễ gây nổ như Clorate, perchlorate, permanganate, dichromate… 3b. Sử dụng I. SULFURIC
1. Mặc đồ bảo hộ, găng tay, đeo kính ACID
2. Cầm công cụ chắc chắn, thao tác cẩn thận.
3. Không tì, đè chai dựng acid lên miệng cốc, ống đong khi rót acid
4. Sử dụng lượng acid vừa phải, lượng acid còn thừa phải thu hồi vào lọ đựng.
5. Không được đổ nước vào dung dịch acid đặc.
3c. Sơ cứu khi bị bỏng acid I. SULFURIC ACID
Rửa với nước lạnh
🡪 giảm nồng độ acid
3c. Sơ cứu khi bị bỏng acid I. SULFURIC ACID
Acid rơi vào mắt?????
Úp mặt vào chậu nước sạch, mở và chớp nhiều lần
3c. Sơ cứu khi bị bỏng acid I. SULFURIC ACID
Trung hòa acid = NaHCO (2%) BAKING SODA 3
3c. Sơ cứu khi bị bỏng acid I. SULFURIC ACID
BĂNG BÓ VẾT THƯƠNG – UỐNG NƯỚC ĐIỆN GIẢI – ĐẾN BỆNH VIỆN 4. TÍNH CHẤT HÓA HỌC
DUNG DỊCH SULFURIC ACID LOÃNG
1. Quỳ tím -> đỏ
2. Tác dụng với KL(đứng trước hidro) -> muối có số oxh thấp của kl + H2 Fe + H SO -> FeSO + H 2 4l 4 2
K Ba Ca Na Mg Al Zn Fe Ni Sn Pb H Cu Hg Ag Pt Au
3. Tác dụng với bazơ NaOH + H SO + H O 2 2 4l -> N a S O 2 2 4 2Al(OH) + 3 H SO Al (SO ) + H O 3 3 2 4l -> 2 4 3 2
4.Tác dụng với oxit KL CuO + H SO -> C uS O + H O 2 4l 4 2 Fe O + H 4 SO -> F eS O + Fe (SO ) 4 4 + H O 3 4 2 4l 2 4 3 2
5.Tác dụng với muối(sau pư……… có 🡡 …… hay🡫……) BaCl + H SO -> B aS O + H O 2 2 4l 2 4🡫 CaCO + H SO -> C a S O CO 🡡 4 + 2 + H O 3 2 4l 2
DUNG DỊCH SULFURIC ACID ĐẶC ♣ H SO đặc 2 4 +6 -2 H SO 0 +4 H S S SO 2 4 2 2
H SO có tính oxh mạnh 2 4
CÂN BẰNG PHẢN ỨNG OXH - KHỬ 0 +6 +2 +4 Zn + H 2 SO Z n S O + S O 2 + H 2 O 2 4 4 2 1 1 2 2 0 +6 +3 +4 2Fe + H 6 SO F e ( S O ) + 3 S O 2 + H 3 O 2 4 2 4 3 2 1 3 6 2
Quan sát, mô tả hiện tượng xảy ra và trả lời các câu hỏi sau:
1. Viết phương trình hóa học, và xác định chất oxh và chất khử 0 +6 +2 +4 Cu + 2H SO C uS O + S O + 2H O ? 2 4 4 ? 2 2 Chất Chất khử oxh
2. Nhận xét về khả năng phản ứng của dung dịch acid
sulfuric đặc nóng với copper Copper phản ứng H SO cho dung dịch màu xanh, 2 4 đặc và có khí thoát ra
1. Tác dụng với kim loại(trừ … A …… u, Pt .) 0 +3 +6 +4 2 Fe + 6H SO Fe (SO ) 2 4 + 3 3 S + O H O 6 2 4 ? ? 2 2 Muối có số SO2 M + H SO đ oxh cao + S + H O 2 4 2 nhất của kl H S 2 Al, Fe, Cr
♣CHÚ Ý : ……………….không tác dụng với H SO đặc 2 4 nguội.
2. Tác dụng với phi kim(C,S,P)🡪 CO , SO , H PO 2 2 3 4 0 +6 +4 2 SO C ? O + 2 2 S O + H 2 O 4 ?+4 C + H2 2 2 0 +6 +4 S + 2H SO 3 S O 2 + H 2 O 2 4 ? 2 0 +5 P 2 + 5 H SO 5 S O +2H PO + H 2 O ? 2 4 2 ? 3 4 2
3. Tác dụng với chất khử khác +2 +3 F 2 eO + 4H SO Fe (SO ) + SO + H4 O 2 4 2 4 3 2 2 +8/3 +3 2Fe O + H 12 SO 3 Fe (SO ) + SO 3 + H 12O 3 4 2 4 2 4 3 3 2 +3 +3 Fe O + H SO Fe (SO ) + H O 2 3 2 4 2 4 3 2 Khô n g l à chất khử
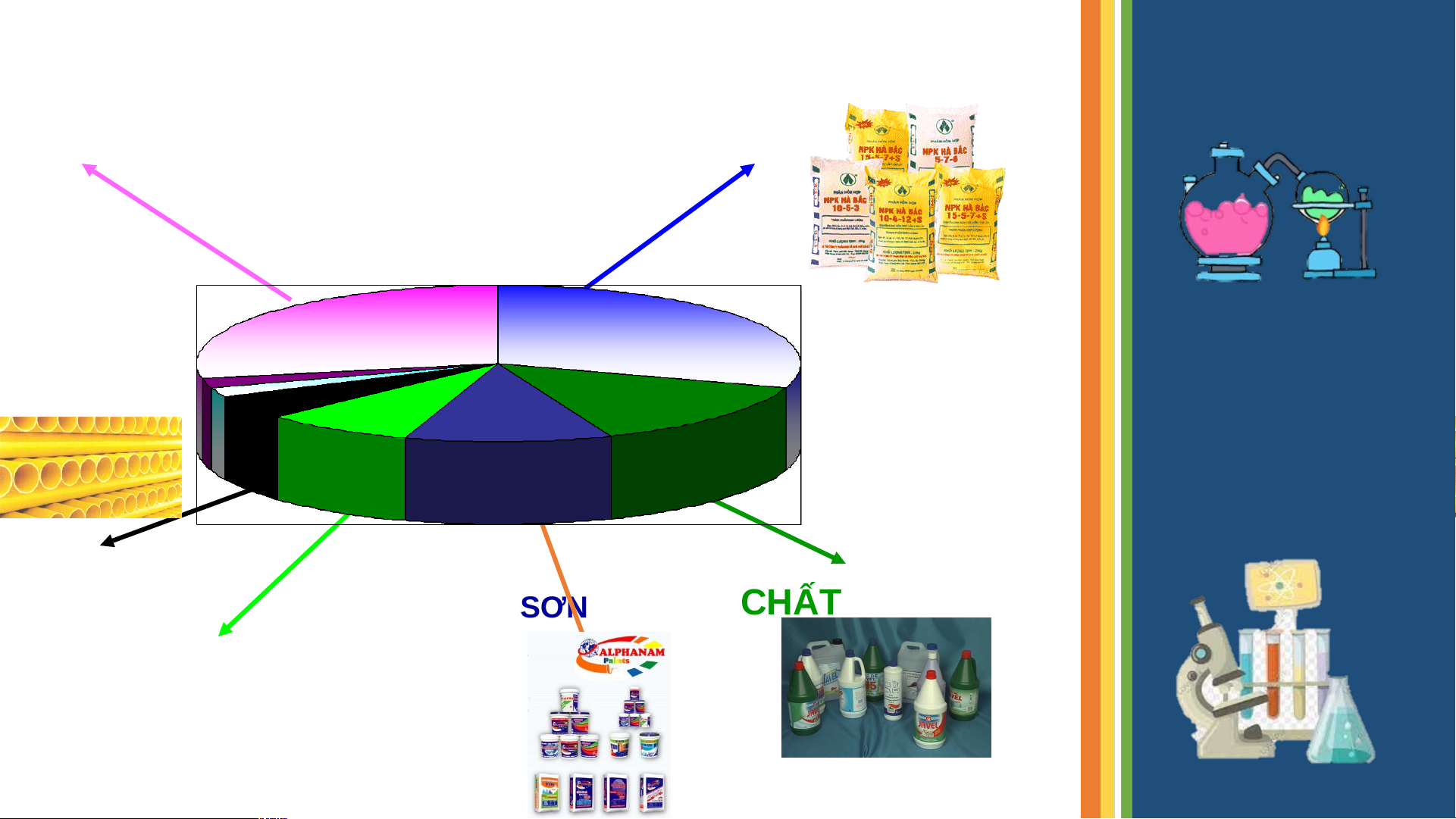
4. Tính háo nước
CuSO .5H O + H SO Đ CuSO +H SO .5H O 4 2 2 4 4K 2 4 2 Màu xanh Màu trắng C H O + H SO + 12C ? H SO .11H O 12 22 11 2 4 2 4 2 C (H O) + H SO n C + H SO .mH O n 2 m 2 4 2 4 2 5. ỨNG DỤNG PHÂN BÓN ƯD KHÁC 28% 30% 5% 8% 11% 14% CHẤT DẺO SƠN CHẤT TẨY RỬA GIẤY 5. SẢN XUẤT 5. SẢN XUẤT
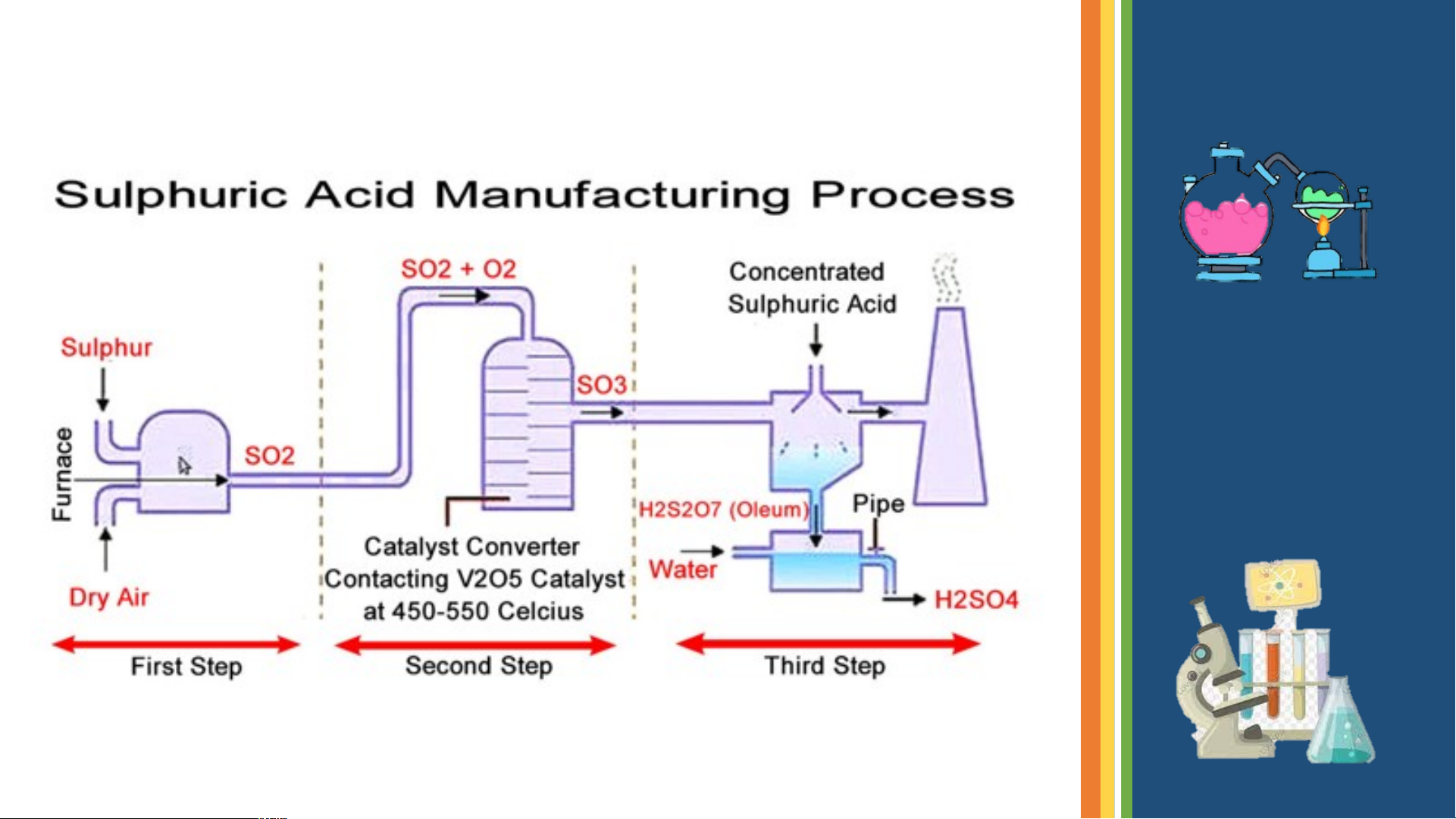
GỒM 3 GIAI ĐOẠN
•GIAI ĐOẠN 1 : sản xuất SO2
♣Đốt quặng pirit sắt 4FeS + 11O 8SO + 2Fe O 2 2 2 2 3
♣ Đốt cháy S S + O SO 2 2
•GIAI ĐOẠN 2 : sản xuất SO3 V O -450-5000C 2SO + O 2 5 2SO 2 2 3 H SO + nSO H SO .nSO 2 4 3 2 4 3 OLEUM
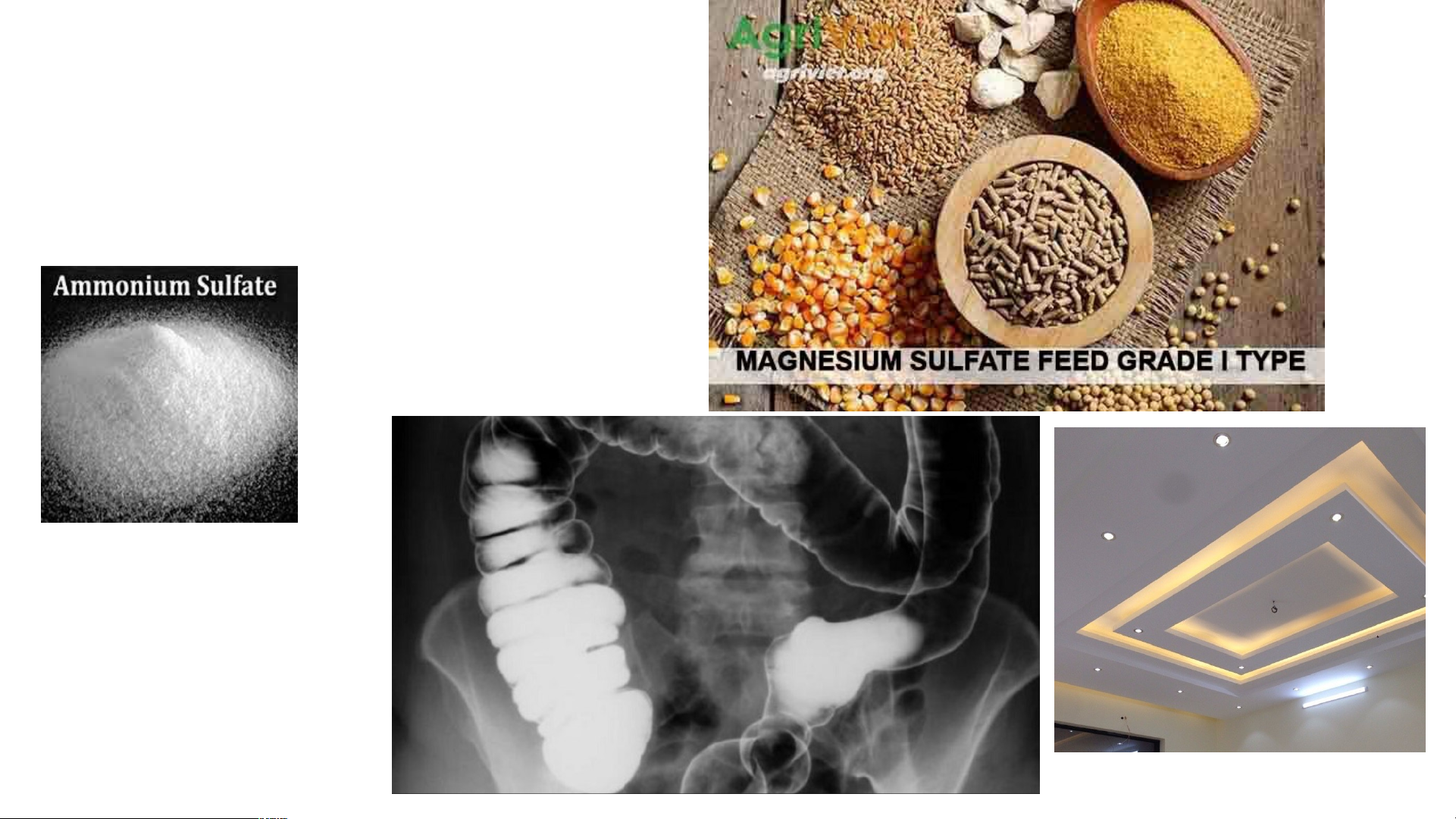
H SO .nSO + nH O (n+1)H O 2 4 3 2 2 II. MUỐI SULFATE THỨC ĂN GIA SÚC 1. Ứng dụng BARIUM SULFATE CALCIUM SULFATE PHÂN ĐẠM CHẤT CẢN QUANG THẠCH CAO
2. NHẬN BIẾT MUỐI SUNFAT II. MUỐI
-Dùng dung dịch có chứa ion Ba2+ để nhận biết SULFATE
ion SO 2- trong axit hay muối, 4
-có hiện tượng : kết tủa trắng không tan trong nuớc và axit PTPƯ :
H SO + Ba(OH) BaSO +2H O 2 4 2 4 2
Na SO + BaCl BaSO + 2NaCl 2 4 2 4
1) H SO đ là một axit có tính oxh mạnh tác 2 4
dụng với hầu hết các KL, vậy để vận chuyển III.
axit này ta làm bằng cách nào? Vì sao? ÔN TẬP
- Người ta dùng những thùng làm bằng Al, Fe
chứa H SO để vận chuyển. 2 4
- Vì Al, Fe thụ động trong axit H SO đặc nguội 2 4
2) Để làm khô khí CO có lẫn hơi nước, người 2 III. ta dùng : ÔN a) H SO Đ 2 4 TẬP b)KOH a c)CuO d)CaO
3) BỔ TÚC CHUỖI PƯ III. ÔN + H O + Br ) 2 2 + O + Al + Pb(NO3 2 FeS 2 SO H SO H S 2 4 2 2 2 TẬP + CuO + NaOHSO + O2 CuS 2 Cu(NO ) 3 2 + Na S 2
4.hoàn thành phương trình phản ứng sau : III. a) Zn + H SO 2 4 b) ZnO + H SO ÔN 2 4 c) Ba(NO ) + H SO 3 2 2 4 TẬP d) Fe(OH) + H SO 3 2 4 e) Zn + H SO 2
4đ,nóng ……+ S + ……….. f) Cu + H SO 2 4đ,nóng g) S + H SO + ……….. 2 4đ,nóng SO2 h) HI + H SO + H S + ……….. 2 4đ,nóng I2 2 0 +6 +2 a) Zn + H SO ZnSO + H 2 4 4 2 III. +2 +2 b) ZnO + H SO ZnSO + H O 4 2 ÔN 2 4 TẬP c) Ba(NO ) + H SO BaSO + H 2 NO 3 2 2 4 4 trắng 3 +3 +3 d) 2 Fe(OH) + H 3 SO Fe (SO ) + H 3 O 3 2 4 2 4 3 2 0 +2 0 +6 e) 2Zn + 4 H SO 3ZnSO 4 4 + H O 2 4đ,nóng + S 2 0 +6 +2 +4 f) Cu + 2 H SO CuSO + SO + H 2 O 2 4đ,nóng 4 2 2 III. 0 +6 +4 g) S + 2H SO 3 + …… 2 H …. O 2 . ÔN 2 4đ,nóng SO2 TẬP -1 +6 0 -2 8 2 4 2 H S + 4H O 2 2 -1 0 *4 2I +2*1e I2 +6 +4 *1 S S + 8e
5.nhận biết các dung dịch mất nhãn Ba(NO ) , K SO , 3 2 2 3 K SO , KNO , III. 2 4 3 HNO3 quỳ tím ÔN HNO Ba(NO ) , K SO , 3 3 2 2 4 quỳ tím hoá đỏ K SO , KNO 2 3 3 TẬP H SO 2 4 Ba(NO ) K SO 3 2 3 BaSO Kết K SO , KNO (SO )Sủi bọt khí 4 2 4 3 2 tủa trắng BaCl2 K SO 2 4 kết tủa trắng KNO3 NaCl, NaNO , 3 NaOH, HCl, HNO3 III. quỳ tím ÔN NaOH HCl, HNO3 quỳ tím quỳ tím NaCl, NaNO3 hóa xanh hóa đỏ TẬP AgNO AgNO3 3 HCl NaCl AgCl Kết AgCl kết tủa trắng tủa trắng HNO NaNO 3 3 Remember… Safety First!
(CHEMISTRY 11 – KET NOI TRI THUC)
Document Outline
- Slide 1
- Slide 2
- 1. CẤU TẠO PHÂN TỬ
- 2. TÍNH CHẤT VẬT LÝ
- a. Trạng thái tự nhiên
- Slide 6
- c. Ứng dụng tính chất vật lý
- 3. Quy tắc an toàn
- 3a. Bảo quản
- 3b. Sử dụng
- 3c. Sơ cứu khi bị bỏng acid
- 3c. Sơ cứu khi bị bỏng acid
- 3c. Sơ cứu khi bị bỏng acid
- 3c. Sơ cứu khi bị bỏng acid
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40