
















Preview text:
CÔNG NGHỆ VẬT LIỆU TRONG Y SINH HỌC
ThS. Trần Lê Bảo Hà I. VẬT LIỆU SINH HỌC 1. Khái niệm
Một vật liệu sinh học là bất kỳ chất hoặc hợp chất nào (không phải là thuốc)
có nguồn gốc tổng hợp hoặc tự nhiên, được dùng để điều trị, tăng cường hoặc thay
thế mô, cơ quan hoặc chức năng của cơ thể (NIH)
Vật liệu sinh học là các vật liệu (tổng hợp và tự nhiên, rắn và lỏng) được sử
dụng trong các thiết bị y học (medical device) hoặc trong tiếp xúc với hệ sinh học
(University of Washington Engineered Biomaterials).
Mặc dù các vật liệu sinh học chủ yếu được ứng dụng trong y học nhưng
chúng cũng được sử dụng trong nuôi cấy tế bào, xử lý các phân tử sinh học trong
công nghệ sinh học, thủy sản, nông nghiệp… 2. Phân loại
Vật liệu sinh học được phân thành: vật liệu sinh học có nguồn gốc sinh học và vật
liệu sinh học tổng hợp.
- Vật liệu sinh học có nguồn gốc sinh học: vật liệu mô mềm và mô cứng
- Vật liệu sinh học tổng hợp: kim loại, polymer, gốm, composit
2.1. Sự khác biệt giữa vật liệu sinh học có nguồn gốc sinh học và vật liệu sinh học tổng hợp
Vật liệu sinh học có nguồn gốc sinh học và vật liệu sinh học tổng hợp có các
đặc tính khác nhau đáng kể. Ví dụ, mô gồm nhiều tế bào; kim loại, gốm, polymer
thì không có tế bào. Mô có khả năng tự sửa chữa một phần hoặc toàn bộ; kim loại, gốm, polymer thì không…
Vật liệu sinh học có nguồn gốc sinh học Vật liệu sinh học tổng hợp Có tế bào Không có tế bào Có nước Khan Không đẳng hướng Đẳng hướng Không đồng nhất Đồng nhất Viscoelastic Mềm dẻo, đàn hồi
Có khả năng tự sửa chữa/sống Không sống 1
Ví dụ về sự khác nhau giữa mô và vật thay thế mô: thành mạch máu. Lót trong
lòng mạch máu là các tế bào nội mô. Các thành phần cấu trúc chính dưới nội mô
gồm các tế bào cơ trơn, collagen và elastin. Số lượng các thành phần này và hướng
của các sợi phụ thuộc vào vị trí trong mô mạch, loại mạch (động mạch, tĩnh mạch)
và kích thước của mạch máu. Để thay thế mô phức tạp này, các ống polymer
polytetrafluoroethylene hoặc poly(ethylene terephthalate) thường được sử dụng
làm vật ghép tổng hợp.
Các loại mô và một số vật liệu sinh học được sử dụng để thay thế Mô
Vật liệu tổng hợp thay thế Mạch máu Polytetrafluoroethylene Poly(ethylene terephthalate) Kính sát tròng Polymethylmethacrylate Hông Ti-6Al-4V Co-Cr-Mo Răng Amalgam Ti
2.2. Phân loại vật liệu sinh học
I. Vật liệu sinh học có nguồn gốc sinh
II. Vật liệu sinh học tổng hợp học 1. Mô mềm 1. Polymer
Da, gân, màng ngoài tim, giác mạc
Ultra High Molecular Weight Polyethylene ( UHM WPE), Polymethylmethacarylate
(PMMA), Polyethyletherketone (PEEK), Silicone, Polyurethane (PU),
Polytetrafluoroethylene (PTFE) 2. Mô cứng 2. Kim loại Xương, răng
Thép không gỉ, hợp kim Cobalt (Co-Cr-
Mo), hợp kim Titan (Ti-Al-V),vàng, bạch kim 2 3. Gốm
Alumina (A 1203), Zirconia (Zr02), Carbon,
Hydroxylapatite [CalO( PO&( OH)z],
Tricalcium Phosphate [Caj(PO4)2],
Bioglass [Na20( CaO)(P203)(Si02)],
Calcium Aluminate [Ca(A1204)] 4. Composit Carbon Fiber (CF)/PEEK, CF/UHMWPE,
CF/PMMA , Zircon idSil icdB IS –GMA 3. Yêu cầu
Các vật liệu sinh học phải có các đặc tính đặc biệt như: tính tương hợp sinh
học, không sinh khối u, kháng xói mòn, có độc tính thấp. Tuy nhiên, tùy thuộc vào
ứng dụng, các vật liệu cần đạt các yêu cầu khác nhau. Đôi khi, các yêu cầu này
ngược nhau hoàn toàn. Ví dụ: trong công nghệ mô xương, khung (scaffold)
polymer cần có khả năng phân hủy sinh học để khi các tế bào tạo ra chất nền ngoại
bào của riêng chúng thì vật liệu polymer sẽ được thay thế hoàn toàn. Trong van
tim cơ học, các vật liệu cần có tính ổn định sinh học, kháng xói mòn và không
phân hủy theo thời gian (tồn tại hơn 20 năm).
Nói chung, các yêu cầu của vật liệu sinh học có thể được phân thành 4 nhóm:
1) Tính tương hợp sinh học: vật liệu phải không gây phản ứng không tốt
của vật chủ nhưng kích thích sự hòa hợp mô - vật ghép tốt. Sự xuất hiện phản ứng
viêm là điều cần thiết trong tiến trình lành hóa vết thương. Tuy nhiên, sự viêm kéo
dài có thể chỉ ra sự hoại tử mô hoặc không có tính tương hợp.
2) Có thể khử trùng: vật liệu có thể chịu được sự khử trùng. Các kỹ thuật
khử trùng gồm: tia gamma, khí (ethylene oxid) và hấp hơi nước. Một số polymer
như polyacetal sẽ khử polymer hóa và sinh ra khí độc formaldehyd khi được chiếu
dưới tia gamma năng lượng cao. Do đó, cách tốt nhất để khử trùng các polymer này là khí ethylene oxid.
3) Có tính chức năng: Tính có chức năng của một bộ phận giả tùy thuộc vào
khả năng tạo được hình dáng phù hợp với một chức năng đặc biệt. Do đó, vật liệu
phải được tạo hình dáng bằng các quy trình chế tạo công nghệ. Sự thành công của
stent động mạch vành (loại vật liệu y học được sử dụng rộng rãi nhất) được cho là
nhờ quy trình chế tạo hiệu quả thép từ việc xử lý nhiệt để tăng độ bền của nó. 3
4) Có thể chế tạo: Nhiều vật liệu có tính tương hợp sinh học nhưng trong
khâu cuối cùng (khâu chế tạo thành công cụ) không thực hiện được.
II. TÍNH TƯƠNG HỢP SINH HỌC CỦA VẬT LIỆU
II.1. TỔNG QUÁT VỀ ĐÁP ỨNG MIỄN DỊCH ĐẶC HIỆU (THE SPECIFIC IMMUNE RESPONSE)
Đáp ứng miễn dịch đặc hiệu là phản ứng bình thường của động vật có
xương sống khi một vật lạ được đưa vào cơ thể. Đây là một phản ứng bảo vệ để
giải độc, trung hòa và giúp loại trừ vật lạ.
Tuy nhiên, trong một số trường hợp, các phản ứng với những vật không độc
có thể gây hại cho cơ thể chủ như các phản ứng dị ứng hoặc quá mẫn.
Các đáp ứng được phân thành bốn loại: loại I, loại II, loại III, loại IV. Bốn
đáp ứng này theo một cơ chế thông thường, được kích động do sự hiện diện của
một vật lạ là kháng nguyên (antigen). Các tế bào trình diện kháng nguyên (antigen
processing cell - APC), thường là tế bào đơn nhân (monocyte) hoặc đại thực bào
(macrophage) hay tế bào bạch tuộc (dendritic) da, bắt kháng nguyên, xử lý nó (cắt
bằng enzym) và chuyển nó (trình diện) đến tế bào khác là tế bào lympho T hỗ trợ
(T helper cell - Th). Sau đó, tế bào Th trình diện kháng nguyên đã được xử lý cho
một tế bào lympho T khác là tế bào T độc (T cytotoxic cell - Tc ) hoặc cho tế bào
lympho B (tế bào B). Tế bào nhận (tế bào T hoặc B) bắt đầu một đáp ứng tác động
kháng nguyên đã được xử lý, tạo một phức hợp hoạt động. Trong trường hợp tế
bào nhận là tế bào T thì đáp ứng miễn dịch là loại IV hay miễn dịch qua trung gian
tế bào. Trường hợp tế bào nhận là tế bào B, kết quả cuối cùng là giải phóng kháng
thể tự do, dẫn đến đáp ứng loại I, II, III thuộc thể dịch. Trong đáp ứng tế bào T,
các tế bào T sẽ tập trung ở vùng hiện diện vật lạ. Trong khi các tế bào B vẫn ở xa
(trong các mô bạch huyết), các kháng thể lưu thông và xuất hiện tại vùng có vật lạ.
Các đặc điểm chính của bốn loại đáp ứng: Loại Kháng Các tế bào liên Các chất trung Kết quả thể quan gian I IgE Tế bào B
Histamin, các Ngứa, viêm mũi, amin vận mạch giãn mạch II IgG, IgM Tế bào B Histamin, các Giãn mạch amin vận mạch III IgG, IgM Tế bào B
Các amin vận Đau, sưng, nghẽn mạch mạch, giãn mạch IV Không có Tế bào T Cytokin Đau, sưng 4
Tế bào T và tế bào B tăng sinh từ một tế bào gốc và trải qua quá trình xử lý
trong tuyến ức để trở thành các tế bào T hoặc trong một vùng chưa biết (có lẽ là
tủy xương) để trở thành các tế bào B. Rất khó phân biệt hai loại tế bào này. Có thể
nhận diện các tế bào T thông qua các marker duy nhất trên bề mặt tế bào nhờ sử
dụng các kháng thể đơn dòng. Các kháng nguyên này là các dấu ấn cụm biệt hóa
(cluster differentiation markers - CDs). Có nhiều loại CD và tầm quan trọng của
mỗi loại đang được đánh giá. Tuy nhiên, tất cả tế bào T đều biểu hiện CD3 và
được xem là dấu ấn tế bào T Pan (Pan = all - tất cả). CD2 cũng có thể là một dấu
ấn tế bào T Pan. Ngoài ra, tế bào Th còn biểu hiện CD4, trong khi tế bào Tc biểu hiện CD8.
Tế bào B có một ít kháng thể trên bề mặt và có thể nhận diện tế bào B dựa
vào các kháng thể này. Đáp ứng tế bào B dẫn đến biệt hóa thành tương bào sản
xuất nhiều kháng thể hơn. Kháng thể là một globulin miễn dịch (Immunoglobulin -
Ig) có các vùng kết hợp đặc hiệu với kháng nguyên. Kháng thể có thể hòa tan, tuần hoàn trong huyết tương.
Có 5 lớp Ig. Nồng độ Ig trong máu người bình thường từ cao nhất đến thấp
nhất là IgG, IgM, IgA, IgE, IgD. IgE là kháng thể có liên quan đến đáp ứng loại I.
IgA là một Ig tiết, có nồng độ cao trong nước bọt, dạ dày-ruột, sữa và các cơ quan
liên quan. IgG và IgM có nồng độ cao trong máu và là các kháng thể “xuất sắc”
cho thử nghiệm miễn dịch học vì chúng có thể tham gia đáp ứng loại II và loại III.
Kết quả của đáp ứng loại I và loại II là giống nhau nhưng cơ chế khác nhau.
Đáp ứng loại I được biết rõ nhất là sốt và dị ứng bụi và là đáp ứng miễn dịch với
các kháng nguyên qua trung gian kháng thể cố định trên da (IgE). Đáp ứng loại II
liên quan đến phản ứng của IgG (hiếm khi IgM) với một kháng nguyên bề mặt tế
bào. Kết quả là ly giải tế bào cùng với giải phóng các sản phẩm. Điều này thường
thấy trong dị ứng thuốc mà gắn với tiểu cầu máu.
Đáp ứng loại III được xem là các phản ứng phức hợp miễn dịch và xảy ra
khi cả kháng nguyên và kháng thể hiện diện cùng một lúc với số lượng lớn. Trong
đáp ứng miễn dịch bình thường, kháng nguyên được xử lý, đáp ứng miễn dịch bắt
đầu và kháng nguyên nhanh chóng biến mất. Tuy nhiên, nếu kháng nguyên bền thì
số lượng rất lớn các phức hợp miễn dịch có thể được tạo ra làm tắc nghẽn các
mạch máu nhỏ và kết quả là hư hỏng mô hoặc cơ quan.
Đáp ứng loại IV liên quan đến sự hiện diện thường xuyên của vật ngoại lai,
như là một vật liệu sinh học ghép. Điển hình là chứng viêm da tiếp xúc do cây thường xuân (ivy) độc.
Trong mỗi trường hợp, một kháng nguyên kích thích đáp ứng miễn dịch và
đáp ứng miễn dịch trở lại phản ứng đặc hiệu với kháng nguyên. Mỗi tế bào T, mỗi
tế bào B và mỗi kháng thể lưu thông chỉ nhận biết một kháng nguyên. Để một chất
là sinh kháng nguyên, nó phải lạ với cơ thể chủ, trọng lượng phân tử cao (> 3000), 5
và có thể được xử lý bởi một APC. Tuy nhiên, một số chất nhỏ cũng có thể trở
thành sinh kháng nguyên nhờ gắn với các phân tử vật mang lớn hơn, thường là các
protein, trong cơ thể chủ. Một chất nhỏ như vậy được gọi là hapten và đáp ứng
miễn dịch xảy ra với phức hợp vật mang – hapten.
II.2. PHÁT HIỆN ĐÁP ỨNG MIỄN DỊCH ĐẶC HIỆU
II.2.1. Phát hiện kháng thể
Để đánh giá một bệnh nhân có sản xuất kháng thể chống lại một vật lạ (như
vật ghép) hay không, bệnh nhân cần được lấy và kiểm tra mẫu máu, sau đó kết quả
được so sánh với nhóm đối chứng. Chọn lựa đối chứng thích hợp là một vấn đề
lớn. Quy trình kiểm tra yêu cầu một đối chứng dương đã biết (thường khó để đạt
được một đánh giá đáp ứng với vật ghép), và một đối chứng âm đã biết (thường là
nước muối, môi trường nuôi cấy mô hoặc huyết thanh bò, ngựa dùng trong nuôi
cấy mô). Các mẫu đối chứng cho bệnh nhân được thu nhận từ các cá thể bình
thường không ghép và không bệnh, các cá thể bị bệnh (ví dụ viêm khớp) nhưng
không ghép (ví dụ thay thế khớp toàn bộ), các cá thể ghép và không có trục trặc,
các cá thể đã được chẩn đoán ghép thất bại. Các kết quả cần được phân tích để
chắc chắn liệu kháng thể có tăng ở bệnh nhân hay không và liệu sự hiện diện của
kháng thể có liên quan đến sự thất bại vật ghép hay không.
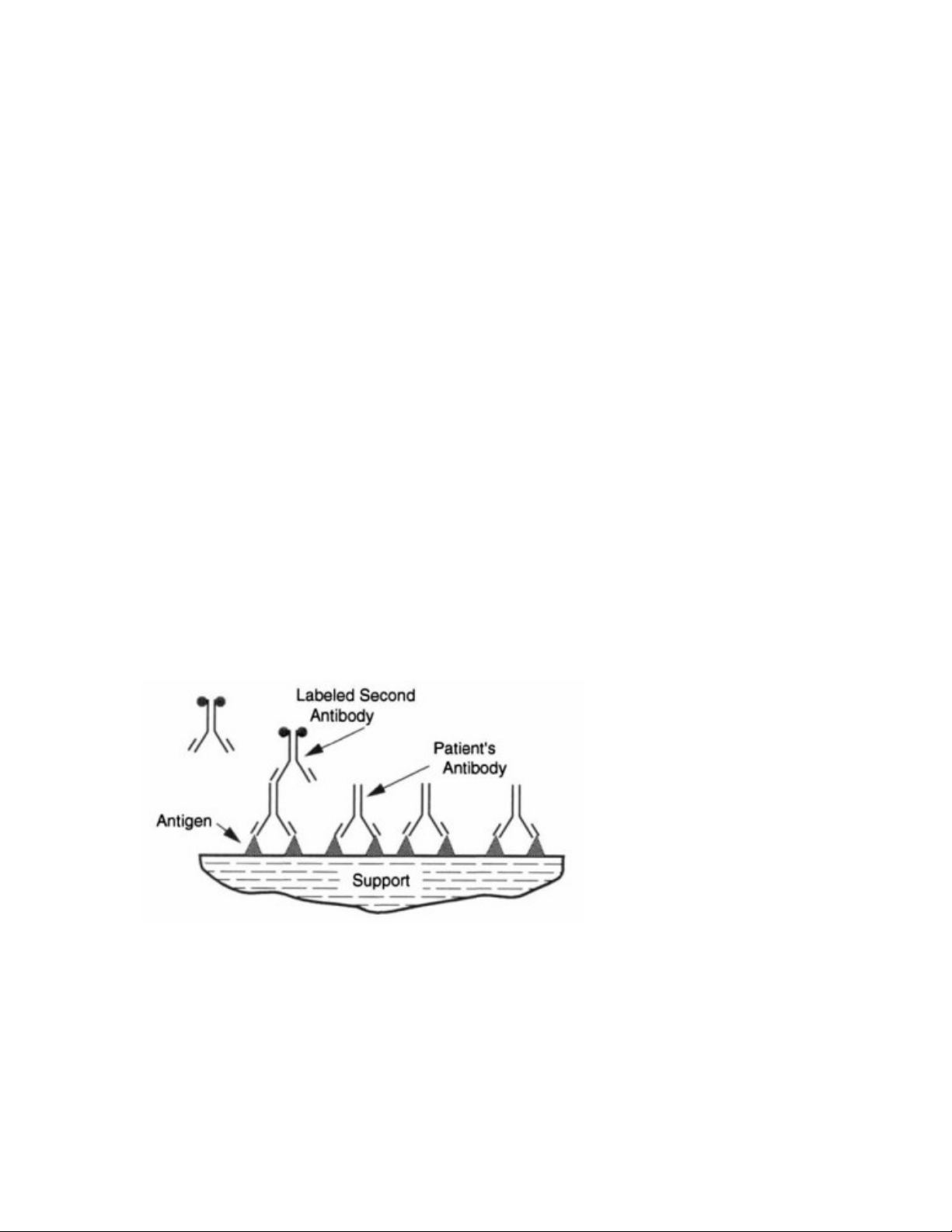
Thử nghiệm phổ biến nhất dựa trên sự cố định kháng nguyên vào một bề
mặt rắn như là polystyren. Quy trình chung được chỉ ra trong Hình 1
Hình 1: Thử nghiệm miễn dịch chuẩn. Một kháng
nguyên được cố định với
một giá thể rắn và gắn với
một kháng thể đặc hiệu
trong dung dịch. Kháng thể
gắn kết được phát hiện nhờ
gắn với một kháng thể thứ
cấp được đánh dấu (enzym, đồng vị…)
Phát hiện kháng thể gắn bằng cách sử dụng enzym (thử nghiệm EIA hoặc ELISA)
hay một kháng thể đánh dấu đồng vị phóng xạ (RIA).
II.2.2. Phát hiện đáp ứng qua trung gian tế bào (loại IV)
Phương pháp phát hiện các đáp ứng qua trung gian tế bào phức tạp và khó
khăn hơn nhiều so với phát hiện kháng thể. Phần lớn các xét nghiệm cần sử dụng 6
tế bào sống nên phải thực hiện nhanh sau khi thu tế bào. Các đối chứng có thể
thực hiện tại thời điểm khác.
Hai phương pháp thử nghiệm in vitro được sử dụng thông thường nhất là
thử nghiệm ức chế sự di cư và tăng sinh tế bào lympho. Cơ sở lý thuyết của cả hai
phương pháp này là trên bề mặt các tế bào T có các thụ quan (receptor), mỗi thụ
quan đáp ứng với một kháng nguyên đặc hiệu. Trong quá trình đáp ứng, các chất
có thể hòa tan (các cytokin hoặc lymphokin) được sản xuất và được phóng thích.
Các chất này, chủ yếu là yếu tố tạo phôi (blastogenic factor) và yếu tố ức chế sự di
cư, hoạt động trên các tế bào khác kể cả các tế bào T khác.
Yếu tố tạo phôi (Lymphocyte transformation factor - Yếu tố chuyển dạng tế bào lympho):
Yếu tố này làm các tế bào lympho khác chuyển dạng và phân chia. Số lượng tế
bào tăng lên. Nếu bổ sung thymidin H3 vào môi trường nuôi thì các tế bào đang
phân chia sẽ hấp thu đồng vị và số đếm tăng lên. Thử nghiệm này, thường được
gọi là LTT cho thử nghiệm chuyển dạng tế bào lympho, cần các tế bào sống để
sản xuất và đáp ứng với yếu tố. Thử nghiệm này mất 7 ngày (7 ngày là khoảng
thời gian bình thường cho một đáp ứng với kháng nguyên). Một số chất kích thích
(mitogen) đối chứng như là PHA (phytohemagglutinin) hoạt động trong 4 – 5 ngày.
Yếu tố ức chế sự di cư (Migration inhibition factor - MIF)
Các tế bào T được kích thích sẽ sản xuất MIF. MIF hoạt động trên các tế bào
thường di động là dòng tế bào đơn nhân/ đại thực bào và các bạch cầu đa hình
nhân polys (polymorphonuclear leukocyte). Do đó, thử nghiệm, thường được gọi
là thử nghiệm yếu tố ức chế bạch cầu (leukocyte inhibition factor - LIF), cần các tế
bào lympho sống và các tế bào đang di cư sống được thu nhận từ máu toàn phần
tươi. Thử nghiệm LIF sẽ có kết quả trong 18 – 24 giờ. Nếu máu không chứa đủ tế
bào đơn nhân để đánh giá sự ức chế di cư của chúng thì tế bào chỉ thị này thường
được thu nhận từ khoang bụng của những động vật khác như chuột hoặc bọ. Tế
bào này có thể kích thích các tế bào lympho người nuôi cấy trong 24 – 48 giờ, sau
đó thu nhận dịch nuôi cấy và bổ sung vào các đại thực bào được thu nhận từ động
vật. Sự di cư (hoặc sự ức chế di cư) của các tế bào được quan sát bằng cách đặt
chúng trong môi trường nuôi mô đã được hóa cứng bằng agarose tinh và quan sát
dưới kính hiển vi trong 18 – 24 giờ hoặc đưa vào ống mao quản và quan sát sau vài giờ.
Thử nghiệm trực tiếp lymphokin hoặc cytokin
Vì các thử nghiệm LTT và LIF hoặc MIF có hạn chế là cần sử dụng tế bào sống
nên thử nghiệm lý tưởng là dùng lymphokin. Các thử nghiệm dựa trên ELISA
hoặc RIA có thể được sử dụng để phát hiện và định lượng cytokin.
Thử nghiệm sự sản xuất cytokin 7
Hiện tại có một thử nghiệm được sử dụng là khảo sát các cytokin được tạo ra để
đáp ứng với vật liệu, đặc biệt là các phần tử nhỏ do phân hủy vật liệu. Nhìn chung,
thử nghiệm được thực hiện dựa trên ELISA hoặc RIA.
Hình 2: Định lượng kháng nguyên bằng thử nghiệm cạnh tranh. Một kháng
nguyên cố định gắn với
một kháng thể đặc hiệu trong dung dịch. Tuy nhiên, nhiều kháng nguyên
được cho vào dung dịch và
lượng kháng thể kết hợp
với kháng nguyên cố định sẽ giảm theo lượng kháng nguyên tự do. Phát hiện
kháng thể gắn bằng một kháng thể thứ cấp được đánh dấu (enzym, đồng vị…) Thử nghiệm in vivo
Thử nghiệm kinh điển cho miễn dịch qua trung gian tế bào (Cell-mediated
immunity - CMI) là thử da. Các kháng nguyên được đưa lên da hoặc được tiêm
dưới da và quan sát nốt phồng sau 24 – 72 giờ nếu có CMI. Đáp ứng này khác với
đáp ứng loại I qua IgE. Đáp ứng loại I xảy ra nhanh (trong vài phút) và thường
biến mất sau 24 giờ. CMI bắt đầu sau 24 giờ, có nốt phồng.
Thử da là một quy trình chẩn đoán tuyệt vời cho các bệnh nhân bị nghi ngờ quá
mẫn. Tuy nhiên, thử da với các hapten, như các ion kim loại, liên quan đến rủi ro
nhạy cảm. Để phát hiện được đáp ứng miễn dịch, hapten phải gắn với các tế bào
trung bì hoặc các protein. Tuy nhiên, việc gắn này tạo ra một kháng nguyên hoàn
toàn, có thể kích thích một đáp ứng miễn dịch. Vì phải mất nhiều thời gian để đáp
ứng miễn dịch này xảy ra nên thử da sẽ âm tính, nhưng các thử nghiệm tiếp theo
sau đó sẽ dương tính. Do đó, các thử nghiệm lặp lại có khả năng cảm ứng tính nhạy cảm và nên tránh. Các kỹ thuật hóa mô
Có nhiều khảo sát để đánh giá các mô được lấy từ những vùng kế cận vật ghép. Có
thể sử dụng các kỹ thuật miễn dịch để xác định loại tế bào và các sản phẩm tế bào
được tạo ra tại vùng đó. Một kỹ thuật được sử dụng là dùng kháng huyết thanh
kháng các dấu ấn CD để phát hiện và phân loại tế bào lympho. Một thử nghiệm
tương tự đang được đề xuất để phát hiện các cytokin trong mô.
II.2.3. Phát hiện đáp ứng miễn dịch với hapten
Hiện tại có một vài kỹ thuật đặc biệt để phát hiện đáp ứng miễn dịch với
hapten. Một phức hợp hapten-vật mang có thể được chuẩn bị in vitro bằng cách
kết hợp trong dung dịch với một protein lớn như albumin hoặc một phân tử nhỏ 8
hơn như glutathione. Sau đó, các phức hợp này có thể được sử dụng để phủ một cơ
chất rắn. Một phương pháp khác là vật mang protein được phủ lên cơ chất, thêm
hapten và thực hiện thử nghiệm.
II.2.4. Đáp ứng miễn dịch của người với các vật liệu II.2.4.1. Nhựa
Vật liệu nhựa được dùng để chế tạo găng, bao cao su… là cao su
(elastomer) trích từ thực vật. Dị ứng với nhựa thường là loại I (đáp ứng qua trung
gian IgE) với phản ứng tức thì (trong vòng vài phút) có thể đe dọa sự sống. Tuy
nhiên, nhựa không được sử dụng để chế tạo vật liệu ghép trong thời gian dài nên
các đáp ứng thời gian dài không được chú ý. II.2.4.2. Collagen
Collagen được thu nhận từ các nguồn vật liệu tự nhiên như da, mô bò…
Đây là một protein ngoại lai nên nó có khả năng kích thích nhiều đáp ứng miễn
dịch. Các kháng thể của lớp IgE, IgM, IgG và các đáp ứng miễn dịch qua trung
gian tế bào đã được quan sát. Phòng ngừa quan trọng là loại bỏ càng nhiều vật
liệu ngoại lai càng tốt. Do collagen của các loài động vật có vú có cấu trúc tương
tự nên có thể loại bỏ các protein nhiễm và để lại vật liệu không sinh dị ứng. Xử lý
hóa học và khâu mạch collagen có thể làm giảm tính sinh kháng nguyên. Các sản
phẩm collagen cần được đánh giá cẩn thận về khả năng khởi động các đáp ứng miễn dịch.
II.2.4.3. Các polymer tổng hợp
Các vật liệu này dựa trên nền tảng các thành phần carbon, hydro, nitơ và
oxy tạo nên hệ sinh học. Do đó việc tạo ra các vật liệu có tính kháng nguyên là
không thể xảy ra. Tuy nhiên, một số vật liệu polymer có nửa hóa học là đáng quan tâm như
polysiloxane (silicone elastomer), polyurethane, poly(methyl)methacrylate…
II.3. KẾT QUẢ CỦA MỘT ĐÁP ỨNG MIỄN DỊCH
Đáp ứng miễn dịch dường như có khuynh hướng trung hòa, khử độc tính và
giúp loại trừ một vật liệu ngoại lai. Tuy nhiên, thỉnh thoảng đáp ứng miễn dịch có thể gây hại.
II.3.1. Hư hỏng vật ghép
Sự viêm, phần khởi đầu của đáp ứng miễn dịch, là một phản ứng oxy hóa.
Các vật ghép bằng polyurethane và polyethylene có thể bị phân hủy.
II.3.2. Hư hỏng các mô kế cận
Các sản phẩm, đặc biệt từ các đáp ứng loại II và IV, có thể khởi động sự
phồng và các đáp ứng mạch khác tại vùng ghép. Giải quyết tiếp theo có thể không
có hại nữa hoặc là gây hoại tử mô và/hoặc mất sinh khối mô cùng với sự lỏng lẻo
và di chuyển của vật ghép. 9
II.3.3. Các đáp ứng hệ thống
Các đáp ứng miễn dịch loại I và loại II sinh ra các chất vận mạch. Các
chất này tuần hoàn và có thể gây giãn mạch. Có thể nhận thấy điều này trong đáp
ứng với các vật liệu nhựa và các thuốc kết hợp với tiểu cầu, tế bào mast hoặc các
bạch cầu ưa acid, dẫn đến một đáp ứng miễn dịch và giải phóng các chất vận mạch này.
II.3.4. Các bệnh tự miễn
Đây là một kết quả gây tranh cãi nhất của đáp ứng miễn dịch với các vật
ghép. Bệnh tự miễn là kết quả của một đáp ứng miễn dịch với mô chủ. Các bệnh
tự miễn như chứng viêm khớp, viêm cầu thận… xảy ra ở các cá thể do nguyên
nhân nào vẫn chưa biết mặc dù có một số liên quan đến nhiễm trước đó (đặc biệt
là nhiễm streptococci). Việc chứng minh nguyên nhân và hậu quả là một vấn đề
dịch tể học với các nghiên cứu quần thể lớn. Vấn đề quan trọng là phải cải tiến kỹ
thuật thử nghiệm miễn dịch để giải thích nguyên nhân, hậu quả liên quan đến các
vật ghép và thực hiện kỹ các khảo sát dịch tể học.
Các đáp ứng này có thể do vài cơ chế. Hai cơ chế có thể xảy ra nhất đối với
vật ghép là (i) vật ghép gắn với mô chủ làm cho nó trở thành một vật ngoại lai như
là phức hợp hapten - vật mang hoặc (ii) biến đổi mô chủ thông qua cuộn (gấp)
protein, phân hủy tế bào hay protein tạo kháng nguyên đối với mô chủ. Đây là hậu
quả chính của việc bơm ngực silicon.
II.4. QUY TRÌNH ĐÁNH GIÁ TÍNH TƯƠNG HỢP SINH HỌC CỦA VẬT LIỆU
Khi vật ghép tiếp xúc với hệ sinh học, các phản ứng sau được quan sát: (1)
Trong vòng vài giây đầu tiên, các protein từ dịch cơ thể sẽ lắng
đọng. Lớp protein này điều hòa nhiều phản ứng của hệ thống tế bào. Cấu trúc
của các protein hấp phụ phụ thuộc vào các đặc tính bề mặt của vật ghép. (2)
Mô xung quanh vật ghép phản ứng giống như phản ứng của cơ thể
với tổn thương hoặc nhiễm trùng. Do các kích thích cơ học và hoá học, vật
ghép có thể gây ra viêm kéo dài. Kết quả là mô hạt hình thành xung quanh vật ghép. (3)
Trong suốt quá trình tiếp xúc giữa vật liệu sinh học và cơ thể, môi trường cơ
thể sẽ gây ra sự phân hủy. Các quá trình thủy phân và oxid hóa có thể làm mất
tính ổn định cơ học và giải phóng các sản phẩm phân hủy.
(4) Kết quả của sự chuyển vận các sản phẩm phân hủy có khả năng hòa tan qua hệ
mạch và bạch huyết là phản ứng của toàn cơ thể với vật ghép là không thể
tránh khỏi. Ngoài ra, sự nhiễm khuẩn của vật ghép cũng được xem là một trở 10 ngại.
II.4.1. Các thử nghiệm tiên quyết để đánh giá tính tương hợp sinh học
Các thử nghiệm thành công về đặc tính in vitro của các vật liệu và các sản
phẩm đầu tiên là điều kiện tiên quyết để đánh giá tính tương hợp sinh học. Đặc
tính lý hóa (như bề mặt, diện tích) và các đặc tính thích hợp khác (như cơ, điện,
vận chuyển, phân hủy sinh học nếu có thể ứng dụng) phải được đánh giá trên vật
liệu thô. Các dữ liệu này phải được so sánh với các kết quả tại các thời điểm chế
tạo, tiệt trùng, đóng gói, bảo quản và bất kỳ tiến trình nào có thể ảnh hưởng bất lợi
đến tính ổn định của sản phẩm, tính an toàn và hiệu quả sau khi ghép. Các vật liệu
không qua các thử nghiệm tiên quyết này thì không được đánh giá tính tương hợp sinh học.
II.4.2. Các phương pháp thử nghiệm và đánh giá tính tương hợp sinh học
Đánh giá tính tương hợp sinh học của vật liệu gồm nhiều thử nghiệm: in vitro
(sử dụng tế bào và mô), ex vivo, mô hình động vật và các thử nghiệm lâm sàng.
Các tổ chức tiêu chuẩn quốc tế và quốc gia có thể cung cấp những thông tin thích
hợp: the American Society for Testing and Materials (ASTM), the International
Organization for Standardization (ISO), FDA và the National Institutes of Health (NIH).
II.4.2.1. Thử nghiệm In Vitro
Ưu điểm chính của phương pháp này là giá cả hợp lý, đầu tư nhỏ trong
phòng thí nghiệm, và quan trọng nhất là quá trình thực hiện nhanh với số lượng lớn vật liệu.
- Tính tương hợp máu của vật liệu: được xác định bằng cách sử dụng máu
chống đông (một hạn chế không thể tránh của các thử nghiệm này) và đánh giá sự
hình thành cục máu đông trên bề mặt vật liệu cũng như sự hoạt hóa đông huyết
tương, sự bám dính và tụ tập tiểu cầu, sự tổng hợp và giải phóng đồng thời các hợp
chất hóa học hoạt động sinh học (như các tác nhân tụ tập, các nhân tố tăng
trưởng), sự hoạt hóa bổ thể và các bạch cầu khi các thành phần này tương tác với
các vật liệu tổng hợp. Tùy thuộc vào mục đích sử dụng cuối cùng của vật liệu, các
thử nghiệm tính tương hợp máu phải được bố trí dưới điều kiện tĩnh hay dòng
chảy trong các thử nghiệm cấp và mãn tính. Hồng cầu vỡ sẽ giải phóng
hemoglobin dưới điều kiện dòng chảy trong bộ phận giả, sự hóa vôi liên quan đến
các bộ phận di chuyển cơ học (các lá của van tim) cũng phải được xác định. Tuy
nhiên, không thể loại trừ các phản ứng này khi máu tiếp xúc với các vật liệu tổng
hợp. Do đó, kiểm soát và tổi thiểu các phản ứng này là mục tiêu trong việc thiết kế
các vật liệu tương hợp máu.
- Những tiến bộ trong kỹ thuật nuôi cấy tế bào đã cung cấp một mô hình in
vitro hữu ích để đánh giá tính tương hợp sinh học của vật liệu trong tiến trình lành 11
hóa vết thương. Các tế bào động vật có vú được sử dụng để xác định các chức
năng của tế bào (bám dính, di cư, tăng sinh, tổng hợp và lắng đọng các chất nền
ngoại bào…) trên vật liệu. Nếu mục tiêu của việc thiết kế và đánh giá các vật liệu
mới là những liên kết mạnh giữa mô xung quanh và vật liệu cấy ghép hoặc có sự
tạo thành mô mới thì chỉ những vật liệu hỗ trợ chức năng của các tế bào đặc biệt
và tối thiếu sự tương tác của các dòng tế bào cạnh tranh mới được đánh giá nhiều
hơn. Ví dụ, chỉ những vật liệu tăng cường chức năng nguyên bào xương (tế bào
tạo xương) nhưng giảm tối thiểu chức năng của các nguyên bào sợi (tế bào cạnh
tranh) mới trở thành “ứng cử viên” cho các ứng dụng trong chỉnh hình hoặc nha khoa.
- Mô hình tế bào động vật in vitro cũng được sử dụng để xác định ảnh
hưởng của các hợp chất hóa học (như loại ion, hàm lượng ion được giải phóng khi
kim loại bị xói mòn, các đại phân tử và các monomer được giải phóng trong suốt
quá trình phân hủy của các polymer có thể tái hấp thu sinh học) được giải phóng
dưới các điều kiện của môi trường sinh lý. Các vật liệu bị thất bại trong thử
nghiệm độc tính cấp sẽ không được đánh giá cũng như xem xét tiếp tục. Ngay cả
khi vật liệu đã qua thử nghiệm khả năng sống của tế bào thì ảnh hưởng của các sản
phẩm được giải phóng đến hình thái (gồm sự tích lũy nội bào của các sản phẩm
phân hủy), sự tăng sinh và các chức năng khác của tế bào từ đầu cho đến kết thúc
sử dụng vật liệu cũng phải được đánh giá.
Các mô hình này rất tốt để khảo sát các chức năng và các cơ chế thích hợp của
một dòng tế bào tại một thời điểm nhưng bị hạn chế trong môi trường phức tạp của
cơ thể. Do đó, cần thiết sử dụng các mô hình khác (như mô hình động vật) để làm
sáng tỏ các sự kiện nhiều khía cạnh, tương tác và linh động mà trực tiếp, trung
gian kiểm soát các tương tác mô – vật liệu bên trong cơ thể.
II.4.2.2. Các mô hình động vật
Tính nhân đạo và các yêu cầu hợp pháp
Các mô hình động vật được sử dụng để xác định tính tương hợp in vivo của các
vật liệu. Các kết quả âm tính (không có kết quả) quyết định khả năng không chấp
nhận hệ thống được thử nghiệm. Tuy nhiên, các kết quả dương tính không nhất
thiết chứng minh tính tương hợp ở người. Do sự khác biệt về loài, việc ngoại suy
các kết luận từ thử nghiệm động vật để tiên đoán các đáp ứng của con người là
không chắc chắn và nguy hiểm. Mô hình động vật thích hợp nhất là linh trưởng do
sự tương đồng của chúng với người, thậm chí sự khan hiếm, giá cả và duy trì… bầy động vật này.
Việc thử nghiệm trên mô hình động vật chỉ được tiến hành sau khi đã thực hiện
thành công các thử nghiệm tiên quyết về đặc tính vật liệu và các thí nghiệm in
vitro. Các nhà nghiên cứu nên xác định loài thích hợp nhất cho mục đích khảo sát,
cẩn thận bố trí thí nghiệm sao cho số lượng động vật sử dụng nhỏ nhất nhưng thu
được kết quả thống kê cao và tránh lặp lại thí nghiệm không cần thiết. 12
Phân loại các thử nghiệm
Các thử nghiệm động vật để đánh giá tính tương hợp sinh học của vật liệu có
thể được phân thành 3 cách chính:
i) Các thử nghiệm không chức năng
Trong trường hợp này, các mẫu có hình dạng bất kỳ được ghép vào mô mềm
(dưới da, trong cơ, trong bụng) qua quy trình tiểu phẫu. Nghiên cứu này cần
khoảng thời gian ngắn (vài ngày đến vài tháng) nhưng cung cấp thông tin giá trị về
các tương tác mô – vật liệu sinh học tại chỗ và các biến chứng hệ thống.
ii) Các thử nghiệm ex vivo
Các shunt động mạch – tĩnh mạch và tĩnh mạch – tĩnh mạch được lấy từ máu
của động vật, qua thử nghiệm vật liệu và đưa trở lại cơ thể động vật. Trong trường
hợp này, các dữ liệu thu nhận được để xác định tính tương hợp sinh học máu của
vật liệu là sự tích lũy protein, sự bám dính tế bào máu và sự đóng cục trên bề mặt vật liệu.
iii) Các thử nghiệm chức năng
Thử nghiệm này cần ghép một vật liệu có chức năng, ví dụ ghép khớp háng và
tim trong những vùng tổ chức của động vật theo cách phẫu thuật tương tự của
người. Các thử nghiệm chức năng là các nghiên cứu thời gian dài, cần những suy
xét đặc biệt (như thiết kế, chế tạo và thử nghiệm bộ phận giả), phức tạp và đắt tiền.
Các đáp ứng sinh học tại chỗ và hệ thống
Sự cấy ghép vật liệu trên động vật cung cấp các thông tin quan trọng về sự
tương tác với tính tương hợp máu, cấp tính, mãn tính, sự viêm tại chỗ và hệ thống,
độ nhạy cảm và tiến trình lành hóa vết thương. Các đáp ứng gây sốt, miễn dịch,
độc tính và sinh khối u của động vật cấy ghép vật liệu cũng có thể được xác định.
các phương pháp và quy trình chi tiết của các thử nghiệm này được ASTM, NIH
và các tổ chức chuyên nghiệp khác cung cấp.
Minh họa một khung thử nghiệm dựa trên các nguyên tắc của FDA và ISO Loại vật liệu Đánh giá ban đầu Đánh giá bổ sung Tiếp xúc cơ Th Độ Độ Độ Độc Độ Độc Sự Tín Độ Sự thể ời c nhạ kíc tính c tính cấy h c sin gia tín y h hệ tín di ghé tươ tín h n h ứn thốn h truy p ng h kh tiếp tế g g dư ền hợp mã ối 13 xúc bà da (cấp ới máu n u o ) mã tín n h tín h Da A B C Màng nhầy A B o o o ặt C o o o Bề mặt bị A o tổn thương B o o o ật liệu bề m V C o o o Blood path A indirect B o C O o Tissue, A o Bone dentin B O o o communica ting C O o o o Máu tuần A O hoàn B o o
ật liệu thông tin bên ngoài V C o Xương/ Mô A o B O o o C O o o Máu A B o ật liệu cấy ghép V C
A – Tiếp xúc ngắn (≤ 24 giờ); B – Tiếp xúc kéo dài (24 giờ - 30 ngày); C – Tiếp
xúc lâu dài (> 30 ngày) 14
- Các thử nghiệm đánh giá FDA và ISO; o – Các thử nghiệm bổ sung do FDA yêu cầu
II.4.2.3. Các thử nghiệm lâm sàng
Các quy trình và các quy định
Nếu các thử nghiệm in vitro và trên động vật đã thành công thì cũng không
thể tiên đoán được tác động của vật liệu trên người nếu không có các thử nghiệm
lâm sàng. Các thử nghiệm lâm sàng phải thành công trước khi các bộ phận giả
được sử dụng rộng rãi cho bệnh nhân.
Ngoài các tiêu chuẩn khoa học, các đánh giá lâm sàng phải tuân theo quy
định pháp luật. Các kết quả thử nghiệm in vitro, ex vivo và in vivo (động vật) phải
được lưu giữ cẩn thận để hỗ trợ cho các thử nghiệm lâm sàng. Người nhận phải
được mua bảo hiểm cho các rủi ro khi cấy ghép vật liệu mới. Hơn nữa, các quy
trình chi tiết mô tả vật liệu, quá trình phẫu thuật, xử lý hậu phẫu, chăm sóc người
nhận và các đánh giá khác như so sánh sức khỏe của ngưới nhận trước và sau khi
cấy ghép, so sánh người nhận với người khỏe mạnh cùng nhóm thích hợp (tuổi,
giới tính, môi trường sống và làm việc…) phải phù hợp với các quy định của
FDA, quốc tế nhằm bảo vệ quyền lợi của những người tham gia trong thử nghiệm lâm sàng
Sự thất bại khi cấy ghép, sự phục hồi và đánh giá
Một thông tin khác quan trọng và có giá trị có thể được thu nhận từ việc
đánh giá vật liệu cũng như các mô sinh học xung quanh là sự phục hồi của bộ
phận giả từ cơ thể vào cuối đời của người nhận.
Mặc dù các vật liệu sinh học được thiết kế dựa trên cơ sở sinh lý của người
khỏe mạnh bình thường nhưng người nhận các vật liệu này lại chủ yếu là người
lớn tuổi hoặc người bệnh. Do đó, không thể dự đoán hết được tác động của vật liệu
dưới tất cả tình trạng người nhận với nhiều bệnh lý và đơn thuốc khác nhau. Dưới
những trường hợp như thế, các biến chứng không dự kiến trước có thể xảy ra như
là mất chức năng, rối loạn hóa lý… Ngoài ra, những biến chứng như là đau hoặc
gây bất tiện có thể kết hợp với viêm nhiễm và các triệu chứng lâm sàng khác gây
nguy hiểm cho sức khỏe người nhận. Khi đó, sự can thiệp của phẫu thuật là không thể tránh khỏi.
II.5. Các biến chứng (complication) liên quan đến sự lành hóa vết thương xung quanh vật ghép
Nhiều trường hợp có thể phức tạp, trì hoãn hoặc thậm chí ngừng tiến trình
lành hóa vết thương xung quanh vật liệu cấy ghép. Ví dụ khi máu tiếp xúc với các
vật liệu sinh học cấy ghép, các thành phần bổ thể có thể được hoạt hóa và huy 15
động bạch cầu. Trong khi sự viêm cấp là một phần thiết yếu trong tiến trình lành
hóa thì sự viêm mãn (kéo dài hàng tuần đến hàng tháng sau cấy ghép ) có thể làm
trì hoãn hoặc ngăn chặn sự lành hóa vết thương tại vùng cấy ghép. Sự viêm mãn
có thể trở thành một vấn đề lâm sàng nghiêm trọng và có thể yêu cầu phẫu thuật
để loại bỏ vật liệu cấy ghép.
Sự tiếp xúc của các vật liệu sinh học trong môi trường làm lành vết thương
(giàu hóa chất phản ứng và các hợp chất hoạt động sinh học) có thể gây ra xói mòn
kim loại và phân hủy polymer làm giải phóng các ion và các monomer (các chất
ổn định, yếu tố polymer hóa, chất nhũ tương…), hoạt động hóa học của các hợp
chất này có thể ảnh hưởng đến hóa học và làm thay đổi hình thể bề mặt vật liệu.
Hình : Các bạch cầu được hoạt hóa làm thay
đổi bề mặt vật liệu cấy ghép. (A) Hình kính hiển
vi điện tử quét bề mặt của đĩa
poly(etherurethane urea) (PEUU) đối chứng,
không cấy ghép. (B) Hình kính hiển vi điện tử
quét bề mặt của đĩa PEUU sau khi ghép 28 ngày
dưới da của chuột. Người ta tin rằng cấu trúc bề
mặt xù xì là do hoạt động của các bạch cầu được hoạt hóa
Một vật liệu cấy ghép có thể là nguồn kích thích viêm vì nhiều lý do. Ví dụ:
vật liệu không được bao bọc và bị ngăn cách hoàn toàn với phần còn lại của cơ
thể; vật liệu lọc các hóa chất tiền viêm (pro-inflammatory); vật liệu bị rã thành
nhiều phần tử nhỏ. Các hạt được tạo ra tại mặt phân cách mô – vật ghép do động
lực, liên quan đến ma sát của hai bề mặt khớp nối (ví dụ trường hợp khớp háng,
khớp hàm tạm thời…). Loại, hàm lượng và hoạt tính sinh hóa của các hợp chất
giải phóng này có thể độc đối với tế bào, cảm ứng viêm và ngăn cản tiến trình lành
hóa vết thương; quan trọng nhất, các hợp chất này cũng có thể gây viêm, dị ứng và
gây phản ứng miễn dịch hệ thống. Ví dụ, sự hiện diện các ion kim loại (như nickel,
chromium, cobalt) có thể gây dị ứng và các phản ứng quá mẫn; các biến chứng
này thường thấy trong lâm sàng khi sử dụng các hợp kim (như cobalt-chromium- 16
molybden) trong nha khoa. Cơ chế chính xác của sự hoạt hóa hệ miễn dịch của các
ion kim loại vẫn chưa được hiểu rõ.
Phần lớn các polymer sử dụng trong các ứng dụng y sinh hiện tại không
gây phản ứng miễn dịch quan trọng. Các vật liệu được thiết kế từ các polymer có
thể phân hủy sinh học và khi phân hủy sinh ra các sản phẩm phụ (như acid lactic,
acid glycolic, acid caproic) có tính tương hợp sinh học hoặc đã có sẵn trong cơ thể
và sẽ được thải ra ngoài qua con đường trao đổi chất bình thường.
Một số ion kim loại (đặc biệt là nickel) và các monomer (như benzyl
chloride) là những tác nhân gây ung thư. Thông qua hoạt động hóa học, các hợp
chất này có thể tham gia chuyển dạng các tế bào bình thường. Sự phát triển khối u
tại chỗ hoặc gần bề mặt vật ghép phụ thuộc vào hình dạng và đặc tính vật lý của vật ghép.
Các biến chứng thông thường nhất trong tiến trình lành hóa vết thương
xung quanh vật ghép liên quan đến bao sợi vật ghép. Do mô tổn thương không
lành hoàn toàn, một lượng lớn mô hạt, sợi xơ và sẹo được tạo thành. Sự cô lập vật
ghép bởi bao sợi là một tiến trình bình thường mà cơ thể đối phó với sự xâm nhập
của vật ghép. Tuy nhiên, các biến chứng có thể tăng khi mô dày, không thấm làm
suy giảm các chức năng cơ học của vật ghép hoặc ức chế sự giải phóng các tác
nhân liệu pháp trong trường hợp hệ phân phát thuốc. Vị trí bị cô lập trở nên khó
giải quyết trong trường hợp nhiễm, vi khuẩn và các vi sinh vật khác tìm thấy một
nơi ẩn náu bên trong bao sợi và phát triển mạnh, kháng sinh và các dược phẩm
khác không thể tác động đến do không thấm qua rào cản mô sợi cũng như không
đủ lượng để có hiệu quả. Dưới trường hợp này, phải phẫu thuật loại bỏ vật ghép.
Nếu được ghép dưới da, vật ghép cô lập trong bao sợi rất gần da và có thể bị đẩy ra ngoài cơ thể.
III. CÁC VẬT LIỆU SINH HỌC TIẾP XÚC MÁU: CÁC Ý TƯỞNG ĐỂ
CẢI TẠO KHẢ NĂNG TƯƠNG HỢP MÁU
Hiện nay, các vật liệu được sử dụng trong lâm sàng đã đạt yêu cầu về các
đặc tính cơ học nhưng tính tương hợp tuyệt đối của chúng với máu vẫn chưa đạt
được. Do đó, các vật liệu polymer như polyurethane, silicone, polyolefin,
polu(vinyl chloride) chỉ sử dụng trong thời gian ngắn đã gây đông và cần chất chống đông máu.
Các vật liệu sử dụng thời gian dài tương tự tác nhân tạo cục máu đông như
DacronTM [poly(ethylene terephthalate)] có cấu trúc mạng sợi tạo thành mạch máu
giả có đường kính lớn hơn 6mm. Cục đông tạo thành để đóng các lỗ mở trong cấu
trúc sợi, fibroblast và fibrin tạo ra sẽ ngăn ngừa máu chảy vào bên trong cấu trúc. 17
Do dòng máu chảy mạnh và đường kính mạch lớn nên không xảy ra sự đóng mạch
như là kết quả của sự hình thành cục máu đông. Nguyên tắc này không có giá trị
đối với những mạch có đường kính nhỏ hơn 6mm.
Dưới điều kiện sinh lý, bề mặt của mạch tiếp xúc với máu là một lớp tế bào
nội mô. Các tế bào này thực hiện các chức năng điều hòa sự nghẽn mạch, tham gia
tổng hợp, vận chuyển các chất hoạt động trong chuyển hóa. Đặc điểm chính của
các tế bào nội mô là tính tương hợp máu. Do đó, việc phủ bề mặt vật liệu với một
lớp đơn tế bào nội mô người là quan điểm hứa hẹn nhất để tạo được một bề mặt
tương hợp sinh học. Tuy nhiên, việc phát triển một cơ quan lai như vậy vẫn chưa
thực hiện được vì hiện tại các tế bào nội mô người không tăng trưởng trên các bề mặt lạ.
Trong mạch bình thường, các tế bào nội mô tăng trưởng trên màng cơ bản
tự tạo gồm collagen (loại I, III. IV), proteoglycan, glycoprotein fibronectin và
laminin. Một đoạn fibronectin có trình tự RGD có vai trò trong sự bám dính của
các tế bào nội mô. Nhiều nhóm nghiên cứu đã cố gắng tăng sinh các tế bào nội mô
trên các polymer tổng hợp bằng cách phủ bề mặt polymer với fibronectin hoặc
collagen hoặc bằng cách kết hợp đồng hóa trị các oligopeptide chứa trình tự tripeptide RGD đặc hiệu.
Việc phát triển một vật liệu cấy ghép có phủ tế bào nội mô để ứng dụng
thời gian dài có lẽ là công việc phức tạp và tiêu tốn nhiều thời gian nhất. Nhiều ý
tưởng đã được thực hiện để cải tạo tính tương hợp máu của vật liệu.
Hình : Các ý tưởng để cải tạo tính tương hợp máu của bề mặt vật liệu
III.1. Tối thiểu sự tương tác
Một phương pháp cải tạo tính tương hợp máu của polymer là căn cứ vào bề
mặt polymer có tính ưa nước cao hơn sẽ giảm sự hấp thụ protein và giảm bám
dính tế bào. Để phát triển các hệ polymer tương hợp máu mới, các domain ưa
nước và kỵ nước được điều chỉnh để giảm năng lượng bề mặt. Một thành phần
thích hợp của hỗn hợp polymer hoặc chiều dài các đoạn trong copolymer khối 18
kiểm soát hình dạng của polymer. Người ta đã quan sát được sự bám dính tiểu cầu
giảm đáng kể trên bề mặt copolymer khối ABA của HEMA ưa nước (A) và styren
kỵ nước (B). Sự thay đổi các đoạn ưa nước mềm và cứng khác nhau của
polyurethane chỉ ra sự hấp thu fibrinogen thấp và albumin cao giúp cải tạo tính tương hợp máu.
Ngoài ra, có thể tối thiểu sự tương tác hệ sinh học/vật liệu sinh học bằng cách
biến đổi bề mặt của polymer mà không thay đổi các đặc tính khối của polymer. Ví
dụ, bề mặt polymer được ghép với PEO thì tính ưa nước sẽ tăng, làm giảm hoạt
hóa bổ thể và bám dính tiểu cầu. Tương tự, polymer kỵ nước được phủ một lớp
hydrogel như PHEMA sẽ cải thiện tính không nghẽn mạch của polymer. Việc cố
định các nhóm chức như nhóm hydroxyl, carboxyl, amino không chỉ làm giảm
năng lượng bề mặt mà còn hoạt động như là nhóm liên kết đẩy mạnh sự biến đổi bề mặt hóa học. III.2. Ghép thuốc
Tính tương hợp máu của các vật liệu sinh học có thể được cải thiện bằng
cách phủ hoặc ghép các chất chống đông, các chất ức chế sự bám dính tiểu cầu
hoặc các chất hoạt hóa tiêu fibrin. Ví dụ phổ biến nhất là bắt cặp ion hoặc đồng
hóa trị của heparin với bề mặt của catheter hoặc stent tiếp xúc với máu. Theo
nguyên tắc này, các chất sinh oxy có heparin gắn đồng hóa trị đã được kiểm tra
trong thử nghiệm lâm sàng. Do hoạt tính của heparin giảm theo thời gian tiếp xúc
nên các ứng dụng thời gian dài vẫn chưa thành công. Nguyên tắc này cũng có thể
được ứng dụng để cố định albumin, urokinase hoặc prostaglandin trên vật liệu sinh
học. Sự bám dính tiểu cầu giảm khi cố định phosphorylcholine, một thành phần
chính của màng tiểu cầu và hồng cầu, trên bề mặt polymer.
III.3. Bắt chước 1 màng sinh học
Một phương pháp đầy hứa hẹn để tránh bất kỳ phản ứng nào chống lại các
bề mặt lạ là bắt chước màng tế bào hồng cầu ở bề mặt tiếp xúc máu.
IV. GIAÛI QUYEÁT SÖÏ NHIEÃM TRUØNG CAÁP TÍNH VAØ MAÕN
TÍNH TRONG CAÙC CA GHEÙP VAÄT LIEÄU SINH HOÏC
Taùc haïi do söï sinh saûn töï nhieân cuûa vi khuaån bao
goàm söï baøo moøn vaø hö hoûng thaønh phaàn kim loaïi. Söï
taïo thaønh biofilm coøn laø moät vaán ñeà nghieâm troïng cuûa
y hoïc, theå hieän ôû söï nhieãm truøng maûnh caáy nhö laø
oáng khí quaûn, oáng thoâng tónh maïch, thuyû tinh theå tieáp 19
xuùc, oáng nieäu vaø nhöõng maûnh gheùp phuï trôï nhö van
tim, khôùp thay theá, maûnh gheùp nha khoa vaø maûnh gheùp xöông soáng.
Trong thöïc teá, vieäc gia taêng söû duïng maûnh gheùp
laøm baèng vaät lieäu sinh hoïc cho con ngöôøi trong nhöõng
naêm gaàn ñaây thöôøng ñi keøm vôùi söï nhieãm truøng vi
khuaån, thöôøng do Staphylococcus epidermis gaây ra. Tuyø
thuoäc vaøo nhöõng cô cheá lieân quan, nhöõng aûnh höôûng
naøy coù theå laø caáp tính hoaëc maõn tính (xuaát hieän nhanh
hay chaäm sau khi caáy gheùp). Söï hình thaønh biofilm thöôøng
daãn ñeán vieäc loaïi boû hoaëc raø soaùt laïi maûnh gheùp gaây
taùc ñoäng, keát quaû gaây ra söï toån thöông ôû beänh nhaân.
IV.1. Biofilm laø gì ?
Chaát nhaày hình thaønh treân beà maët cuûa caùc maûnh
gheùp y hoïc (nuùt xoang nhó, khôùp nhaân taïo, oáng thoâng…)
thöôøng laø nôi aån naùu cuaû caùc loaïi vi sinh vaät, chuùng coù
theå toàn taïi dai daúng baát chaáp söï hieän dieän cuaû thuoác
khaùng khuaån hoaëc khaùng naám. Nhöõng vi sinh vaät naøy
(thöôøng laø caùc hoï vi khuaån, naám, vaø caùc vi sinh vaät
khaùc) taïo thaønh moät quaán theå thöôøng ñöôïc bieát vôùi teân goïi biofilm. Biofilms are multilayered
colonies of bacteria that often form on biomedical implants,
manifesting themselves as acute
or chronic infections in a patient. This atomic force microscope (AFM) image of the surface
structure of a hydrated biofilm reveals microcolonies of
bacteria, with channels that are
believed to act as passageways
carrying nutrients to the bacteria.
Institute scientists were the first to generate and study AFM
images of hydrated biofilms. 20




