












Preview text:
Hiệu ứng trong Hóa Hữu cơ (1)
1. Khái niệm về hiệu ứng
2. Hiệu ứng cảm ứng
1. Khái niệm về hiệu ứng
Công thức hóa học của một chất không cho phép biểu
thị mật độ phân bố electron trong phân tử riêng biệt
cũng như khi chất đó tác dụng với một chất khác. CH -CH -CH -Cl 3 2 2 n-proyl clorua - CH -CH -CH -Cl + OH ??? 3 2 2
Bằng lý thuyết và thực nghiệm đã khẳng định khả năng phản
ứng của mỗi chất là do sự tác dụng tương hỗ của các
nguyên tử/nhóm nguyên tử hay tính chất của 1 nguyên tử,
nhóm nguyên tử không những chịu ảnh hưởng trực tiếp bởi
các nguyen tử liên kết trực tiếp mà còn bởi các nguyên tử,
nhóm nguyên tử gián tiếp trong phân tử.
Khái niệm về hiệu ứng
1. Khái niệm về hiệu ứng
Sự ảnh hưởng tương hỗ của các
nguyên tử/nhóm nguyên tử gây nên sự
chuyển dịch electron trong phân tử
hợp chất hữu cơ được gọi là hiệu ứng.
Các loại hiệu ứng trong Hóa Hữu cơ: + Hiệu ứng cảm ứng + Hiệu ứng liên hợp
+ Hiệu ứng siêu liên hợp + Hiệu ứng cộng hưởng + Hiệu ứng không gian
2. HIỆU ỨNG CẢM ỨNG (I, INDUCTIVE EFFECT)
Sự chuyển dịch mật độ electron s dọc theo trục
liên kết đơn (liên kết s) trong phân tử hợp chất
hữu cơ gây ra bởi sự chênh lệch về độ âm điện
gọi là hiệu ứng cảm ứng, ký hiệu là I. Ví dụ:
etan là phân tử đối xứng và giữa các nguyên tử
không có sự khác nhau lớn về độ âm điện nên
trong etan không có hiệu ứng.
Khi thay 1 nguyên tử H bằng Cl thì trong etyl
clorua: CH -CH -Cl xuất hiện hiệu ứng cảm ứng. 3 2
2. HIỆU ỨNG CẢM ỨNG (I, INDUCTIVE EFFECT)
Sự chuyển dịch mật độ electron s dọc theo trục liên kết đơn (liên kết s) trong phân tử hợp chất hữu cơ gây ra
bởi sự chênh lệch về độ âm điện gọi là hiệu ứng cảm ứng, ký hiệu là I.
Ví dụ: CH -CH : etan không có hiệu ứng. 3 3
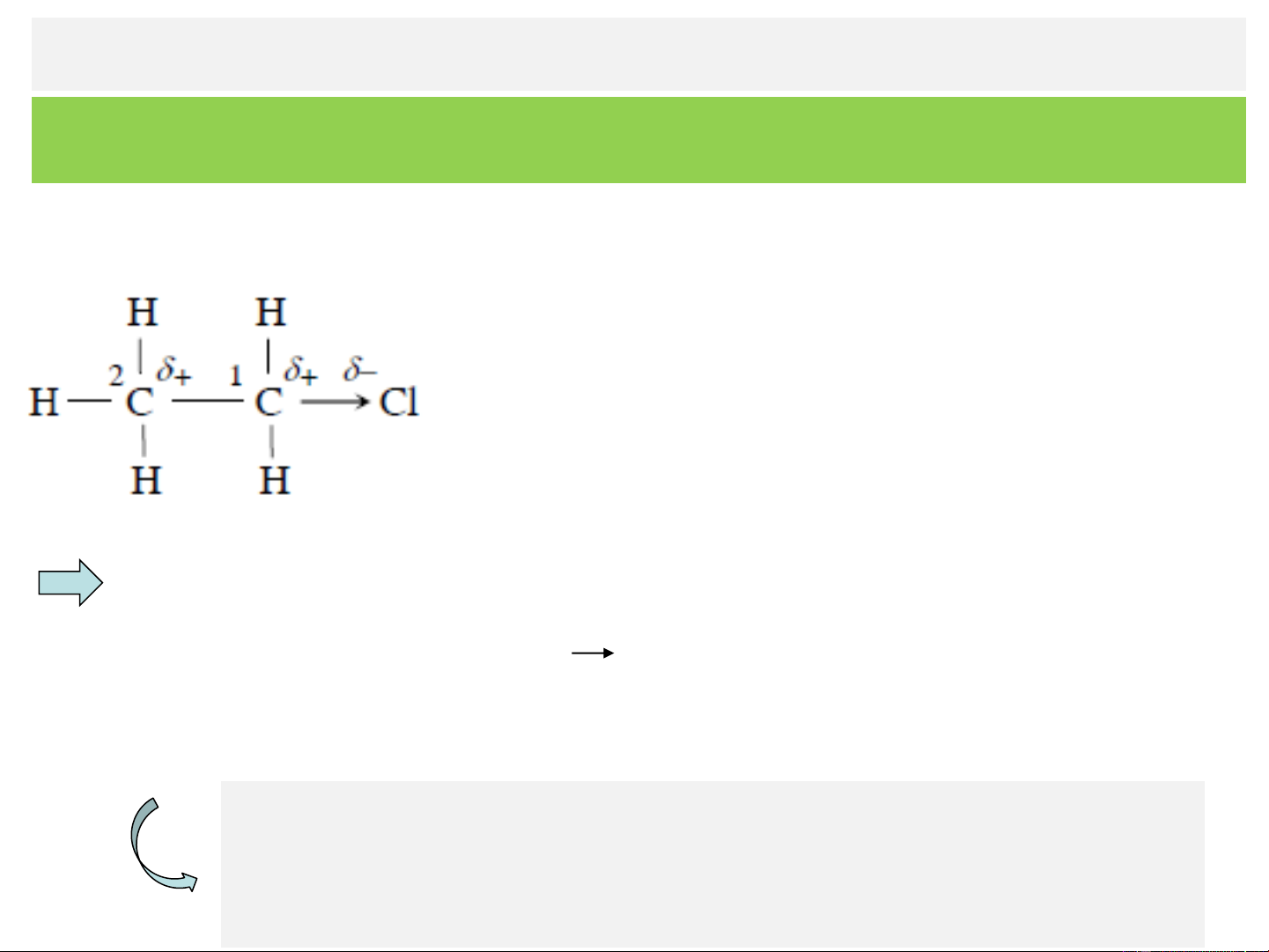
Nếu thay một nguyên tử H trong phân tử
etan bằng một nguyên tử Cl (clo) thì liên
kết C−Cl mới hình thành là một liên kết
phân cực (do độ âm điện c > c ). Cl C
Nguyên tử clo tích điện tích âm phần d-, còn C tích 1
điện tích dương phần d+ .Việc xuất hiện d+ ở C làm đôi 1 electron của liên kết C
C bị lệch về phía C , nhằm bù 2 1 1
trừ điện tích dương phần d+ ở C1, do vậy C2 cũng trở nên
tích điện tích dương phần d'+.
Do ảnh hưởng của nguyên tử Cl, các liên kết trong
phân tử CH -CH -Cl đều bị phân cực một cách 3 2
cảm ứng hay xuất hiện hiệu ứng cảm ứng
2. HIỆU ỨNG CẢM ỨNG (I, INDUCTIVE EFFECT)
❖ Ký hiệu của hiệu ứng cảm ứng
Chiều chuyển dịch electron từ nguyên tử này sang
nguyên tử khác được ký hiệu bằng mũi tên thẳng (→)
hướng từ nguyên tử có độ âm điện nhỏ đến nguyên tử
có độ âm điện lớn và dọc theo trục liên kết s. ❖Phân loại
+ Hiệu ứng cảm ứng tĩnh, ký hiệu I (s: static, tĩnh) đặc s
trưng cho sự dịch chuyển es trong phân tử ở trạng thái
tĩnh (cô lập, tách biệt, khi không có phản ứng).
+ Hiệu ứng cảm ứng động, ký hiệu I (d: dynamic, động) d
đặc trưng cho sự dịch chuyển es trong phân tử ở trạng
thái động (khi phân tử chịu tác động điều kiện bên ngoài,
môi trường hay khi phản ứng).
2. HIỆU ỨNG CẢM ỨNG (I, INDUCTIVE EFFECT)
2.1. Hiệu ứng cảm ứng tĩnh, ký hiệu Is
❖Quy ước về dấu của I : s
+ Với liên kết C - H có I = 0 s
+ Hiệu ứng cảm ứng tĩnh dương +I : khi nguyên tử hay s
nhóm nguyên tử đẩy electron ra khỏi nó .
Hiệu ứng +I thường có trong các nhóm ankyl và độ lớn của s
hiệu ứng tăng theo bậc của gốc hydrocacbon no.
+I : -CH (metyl) < -CH -CH (etyl) < s 3 2 3 -
< -CH(CH ) (isopropyl) < -C(CH ) (tert-butyl) < O 3 2 3 3
2. HIỆU ỨNG CẢM ỨNG (I, INDUCTIVE EFFECT)
2.1. Hiệu ứng cảm ứng tĩnh, ký hiệu Is
❖Quy ước về dấu của I : s
+ Hiệu ứng cảm ứng tĩnh âm -I : có nguyên tử hay nhóm s
nguyên tử hút electron về phía mình.
Hiệu ứng –I đặc trưng cho các nguyên tử hoặc nhóm s
nguyên tử có độ âm điện lớn hơn cacbon và độ lớn của hiệu
ứng cũng tăng theo độ âm điện của các nhóm đó. -I : s
-I (iod) < -Br (brom) < -Cl (clo) < -F (flo)
-NH (amino) < -OH (hydroxyl) < -F (flo) 2
-H < -CH=CH < -C H < -C≡CH < -C≡N < -NO 2 6 5 2
C=C- < -C=N < -C=O
VD: trong etyl clorua CH -CH -Cl, nguyên 3 2
tử Cl thì thể hiện hiệu ứng -I còn nhóm s (C H -) thể hiện +I 2 5 s.
❖Phuơng pháp xác định dấu và trị số của I : Việc xác định s
dấu và các trị số của hiệu ứng cảm ứng tĩnh dựa trên việc so
sánh tính chất hóa lý của các phân tử cùng loại nhưng chứa
những nguyên tử/ nhóm nguyên tử cần xác định dấu và trị số. Gồm 2 phương pháp chính:
+ Phương pháp so sánh hằng số phân ly của axit:
các nhóm hút electron (-I ) làm tăng k ; và các nhóm đẩy s a
electron (+I ) làm giảm k ) s a
+ Phương pháp so sánh giá trị momen lưỡng cực
của một hợp chất khi thế nguyên tử hydro (H) bằng nguyên tử
hoặc nhóm nguyên tử khác.
Xem thêm về phương pháp xác định trong giáo trình và sổ tay hóa học
❖Đặc điểm của hiệu ứng cảm ứng tĩnh I : s
+ Các electron s sẽ di chuyển từ các nguyên tử có độ âm điện
nhỏ → nguyên tử có độ âm điện lớn dọc theo chiều dài của trục
liên kết s trong phân tử. Nghĩa là hiệu ứng cảm ứng đặc trưng
cho sự chuyển dịch liên kết s trong phân tử (tương tác es - es )
+ Hiệu ứng I rất chóng tắt dần theo chiều dài của mạch cacbon s
trong phân tử (tắt dần khi truyền qua nhiều liên kết s). Thông
thường chỉ qua 2 đến 3 nguyên tử cacbon thì hiệu ứng I đã s không còn hiệu lực )
Ví dụ: Cl–CH –COOH K =136.10-5 2 a Cl–CH –CH –COOH K =8,5.10-5 2 2 a
Cl–CH –CH –CH –COOH K =3.10-5 2 2 2 a CH –COOH K =1,76.10-5 3 a
2. HIỆU ỨNG CẢM ỨNG (I, INDUCTIVE EFFECT)
2.2. Hiệu ứng cảm ứng động, ký hiệu Id
❖Là hiệu ứng cảm ứng xảy ra trong phân tử các chất
dưới ảnh hưởng của các tác nhân bên ngoài: điện
trường, ánh sáng, tác nhân phản ứng làm chuyển dịch
electron s trong phân tử
Hiệu ứng cảm ứng I do độ khả phân cực của liên kết quyết d
định. Độ khả phân cực là khả năng phân cực của liên kết
dưới tác dụng của điều kiện bên ngoài và cấu tạo nguyên
tử của nguyên tố hóa học. ❖ Đặc điểm:
+ Cũng chia làm hiệu ứng cảm ứng động dương +I và d
hiệu ứng cảm ứng động âm -I như hiệu ứng cảm ứng tĩnh. d
2. HIỆU ỨNG CẢM ỨNG (I, INDUCTIVE EFFECT)
2.2. Hiệu ứng cảm ứng động, ký hiệu Id ❖ Đặc điểm:
+ cũng chia làm hiệu ứng cảm ứng động dương +I và hiệu ứng cảm ứng động âm -I như hiệu d d
ứng cảm ứng tĩnh.
+ Khi giải thích phản ứng I sẽ quyết định. Thông thường I d s
và I biến đổi cùng chiều: + I , +I và - I , -I cùng tăng hoặc d s d s d giảm CH3 CH3 CH3 C2H5 CH C CH3 CH3 CH3 +Is t¨ng; +Id t¨ng
2. HIỆU ỨNG CẢM ỨNG (I, INDUCTIVE EFFECT)
2.2. Hiệu ứng cảm ứng động, ký hiệu Id
Riêng trong dãy Halogen, I và I biến đổi ngược chiều s d
(–I ) : –F > –Cl > –Br >–I s
(–I ) : –F < –Cl < –Br <–I d
Giải thích: trong dãy halogen từ F→I, khoảng cách từ hạt
nhân nguyên tử tới e- lớp ngoài cùng là tăng dần, do vậy liên
kết của I với các nguyên tố khác dễ bị biến dạng nhiều hơn so
với các nguyên tố halogen khác.Khi có tác động của ĐK bên
ngoài → liên kết C-I dễ dàng bị đứt ra, do đó hiệu ứng –I của d
I là lớn nhất trong dãy halogen. Điều này cũng phù hợp với
năng lượng liên kết C–I là 51kcal/mol, C–F là 116kcal/mol. - VD:
CH Br + OH- → CH OH+ Br phản ứng dễ 3 3 hơn
CH F + +OH- → CH OH+ F- 3 3 Hướng vận dụng -
Giải thích tính axit - bazơ của các hợp chất hữu cơ -
Giải thích một số quy tắc, quy luật -
Giải thích cơ chế phản ứng -
Ví dụ: phản ứng nào dễ nhất? NH + H+ → NH + (1) 3 4 CH -NH + H+ → CH NH + (2) 3 2 3 3 CH -NH-CH + H+ → (CH ) NH + (3) 3 3 3 2 2 (CH ) N + H+ → (CH ) NH+ (4) 3 3 3 3 -
Phản ứng 4>3>2>1 do có hiệu ứng +I của các
nhóm alkyl đẩy e vào N làm tăng mật độ e trên N nên dễ nhận H+ hơn 14 NỘI DUNG CẦN NHỚ
VỀ HIỆU ỨNG TRONG HÓA HỮU CƠ (1)
1. Khái niệm về hiệu ứng
2. Hiệu ứng cảm ứng (I) - Khái niệm - Đặc điểm - Hướng vận dụng




