










Preview text:
Hiệu ứng trong Hóa Hữu cơ (2)
3. Hiệu ứng liên hợp
3. HIỆU ỨNG LIÊN HỢP (C) ❖ Hệ liên hợp:
Hệ liên hợp là những hệ gồm:
- Các liên kết đơn và liên kết đôi luân phiên nhau. Hệ liên
hợp này còn gọi là hệ liên hợp p-p. CH2 = CH − CH = CH2 Butadien Benzen
- Phân tử chứa nguyên tử có cặp electron tự do đính với hệ nối
đôi qua một nối đơn. Hệ liên hợp này còn gọi là hệ liên hợp p-p. .. H .. CH3 C N CH H 2 = CH − Cl Vinyl clorua O Axetamid
3. Hiệu ứng liên hợp ❖ Hệ liên hợp:
- Các ion chứa orbital trống hoặc electron lẻ gắn với C không no + . CH2 = CH − CH2 CH2 = CH − CH2
❖ Khái niệm Hiệu ứng liên hợp (C, CONJUGATE
EFFECT): là sự dịch chuyển các electron p hoặc
electron p trong hệ liên hợp.
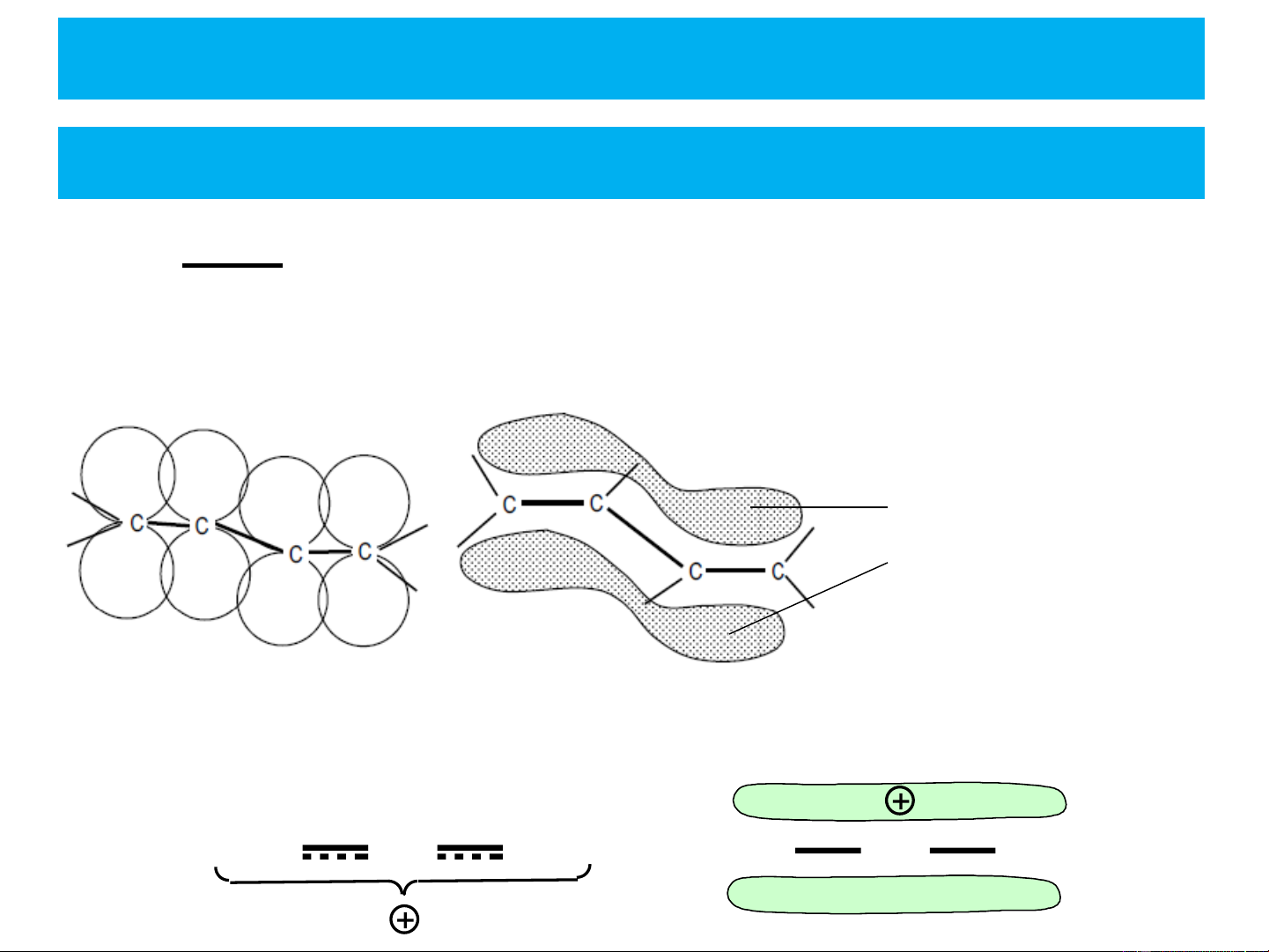
Trong hệ liên hợp, các electron p hay p không định vị mà giải
toả trong toàn bộ hệ thống. Vì đám mây electron p linh động,
các liên kết p dễ phân cực, dễ tham gia phản ứng, nên hệ
đám mây electron p hình thành cũng rất linh động, dễ biến
dạng dưới một tác động nào đó.
3. Hiệu ứng liên hợp
❖ Khái niệm Hiệu ứng liên hợp C: Ví dụ:
- Trong phân tử butadien CH = CH-CH=CH có đám 2 2
mây electron p giải toả trên toàn bộ phân tử
đám mây electron p liên
hợp giải toả trên toàn bộ phân tử
- Trong ion CH =CH−CH + có đám mây electron p giải toả trên 2 2 toàn bộ ion CH2 CH CH2 CH2 CH CH2
3. Hiệu ứng liên hợp
❖ Kí hiệu và biểu diễn Hiệu ứng liên hợp C:
Ký hiệu: bằng chữ C, Trong hiệu ứng liên hợp, chiều
chuyển dịch electron được biểu diễn bằng mũi tên cong (
) hướng về phía nguyên tử hoặc nhóm nguyên tử
có khả năng hút electron, thường là do sự chênh lệch
độ âm điện gây nên, hoặc hướng từ phía cặp electron p
tự do về phía liên kết p.
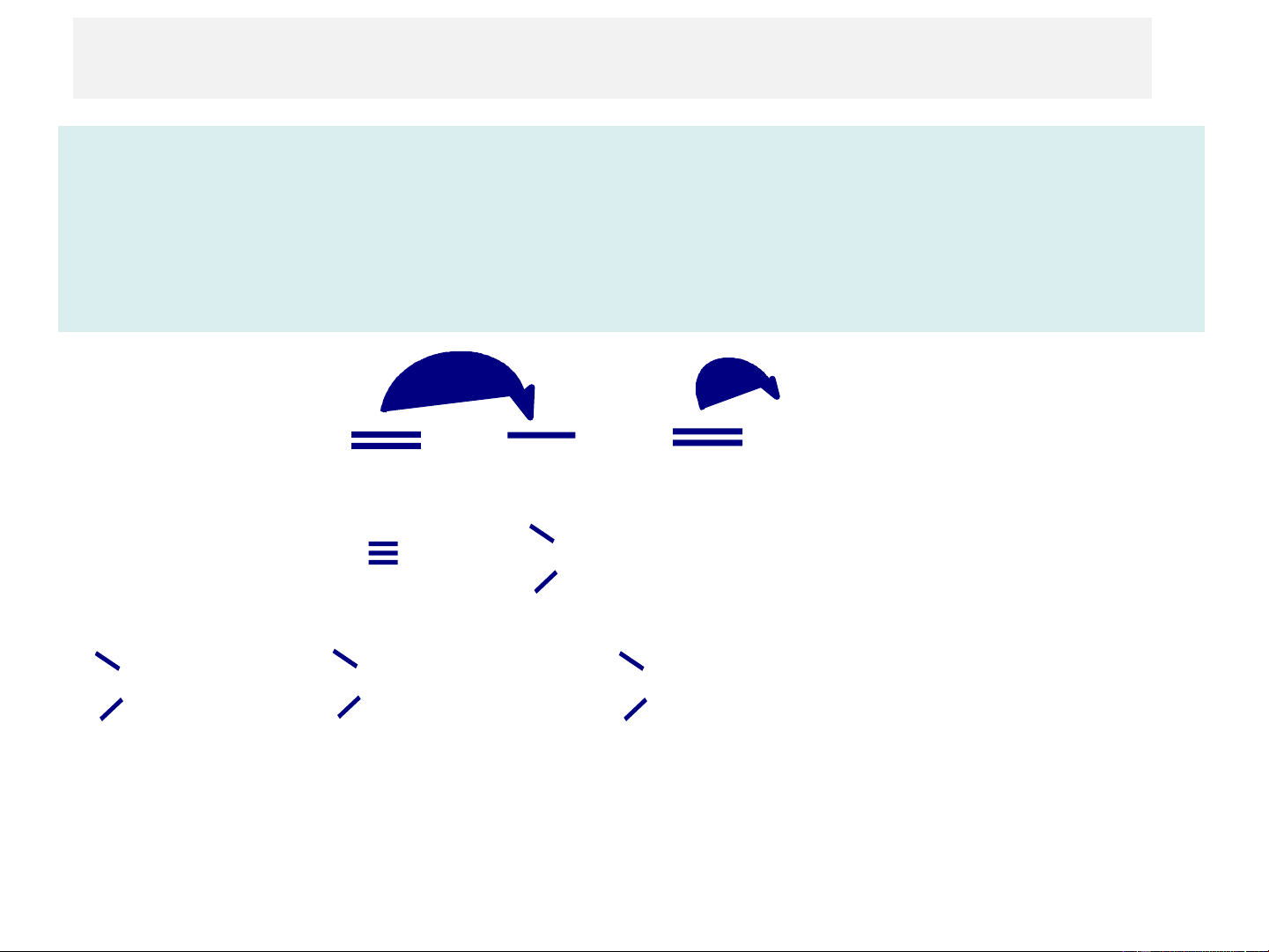
- Hệ liên hợp p−p : sự chuyển dịch electron p làm xuất hiện các
điện tích dương phần (d +) và điện tích âm phần (d −)xen kẽ nhau. d- d+ d- d+ d- d+ O CH2 = CH − CH = CH − C O H
❖ Kí hiệu và biểu diễn Hiệu ứng liên hợp C:
- Hệ liên hợp p−p : có sự xen phủ giữa đám mây electron p của
cacbon C với đám mây electron p của cặp electron tự do của các
nguyên tử N, O, S, halogen… Sự xen phủ này làm chuyển dịch
một phần đám mây electron p của nguyên tử có cặp electron tự do
về phía mạch chứa liên kết đôi. d- d+ .. CH2 = CH − Cl .. ❖ Phân loại: CH2 = CH − O − CH3
+ Hiệu ứng liên hợp tĩnh (C ): là hiệu ứng liên hợp xảy ra s
trong phân tử ở trạng thái biệt lập (trạng thái tĩnh chưa phản ứng).
+ Hiệu ứng liên hợp động (C ): là hiệu ứng liên hợp xảy ra d
trong phân tử dưới ảnh hưởng của các điều kiện bên
ngoài (như điện trường, ánh sáng, tác nhân phản ứng…).
❖ Quy ước về dấu của hiệu ứng liên hợp C:
+ Nguyên tử/nhóm nguyên tử hút electron về phía mình
thể hiện hiệu ứng liên hợp âm (-C).
+ Nguyên tử/nhóm nguyên tử đẩy electron về phía khác
thể hiện hiệu ứng liên hợp dương (+C).
+ Hiệu ứng liên hợp tĩnh C và động C luôn s d
biến đổi cùng chiều + Cs + Cd − C − s Cd Gi¶m T¨ng
+ Phương pháp xác định dấu và trị số của
hiệu ứng liên hợp C:
Nguyên tắc: So sánh momen lưỡng cực của dãy
hợp chất mạch thẳng CH -A và dãy hợp chất thơm 3
C H -A (với A là nguyên tử hay nhóm nguyên tử cần 6 5
xác định dấu và trị số).
Dm > 0 : nhóm nguyên tử thể hiện hiệu ứng liên hợp dương +C .s
Dm < 0 : nhóm nguyên tử thể hiện hiệu ứng liên hợp âm −C .s
Dm > 0 : nhóm nguyên tử thể hiện hiệu ứng
liên hợp dương +C . s
Dm < 0 : nhóm nguyên tử thể hiện hiệu ứng
liên hợp âm −C . s Nguyên tử/nhóm (D) (D) Dm (D) Hiệu ứng nguyên tử A −F 1,81 1,57 +0,24 +Cs −Cl 1,86 1,70 +0,16 +Cs −Br 1,76 1,71 +0,05 +Cs −C≡N 3,94 4,39 −0,45 −Cs −NO2 3,54 4,23 −0,69 −Cs −COCH3 2,84 3,00 −0,16 −Cs −COOC H 2 5 1,76 1,95 −0,19 −Cs
❖ Hiệu ứng liên hợp dương (+C).
Các nhóm A thể hiện hiệu ứng +C nói chung đều có
cặp electron tự do và chuyển dịch electron theo
hướng về phía liên kết p: : .. A C C
-NH > -OH > -F > -Cl > -Br > -I 2 -NR > -OR > -F 2 -O- > -OR > -+OR2
❖ Hiệu ứng liên hợp dương (+C). ..
+ Quy luật của nhóm A có hiệu ứng +C: A C C
- Nhóm mang điện tích âm có hiệu ứng +C lớn hơn nhóm
tương tự không mang điện, ví dụ O- > OR.
- Trong cùng một chu kỳ, hiệu ứng +C giảm dần từ trái sang
phải do nguyên tử của các nguyên tố này có độ âm điện
khác nhau. Nếu độ âm điện càng lớn thì khả năng giữ cặp
electron càng chặt chẽ và hiệu ứng +C càng giảm và ngược
lại, ví dụ -NR > -OR > -F. 2
- Trong dãy halogen, độ âm điện của I là nhỏ nhất nhưng có
sự sắp xếp hiệu ứng +C theo dãy -F > -Cl > -Br > -I. Điều
này được giải thích là do F có cặp electron tự do ở lớp n=2
(cũng tương tự như electron 2p của cacbon) nên tạo sự xen
phủ nhiều nhất; còn Cl (n=3), Br (n=4) và I (n=5) nên không
đảm bảo sự xen phủ với electron p của cacbon.
❖ Hiệu ứng liên hợp âm (-C).
Các nhóm A thể hiện hiệu ứng -C là những nhóm s
không no hoặc -NO, -CN, ... có hướng chuyển dịch
electron về phía nhóm hút e. C C C A −NO − 2 C N C=O −COO− −COOR C=O C=NR C=CR2
Trong cùng một chu kỳ, hiệu ứng –C tăng từ trái sang s
phải do nguyên tử/nhóm nguyên tử có độ âm điện càng
lớn thì có hiệu ứng –C càng lớn. s
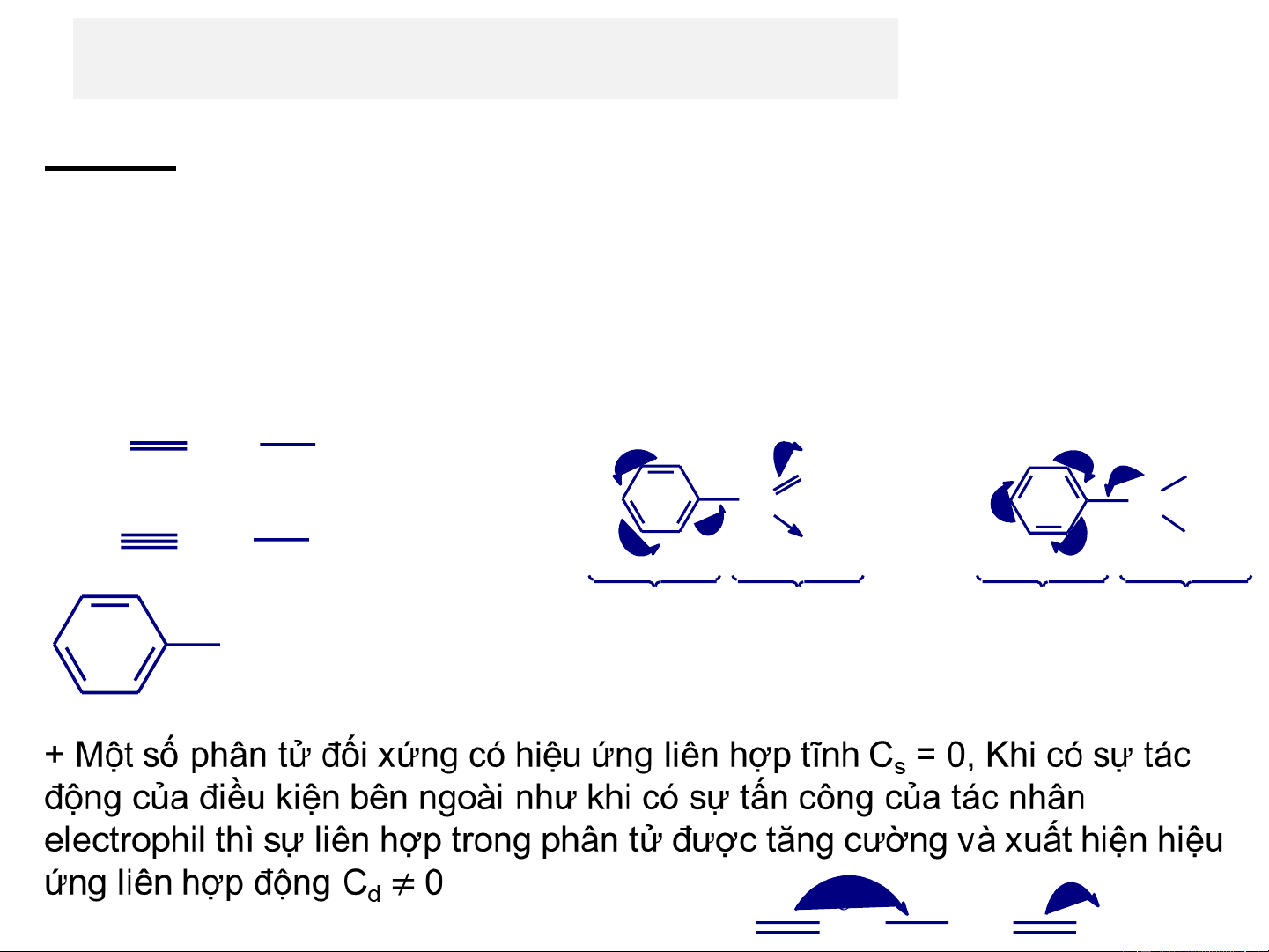
❖ Hiệu ứng liên hợp (C)
Chú ý: + Một số nhóm có hiệu ứng liên hợp với dấu thay đổi là
+C hoặc -C tùy theo bản chất của nhóm thế liên kết với chúng:
liên kết với nhóm hút e mạnh hơn nó sẽ thể hiện +C, nếu liên
kết với nhóm hút e yếu hơn (đẩy e mạnh hơn) sẽ thể hiện -C. CH d 2 CH : vinyl - d+ O H N N CH CH : etinyl O H +C −C −C +C : phenyl Ph©n tö nitrobenzen Ph©n tö anilin d+ butadien d+ d- d- CH2 CH CH CH2
❖ Đặc điểm của hiệu ứng liên hợp C:
+ Đặc trưng cho sự chuyển dịch electron p hay p trong hệ liên hợp
(tương tác ep − e p hay e p − e p )
+ Hiệu ứng liên hợp hầu như không tắt nếu tăng chiều dài của mạch liên hợp
do ảnh hưởng của hiệu ứng +C của
clo mà điện tích âm phần (d−) của d- d+ +C
các nguyên tử C ở cuối mạch trong CH2 CH Cl
hai hợp chất này là xấp xỉ nhau. +C d- d+ d- d+ d- d+ CH2 CH CH CH CH CH Cl
+ Hiệu ứng liên hợp chỉ có hiệu lực trên hệ liên hợp phẳng hay gần
phẳng. Vì ở hệ liên hợp phẳng thì trục của các orbital p hay p song
song (hoặc gần như song song) với nhau mới có sự liên hợp. Hướng vận dụng -
Giải thích tính axit - bazơ của các hợp chất hữu cơ -
Giải thích một số quy tắc, quy luật -
Giải thích cơ chế phản ứng, hướng tạo thành sản phẩm -
Giải thích tính có màu của một số hợp chất hữu cơ 15 NỘI DUNG CẦN NHỚ
VỀ HIỆU ỨNG TRONG HÓA HỮU CƠ (2)
3. Hiệu ứng liên hợp C - Khái niệm - Đặc điểm - Hướng vận dụng




