





































































Preview text:
Trường Đại Học Quốc tế Hồng Bàng
Khoa Dược - Bộ môn Hóa Học - Hoá Dược HÓA HỮU CƠ
GV: TS. Uông Thị Ngọc Hà ngochakhtnk22@gmail.com 1
GIÁO TRÌNH THAM KHẢO
1. Trương Thế kỷ, Hoá Hữu cơ, NXB Y học, 2006
2. Lê Ngọc Thạch, Hoá Hữu cơ, NXB Đại học Quốc Gia TP.HCM, 2016.
3. Đặng Văn Hoài, Hoá học Đại cương và Hữu cơ, NXB Y học, 2022. 2 MỤC TIÊU
1. Cấu trúc điện tử của nguyên tử carbon và sự tạo
thành các liên kết trong hợp chất hữu cơ.
2. Phân loại các loại đồng phân lập thể hình học, quang học.
3. Xác định được carbon bất đối xứng, tâm đối xứng và
thứ tự các nhóm lớn nhỏ, phân biệt được hợp chất
xuyên lập thể phân, hợp chất meso.
4. Phân tích cấu hình R, S từ cấu trúc lập thể, hình
chiếu Fischer, và xác định cấu hình D, L.
5. Viết được cấu tạo, đồng phân, xác định danh pháp,
tính chất vật lý – hoá học và phương pháp điều chế
các hydrocarbon và halogenur alkyl.
ĐẠI CƯƠNG VỀ HÓA HỌC HỮU CƠ LỊCH SỬ
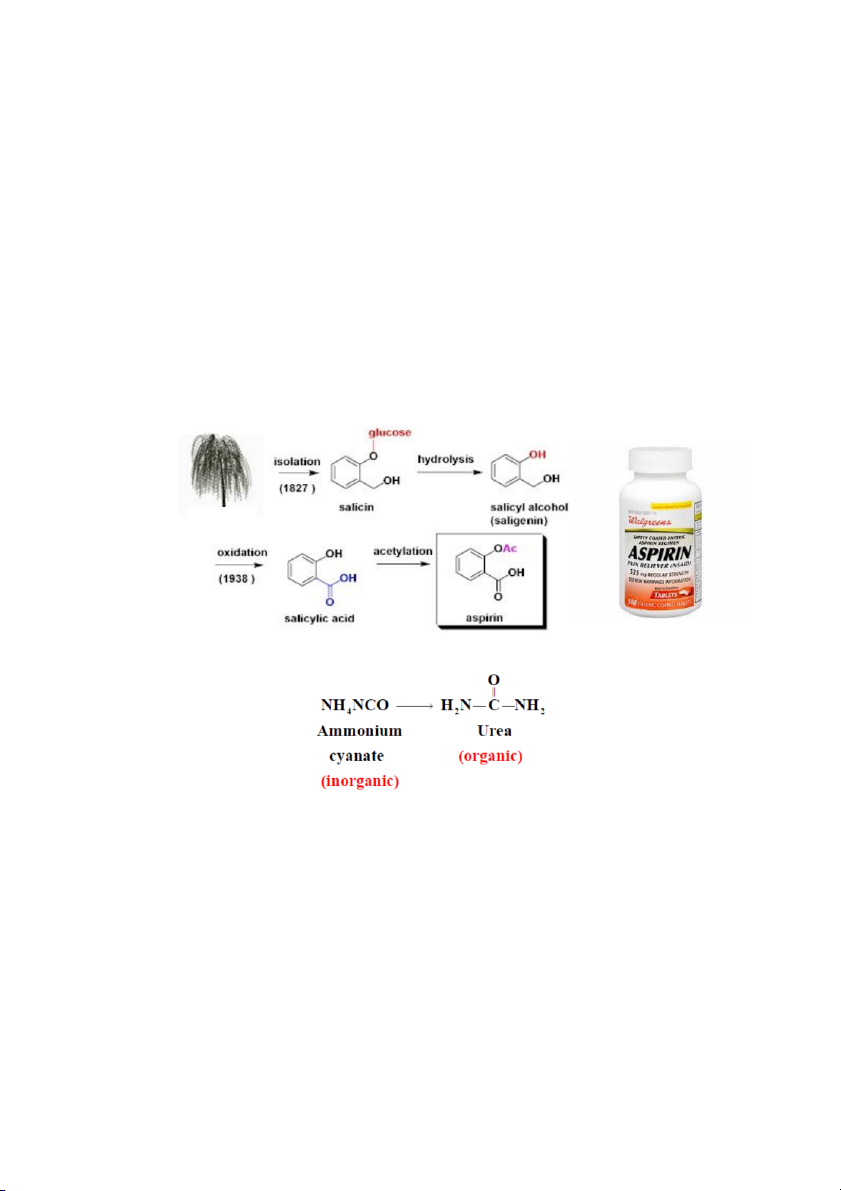
Thế kỉ 18, các nhà hóa học cho rằng các hợp chất hữu cơ có nguồn gốc từ thực vật và động vật Cây liễu
1828, Friedrich Wöhler đã tổng hợp được urê từ muối vô cơ 4
Hóa Học Hữu cơ là hóa học
của các hợp chất chứa Carbone
(trừ CO, CO2, muối cacbonat) 5 6 ALKANE – CYCLOALKANE
Alkane: Hydrocarbon bão hòa, hay còn được gọi là parafin,
trong phân tử chỉ chứa liên kết đơn. CTTQ: CnH2n+2
Về mặt cơ cấu: alkan mạch thẳng và alkan mạch nhánh CH CH 3 3 CH3CH2CH CH CH 2 2 3 CH3CHCH CH 2 3 CH CCH 3 3 DANH PHÁP n-Pentane 2-Methylbutane CH3 2,2-Dimethylpropane Số Tên gọi CTPT Số Tên gọi CTPT carbon carbon 1 Metane CH4 6 Hexane C6H14 2 Etane C2H6 7 Heptane C7H16 3 Propane C3H8 8 Octane C8H18 4 Butane C4H10 9 Nonane C9H20 5 Pentane C5H12 10 Decane C10H22
Alkyl: khi loại bỏ 1 hydrogen của 1 alkane ta thu được 1 alkyl tương ứng 7
-CH3: Methyl (Me), -C2H5: Ethyl (Et) , -CH2CH2CH3:Propyl (Pr), -CH2CH2CH2CH3:Butyl (Bu) DANH PHÁP IUPAC
Bước 1: Chọn mạch dài nhất làm mạch chính. Nếu hai mạch cùng chiều
dài chọn mạch có nhiều nhánh làm mạch chính. CH3 CH CH 2 3 CH CHCHCH CH CH CH 3 2 2 3 3CH2CH2CHCH3 CH CH 2 3
Bước 2: Đánh số các nguyên tử C của mạch chính sao cho tổng vị trí của các
C mang mạch nhánh là nhỏ nhất. CH2CH3 CH2CH3 CH CHCH CH CHCHCH CH 3 2 2 2 3 CH3
Bước 3: Xác định nhóm thế và vị trí nhóm thế 8 9 CH2CH3 CH2CH3 4 3-ethyl CH3CHCH CH CHCHCH CH 2 2 2 3 4-methyl 7 6 3 5 2 1 7-methyl CH3 8 Bước 4: Gọi tên.
Sử dụng dấu gạch nối để phân tách giữa chữ số và chữ cái.
Sử dụng dấu phẩy để phân tách giữa các số với nhau.
Nếu có 2 hoặc nhiều nhóm thế giống nhau thì sử dụng các tiền tố đi, tri, tertra… 8 9 CH2CH3 CH2CH3 3-ethyl 4 CH3CHCH2CH2CHCHCH2CH3 4-methyl 3-Ethyl-4, - 7 dimethylnonane 7 6 5 3 2 1 7-methyl CH3
Bài tập: Gọi tên các alkane sau theo danh pháp IUPAC CH3 CH3 CH3 CH2 CH CH CH2 CH3 CH3CH2CCH2CHCH3 Et Me CH2CH3 CH3 CH3 H CH3CHCHCH2CH2CHCH2CHCH H C 3 3C CH3 CH CH 2CH2CH2CH3 CH CH CH CHCH CH 3 3 2 2 2 2CH3 9 DANH PHÁP
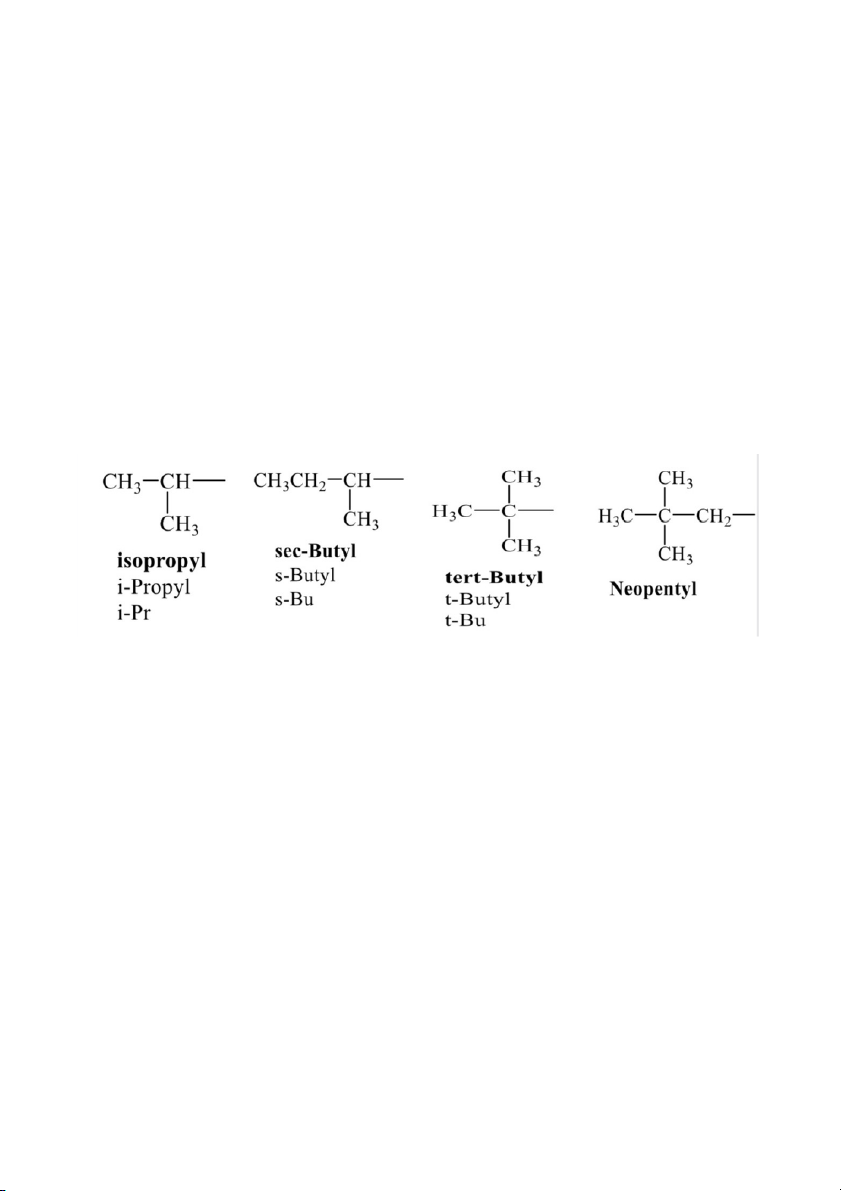
Tên của các nhóm ankyl phân nhánh được quy định như sau 10 LÝ TÍNH
Hợp chất không phân cực, kỵ nước, tan tốt trong các dung
môi không phân cực hoặc phân cực yếu
Nhiệt độ sôi tỉ lệ thuận với khối lượng phân tử
Thí dụ: Nhiệt độ sôi của propane thấp hơn butane
Bài tập: So sánh nhiệt độ sôi của các alkane sau
Octane, (CH3)3C-C(CH3)3, CH3CH2C(CH3)2CH2CH2CH3 11 ỨNG DỤNG
C1-C4: Chất khí, dùng làm khí đốt gia đình, nguyên liệu cho các động cơ đốt trong
C5-C8: Chất lỏng, thành phần chính của xăng
C9-C16: Chất lỏng, nhớt, dùng làm dầu hỏa, dầu dies nhiên liệu phản lực
> C16: Chất rắn, dùng làm nến, nhựa đường... 12 HÓA TÍNH 1. Phản ứng halogen hóa t° or light R-H + X2 R-X + HX as CH Cl CH 4 2 3Cl HC Thí dụ:
Alkan có từ 3 nguyên tử carbon trở lên CH3− CH− CH3 Cl askt CH Sản phẩm chính 3− CH2− CH3 + Cl2 + HCl 13 CH2− CH2− CH3 | Cl HÓA TÍNH 1. Phản ứng halogen hóa ClCH2 - CH - CH2 - CH3 30% CH3 CH3 - CH - CH2 - CH2Cl 15% CH Cl2 3 - CH - CH2 -CH3 CH3 3000C CH3 CH3 - CH - CHCl - CH333% CH3 Cl CH3 - C - CH2 - CH3 22% CH3
chú ý: độ hoạt động hóa của các halogen trong pư: 14 F2 >Cl2 >Br2 > I2 Cơ chế phản ứng Giai đoạn khơi mào Giai đoạn lan truyền Giai đoạn kết thúc
Bài tập: Cho biết cơ chế pư và sản phẩm tạo thành Br as 15 CH CH CH 3 2 3 2 HÓA TÍNH 2. Phản ứng oxi hoá Phản ứng cháy 3n + 1 toC CnH2n+2 O nCO + 2 2 + (n+1) H2O 2 toC Thí dụ: C H 5O 3 8 2 3CO2 4H2O
Phản ứng oxi hoá không hoàn toàn CH P, to, Cu 4 HCHO + H2O 16 HÓA TÍNH 3. Phản ứng tách a. Tách Hidro Đề hidro hóa Đề hidro hóa đóng vòng
b. Cracking: Khi đun nóng trên 500o C các liên kết C-C tự đứt
nhau ra tạo thành các ankan và các anken hay ankin có mạch
ngắn hơn, thành phần sản phẩm phụ thuộc vào nh ệ i t độ và thời gian pư. o t cao RCH2CH2R' RCH CH2 + R'H
c. Hidro hóa cắt mạch C-C (hydrocracking) : chỉ xảy ra ở to 17
cao(400o) và áp suất H2 rất cao.
R-R’ +H-H → R-H +R’-H (p/ứng có xúc tác ) ĐIỀU CHẾ
1. Phương pháp giữ nguyên mạch carbon - Hydrogen hóa alkene, alkyne C H n 2n nH2 H2 ,Pt(Pd,Ni) CnH2n+2 H C 2, Pt(Pd,Ni) C nH2n-2 2n H2 nH2n+2
- Khử hóa dẫn xuất halogen R-X + 2HCl + Zn R-H + HX + ZnCl2
- Thủy phân hợp chất cơ kim (phương pháp Grignard) RMgX + H2O RH + 1/2 MgX2 + 1/2 Mg(OH)2
- Hoàn nguyên các hợp chất carbonyl Zn-Hg / HCl NH -NH R C R' R-CH R C R' 2 2 / OH- R-CH -R' 2-R' 2 O t°C O t°C
2. Phương pháp tăng mạch carbon 2 RX + 2 Na R-R + 2 NaX (Tổng hợp Wurtz)
3. Phương pháp giảm mạch carbon 18 RCOONa NaOH RH Na CO 2 3 ALKENE
Hydrocarbon có chứa nối đôi C=C trong phân tử, còn được gọi là olefin. CTPT: CnH2n (n ³ 2)
Một số hợp chất alkene có trong tự nhiên 19 DANH PHÁP IUPAC
Bước 1: Chọn mạch chính H H H H 3CH2C H 3CH2C H3CH2C C C C C C C H3CH2CH2C H H3CH2CH2C H H3CH2CH2C H
Bước 2: Đánh số các nguyên tử carbon của mạch chính 6 5 4 3 2 1 CH CH CH CH3CH2CH2CH=CHCH 3 2 2CH=CHCH3 3 CH3 CH3 CH3 CH CHCH=CHCH CH 3 2 3 CH3CHCH=CHCH2CH3 CH CHCH=CHCH CH 3 2 3 1 2 3 4 5 6 6 5 4 3 2 1 Bước 3: Gọi tên
-Chỉ ra vị trí và gọi tên nhóm thế
-Chỉ ra vị trí nối đôi trong phân tử
-Nếu có nhiều nối đôi thì sử dụng các tiên
tố đi, tri,…để chỉ số lượng nối đôi
Bài tập: Gọi tên IUPAC của các alkene sau 20 ĐỒNG PHÂN HÌNH HỌC Đồng phân cis-trans cis-2-Pentene trans-2-Pentene Đồng phân E-Z (Z)-1-Bromo-1-cloropropene (E)-1-Bromo-1-chloropropene
Bài tập: Gọi tên IUPAC của các hợp chất sau H H Br H H Độ bền H C CH 3 3 21 HÓA TÍNH 1. Phản ứng cộng hợp
a. Cộng tác nhân đối xứng
Phản ứng với H2 (phản ứng hydrogen hóa) 1R R3 1R R3 Ni H C C 2 CH CH 2R R4 2R R4 Ni CH Thí dụ: 2=CH2 H2 CH3CH3
Phản ứng với halogene (phản ứng halogene hóa) X 1 X R R3 X C C 1 2 R C C R3 2R R4 2R R4 CCl 22 Thí dụ: CH =CH 4 CH 2 2 Br2 2Br-CH Br 2 HÓA TÍNH 1. Phản ứng cộng hợp
b. Cộng tác nhân bất đối xứng
Phản ứng diễn ra qua hai bước
Bước 1: là sự hình thành cacbocation
Bước 2: quá trình bền hóa cacbocation nhờ anion halogenua 23 HÓA TÍNH Qui tắc Markownikoff
b. Cộng tác nhân bất đối xứng H-X H X 1R R3 C C HX 1R C C R3 2R R4 2R R4 X: Cl, Br, I, OH,… Thí dụ: CH =CH HBr H2C CH2 2 2 Cơ chế: H Br H Br H Br H H H Br H H H H H 24 H H H H H HÓA TÍNH Qui tắc
b. Cộng tác nhân bất đối xứng H-X Markownikoff
Bài tập: cho biết sản chính tạo thành của phản ứng sau CH3 CH C=CH HBr 3 2 Br H H H C Br 3 H C 3 H H Br H H C 3 H H C 3 H H3C H H Br H H C 3 H H Br H C 3 H H C 3 H C 3 H H H C 25 3 Qui tắc Markownikoff
Quy tắc Maconhicop: khi cộng hidrohalogenua vào anken
không đối xứng, hidro ưu tiên cộng vào nguyên tử cacbon
được hidro hoá nhiều hơn của nối đôi còn halogen cộng vào
cacbon được hidro hoá ít hơn.
Khi phản ứng xảy ra, về nguyên tắc có thể tạo ra hai sản
phẩm thông qua hai cacbocation trung gian tương ứng. (a) (b)
Cacbocation hình thành theo phản ứng (a) bền vững hơn ở 26 phản ứng (b). 2. Phản ứng với KMnO4 R2 R3 1R C C 1 R3 KMnO4 loãng R C C H OH- R2 H OH OH O 1R C C R3 KMnO4, H2SO4 1R C R3COOH R2 H R2 3. Phản ứng với O3 1R R3 1. O 1R R3 3 C C C O O C 2. Zn, CH 2 3COOH R H 2R H
Bài tập: cho biết sản phẩm tạo thành của các phản ứng sau 1. O3 KMnO4 2. Zn, H O 3 27 H2SO4 Điều chế 1. Từ alcohol H+, CH3-CH2-CH-CH3
CH3-CH =CH-CH3 + CH3-CH2-CH =CH2 - H O 2 SPC SPP OH
Cơ chế phản ứng khử E1
Step 1: Protonation of the hydroxy group (fast equilibrium) OH OH2 CH CH CHCH H 3 2 3 CH3CH2CHCH3
Step 2: Ionization to a carbocation (slow, rate limiting) OH2 CH CH CHCH 3 2 3 CH CH 3 2 CH CH3
Step 3: Deprotonation to give the alkene (fast) H H H O H 2 2O CH CH=CHCH 3 3 CH3CH CH CH2 CH CH CH=CH 3 2 2 28 major product minor product
Bài tập: Cho biết các sản phẩm tạo thành của phản ứng sau a. OH b. OH c. CH H2SO4 3CHCHCH2CH3 CH H2SO 3CH2CH2CCH2CH3 4 H2SO4 CH3CHCH2CH2OH CH3 CH3 CH3 2. Từ halogenur alkyl KOH R-CH-CH-CH3 R-C=CH-CH3 + R-C-CH =CH2 EtOH R' X R' R' SPC SPP Cơ chế phản ứng E2 H H H H HO H HO R C C CH R C C CH 2 2 R C C CH2 H H R R X R
Bài tập: Cho biết cơ chế phản ứng và sản phẩm tạo thành của phản ứng sau CH3 KOH CH CH CCH CH CH 3 2 2 2 3 EtOH 29 Br ALKYNE
Hydrocarbon có chứa nối ba trong phân tử. CTPT: CnH2n-2 Danh pháp IUPAC
- Chọn mạch carbon dài nhất có chứa nối ba làm mạch chính
- Đánh số carbon gần với nối ba nhất và có tổng vị trí nhóm thế nhỏ nhất 30 ALKYNE
Bài tập: Gọi tên các hợp chất sau theo danh pháp IUPAC 6-Bromo-2-methyl-3-heptyne 2-Methyl-1-penten-3-yne 1-Pente - n 4-yne 31 HÓA TÍNH Cộng hydrogene Ni R C C R' + H2 R CH CH R' Ni R C C R' + 2 H2 R CH2 CH2 R' Na hay Li H R' C C trans NH3 loãng R H R C C R' + H2 H H Pd/C C C cis R R' Cộng halogene Br R + Br + Br2 R C C R 2 C C R-CBr2-CRBr2 R Br 32 Cộng nước HgSO4 R C C R + H2O R C CH -R 2 H SO 2 4 loãng O HgSO4 R C CH + H2O R C CH R C CH3 H SO 2 2 4 loãng OH O Cộng HX HCl HCl R C C-R R-CCl=CH-R R-CCl2-CH2-R Oxid hóa KMnO4 RC CR' RCOOH or O R'COOH 3 KMnO4 RC CH RCOOH CO or O 2 3 Tính acid R C CH + Na R C CNa + 1/2 H2 R C CH + KNH 33 2 R C CK + 1/2 NH3
Bài tập: Cho biết sản phẩm tạo thành của các phản ứng sau 35 ĐIỀU CHẾ
1. Từ carbur calcium với nước CaC2 + 2 H2O C2H2 + Ca(OH)2
2. Từ vic- hay gem-dihalogenur NaNH2 / NH3 RCHBr-CHBr-R R C C-R NaNH R CH 2 / NH3 2 CCl2-R R C C-R 3. Từ tetrahalogenur X X R C C R' + 2 Zn R C C R' + 2 ZnX2 36 X X ARENE 37 ARENE Benzene Benzaldehyde Toluene 38
I. Đồng phân danh pháp và đồng đẳng của benzen
1. Các đồng đẳng của benzen
• K/n : khi thay các nguyên tử hidro trong phân tử benzen
= các nhóm ankyl ta được các ankylbenzen gọi là đồng đẳng của benzen. CH3 C2H5 C3H5 metylbenzen etylbenzen propylbenzen
Vậy đồng đẳng của benzen có công thức chung là: CnH2n-6 ; n >= 6 39 2. Đồng phân
- Đồng phân vị trí của nhóm ankyl
- Đồng phân về cấu tạo mạch cacbon ở nhánh
ví dụ: C8H10 có 4 đồng phân CH CH 3 CH3 3 C H 2 5 CH3 CH3 CH3
etyl benzen o-dimetyl benzene m-dimetyl benzene p-dimetyl benzen 40
Viết tấ cả đồng phân của C9H12 41 3. Danh pháp 1-Bromo-4-methylbenzene p-Bromotoluene 4-Bromotoluene
Bài tập: Gọi tên các hợp chất sau CH2CH3 CH3 CHCH2CH2CHCH3 42 Bài tập
Câu 1: Viết CTPT các đồng phân thơm có CTPT và gọi tên từng chất: C8H10 b. C9H12
Câu 2: Viết công thức cấu tạo của các hợp chất sau: Etylbenzen c. 4-cloetybenzen
1,3,5-trimetylbenzen d. 0-clotoluen 43 4. Hóa tính
4.1. Phản ứng thế ái điện tử trên vòng benzene Halogen hóa Cl AlCl + Cl 3 2 Cơ chế phản ứng Br2 FeBr3 Br+ FeBr4 Br Br+ FeBr FeBr4 4 Br Br H FeBr4 HBr FeBr3 44 Hóa tính
1. Phản ứng thế ái điện tử trên vòng benzene Halogen hóa Cl AlCl + Cl 3 2 Cơ chế phản ứng Br2 FeBr3 Br+ FeBr4 Br Br+ FeBr FeBr4 4 Br Br H FeBr4 HBr FeBr3 45 4. Hóa tính 4.2. Phản ứng Nitro hóa NO2 HNO3 , H2SO4 + H2O Cơ chế phản ứng Thí dụ 46 4. Hóa tính 4.3. phản ứng Alkyl hóa R AlCl + R-Cl 3 + HCl Cơ chế phản ứng RCl AlCl - 3 R+ AlCl4 H AlCl - R 4 R+ R HCl AlCl3 CH CH 2 3 CH CH CH 2 2 3
Bài tập: từ benzene điều chế các hợp chất sau 47 4. Hóa tính 4.4. phản ứng Acyl hóa CO-R AlCl3 + R-CO-Cl Cl Cơ chế phản ứng
Hoàn nguyên các hợp chất carbonyl Zn-Hg / HCl NH -NH R C R' R-CH R C R' 2 2 / OH- R-CH 2-R' 48 2-R' O t°C O t°C 4. Hóa tính 4.5. Phản ứng cộng Ni + 3 H2 , p 4.6. Phản ứng oxi hóa CH3 COOH CH COOH 2CH2CH2CH3 KMnO4 KMnO4
Bài tập: cho biết sản phẩm tạo thành của phản ứng sau CH(CH3)2 KMnO4 49 (H C) C 3 3
SỰ ĐỊNH HƯỚNG CỦA PHẢN ỨNG TRÍ HOÁN THÂN
ĐIỆN TỬ TRÊN NHÂN HƯƠNG PHƯƠNG Định hướng orto, para OH OH OH HNO3 , H2SO4 NO2 + Nhóm tăng hoạt NO2 Cl Cl Cl NO Nhóm giảm hoạt HNO 2 3 , H2SO4 + NO2
Quy tắc thế ở vòng benzen :
• Khi vòng benzen đã có sẵn nhóm ankyl (hay các nhóm –OH , - NH2,-OCH3,…): phản n
ứ g thế xảy ra dễ hơn và u ư tiên xảy ra ở vị trí ortho và para
• Khí vòng benzen đã có sẵn nhóm –NO2 ;-COOH,-SO3H ,…:phản n
ứ g thế xảy ra khó hơn và u
ư tiên xảy ra ở vị trí meta 5. ĐIỀU CHẾ
1. Dầu mỏ và nhựa than đá Chưng cất benzen và ankylbenzen 2. Từ Ankan 3. Từ xicloankan: 4. Từ acetilen: C 600oC, C 2H2 C6H6
5. Từ benzen và etilen điều chế Etylbenzen 51 Bài tập
Câu 1: Bằng phản ứng hóa học hãy chứng minh benzene vừa là
hidrocacbon no vừa là hidrocacbon không no
Câu 2: Cho biết ảnh hưởng qua lại giữa nhân thơm và nhóm thề trong phân
tử toluene. Viết phương trình phản ứng minh họa
Câu 3: Hoàn thành các PTHH của các phản ứng sau (nếu c ) ó : a. Benzen + Cl2 (ánh sáng) b. Benzen + Cl 0 2 (bột sắt, t )
c. Benzen + HNO3(đặc) (xúc tác H2SO4 đặc, tỉ lệ mol 1:1)
d. Benzen + HNO3 (đặc) (xúc tác H2SO4 đặc, tỉ lệ mol 1:2)
e. BenZen + HNO3(đặc) (xúc tác H2SO4 đặc , tỉ lệ mol 1:3) f. Benzen + H 0 2 (dư, Ni, t )
g. Nitrobenzen + HNO3 (đặc) (xúc tác H2SO4 đặc, tỉ lệ mol 1:1) 52 h. Benzen + dd KMnO4 (t0) Bài tập 4. CH3 COCH3 a . 53 BÀI TẬP
Câu 5: Thực hiện chuỗi phản ứng sau (ghi rõ điều kiện phản ứng nếu có)
Đá vôi→ vôi sống→ đất đèn → axetilen→ etile → n C OH 2H5 ↓ ↓ Benzen butađien → cao su buna
Câu 4: Phân biệt các chất sau bằng phương pháp hóa học: But-1-in, propilen và propan 54 55 BÀI 4 DẪN XUẤT HALOGEN HALOGENUR ALKYL (ALKYL HALIDE) Danh pháp – Đồng phân
a. Đồng phân: dẫn xuất halogen có đồng phân mạch cacbon và
đồng phân vị trí nhóm ch c ứ
ví dụ: FCH2CH2CH2CH3, CH3CHFCH2CH3, FCH2CH(CH3)2, CF(CH3)3 b. Tên thông thường:
CHCl3( clorofom) , CHBr3(bromofom) , CHI3( iodofom) c. Tên gốc-ch c ứ : CH2=CH-Cl (vinyl clorua) CH2=CH-CH2-Cl (anlyl clorua) C6H5CH2Cl (Benzyl clorua)
d. tên thay thế: coi các nguyên tử halogen là các nhóm thế 58 CH2-Cl-CH2Cl (1,2-dicloetan) CHCl3 (triclometan) Danh pháp
Bước 1: Chọn dây carbon dài nhất làm dây chính, dây chính phải
chứa nối đôi, nối ba (nếu có)
Bước 2: Đánh số carbon tại đầu dây carbon gần nhánh nhất và
tổng vị trí các nhóm thế là nhỏ nhất Cl CH Br 3 BrCH CH CHCHCH CH CHCH CH CHCH 2 2 3 3 2 2 3 CH3 1-Bromo-3-cloro-4-metylpentan 2-Bromo-5-metylhexane 59 Danh pháp
Gọi tên các hợp chất sau Cl CH Br 3 BrCH CH CHCH CH CHCH 2CH2CHCHCH3 3 2 2 3 CH3 60 Danh pháp
Gọi tên các hợp chất sau Cl CH Br 3 BrCH CH CHCH CH CHCH 2CH2CHCHCH3 3 2 2 3 CH3 1-Bromo-3-cloro-4-metylpentan 2-Bromo-5-metylhexane 1-Chloro-3-ethyl-4-iodopentane 2-Chloro-4-( - 1 methylpropyl)nonane
trans-1-Chloro-3-methylcyclopentane 4-( - 2 Fluoroethyl)hentane 61 BÀI TẬP
Câu 1 : Số đồng phân của C4H9Br là A. 4. B. 2. C. 3. D. 5.
Câu 2: Số đồng phân dẫn xuất halogen bậc I có CTPT C4H9Cl là A. 2. B. 3. C. 4. D. 5.
Câu 3: Số đồng phân mạch hở (kể cả đồng phân hình học) của chất có CTPT là C3H5Br là A. 2. B. 3. C. 4. D. 5.
Câu 4: Một hợp chất hữu cơ Z có % khối lượng của C, H, Cl lần lượt là :
14,28% ; 1,19% ; 84,53%. CTPT của Z là A. CHCl2 B. C2H2Cl4. C. C2H4Cl2 D. một kết quả khác.
Câu 5: Dẫn xuất halogen không có đồng phân cis-trans là A. CHCl=CHCl. B. CH2=CH-CH2F. C. CH3CH=CBrCH3. D.CH3CH2CH=CHCHClCH3.
Câu 6: Danh pháp IUPAC của dẫn xuất halogen có công thức cấu tạo : ClCH2CH(CH3)CHClCH3 là A. 1,3-đicl - o 2-metylbutan. B. 2,4-điclo-3- metylbutan. 62 C. 1,3-điclopentan. D. 2,4-điclo-2-metylbutan. BÀI TẬP
Câu 1 : Số đồng phân của C4H9Br là A. 4. B. 2. C. 3. D. 5.
Câu 2: Số đồng phân dẫn xuất halogen bậc I có CTPT C4H9Cl là A. 2. B. 3. C. 4. D. 5.
Câu 3: Số đồng phân mạch hở (kể cả đồng phân hình học) của chất có CTPT là C3H5Br là A. 2. B. 3. C. 4. D. 5.
Câu 4: Một hợp chất hữu cơ Z có % khối lượng của C, H, Cl lần lượt là :
14,28% ; 1,19% ; 84,53%. CTPT của Z là A. CHCl2 B. C2H2Cl4. C. C2H4Cl2 D. một kết quả khác.
Câu 5: Dẫn xuất halogen không có đồng phân cis-trans là A. CHCl=CHCl. B. CH2=CH-CH2F. C. CH3CH=CBrCH3. D.CH3CH2CH=CHCHClCH3.
Câu 6: Danh pháp IUPAC của dẫn xuất halogen có công thức cấu tạo : ClCH2CH(CH3)CHClCH3 là A. 1,3-điclo-2-metylbutan. B. 2,4-điclo-3- metylbutan. 63 C. 1,3-điclopentan. D. 2,4-điclo-2-metylbutan. Phản ứng thế R-X + Y R-Y + X CH3O Na + R-CH2-Br R-CH2-OCH3 + NaBr R'COO Na + R-CH2-Br R-CH2-O-CO-R' + NaBr R'C C Na 64 + R-CH2-Br R-CH2C CR' + NaBr Phản n ứ g
Phản ứng thế thân hạch SN2 H3C CH3 HO I- H I OH H C H 2 5 C H 2 5 Cơ chế phản ứng H3C CH3 CH3 I OH I I- HO H OH H C H C 2H5 2H5 C2H5
Cho biết sản phẩm tạo thành của phản ứng sau Br H KCN CH3 65
Các yếu tố ảnh hưởng đến phản ứng thế SN2 Chất nền R-X + Y R-Y + X
So sánh vận tốc phản ứng của các phản ứng sau H3C C2H5 HO I HO I H H H C2H 3C 5 TÁC NHÂN THÂN HẠCH
Phân tử mang điện tích có tính thân hạch mạch hơn phân tử trung hòa điện tích
Tính thân hạch tăng dần từ trên xuống dưới trong cùng một phân nhóm chính
Tính thân hạch giảm dần từ trái sang phải NHÓM XUẤT
So sánh vận tốc phản ứng của các phản ứng sau a H b H c H d H3C HO I HO Cl NH I HO Cl H H 2 H H C H C2H5 C2H5 C2H5 2 5 DUNG MÔI 68
PHẢN ỨNG THẾ THÂN HẠCH SN1 Cơ chế phản ứng 69
YẾU TỐ ẢNH HƯỞNG ĐẾN PHẢN ỨNG SN1 Chất nền Dung môi 70 Lập thể phản ứng
Bài tập: Cho biết tên cơ chế phản ứng và dự đoán sản
phẩm tạo thành của các phản ứng sau Cl a. b. CH Br 2 CH ONa EtOH 3 CH CH 2 3 DMF Phản ứng khử Br Phản ứng khử E2 EtONa CH3CH2CHCH3 CH3CH=CHCH EtOH 3 + CH3CH2CH=CH2 81% 19% Cơ chế phản ứng EtO OEt H H H H C CH =CHCH CH 2 C CHCH3 2 2 3 CH CH=CHCH 3 3 Br Phản ứng khử E1 CH3 EtOH CH-C-Br CH2=CCH3 toC CH3 CH3 Cơ chế: Br H Br- EtOH H H3C C CH 3C C CH3 H3C C CH2 2 CH CH 3 CH3 3
Bài tập: Cho biết sản phẩm kh
ử tạo thành của các phản n ứ g sau: Cl Br CH KOH Etanol 3 CH CHCHCH 3 3 Etanol toC CH3 Điều c ế h
Từ alkan, alken, alkin tác dụng với HX hoặc halogen
Từ alcol tác dụng với SOCl2, PCl5 hoặc HX R-OH + HX R-X + H2O R-CH2-OH + SOCl2 R-CH2-Cl + SO2 + HCl R-CH2-OH + PCl5 R-CH2-Cl + POCl3 + HCl Thí dụ: H3C OH H3C Cl HCl OH Br H PBr 2O 3 CH CH3CH2CHCH 3CH2CHCH3 3
Bài tập: cho biết tác nhân cần thiết để thực hiện phản ứng chuyển hóa sau ? 73 CH CH3CH 3CH2CH2OH 2CH2Br HỢP CHẤT GRIGNARD Điều chế eter khan R-X + Mg RMgX Phản ứng François Auguste
Với hợp chất có hydrogen linh động Victor Grignard RMgX + H2O RH + MgXOH RMgX + R'-COOH R-H + R'COOMgX 74 BÀI TẬP
Câu 1: a. Sản phẩm chính của phản ứng tách HBr của CH3CH(CH3)CHBrCH3 là A. 2-metylbut-2-en. B. 3-metylbut-2-en. C. 3-metyl-but-1-en. D. 2-metylbut-1-en.
b. Sản phẩm chính tạo thành khi cho 2-brombutan tác dụng với dung dịch KOH a / ncol, đun nóng
A. metylxiclopropan. B. but-2-ol. C. but-1-en. D. but-2-en.
Câu 2: Sự tách hiđro halogenua của dẫn xuất halogen X có
CTPT C4H9Cl cho 3 olefin đồng phân, X là chất nào trong những chất sau đây ? A. n- butyl clorua. B. sec-butyl clorua. B. C. iso-butyl clorua. D. tert-butyl clorua.
Câu 3: Cho hợp chất thơm : ClC6H4CH2Cl + dung dịch KOH (loãng, d ,
ư to) ta thu được chất nào ? A. HOC6H4CH2OH. B. ClC6H4CH2OH. 75 B. C. HOC6H4CH2Cl. D. KOC6H4CH2OH. BÀI TẬP
Câu 1: a. Sản phẩm chính của phản ứng tách HBr của CH3CH(CH3)CHBrCH3 là A. 2-metylbut-2-en. B. 3-metylbut-2-en. C. 3-metyl-but-1-en. D. 2-metylbut-1-en.
b. Sản phẩm chính tạo thành khi cho 2-brombutan tác dụng với dung dịch KOH a / ncol, đun nóng
A. metylxiclopropan. B. but-2-ol. C. but-1-en. D. but-2-en.
Câu 2: Sự tách hiđro halogenua của dẫn xuất halogen X có
CTPT C4H9Cl cho 3 olefin đồng phân, X là chất nào trong những chất sau đây ? A. n- butyl clorua. B. sec-butyl clorua. B. C. iso-butyl clorua. D. tert-butyl clorua.
Câu 3: Cho hợp chất thơm : ClC6H4CH2Cl + dung dịch KOH (loãng, d ,
ư to) ta thu được chất nào ? A. HOC6H4CH2OH. B. ClC6H4CH2OH. 76 B. C. HOC6H4CH2Cl. D. KOC6H4CH2OH. The end 77