



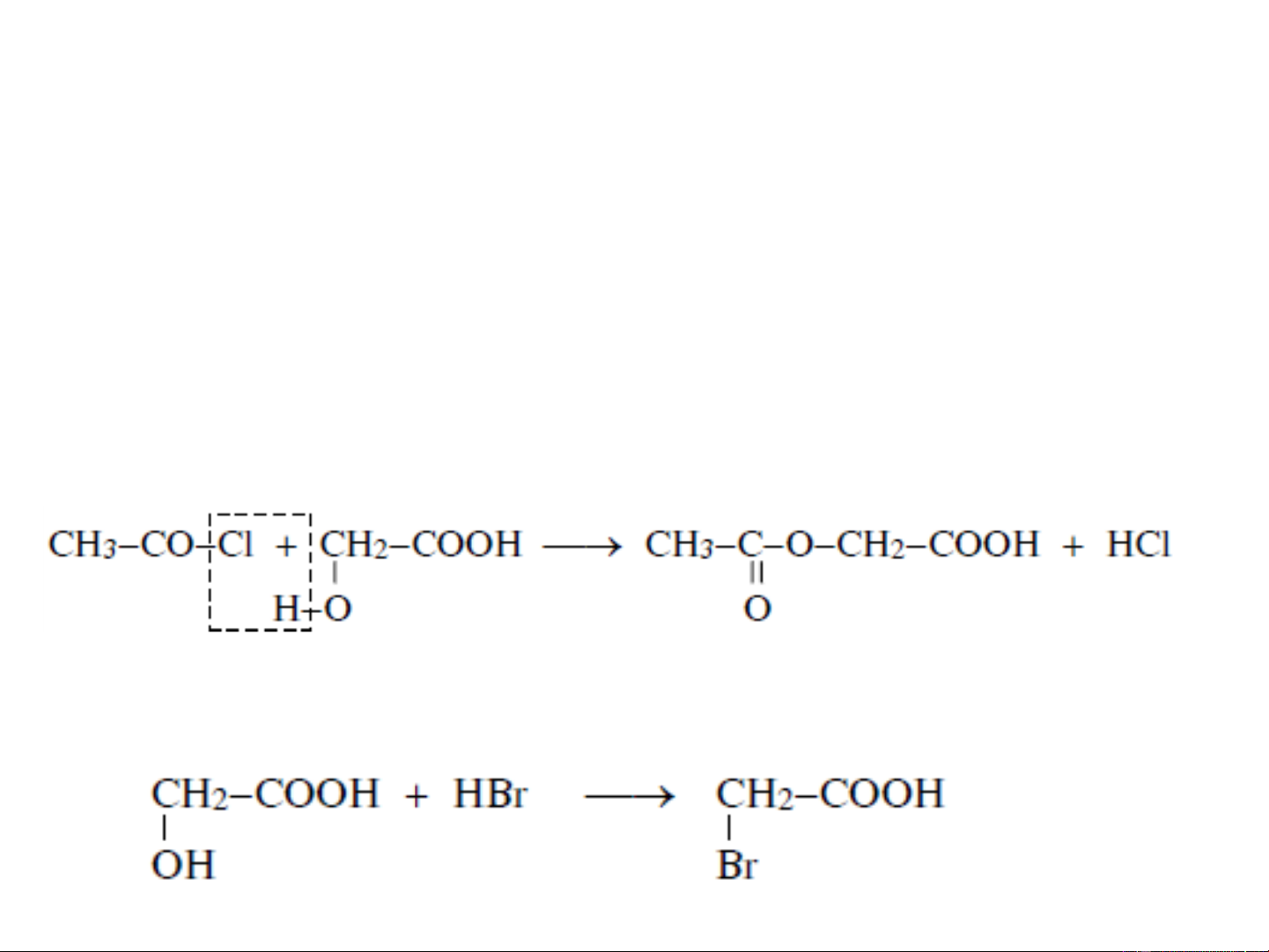
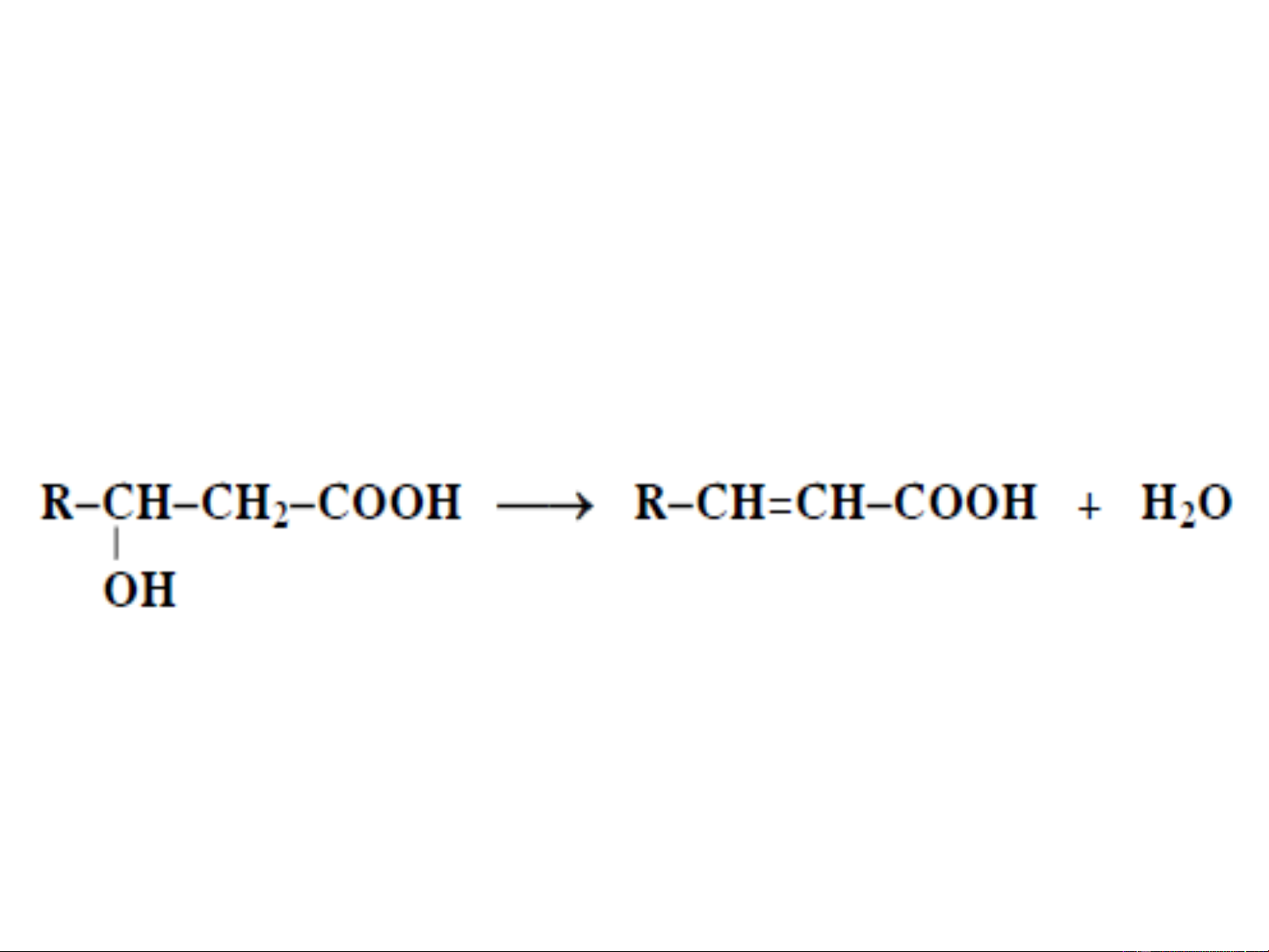
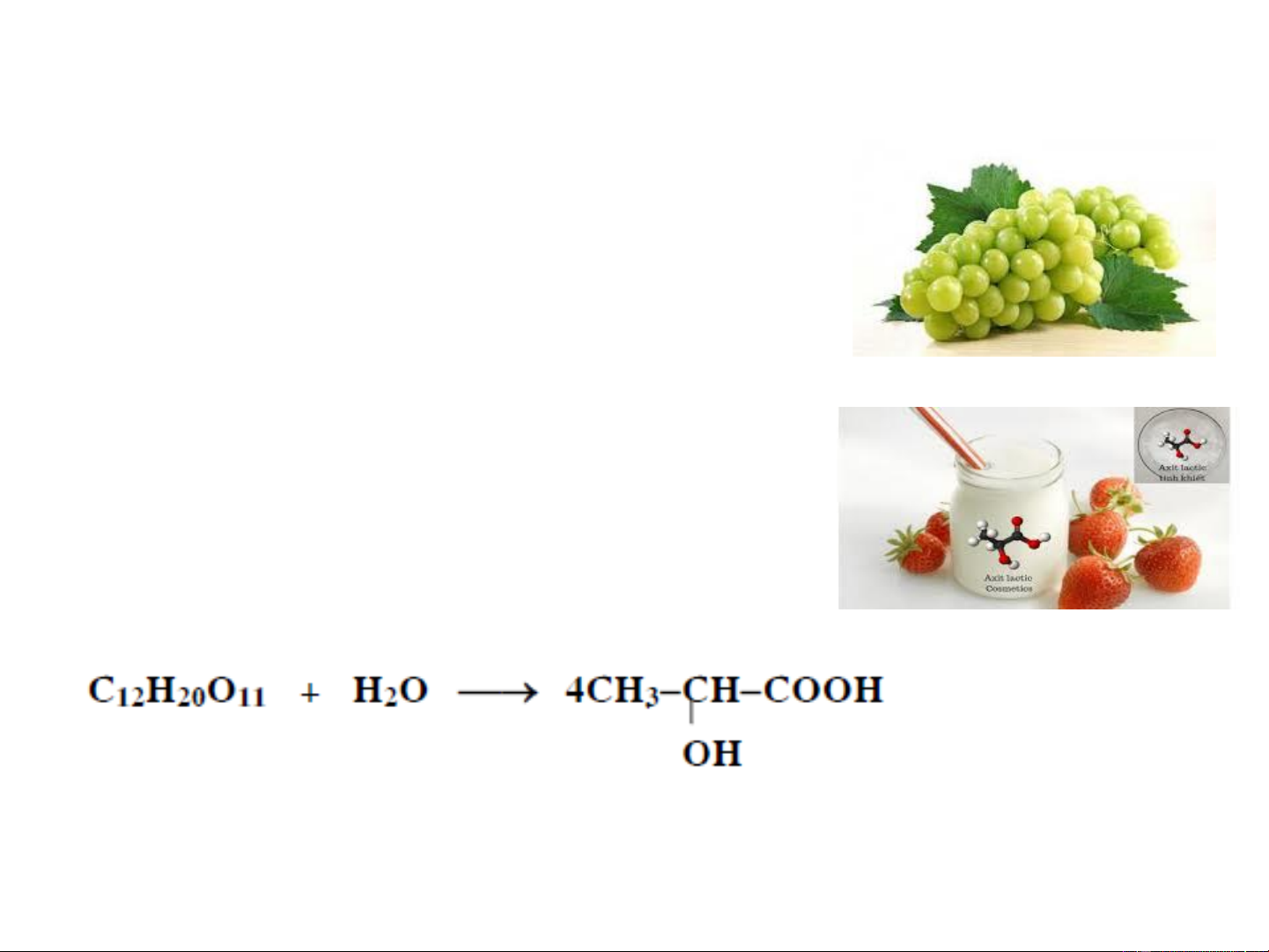
Preview text:
HỢP CHẤT TẠP CHỨC (1) HYDROXY AXIT 1. KHÁI NIỆM
Hợp chất tạp chức là các hợp chất mà trong
phân tử có nhiều loại nhóm chức khác nhau.
Hydroxy axit là những dẫn xuất hữu cơ có chứa
đồng thời hai loại nhóm chức trong phân tử: nhóm
cacboxyl -COOH (nhóm chức axit) và nhóm
hydroxyl -OH(nhóm chức ancol)
Có đồng thời các tính chất của cả hai loại nhóm chức.
Có những tính chất riêng, đặc trưng cho sự tồn tại
đồng thời của hai loại nhóm chức trong phân tử.
Đặc biệt ở hydroxy axit cũng như ở các dẫn xuất hữu cơ chứa
các nhóm chức hỗn tạp khác, do sự có mặt của nguyên tử
cacbon bất đối nên chúng có các dạng đồng phân quang học
Hydroxy axit là những dẫn xuất hữu cơ có chứa đồng thời hai loại nhóm chức trong
phân tử: nhóm cacboxyl -COOH và nhóm hydroxyl -OH •
Hydroxy axit là những hợp chất khá phổ biến trong tự nhiên,
trong thế giới thực, động vật. ❖ Phân loại
- Axit monohydroxy monocacboxylic: VD: Axit glycolic
1 nhóm - OH, 1 nhóm COOH HO - CH -COOH 2
- Axit polyhydroxy monocacboxylic:
Nhiều nhóm -OH, 1 nhóm COOH
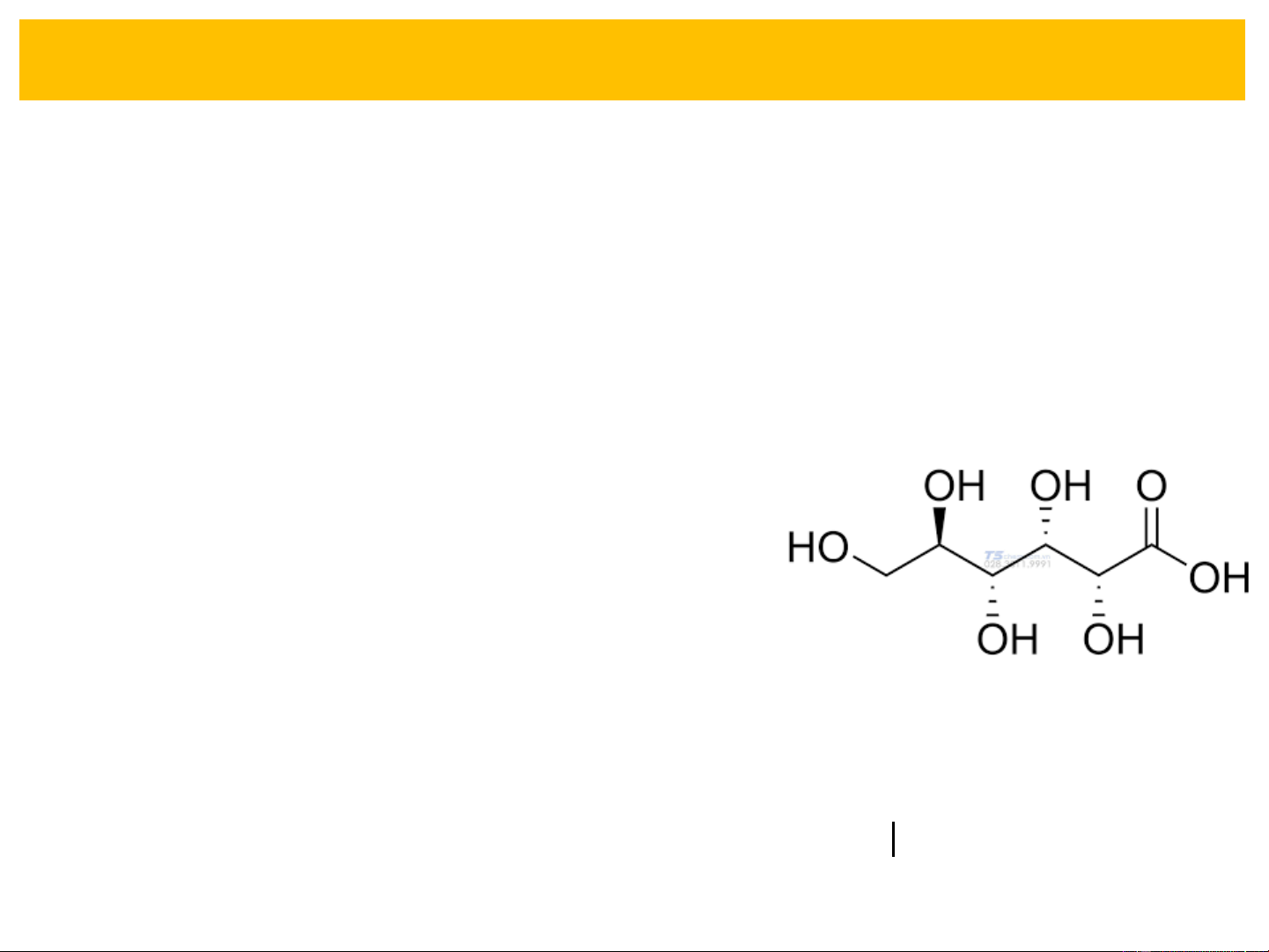
VD: Axit gluconic CH OH−(CHOH) −COOH 2 4
- Axit hydroxy polycacboxylic:
1 nhóm -OH, nhiều nhóm COOH
HOOC−CH−CH −COOH 2
VD: Axit malic (axit hydroxy sucxinic) OH
2. PHƯƠNG PHÁP ĐIỀU CHẾ
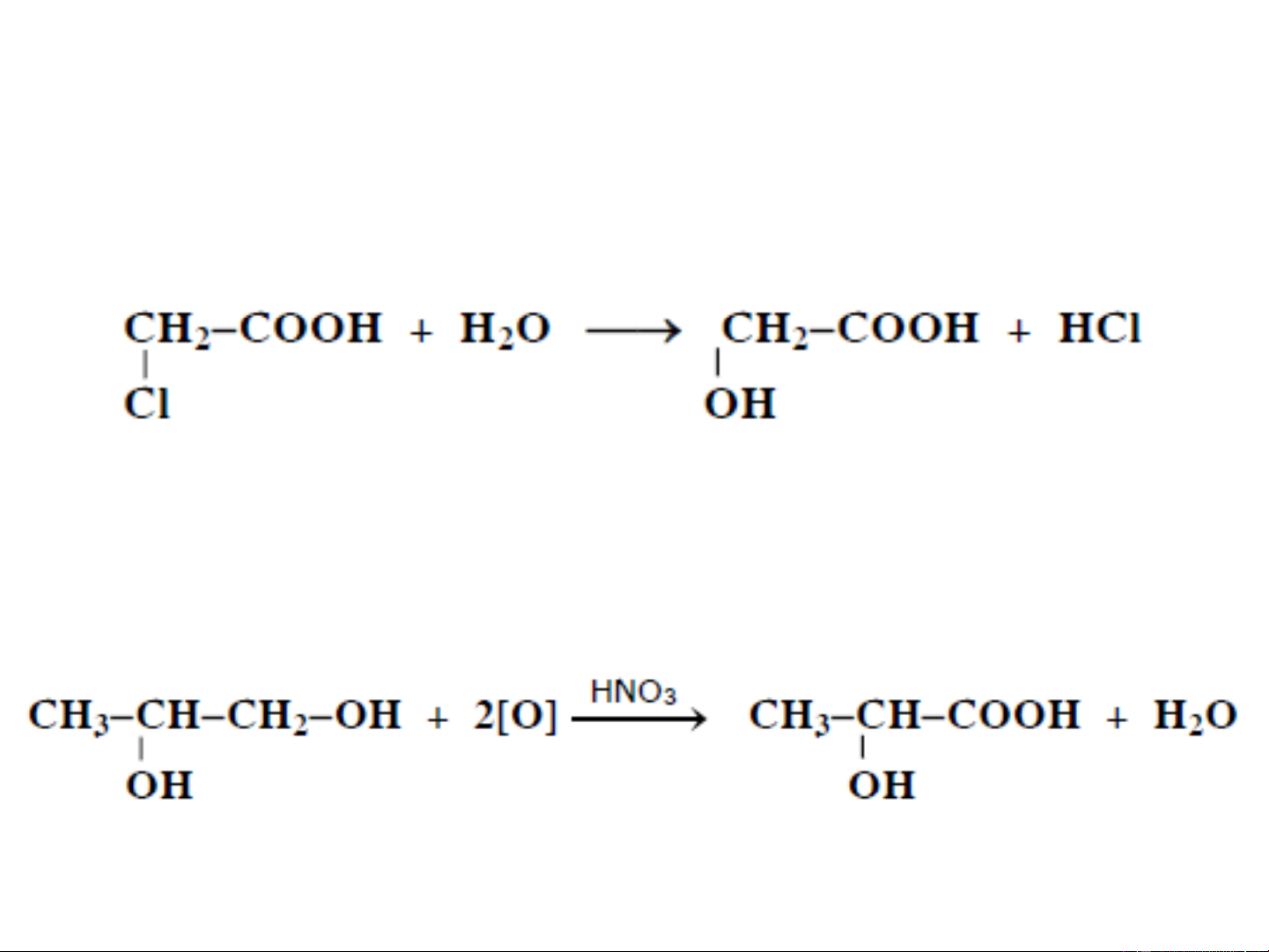
❖ Thuỷ phân halogeno-axit bằng bạc oxit ẩm, natri
hydroxit hay natri cacbonat:
Phản ứng có hiệu suất khá cao
❖ Oxi hoá glycol, chứa ít nhất một nhóm ancol bậc nhất :
Phản ứng có hiệu suất thấp
2. PHƯƠNG PHÁP ĐIỀU CHẾ
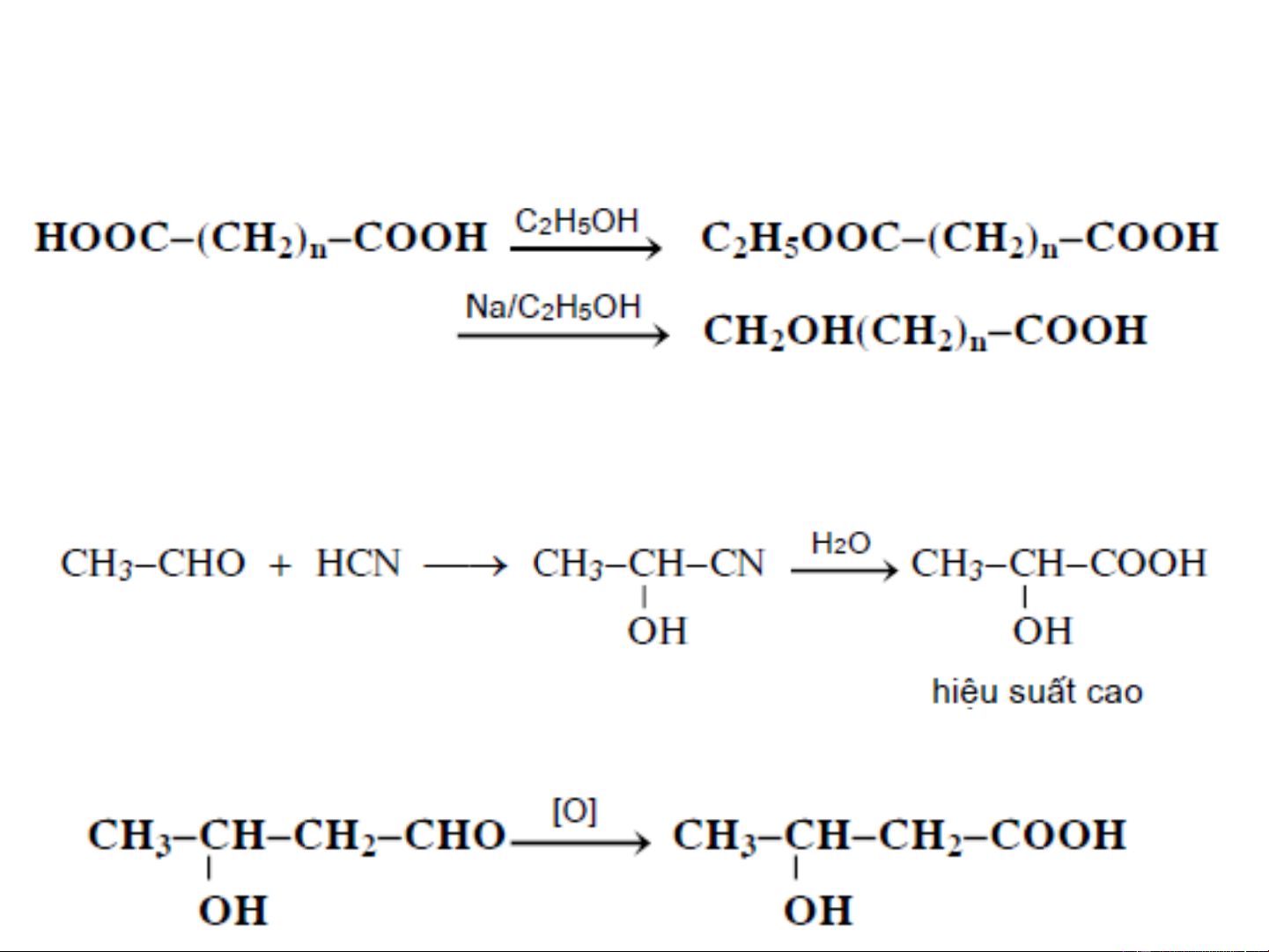
❖ Khử hoá andehit axit, xeton axit hoặc dicacboxylic axit
trong những điều kiện thích hợp:
Trong thực tế, chỉ sự khử hóa diaxit là quan trọng
❖ Thuỷ phân xyanhydrin:
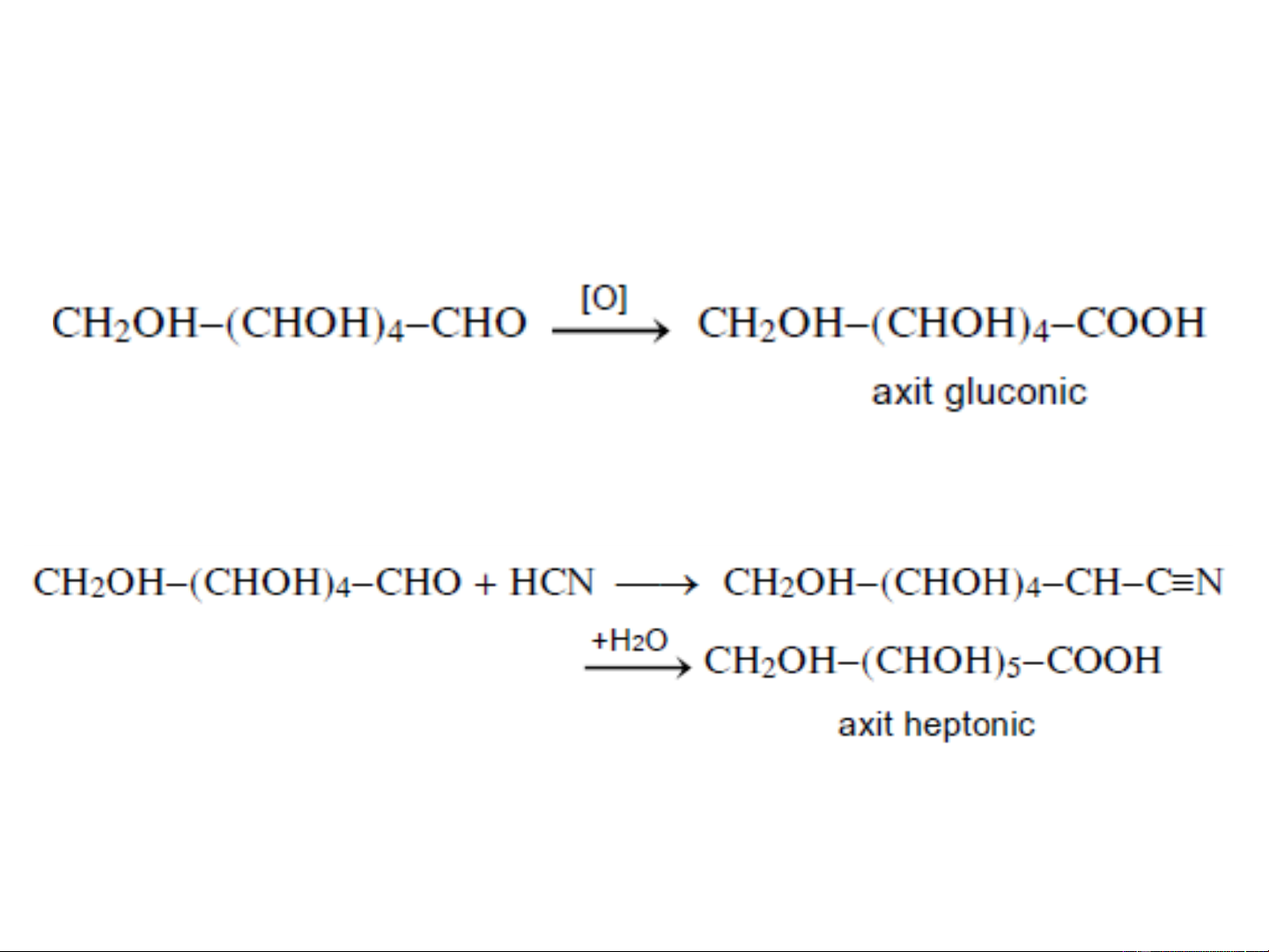
❖ Oxi hoá hydroxy andehit:
2. PHƯƠNG PHÁP ĐIỀU CHẾ
❖ Tác dụng axit nitrơ với amino axit:
H N−CH −COOH + HO−N=O ⎯→ 2 2
⎯→ HO−CH −COOH + N + H O 2 2 2
Phương pháp này cũng thường chỉ dùng để điều chế
-hydroxy axit từ -amino axit phổ biến trong thiên nhiên
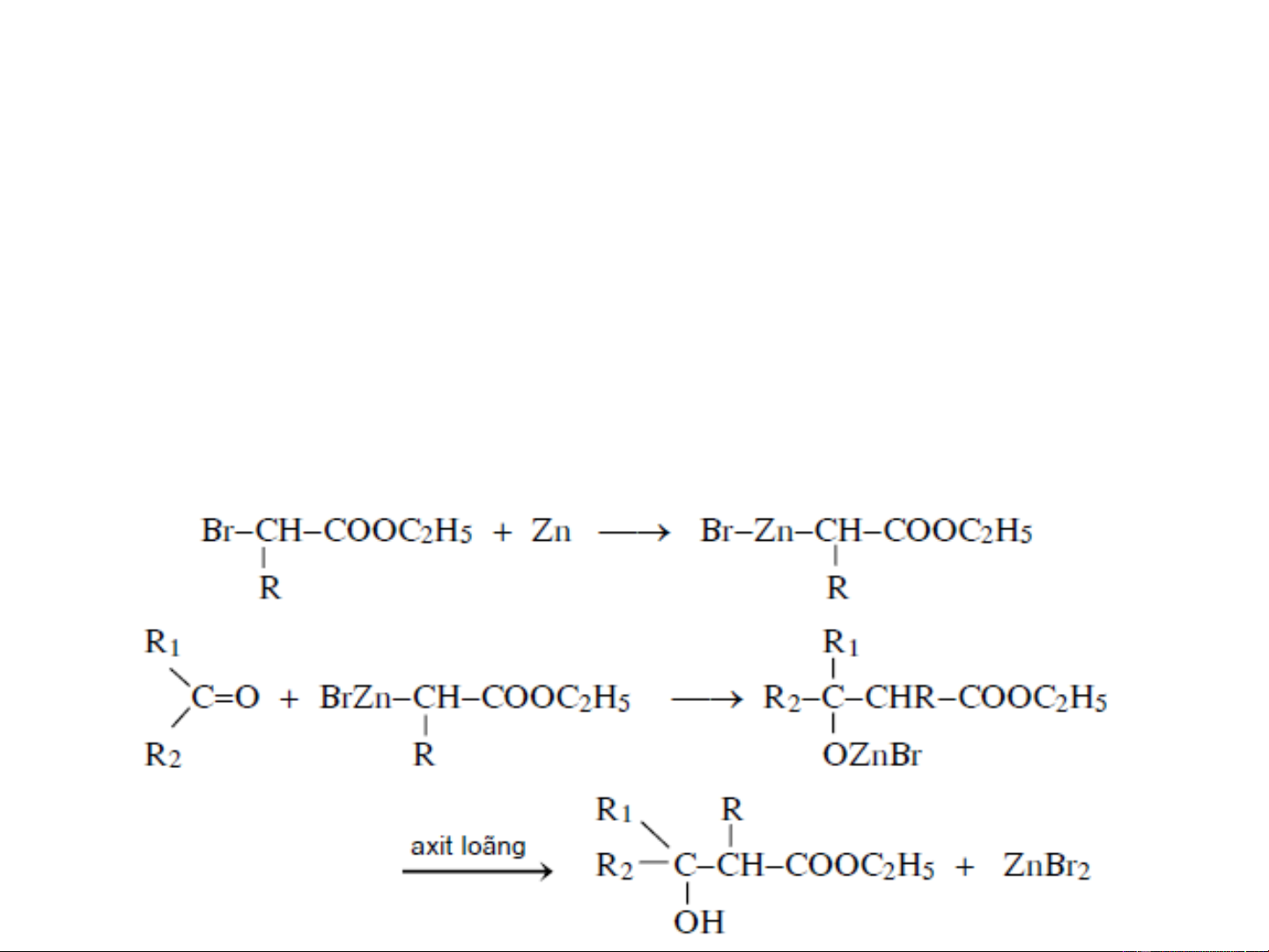
❖ Điều chế nhờ hợp chất cơ kim: Phản ứng Reformatsky
2. PHƯƠNG PHÁP ĐIỀU CHẾ
❖ Điều chế Axit polyhydroxy monocacboxylic:
- Oxi hoá polyol hoặc các andozơ (monosaccarit thuộc nhóm andozơ)
- Cộng hợp axit xyanhydric với andozơ rồi thuỷ phân
3. TÍNH CHẤT HÓA HỌC CỦA HYDROXY AXIT NHẬN XÉT CHUNG: HO – R–COOH
Các hợp chất hydroxy axit trong phân tử có
chứa hai nhóm –OH và –COOH nên:
+) Mang cả 2 tính chất đặc trưng của hai nhóm –OH và –COOH
+) Tính axit của hydroxy axit mạnh hơn so với
axit cacboxylic cùng loại do ảnh hưởng hiệu ứng –I của nhóm OH
+) Có hiện tượng phổ biến là các đồng phân
quang học do có C bất đối.
❖ Được sử dụng trong ngành công nghiệp mỹ phẩm, thuộc
da, tổng hợp hữu cơ cũng như trong đời sống,...
❖ Tính tan: Nói chung hydroxy axit tan trong nước nhiều
hơn các axit béo hoặc ancol tương ứng, do có mặt cả
hai nhóm chức có khả năng tạo liên kết hydro với nước. ❖ Tính axit:
Các hydroxy axit thường có tính axit mạnh
hơn axit no thông thường, nhất là khi hai nhóm chức khá gần nhau Axit axetic K = 1,76.10−5 CH COOH 3 Axit propionic K = 1,34.10−5 CH CH COOH 3 2 Axit glycolic K = 1520.10−5
HO−CH −COOH 2 Axit lactic K = 1550.10−5
CH −CHOH−COOH 3
❖Tính chất của nhóm chức:
+ Nói chung hydroxy axit thể hiện cả tính chất của axit và của
ancol, trong nhiều phản ứng, nhóm cacboxyl và nhóm hydroxyl
không ảnh hưởng lẫn nhau, đặc biệt là khi chúng cách xa nhau.
+ Nhóm cacboxyl (-COOH) có thể tham gia các phản ứng tạo
thành este, anhydrit, axyl clorua, amid, nitril...
+ Nhóm hydroxyl (-OH) cũng có thể chuyển thành ete, este, ... axetyl glycolic axit
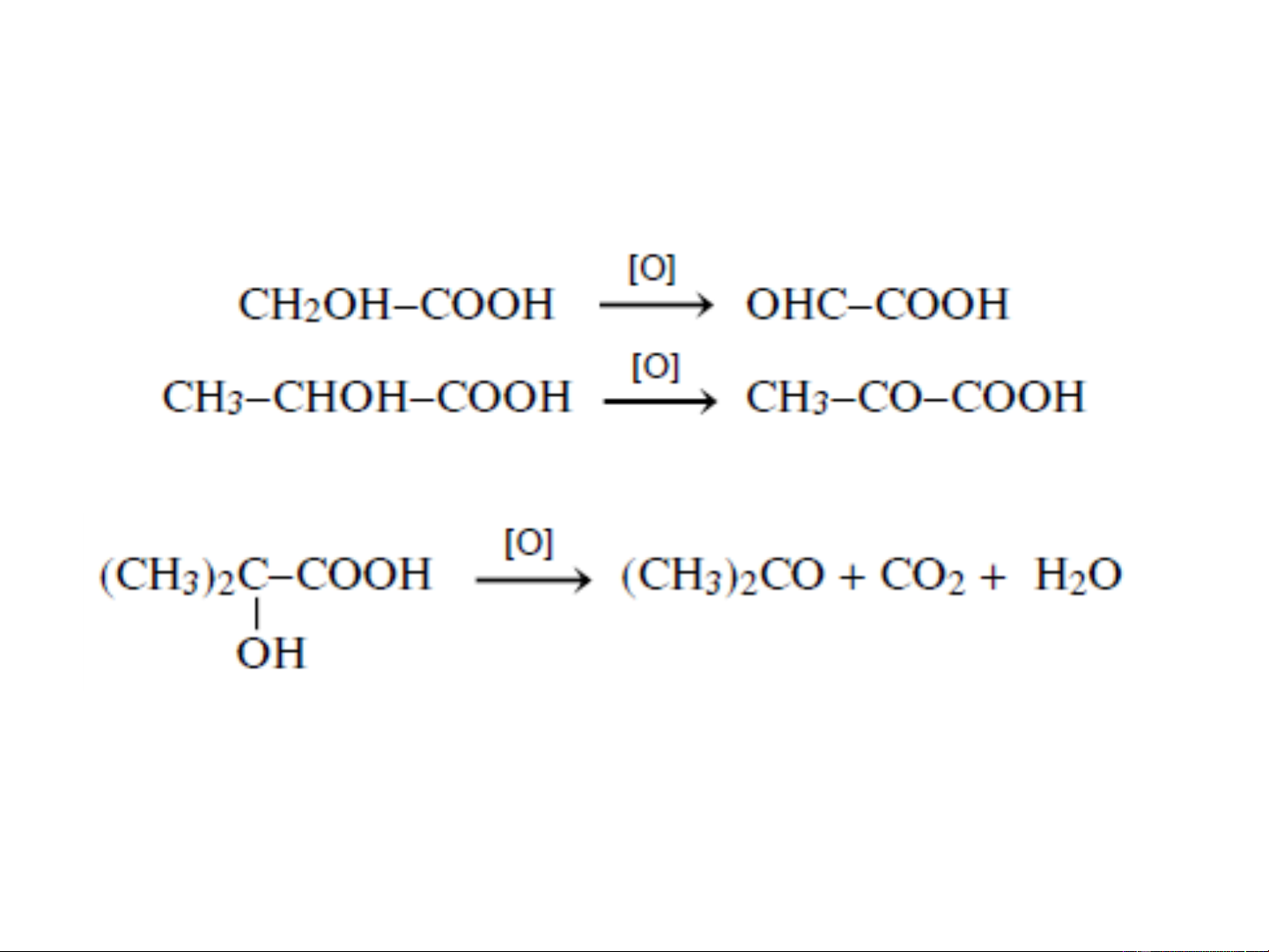
+ Phản ứng Oxy hóa:
- nhóm ancol bậc 1 và bậc 2 chuyển thành nhóm cacbonyl
- nhóm ancol bậc ba thường bị bẻ gãy mạch C:
Các tác nhân oxy hoá khác nhau có thể dùng như: axit
nitric loãng, thuốc thử Fenton (H O và sunfat sắt II), 2 2 permanganat...
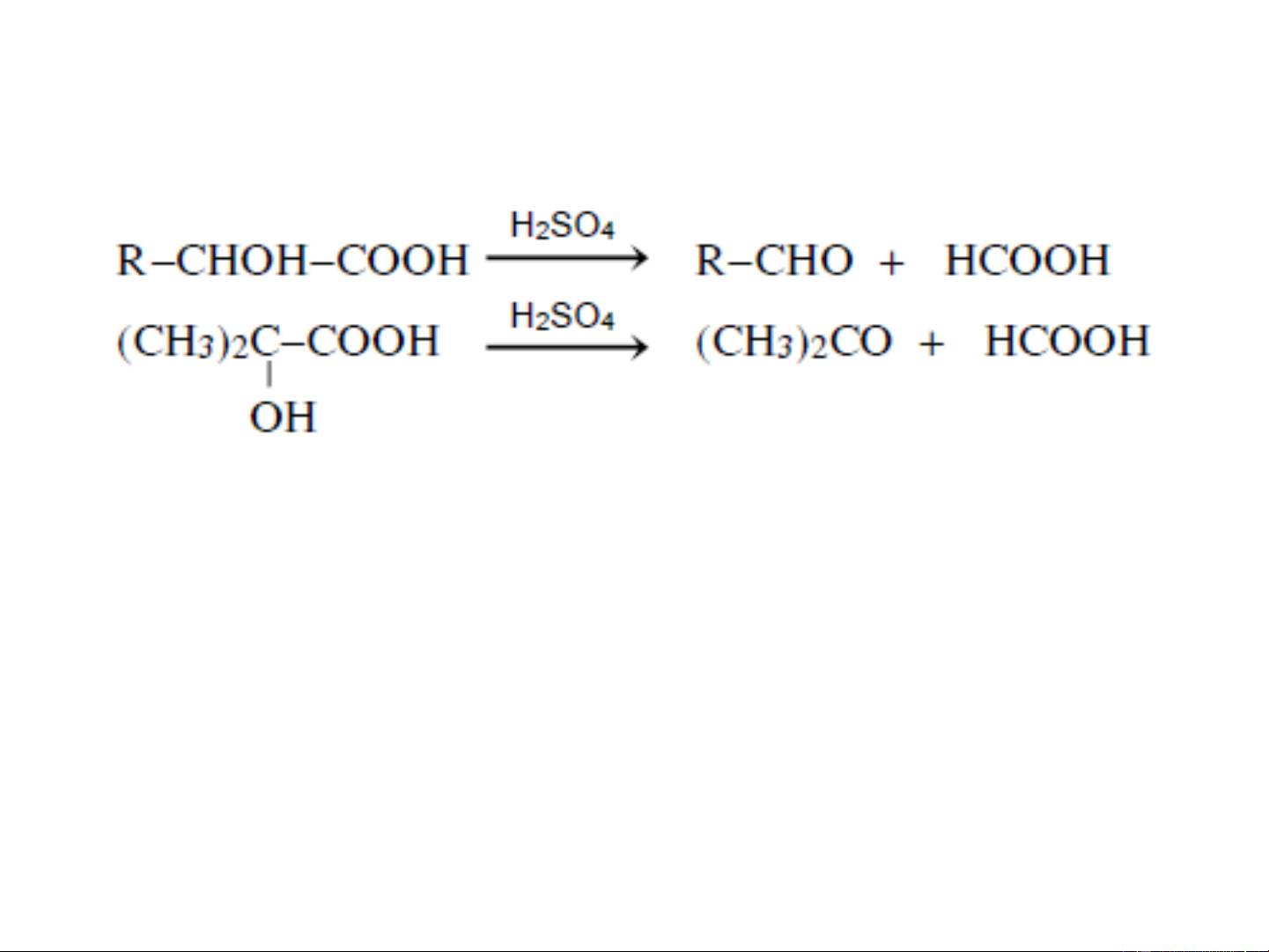
+ Khi đun nóng với axit sunfuric loãng, các -hydroxy axit
chuyển thành andehit hoặc xeton
+ Phản ứng phân biệt các loại hydroxy axit :
Khi đun nóng hydroxy axit, sẽ tạo thành các
sản phẩm khác nhau phụ thuộc vào vị trí tương
đối của hai nhóm hydroxyl và cacboxyl.
+ Phản ứng phân biệt các loại hydroxy axit khi đun nóng:
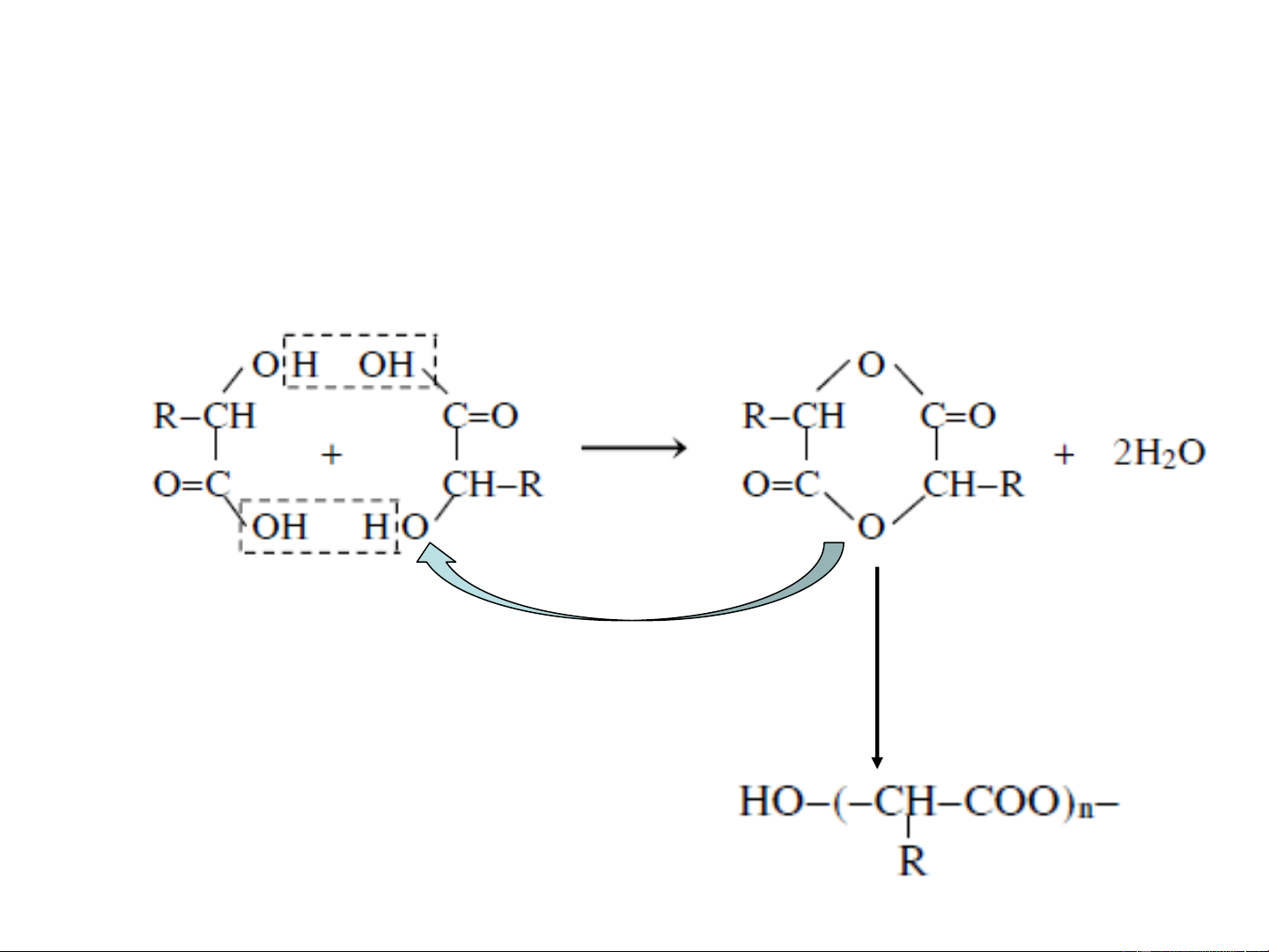
- Đối với -hydroxy axit sẽ tạo thành lactit, là hợp
chất dieste vòng 6 cạnh do hai phân tử hydroxy axit tạo thành to - Vòng lactit Khi đun nóng với kiềm, OH
lactit dễ dàng thuỷ phân ZnCl , to 2 cho ta hydroxy axit ban đầu H polyeste thẳng
+ Phản ứng phân biệt các loại hydroxy axit khi đun nóng:
- Khi -hydroxy axit được đun nóng, bị loại một
phân tử nước, tạo thành axit không no (chủ yếu là
,-etylenic axit và một lượng rất nhỏ ,-etylenic) NaOH 10% to Mất màu nước Br2
+ Phản ứng phân biệt các loại hydroxy axit khi đun nóng:
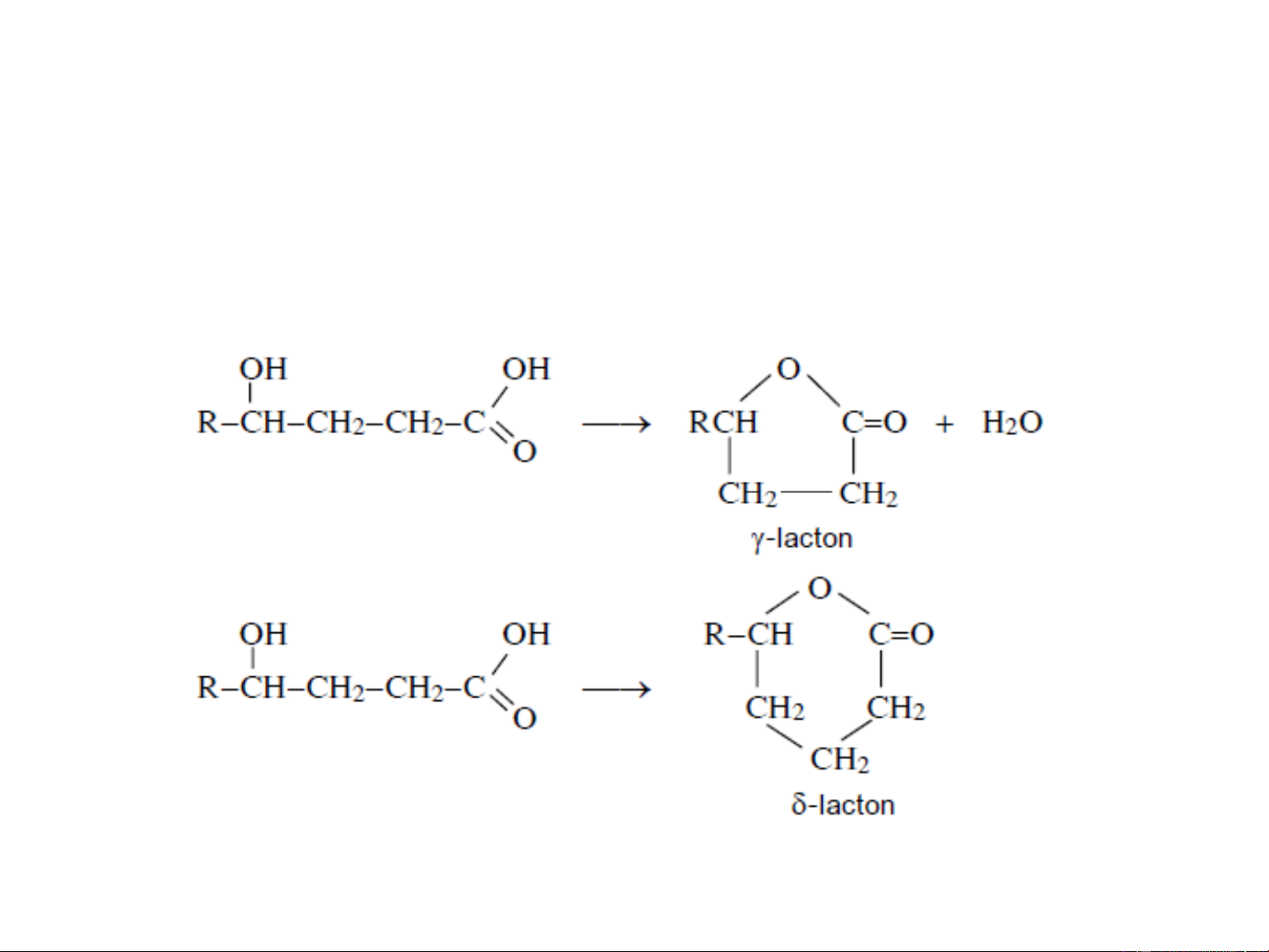
- Khi để yên, và -hydroxy axit dễ dàng chuyển
thành este nội phân tử, gọi là lacton ngay cả ở nhiệt độ phòng.
- Khi để yên, và -hydroxy axit dễ dàng chuyển
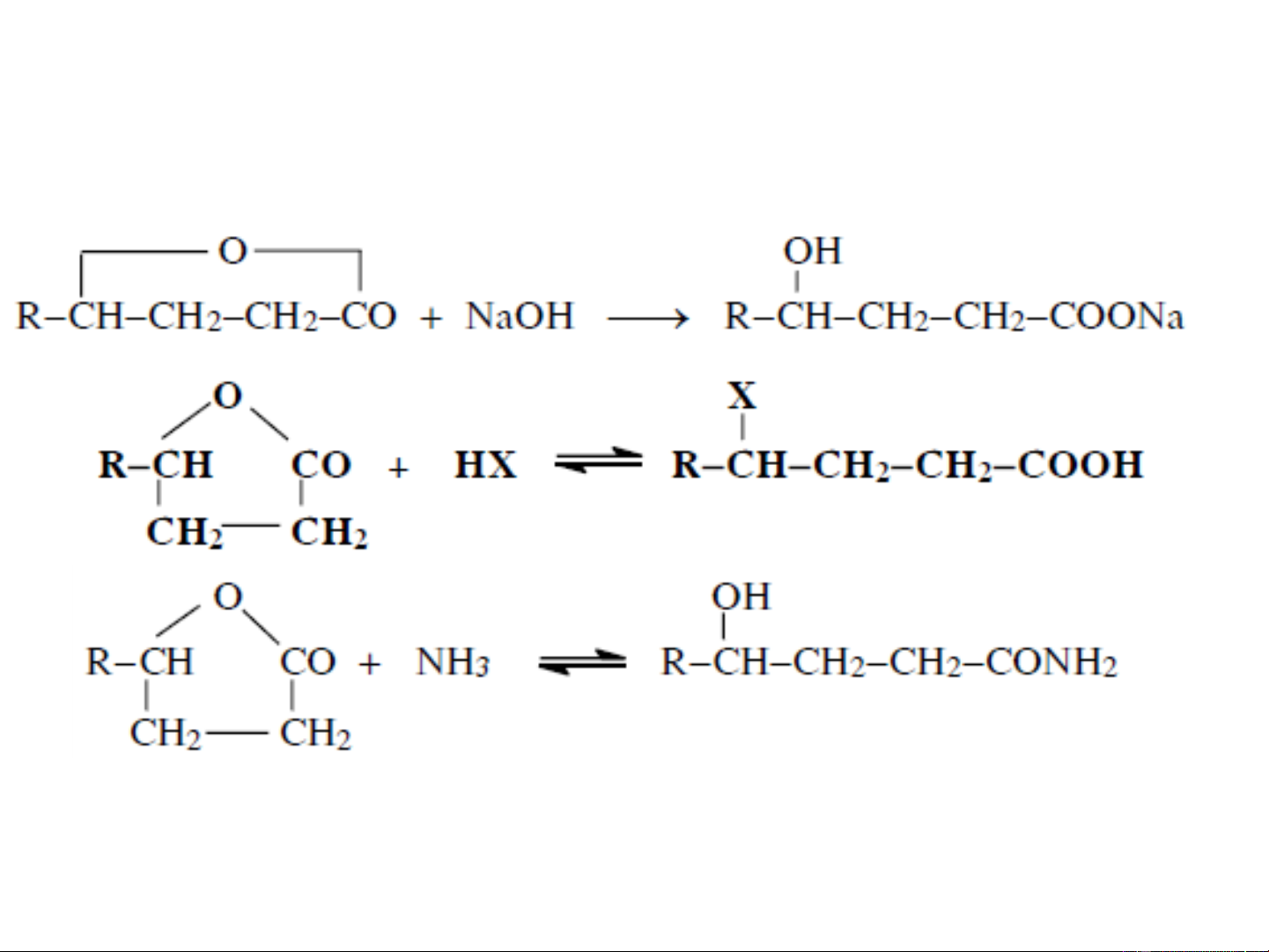
thành vòng lacton. Vòng lacton có ngay cả ở nhiệt độ
phòng một số phản ứng:
- Những hydroxy axit có nhóm hydroxy ở xa nhóm cacbonyl
hơn thường tạo thành axit không no, hoặc tạo thành polyeste mạch thẳng
Giới thiệu một số chất tiêu biểu
1. Axit glycolic (hydroxy axit axetic) CH OH−COOH 2
- Là hydroxy axit đơn giản nhất, và
thường có trong nước ép củ cải
đường, trong nho xanh v.v... 2. Axit lactic
Axit lactic là chất lỏng sánh, không màu,
nóng chảy ở 18oC và sôi ở 122oC/15
mmHg, có mùi và vị chua, hút ẩm, tan
nhiều trong nước, có mọi tính chất của hydroxy axit Lên men Lactozơ Axit lactic
Axit lactic được dùng trong công nghiệp thuộc da, phẩm
nhuộm. Etyl lactat dùng làm dung môi hoà tan nitrat xenlulozơ, dung môi sinh học.
Giới thiệu một số chất tiêu biểu
3. Axit malic (axit hydroxy sucxinic)
- Axit L-malic rất phổ biến trong thiên nhiên,
có trong nhiều quả xanh như táo, nho, thanh
trà v.v... (tiếng La tinh: Malum = táo).
- Axit malic tự nhiên, kết tinh ở dạng hình
kim, nóng chảy ở 100oC, tan tốt trong nước.
- Axit malic được dùng trong sản xuất nước
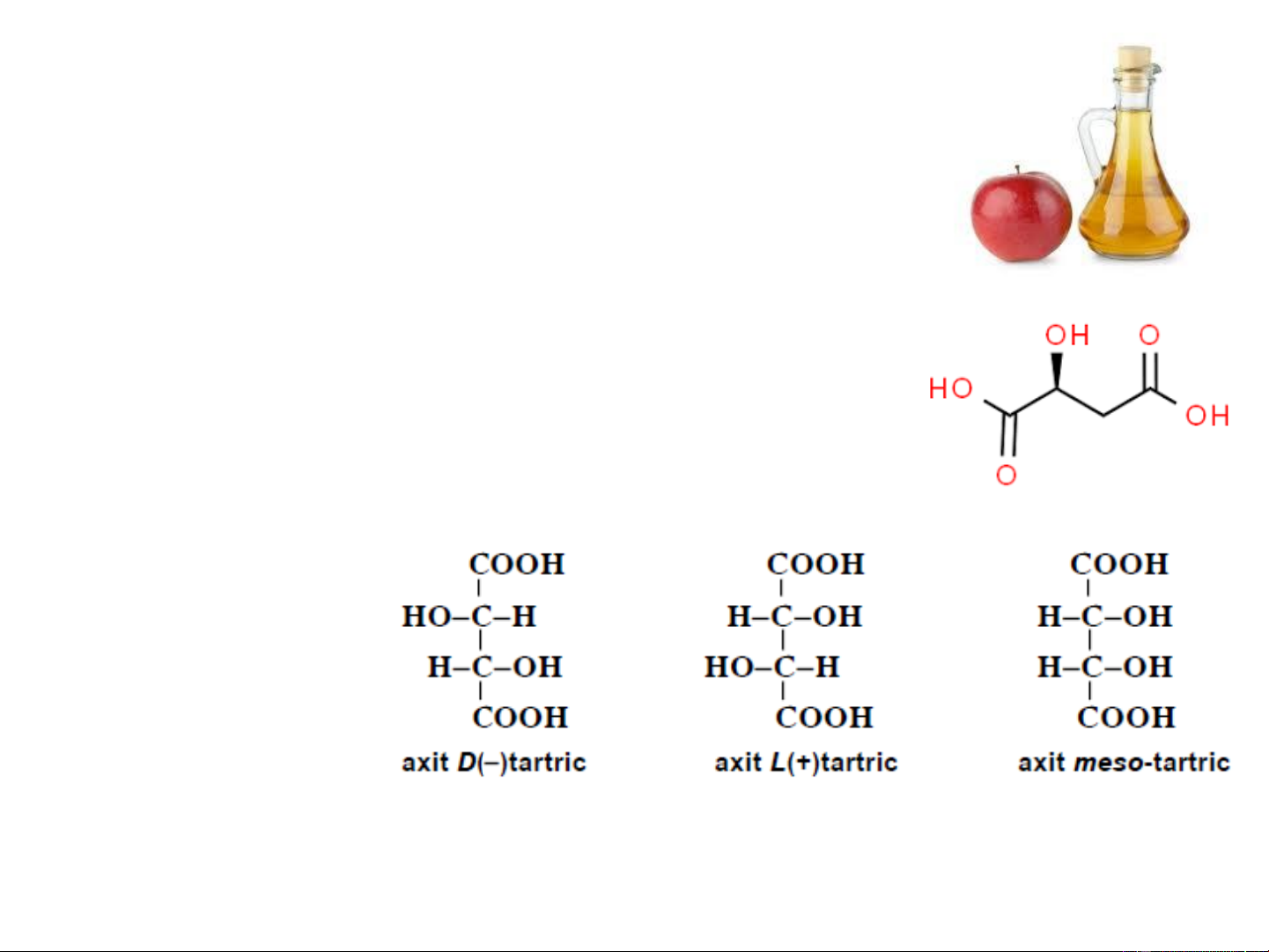
giải khát, xirô, nước hoa quả. 4. Axit tartric
Trong phân tử axit tartric có chứa hai nguyên tử cacbon bất đối
hoàn toàn giống nhau, vì vậy nó chỉ tồn tại ở 2 dạng: một cặp
dạng quang hoạt, một dạng meso:
Giới thiệu một số chất tiêu biểu
3. Axit malic (axit hydroxy sucxinic)
- Axit L-malic rất phổ biến trong thiên nhiên,
có trong nhiều quả xanh như táo, nho, thanh
trà v.v... (tiếng La tinh: Malum = táo).
- Axit malic tự nhiên, kết tinh ở dạng hình
kim, nóng chảy ở 100oC, tan tốt trong nước.
- Axit malic được dùng trong sản xuất nước
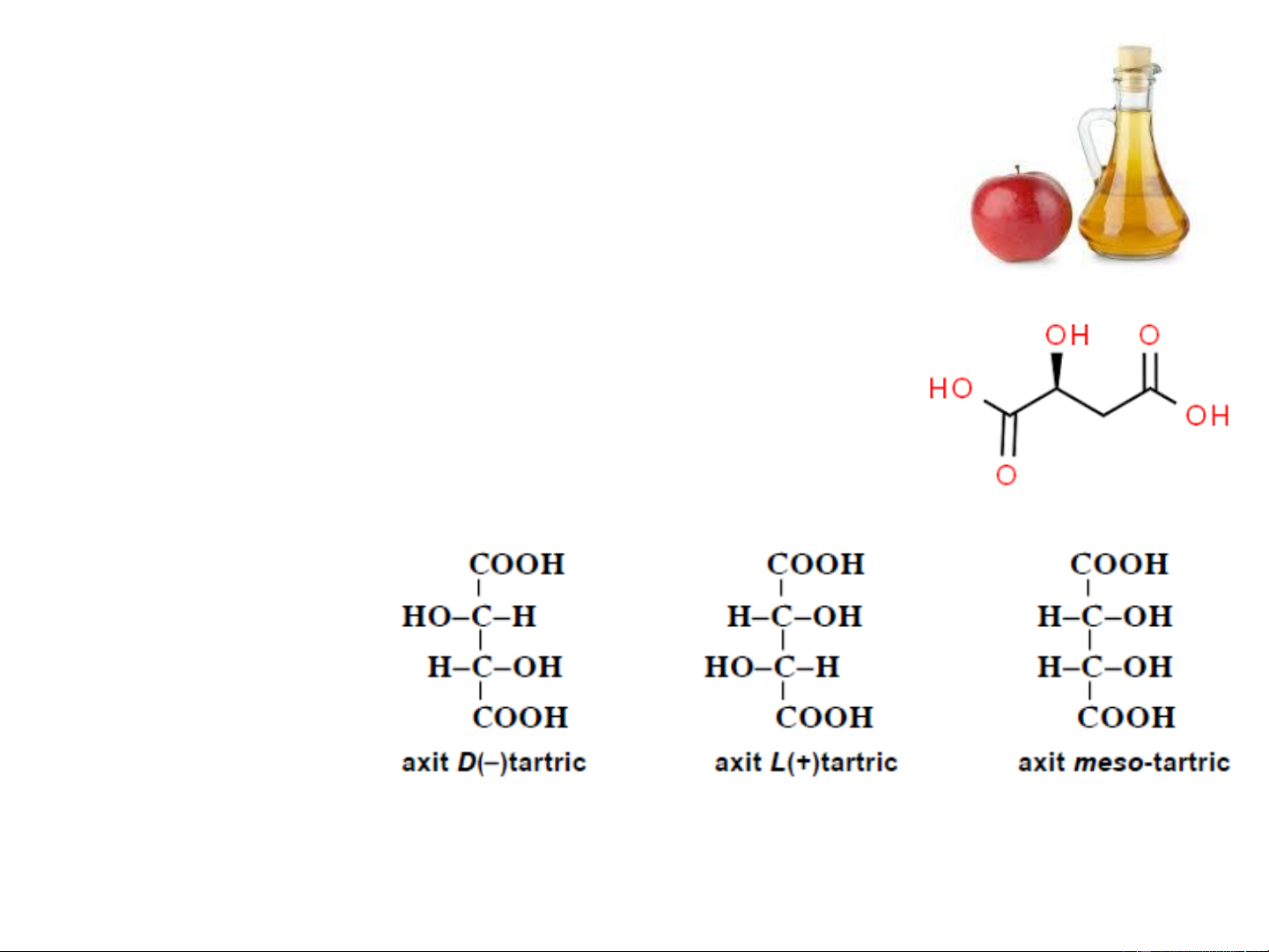
giải khát, xirô, nước hoa quả. 4. Axit tartric
Trong phân tử axit tartric có chứa hai nguyên tử cacbon bất đối
hoàn toàn giống nhau, vì vậy nó chỉ tồn tại ở 2 dạng: một cặp
dạng quang hoạt, một dạng meso:
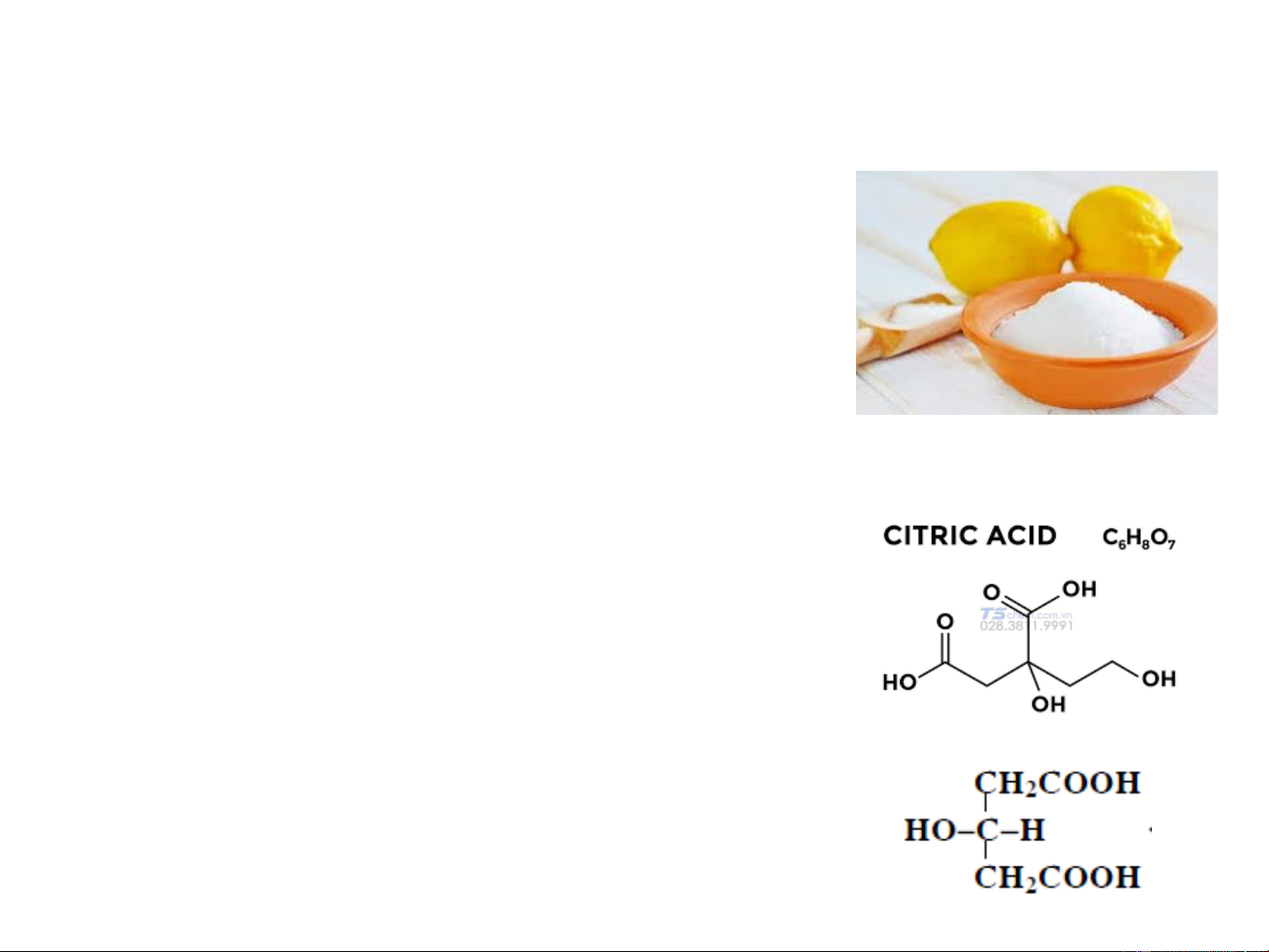
Giới thiệu một số chất tiêu biểu 5. Axit xitric
Axit xitric thường gặp trong nhiều quả,
nhất là các quả thuộc họ chanh. Ví dụ
nước chanh có chứa 6 - 10% axit xitric.
Axit xitric được điều chế từ chanh bằng
cách chiết nước chanh, đun sôi cho đông
tụ các chất protein, và trung hoà với canxi
cacbonat. Lọc kết tủa canxi xitrat và đem
kết tủa phân huỷ với axit sunfuric loãng
đã tính toán sẵn. Loại canxi sunfat bằng
cách lọc và cho bay hơi nước lọc đến khi kết tinh




