









Preview text:
HYDROCACBON CHƯA NO,
CÓ 1 LIÊN KẾT ĐÔI: ANKEN (1) 1. Khái niệm 2. Danh pháp 3. Đồng phân 4. Điều chế 1. KHÁI NIỆM
Anken là hợp chất hydrocacbon chưa no
(không no) mạch hở mà trong phân tử chứa 1 liên kết đôi C=C.
+ Công thức phân tử chung của anken là C H với n 2 n 2n
Khi n = 2, ta có chất đầu tiên của dãy đồng
đẳng, gọi là etylen C H nên dãy anken còn 2 4
gọi là dãy đồng đẳng của etylen.
Anken còn được gọi là "ôlêfin" hay "olefin" (tên lịch sử
nhưng được sử dụng rộng rãi trong công nghiệp hóa
dầu) hoặc các hợp chất vinyl. 2. DANH PHÁP
2.1. Hợp chất Alken/Anken:
❖ Cách gọi tên thông thường Tên hydrocacbon no thay đuôi "an" tương ứng + bằng đuôi "ylen" C H etan C H etylen 2 6 2 4 C H propan C H propylene 3 8 3 6 C H butan C H butylene 4 10 4 8 C H pentan C H pentylen 5 12 5 10 2. DANH PHÁP
❖Cách gọi tên quốc tế IUPAC: theo một số nguyên tắc
Tên quốc tế của các ankan tương ứng
nhưng đổi đuôi "an" thành "en"
- Xác định mạch chính: Đó là mạch chứa liên kết đôi dài nhất
và có nhiều nhóm thế nhất (các nhánh phụ coi là nhóm thế)
- Đánh số mạch chính từ đầu gần liên kết đôi hơn và sao cho
tổng số chỉ vị trí của nhánh (locant) là nhỏ nhất 1 2 3 4 5 6
CH – CH – CH = CH – CH – CH 3 2 3 CH3 - Gọi tên: Tên vị trí tên anken STT + nhóm liên kết mạch chính + + nhóm thế thế đôi (đuôi en) 2. DANH PHÁP
❖ Cách gọi tên theo IUPAC (International Union Pure and Applied Chemistry) 1 2 3 4 5 6 7
2 – etyl- 3,5 – dimetyl-1-hepten
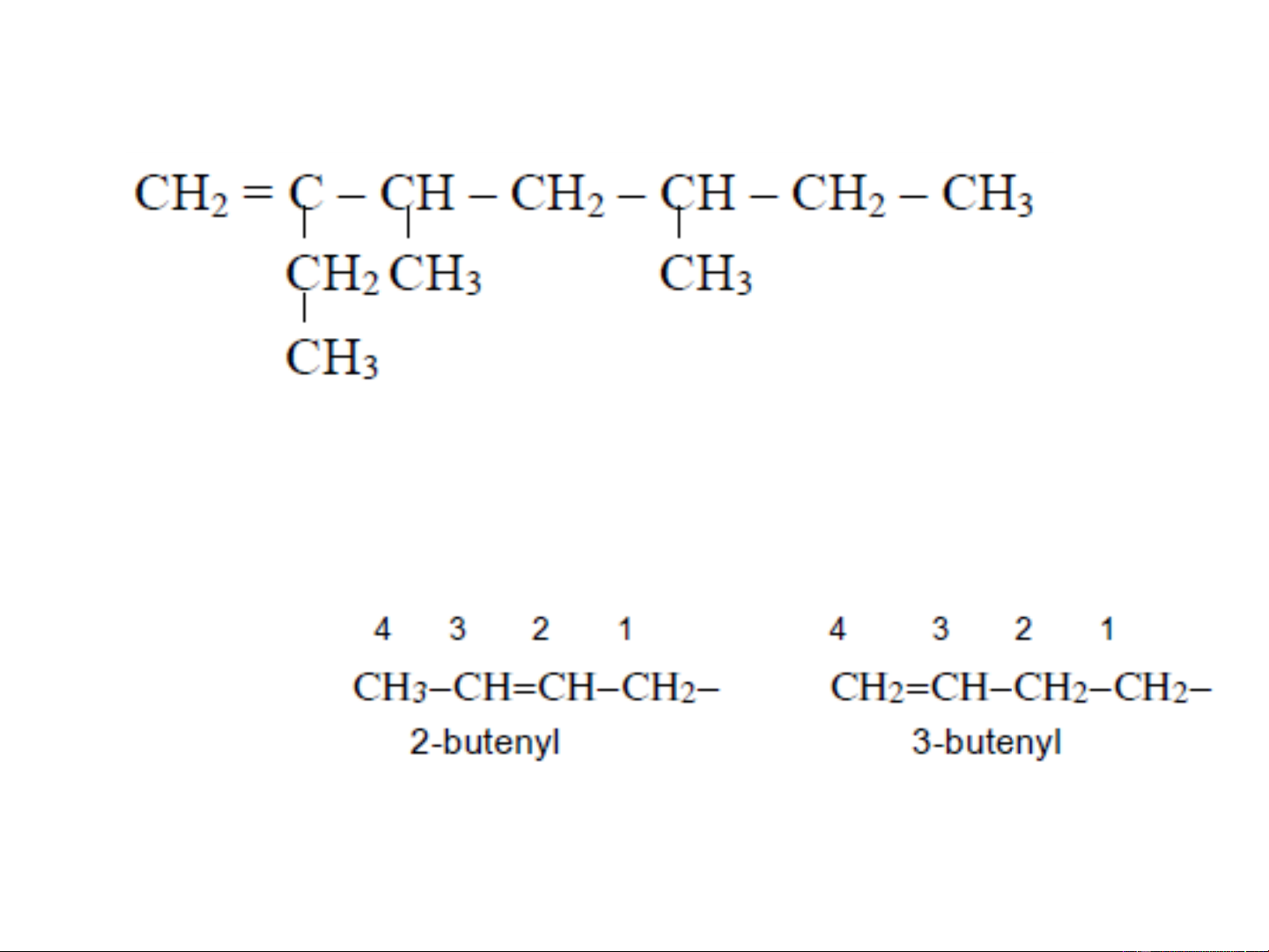
- Các gốc hydrocacbon chứa liên kết đôi có đuôi "enyl", việc
đánh số mạch cacbon trong gốc bắt đầu từ nguyên tử cacbon có hoá trị tự do
Một số gốc ankenyl có tên thông thường được sử dụng phổ biến: Vinyl CH =CH- =CH-CH - 2 allyl CH2 2 3. ĐỒNG PHÂN
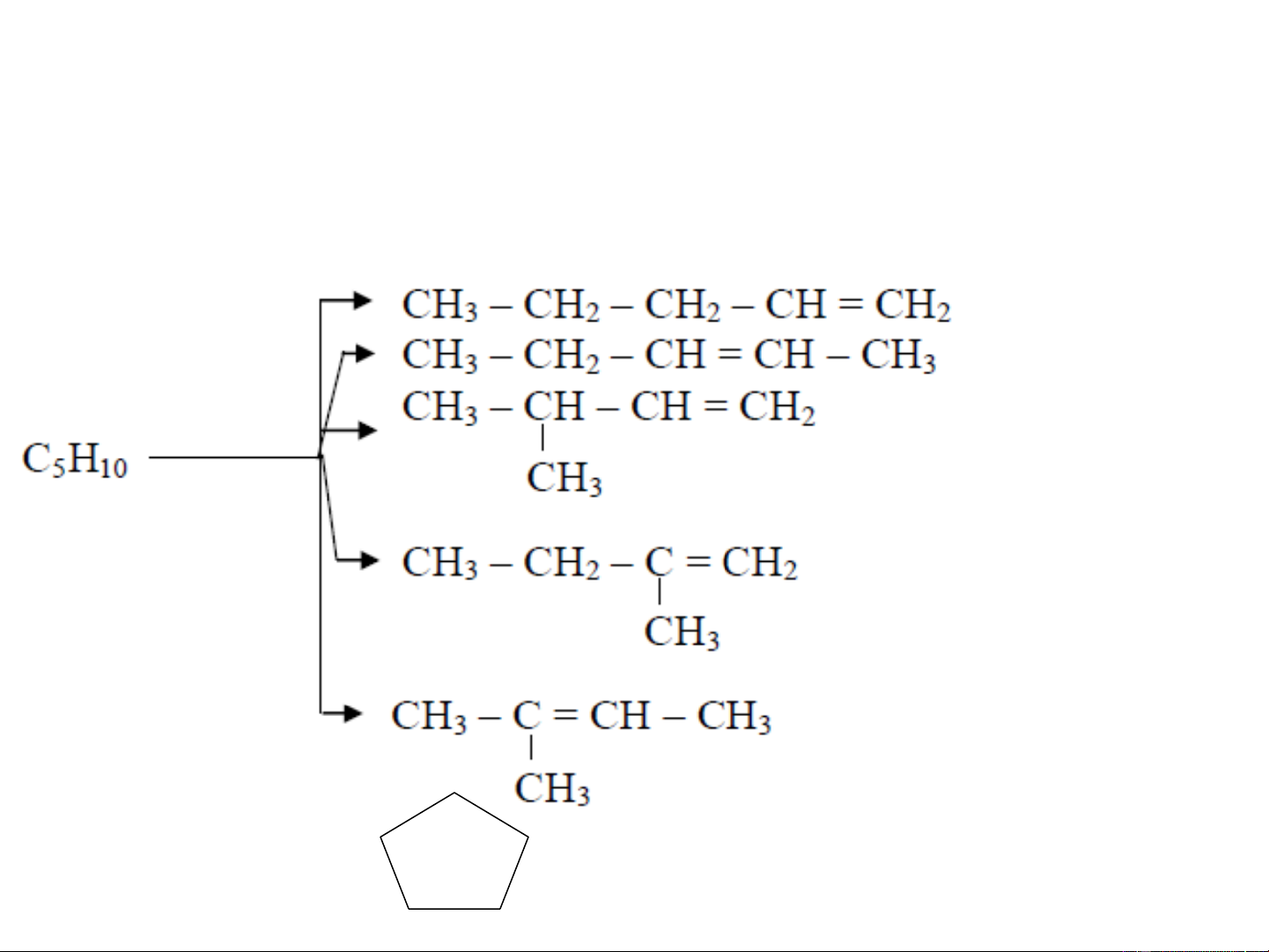
❖Đồng phân cấu tạo: đồng phân mạch, vị trí liên
kết đôi, kiểu liên kết,... Penten-1 Hoặc 1-penten Penten-2 3-metyl-1-buten 2-metyl-1-buten 2-metyl-2-buten xyclopentan 3. ĐỒNG PHÂN
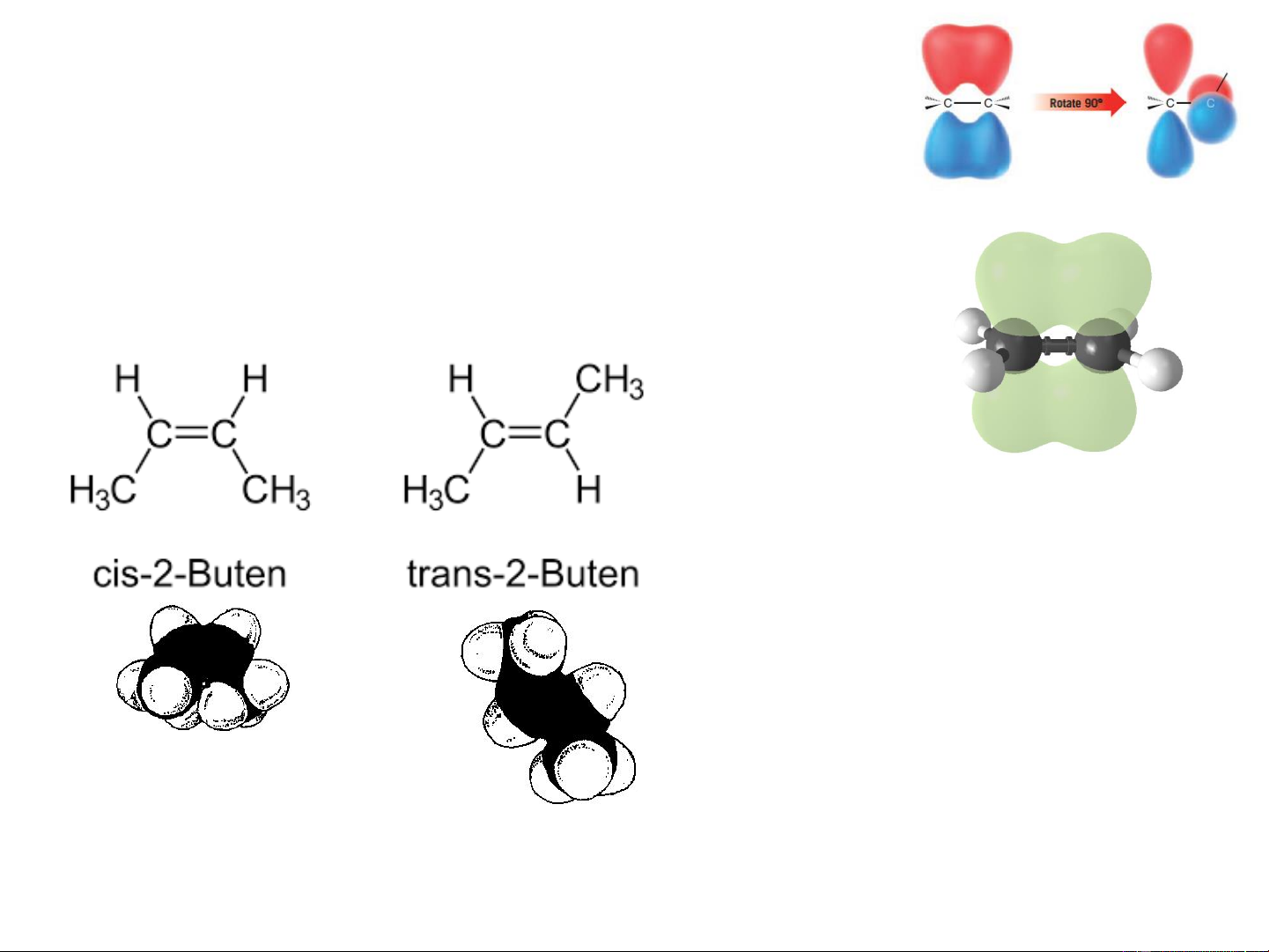
❖ Đồng phân hình học: Có đồng phân
hình học do mặt phẳng của liên kết đôi là
phần cố định, nhóm thế không thể quay tự
do xung quanh liên kết đôi như liên kết đơn,
vì khi quay như thế liên kết đôi sẽ bị phá vỡ Eten (etylen)
Các đồng phân cis −
trans có tính chất vật lý và hoá học khác nhau, Nói chung,
dạng trans bền vững cis-2-buten
hơn dạng cis, do ở t = −139oC; trans-2-buten nc trạng thái năng lượng t = +3,37oC t = −105oC; t = +1oC sôi nc sôi thấp hơn
4. PHƯƠNG PHÁP ĐIỀU CHẾ
4.1. Loại nước của rượu ( dehyrat hoá rượu ):
+) Với xúc tác H SO , đặc, : 2 4 H PO , P O 3 4 2 5 R– OH + H SO
→ R– OSO H→ R-CH = CH + H SO 2 4, đặc 3 2 2 4 Alkyl sunfat Anken
Ví dụ, đun nóng ancol etylic với H SO đặc ở nhiệt độ trên 2 4 170oC sẽ thu được etylen CH – CH – OH + H SO → CH – CH – OSO H 3 2 2 4, đặc 3 2 3 CH – CH – OSO H → CH = CH + H SO 3 2 3 2 2 2 4
Với rượu mạch dài, phản ứng loại H2O thường tuân theo qui
tắc tách Zaitsev (ưu tiên tách OH cùng H ở C bậc cao hơn)
CH – CH –CHOH – CH + H SO
→ CH – CH = CH – CH 3 2 3 2 4, đặc 3 3
4. PHƯƠNG PHÁP ĐIỀU CHẾ
4.1. Loại nước của rượu ( dehyrat hoá rượu ):
+) Với xúc tác axit rắn: Zeolit, Al O : Đây là phương 2 3
pháp sử dụng trong công nghiệp. 3500C CH – CH –CH – OH CH – CH = CH + H O 3 2 2 3 2 2 Al O 2 3
4. PHƯƠNG PHÁP ĐIỀU CHẾ
4.2. Tách loại hydro halogenua (HX) của mono ankyl halogenua: +) Phản ứng: KOH/rượu R – CH – CH – X R – CH = CH + HX 2 2 2 2
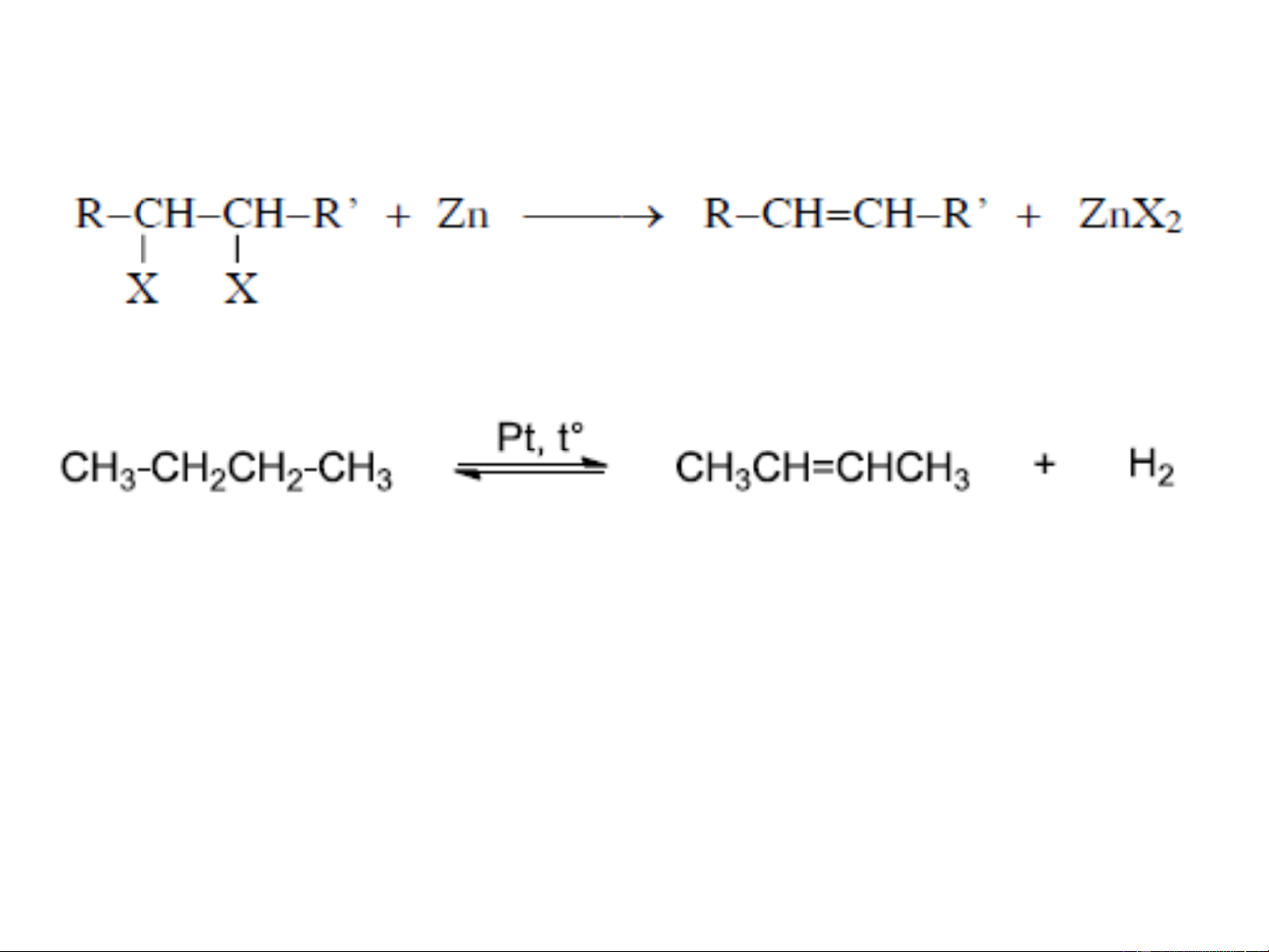
4. PHƯƠNG PHÁP ĐIỀU CHẾ
4.3. Đi từ dẫn xuất dihalogen : Dd CH COOH 3
4.4. Dehyro hóa:
4.5. Craking dầu mỏ: to
R – CH – CH – R’ → R – CH = CH + R’H 2 2 2 anken ankan NỘI DUNG CẦN NHỚ
VỀ HỢP CHẤT ANKEN (1) 1. Khái niệm 2. Danh pháp - Thông thường - IUPAC 3. Đồng phân
- đồng phân cấu tạo
- Đồng phân hình học
4. Phương pháp Điều chế - Oxi hóa - Hydrat hóa - Tách loại, - Cracking,... HYDROCACBON CHƯA NO,
CÓ 1 LIÊN KẾT ĐÔI: ANKEN (2)
1. Tính chất vật lý
2. Tính chất hóa học
1. TÍNH CHẤT VẬT LÝ
+) Trạng thái: C2 và C3: Khí C4 : Lỏng
Các đồng đẳng với số C lớn hơn: Rắn
+) to < ankan có cùng số nguyên tử C. s
cis-Anken có t°s cao hơn (µ lưỡng cực lớn hơn), nhưng có
t°nc thấp hơn (vì ít đối xứng hơn) trans-anken tương ứng.
+) Tan rất ít trong H O, tan nhiều hơn trong dung môi hữu cơ 2
ít phân cực. Các anken tan được trong SO lỏng. 2
+) d, n (chiết suất) > alkan cùng số nguyên tử C
2. TÍNH CHẤT HÓA HỌC NHẬN XÉT CHUNG:
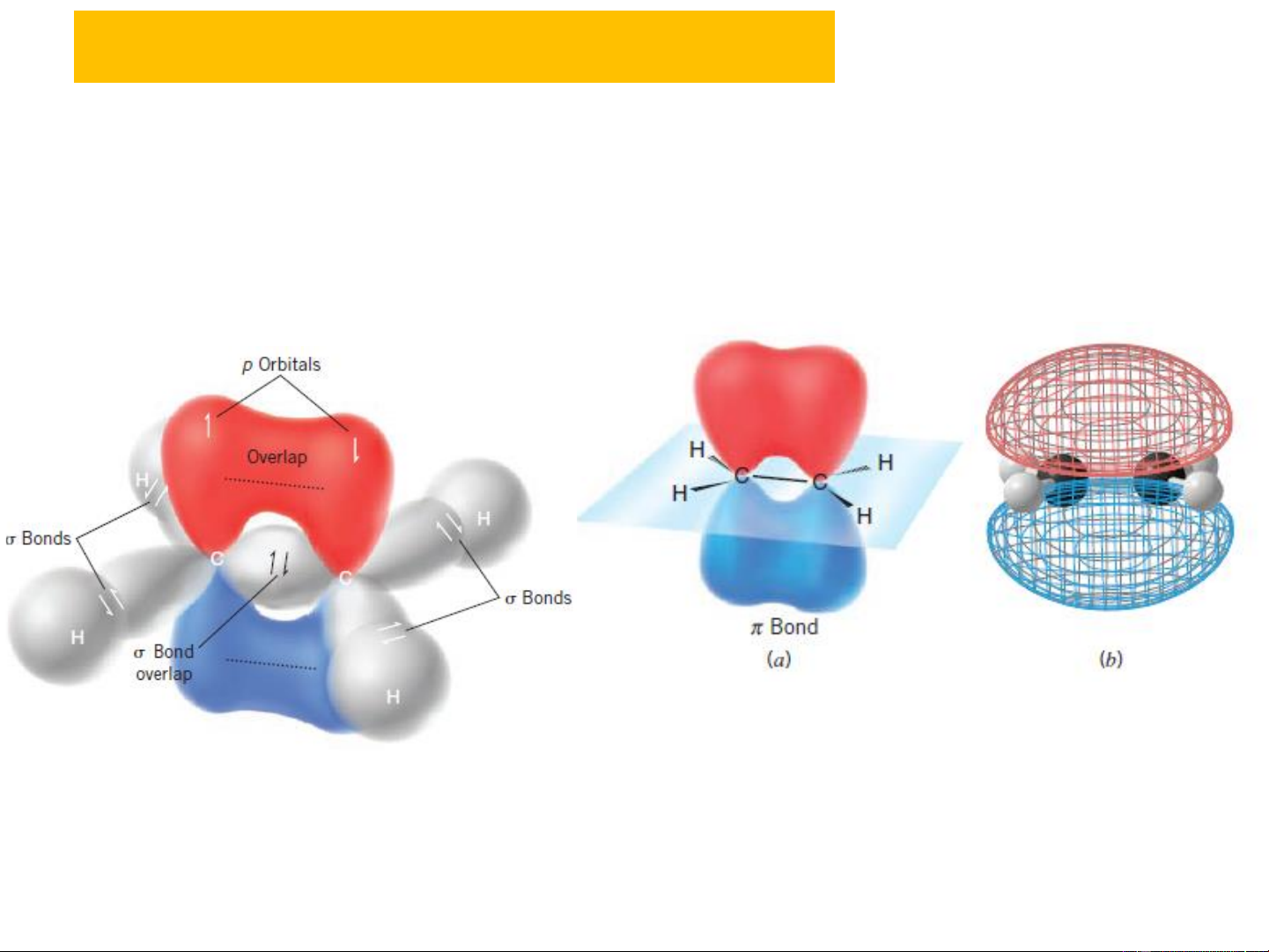
+ Nguyên tử C chứa liên kết đôi trong anken ở trạng
thái lai hoá sp2, trong liên kết đôi có một liên kết do sự xen
phủ trục của hai electron lai hoá và một liên kết do sự xen
phủ bên của hai electron p.
Ví dụ phân tử CH2=CH2
Tất cả các nguyên tử liên kết trực tiếp với hai nguyên tử C trong liên kết đôi đều
nằm trên cùng một mặt phẳng với hai C đó (mặt phẳng liên kết). Hai trục của hai
electron p song song nhau tạo thành mặt phẳng vuông góc với mặt phẳng liên kết.
Thực chất của liên kết tạo thành là orbital liên kết có mật độ electron bao phủ cả
phía trên và phía dưới hai nguyên tử C trong nối đôi
2. TÍNH CHẤT HÓA HỌC NHẬN XÉT CHUNG:
+ Mà so với liên kết đơn C-C, khoảng cách của liên kết đôi
C=C ngắn hơn, do vậy mật độ e trên liên kết đôi C=C này lớn
hơn so với liên kết đơn C-C trong ankan C – C: d = 1,54 Ao, C = C: d = 1,34 Ao
❖ Như vậy, các orbital mở rộng về 2 phía của liên kết và
có mật độ e cao nên nó là 1 bazơ Lewis và các axit (tác
nhân E) dễ tấn công vào anken. Phản ứng cộng vào
anken đặc trưng là phản ứng cộng electrophil, đôi khi có
phản ứng cộng gốc tự do.
❖ Liên kết hình thành bởi sự xen phủ bên nên liên kết
không bền, dễ đứt so với liên kết (Năng lượng liên kết
ở anken: 83 kcal/mol – Năng lượng liên kết ở anken:
63 kcal/mol). Vì vậy anken có khả năng phản ứng cao
hơn nhiều so với ankan.
Từ cấu trúc suy ra các hướng phản ứng chính
của hợp chất Anken:
+ Phản ứng cộng vào liên kết C=C + Phản ứng oxi hoá
+ Phản ứng trùng hợp
2.1. Phản ứng cộng 2.1.1. Cộng H2 C = C + H → CH – CH + Q 2
+ Phản ứng tỏa nhiệt + Cần xúc tác :
2.1. Phản ứng cộng
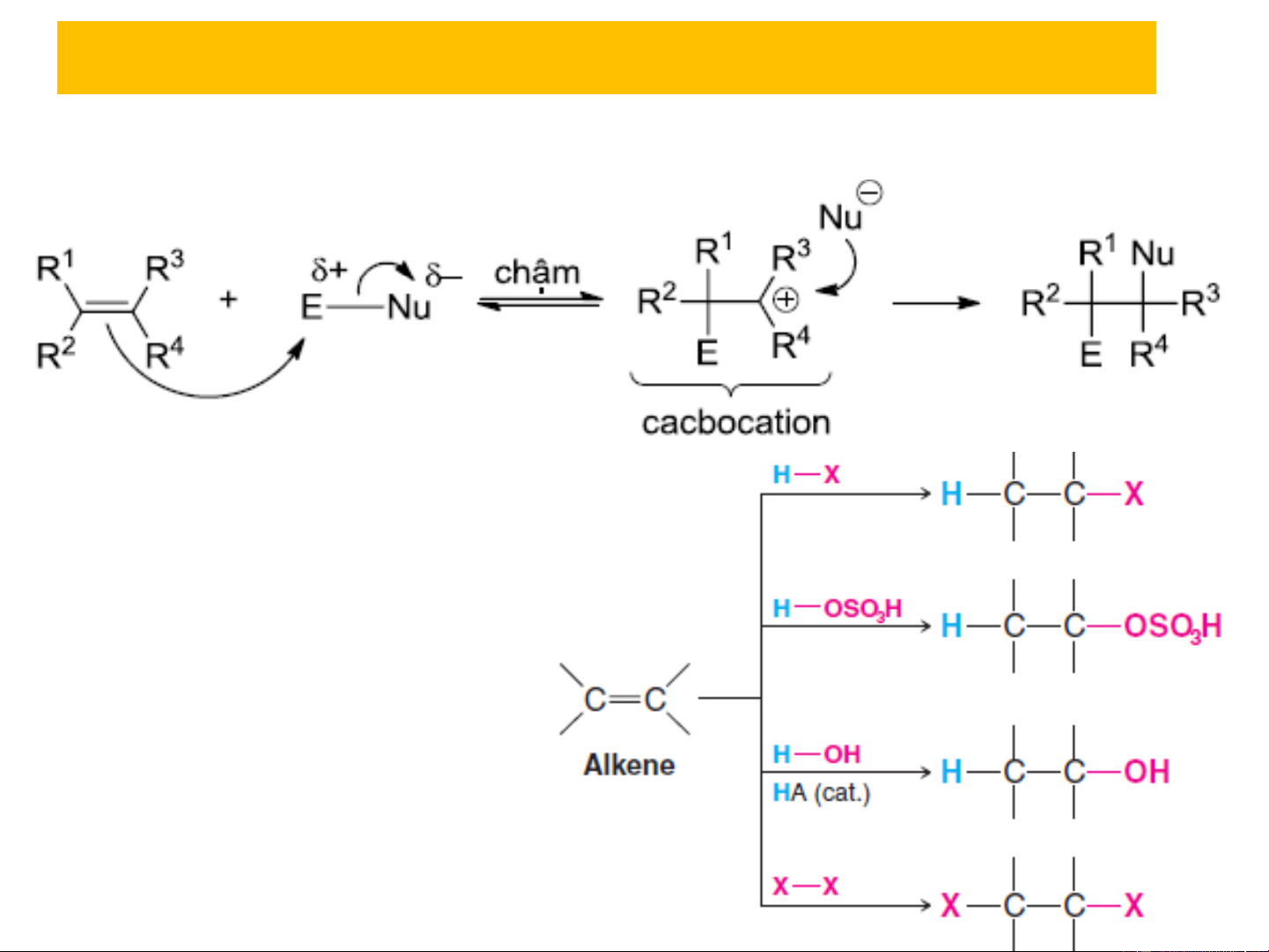
2.1.2. Phản ứng cộng electrophil AE nhanh Giai đoạn 1 Giai đoạn 2 Giai đoạn tạo thành cacbocation là giai đoạn
chậm, quyết định tốc độ chung của cả quá trình
+ Một số phản ứng:
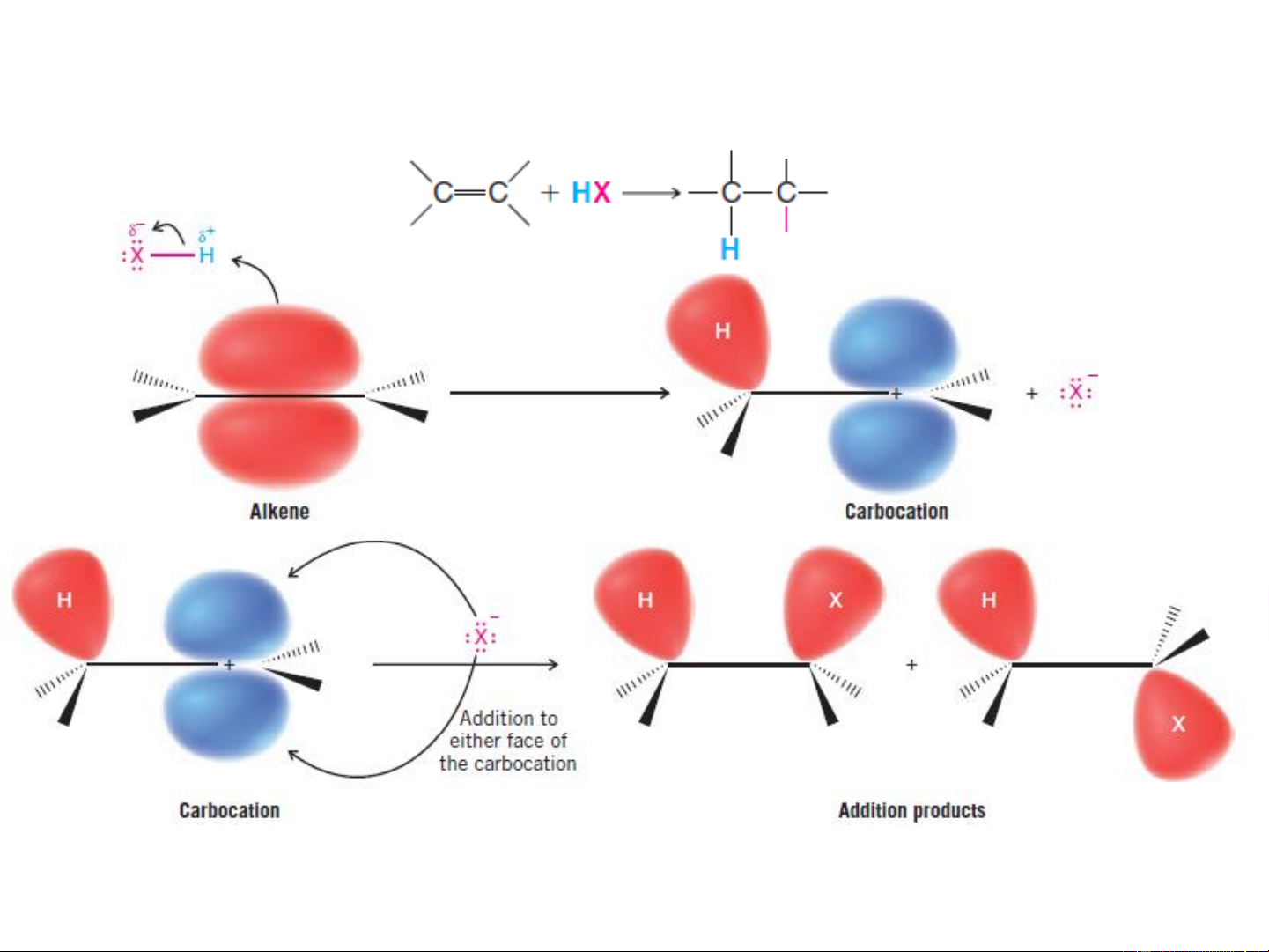
2.1.2. Phản ứng cộng electrophil AE
❖ Cộng axit HX (hydro halogenua) X Chậm nhanh SP cộng kiểu trans do thuận lợi hơn về mặt
+ Khả năng phản ứng: HI >HBr >HCl không gian




