
















Preview text:
CÁC KHÁI NIỆM CƠ BẢN TRONG HÓA HỌC HỮU CƠ 2
KHÁI NIỆM VỀ TÁC NHÂN PHẢN ỨNG
1. Các kiểu gẫy liên kết hoá học trong quá trình phản ứng
2. Các loại tác nhân phản ứng
KHÁI NIỆM VỀ TÁC NHÂN PHẢN ỨNG
1. Các kiểu gẫy liên kết hoá học trong quá trình phản ứng
Phản ứng hoá học của các hợp chất hữu cơ (còn gọi
là phản ứng hữu cơ, organic reaction) được căn cứ
vào sự biến đổi các liên kết trong phân tử ở mức độ
phá vỡ liên kết cũ và hình thành liên kết mới dưới tác
dụng của các điều kiện và tác nhân phản ứng.
Xét phản ứng: A - B + C = A - C + B'
Trong quá trình phản ứng thì liên kết cũ (A-B) bị bẻ gãy
và hình thành liên kết mới (A-C).
1. Các kiểu gãy liên kết hoá học trong quá trình phản ứng
Xét phản ứng: A - B + C = A - C + B'
Việc bẻ gẫy liên kết hoá học có thể diễn ra theo hai cách:
Phân cắt đồng ly: gãy liên kết A-B tạo thành hai gốc
tự do A, B . . A : B A + B (1)
Sự đứt liên kết theo kiểu đồng ly thường là đứt liên kết cộng hóa trị đối xứng
Gốc tự do là tiểu phân trung gian, thường không bền và có thời gian sống ngắn
1. Các kiểu gãy liên kết hoá học trong quá trình phản ứng
Việc bẻ gẫy liên kết hoá học có thể diễn ra theo hai cách:
Phân cắt đồng ly: gãy liên kết A-B tạo thành hai gốc tự do A, B
Phân cắt dị ly: gãy liên kết A-B tạo thành ion âm và ion dương. A : B + B− A+ (2) A : B + B+ A− (3)
Sự đứt liên kết theo kiểu dị ly thường là đứt liên kết cộng hóa trị không đối xứng
2. Các loại tác nhân phản ứng
Xét phản ứng: A - B + C = A - C + B'
Sự phá vỡ liên kết cũ (A-B) và hình thành liên kết mới (A-C)
tạo sản phẩm phản ứng: . . A : B A + B (1)
Nếu liên kết A-B gãy theo kiểu đồng ly (1) thì để hình
thành liên kết mới C phải là tác nhân gốc tự do.
Tác nhân gốc tự do (R) là nguyên tử hay
nhóm nguyên tử trung hoà về điện và có
một electron lẻ (electron độc thân)
Ví dụ: Cl, Br, R…
Tác nhân gốc tự do tấn công vào vị trí có chỉ số hoá trị tự do cao nhất.
2. Các loại tác nhân phản ứng
Xét phản ứng: A - B + C = A - C + B'
Nếu liên kết A-B gãy theo kiểu dị ly (2) thì để hình thành
liên kết mới C phải là tác nhân dư electron (Tác nhân
nucleophil - tác nhân ái hạt nhân) A : B + B− A+ (2)
Tác nhân nucleophil (Nu-) là nguyên tử hay
nhóm nguyên tử mang điện tích âm (anion)
hoặc mang cặp electron không chia.
Tác nhân nucleophyl tấn công vào nơi tập trung điện tích (+) lớn nhất trong phân tử.
2. Các loại tác nhân phản ứng
Xét phản ứng: A - B + C = A - C + B'
Nếu liên kết A-B gãy theo kiểu dị ly (2) thì để hình thành liên kết mới C phải là tác nhân dư
electron (Tác nhân nucleophil - tác nhân ái hạt nhân) A : B + B− A+ (2)
Tác nhân nucleophil (Nu-) là nguyên tử hay nhóm nguyên tử mang điện tích
âm hoặc mang cặp electron không chia.
Ví dụ: - Các anion: Cl-, C H O-, NH -…. 2 5 2 -
Phân tử trung hòa có chứa cặp electron : : : không chia: RO : H , HO : H , NH3
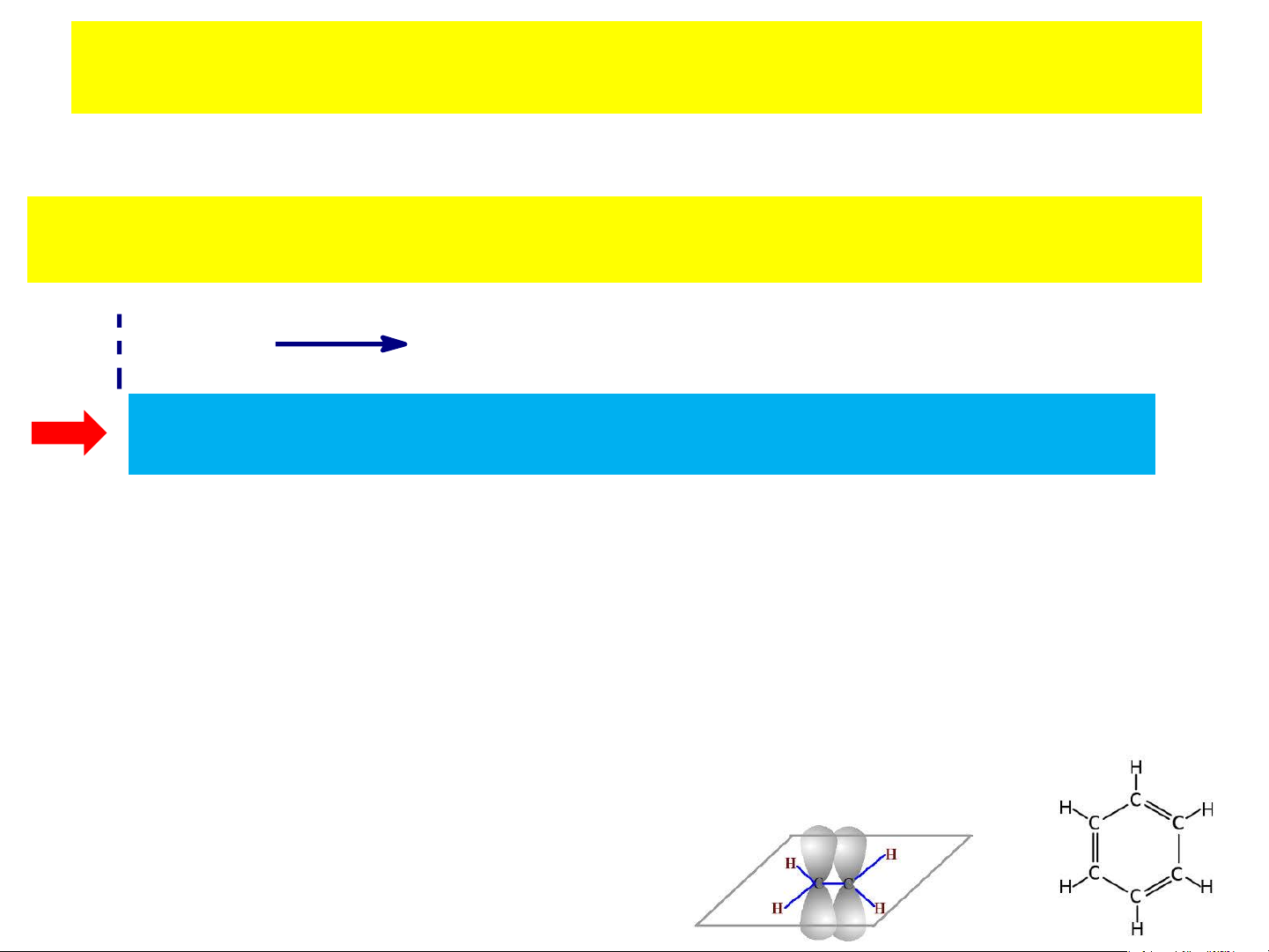
- Phân tử có chứa electron p linh động:
2. Các loại tác nhân phản ứng
Xét phản ứng: A - B + C = A - C + B'
Nếu liên kết A-B gãy theo kiểu dị ly (3) thì để hình thành
liên kết mới C phải là tác nhân thiếu electron (Tác nhân
electrophil - tác nhân ái điện tử) A : B + B+ A− (3)
Tác nhân electrophil (E) là nguyên tử hay
nhóm nguyên tử mang điện tích dương
(catioin) hoặc thiếu một cặp electron không chia
Tác nhân electrophil tấn công vào nơi tập trung điện tích (-) lớn nhất trong phân tử
2. Các loại tác nhân phản ứng
Xét phản ứng: A - B + C = A - C + B'
Nếu liên kết A-B gãy theo kiểu dị ly (3) thì để hình thành liên kết mới C phải là tác
nhân thiếu electron (Tác nhân electrophil - tác nhân ái điện tử) A : B + B+ A− (3)
Tác nhân electrophil (E) là nguyên tử hay nhóm nguyên tử mang
điện tích dương (catioin) hoặc thiếu một cặp electron không chia
Ví dụ: - Các ion dương hay cation: NO +, CH +, 2 3 SO H+, H+… 3 -
Phân tử có các nguyên tử còn chứa các
orbital trống: AlCl , BF , SO ,... 3 3 3
Nếu xác định được tác nhân phản ứng sẽ biết được phản ứng thuộc loại nào NỘI DUNG CẦN NHỚ
VỀ TÁC NHÂN PHẢN ỨNG
1. Các kiểu gẫy liên kết hoá học trong quá trình phản ứng: - Phân cắt đồng ly - Phân cắt dị ly
2. Các loại tác nhân phản ứng:
- Tác nhân gốc tự do (R)
- Tác nhân nucleophil (Nu-)
- Tác nhân electrophil (E)
KHÁI NIỆM VỀ CƠ CHẾ PHẢN ỨNG
1. Phân loại phản ứng hữu cơ
2. Cơ chế phản ứng hữu cơ
KHÁI NIỆM VỀ CƠ CHẾ PHẢN ỨNG
1. Phân loại phản ứng hữu cơ
Phân loại theo 3 cách:
1.Theo đặc điểm biến đổi liên kết;
2. Theo số phân tử tham gia vào giai đoạn quyết
định tốc độ phản ứng;
3. Theo hướng phản ứng.
1. Phân loại phản ứng hữu cơ
❖ Theo đặc điểm biến đổi liên kết:
- Nếu gãy đồng ly: phản ứng đồng ly hay phản ứng gốc tự do.
- Nếu gãy dị ly: phản ứng dị ly hay phản ứng ion.
❖ Theo số phân tử tham gia vào giai đoạn quyết định tốc
độ phản ứng:
- Nếu có một phân tử tham gia: phản ứng đơn phân tử.
- Nếu có hai phân tử tham gia: phản ứng lưỡng phân tử.
- Nếu có nhiều phân tử tham gia: phản ứng đa phân tử.
1. Phân loại phản ứng hữu cơ
❖ Phân loại phản ứng theo hướng của phản ứng. - Phản ứng thế. - Phản ứng cộng.
- Phản ứng tách loại.
- Phản ứng chuyển vị.
- Phản ứng oxy hóa-khử.
1. Phân loại phản ứng hữu cơ
❖ Theo hướng phản ứng:
- Phản ứng thế (ký hiệu S; Subtitution): là phản ứng
trong đó một nguyên tử hay nhóm nguyên tử bị thay thế
bởi một nguyên tử hay nhóm nguyên tử khác. Ví dụ:
Phản ứng thế clo vào metan dưới tác dụng của ánh sáng h CH4 + Cl2 CH + HCl 3 Cl Metan Metylclorua
1. Phân loại phản ứng hữu cơ
Tùy theo loại tác nhân thế mà chia thành:
+ Phản ứng thế electrophil (ký hiệu S ) E R X Y+ + R Y X+ + T¸c nh©n electrophil
+ Phản ứng thế nucleophil (ký hiệu S ) N R X Y− + (hoÆc Y :) R Y X- + (hoÆc X :) T¸c nh©n nucleophil
+ Phản ứng thế gốc tự do (ký hiệu S ) R . . R X + Y R Y + X T¸c nh©n gèc tù do
1. Phân loại phản ứng hữu cơ
- Phản ứng cộng (ký hiệu A; Addition): là phản ứng trong đó
hai hay nhiều phân tử kết hợp với nhau thành phân tử mới.
Ví dụ: Phản ứng cộng clo vào nối đôi của etylen CH + Cl 2 CH2 2 Cl CH CH 2 2 Cl Etylen 1,2-Dicloetan
Tùy theo bản chất của tác nhân tấn công ở giai đoạn
quyết định của phản ứng mà chia thành:
+ Phản ứng cộng electrophil (ký hiệu A ) E
+ Phản ứng cộng nucleophil (ký hiệu A ) N
+ Phản ứng cộng gốc tự do (ký hiệu A ) R
1. Phân loại phản ứng hữu cơ
Phản ứng tách loại (ký hiệu E; Elimination): là
phản ứng trong đó hai nguyên tử hay nhóm
nguyên tử bị tách ra khỏi phân tử để tạo thành liên kết bội.
Ví dụ: Phản ứng dehydrat hóa etanol ở 170oC H SO C – C 2 4 C = C + HOH 1700C H OH




