

















Preview text:
222
BÀI 1A: KHẢO SÁT PHỔ UV-VIS CỦA DUNG DỊCH KALI
PERMANGANAT TRONG MÔI TRƯỜNG ACID 1. Cơ sở lý thuyết:
Kali permanganate có màu tím nên hấp thu ược trong vùng ánh sáng nhìn
thấy (Vis – 375 – 800nm) -
Pha loãng mẫu ó KMnO4 ến nồng ộ thích hợp (nằm trong khoảng tuyến tính
– nồng ộ pha loãng phải ược pha loãng ở ộ hấp thu 0 - 1) và sử dụng chức năng
Scan của máy o quang phổ ể quét phổ trong vùng UV-Vis. Nhận xét ỉnh hấp thu cực ại trong vùng Vis. -
Đo ộ hấp thu của các dung dịch KMnO4 có nồng ộ khác nhau tại ỉnh cực ại
này và vẽ ường coi chuẩn ộ của ộ hấp thu theo nồng ộ. -
Xác ịnh nồng ộ của chất cần o theo hai phương pháp:
+ Suy ra nồng ộ của chất cần o từ ường biểu diễn này.
+ Tính nồng ộ của chất cần o theo hệ số hấp thu mol 𝜀 trung bình ược suy ra từ
5 hệ số hấp thu mol của các dung dịch ã o theo công thức ịnh luật LamberBeer: 𝐴
= 𝜀. 𝐶. 𝑙 trong ó A: ộ hấp thu, l: chiều dày của cuvet, C: nồng ộ chất hấp thu, 𝜀: hệ số hấp thu mol.
- Máy quang phổ UV – Vis (THERMO SCIENTIFIC – EVOLUTION 300): máy o 2 chùm tia.
(1) Điều kiện ứng dụng ịnh luật Lamber-Beer: - Ánh sáng phải ơn sắc
- Dung dịch phải loãng và trong suốt (không tán xạ)
- Chất khảo sát phải bền trong dung dịch và bền dưới tác dụng của tia UV-Vis (2) Đèn nguồn: - Deuterium o UV - Tungsten o Vis
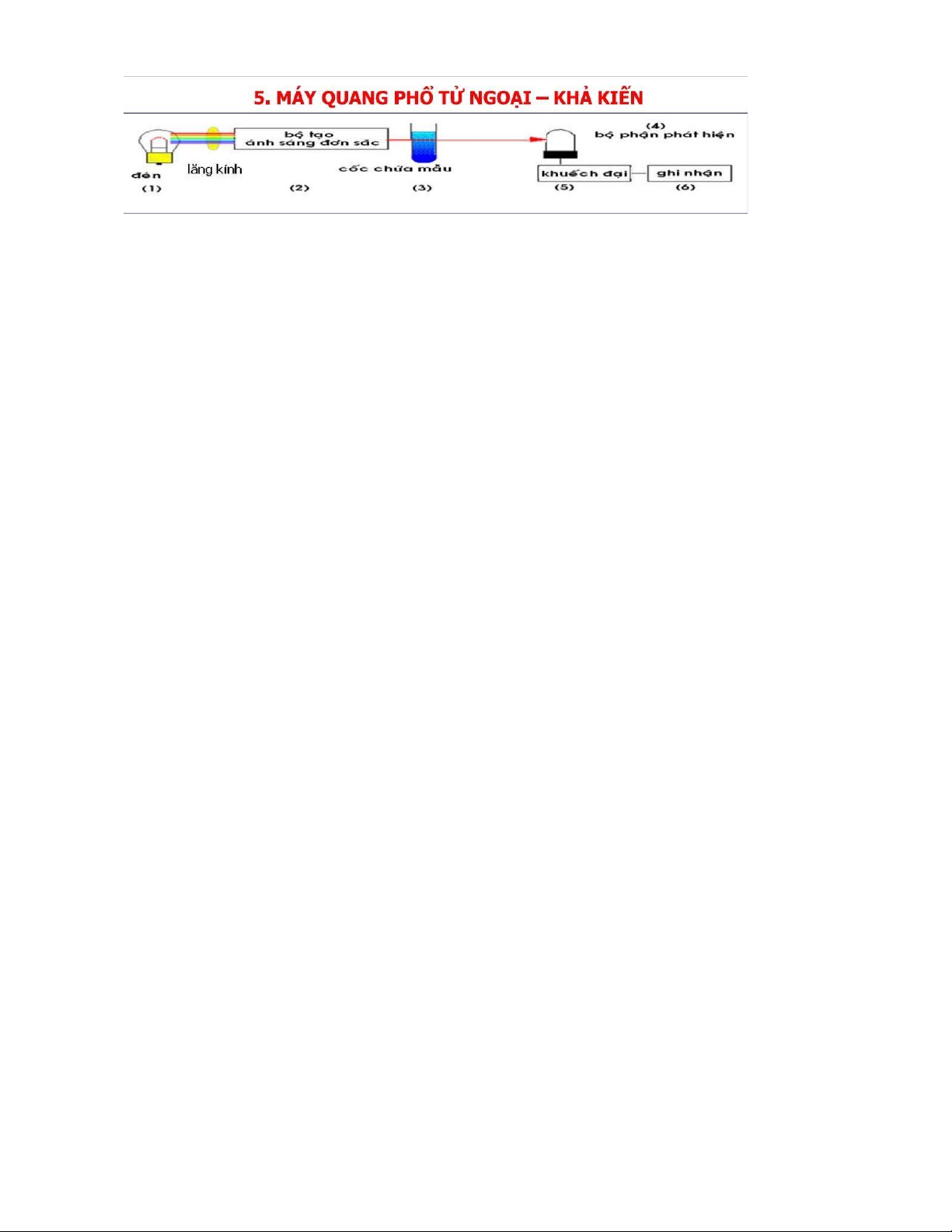
(3) Sơ ồ khối máy quang phổ UV-Vis 222 (1) Đèn nguồn
(2) Cách tử hoặc lăng kính (1200 vạch/mm) (3) Cốc o (4) Bộ phận phát hiện
(5) + (6) Bộ phận khuếch ại và máy ghi tín hiệu (4) Cốc o
- Thạch anh có thể sử dụng trong vùng UV và Vis
- Thủy tinh và plastic: thích hợp cho vùng khả kiến (Vis) (5)
Mắt người nhìn thấy màu bổ trợ cho màu hấp thụ (6)
Màu tím của KMnO4 là màu sắc thấy ược của chất còn màu hấp phụ là màu
lục – vàng ở bước sóng 560 – 580nm
2. Lưu ý trong thực hành:
- Bảng 1.1 dung dịch S0 phải lấy bằng buret.
- Chuẩn bị khi i o mẫu gồm: mẫu thử, mẫu trắng, khăn giấy, nước cất, cốc rửa. 3. Cách o
(1) Máy quang phổ gồm 4 chức năng chính (chỉ học 3) -
Scan: quét phổ: dùng ể xác ịnh ộ hấp thu cực ại.
- Fixed: o iểm. = photo metry
- Rate: o ộng học: khảo sát thời gian phản ứng xảy ra hoàn toàn.
- Quant: xác ịnh ường chuẩn (Excel)
(2) Chức năng Scan: File -> New Application Methods
Scan Method: cài ặt tham số
Date mode: Absorbance: ộ hấp thu T%: ộ truyền qua 222
Start wavelength: bước sóng bắt ầu: 400nm
Stop wavelength: bước sóng kết thúc 650nm
Band width: ộ rộng khe phổ: 1 – 2 tách ỉnh (KMnO4 = 2nm)
Scan speed: tộ ộ 240nm/min
Graph High: ộ cao của trục max = 2
Resuilt Tables:bảng giá trị: Peak Pick -> Set up. Sensitivity: Medium -> OK
* Bước 1: Baseline ường nền: loại trừ các ỉnh của mẫu trắng ưa các ỉnh về ường nền. -
Cho mẫu thử (2 mẫu giống nhau) -> Run -> Proceed -> IDLE -> hoàn tất. -
Bắt ầu cho chất cần xác ịnh ộ hấp thụ vào (Rửa cuvet bằng nước cất sau ó
dùng dd cần o rửa cuvet 3 lần) *
Bước 2: Bắt ầu cho mẫu: Run -> Name -> KMnO4 -> Proceed -> Bắt ầu quét
phổ. Ta thấy ở 𝑚𝑎𝑥 = 525nm và A = 0,1188 *
Bước 3: Fixed: Fixed Method
Wavelength: 525nm ( 𝑚𝑎𝑥)
Baseline: 2 cuvet acid-> Proceed -> IDLE
Cho mẫu thử -> Run -> Name -> Proceed 4. Trả lời câu hỏi (1)
Khi sử dụng công thức Lambert-Beer thì nồng ộ của dung dịch phải là nồng ộ mol.
Công thức liên quan giữa nồng ộ ương lương và nồng ộ mol: 𝐶𝑁
𝐶𝑀 = 𝑛 Trong ó CM: nồng ộ mol (M hoặc mol/l), CN: nồng ộ ương lương (N), n: số e trao ổi (2)
Chất khảo sát trong bài thực tập có màu tím hấp thu trong khoảng 500 –
600nm. Phù hợp với lý thuyết. Không thể khảo sát KMnO4 trong môi trường trung tính và kiềm. 222
KMnO4 ở trong môi trường kiềm và trung tính. Phản ứng xảy ra nhiều nấc, kém ổn
ịnh, dễ bị phân hủy dẫn ến sai số. -
Trong môi trường trung tính: 𝑀𝑛7+ + 3𝑒 → 𝑀𝑛4+(𝑡ạ𝑜 𝑀𝑛𝑂2𝑚à𝑢 đ𝑒𝑛) -
Trong môi trường kiềm: 𝑀𝑛7+ + 𝑒 → 𝑀𝑛6+ (𝑡ạ𝑜 𝑚𝑢ố𝑖 𝐾2𝑀𝑛𝑂4 𝑚à𝑢 𝑥á𝑚)
- Môi trường acid KMnO4 có tính oxi hóa mạnh nhất. (3)
Mẫu trắng ược sử dụng trong bài thực tập là H2SO4. Không thể thay bằng nước cất. (4)
Mục ích của việc pha loãng dung dịch chuẩn 1 – 5: iều kiện của ịnh luật
Lamber-Beer, xây dựng ường chuẩn, xác ịnh nồng ộ. (5)
Nếu chỉ o ộ hấp thu A của một dung dịch chuẩn (chẳng hạn dung dịch S3) thì
vẫn xác ịnh ược 𝜀. Phải tính hệ số hấp thu mol trung bình của 5 dung dịch ể tránh sai số. (6)
Phải o mẫu trắng ể máy có thể loại các ỉnh hấp thu của mẫu trắng như vậy
còn các ỉnh của KMnO4 như vậy sẽ chính xác hơn. (7) Mối liên hệ giữa ộ hấp thu và ộ truyền quang 1 𝐴 = 𝑙𝑜𝑔 𝑇 5. Tính toán * Cách 1: -
Với 5 dung dịch có 5 nồng ộ (chuyển N sang M) o ược 5
ộ hấp thu -> tính ược 5 𝜀 -> tính 𝜀 -
Đo ược AX ( ộ hấp thu của dung dịch X) - Áp dụng ịnh luật Lamber-Beer ta có 𝐴𝑋 𝐶𝑋 = 𝜀.̅ 𝑙
* Cách 2: Dựa vào số liệu C(M) và A ta vẽ ược ồ thị y = ax + b 222
Trong ó: y là ộ hấp thu của dung dịch KMnO4 tại bước sóng 525nm, x là nồng ộ dung dịch KMnO4 cần tìm.
BÀI 1B: KHẢO SÁT ẢNH HƯỞNG CỦA DUNG MÔI VÀ pH ĐẾN SỰ HẤP
THU UV CỦA BENZEN VÀ PHENOL 1. Cơ sở lý thuyết:
Phổ iện tử là một ường cong trình bày những biến ỏi cường ộ hấp thu (A) của chất
khảo sát theo ộ dài sóng ( ). Dạng của phổ phụ thuộc vào bản chất của chất khảo sát, môi trường.
Phổ hấp thụ UV-Vis của benzene thể hiện hai dãy hấp thu ược ịnh danh như sau:
Chuyển dịch 𝜋 → 𝜋∗
Dãy E 202nm 𝜀=7000 M-1cm-1 Dãy B 254nm 𝜀=200 M-1cm-1
Và phổ hấp thụ UV-Vis của phenol (benzel gắn một nhóm thế OH trên vòng thơm)
sẽ có những hiệu ứng chuyển dịch sang ỏ hoặc hiệu ứng chuyển dịch sang xanh của các dãy này. -
Nhóm mang màu(chromophore) là nhóm chức chưa no, liên kết ồng hóa trị
trong phân tử gây ra sự hấp thụ bức xạ trong vùng UV-Vis ( >200) -
Nhóm trợ màu (auxochrome) là những nhóm thế no gắn vào nhóm mang
màu làm thay ổi cả bước sóng lẫn cường ộ của dải hấp thụ cực ại. Thường làm
chuyển dịch 𝑚𝑎𝑥về phía dài hơn. -
Sự chuyển dịch sang ỏ (Red Shift = bathochromic shift) 𝑚𝑎𝑥 chuyển về bước sóng ngắn hơn. -
Sự chuyển dịch sang xanh (blue shift = hypsochromic shift) 𝑚𝑎𝑥 chuyển về bước sóng ngắn hơn. -
Hiệu ứng tăng cường ộ thường kèm theo sự chuyển dịch sang ỏ. Hiệu ứng
giảm cường ộ thường kèm chuyển dịch xanh. -
Các yếu tổ ảnh hưởng ến ộ hấp thụ: + Cấu trúc phân tử. 222
+ Môi trường: nồng ộ, pH, nhiệt ộ, dung môi.
2. Lưu ý trong thực hành:
- Thứ tự các bình trong bảng 1.2 pha loãng bình 2 từ 1, bình 3 từ bình 2, bình 4 từ
bình 3, bình 5 từ bình 4 và bình 6 từ bình 5. 3. Trả lời câu hỏi (1)
Phổ ồ UV-Vis từ dung dịch 1 sang dung dịch 2 ược quan sát thấy có sự
chuyển dịch sang ỏ (bathocrome) và hiệu ứng tăng màu (hyperchrome) do
Benzen/cyclohexan hấp thu ở khoảng bước sóng 220-270nm còn
phenol/cyclohexan hấp thu ở bước sóng 220-280nm như vậy sự chuyển dịch bước
sóng dài hơn, chứng tỏ có gắn nhóm trợ màu ó là nhóm OH. (2)
Phổ ồ UV-Vis từ dung dịch 3 sang dung dịch 4 và 5 ược quan sát thấy có
chuyển dịch sang ỏ (bathocrome) và hiệu ứng tăng màu (hyperchrome) do Dung
dịch 3: phenol/cyclohexan hấp thu ở khoảng bước sóng 220-280nm.
Dung dịch 4: phenol/nước cất hấp thu ở khoảng bước sóng 220-280nm.
Dung dịch 5: phenol/ NaOH hấp thu ở khoảng bước sóng 280-300nm.
Chứng tỏ cùng một chất là phenol pha trong nhiều hệ dung môi khác nhau thì có
những ỉnh hấp thu khác nhau (có chất có một ỉnh, có chất nhiều ỉnh). Trong môi
trường trung tính và kiềm có sự chuyển dịch bước sóng dài hơn trong dung môi hữu cơ. (3)
Chất liệu của cốc o sửa dụng trong bài thực tập là thạch anh vì chất liệu này o ược trong vùng UV. (4)
Phép o bài thực tập ược thực hiện trong vùng UV (bước sóng 200-375nm) (5)
Dung dịch trắng trong suốt hấp thu trong vùng UV là chủ yếu. Dung dịch có
màu hấp thu trong vùng Vis là chủ yếu.
BÀI 2A: ĐỊNH LƯỢNG NITRIT BẰNG PHƯƠNG PHÁP QUANG PHỔ UV- VIS 1. Cơ sở lý thuyết: 222 -
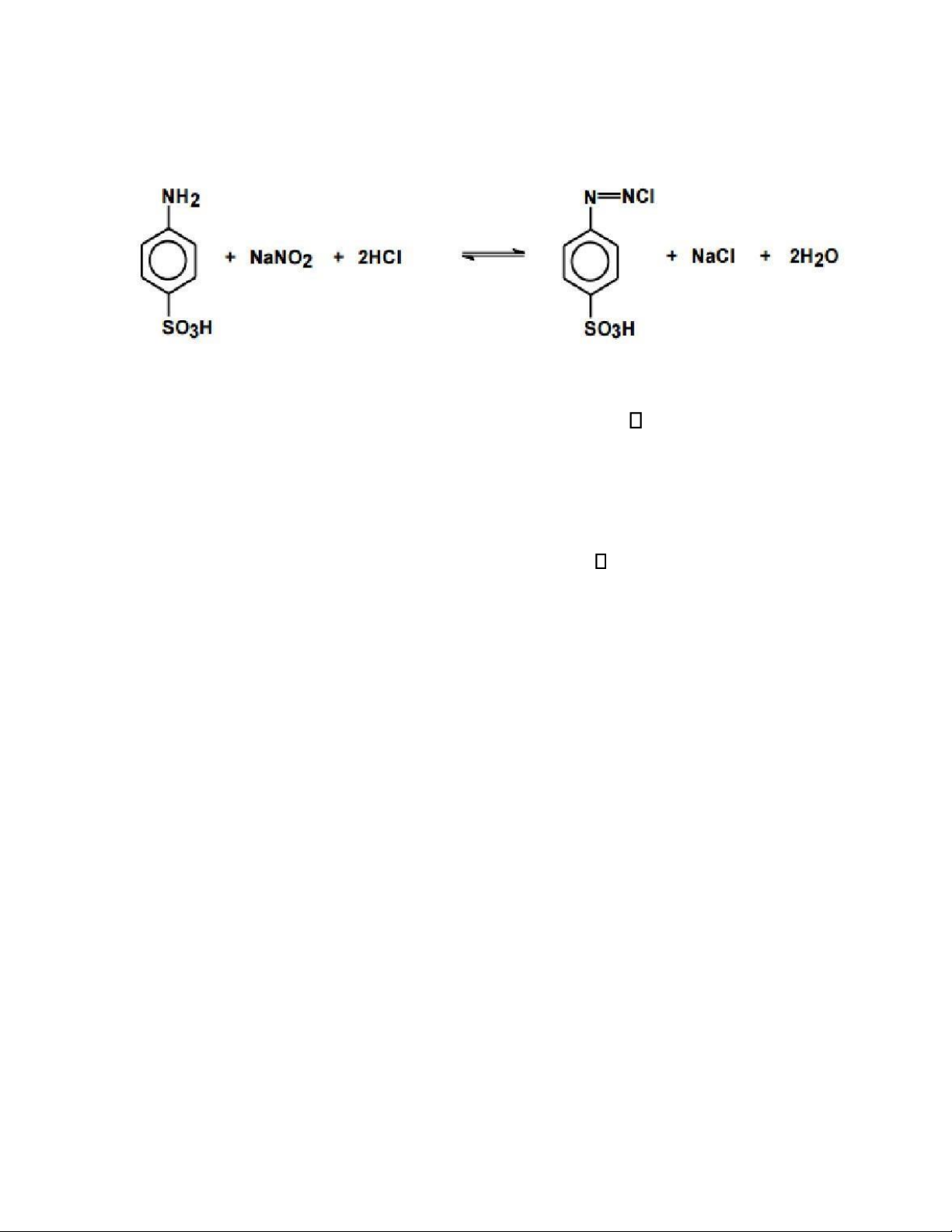
Acid nitro (hay những nitrit trong môi trường aicd) tạo với acid sulfanilic
thành một hợp chất diazoic có thể hấp thu trong quang phổ tử ngoại. Phản ứng xảy ra như sau: -
Trong ó acid sulfanilic là thuốc thử hóa học, Natri nitric là chất cần ịnh
lượng, HCl làm môi trường, hợp chất diazo là chất cần tìm 𝑚𝑎𝑥. -
Đây là phương pháp ịnh lượng gián tiếp. -
Đồ thị chế ộ Fixed: Độ hấp thu A theo nồng ộ CM. -
Đồ thị chế ộ Scan: Độ hấp thu A theo bước sóng . -
Đồ thị chế ộ Rate: Độ hấp thu A theo thời gian t.
2. Lưu ý trong thực hành: -
Nếu ề yêu cầu thực hành hết thì làm 3.5 trước rồi làm song song với 3.3. -
Bảng 2.1: Lấy dung dịch NaNO2 ể ịnh ượng và dung dịch chuẩn NaNO2
bằng buret. Dung dịch acid sulfanilic và dung dịch HCl bằng pipet khắc vạch, nước
cất dùng bình ịnh mức. X là ịnh lượng NaNO2 chưa biết nồng ộ. -
Khi tính toán C x 20 vì pha loãng 20 lần. 3. Trả lời câu hỏi: (1)
Nguyên tắc phản ứng: Acid nitro tạo với acid sulfanilic thành một hợp chất
diazoic có thể hấp thu trong quang phổ tử ngoại do có nối ôi và các chất xung
quanh có iện tử tự do vì vậy có thể o ược trong vùng UV-Vis. (2)
Khi tự pha chế thuốc thử trong bài, phải tuân theo úng thứ tự trong bảng 2.1
vì nếu HCl ược thêm vào trước acid silfanilic thì một phần nitrit có thể bị oxy hóa
thành nitrat và như vậy sẽ không ịnh lượng ược. 222 (3)
Trong phần khảo sát ộng học của phản ứng theo thời gian, không cần o ngay
lâp tức vì mục ích là khảo sát thời gian phản ứng xảy ra hoàn toàn nên ộ hấp thu không thay ổi. (4)
Sử dụng phương pháp Rate ể khảo sát thời gian cuối của phản ứng là nơi
phản ứng ạt trạng thái cân bằng. (5)
Có 3 phương pháp sinh viên sử dụng: Rate, Scan, Fixed. (6)
Sử dụng bước sóng 270nm vì bước sóng này gần với cực ại hấp thu của nhóm chức N=N. (7)
Không dùng cốc o thủy tinh vì thủy tinh hấp thu tia UV. (8)
Dùng bình số 5 ể khảo sát vì bình này nồng ộ NaNO2 cao nhất nếu bình 5 ã
phản ứng hết thì các bình còn lại ều phản ứng hết. (9)
Ở giai oạn chọn 𝑠𝑡𝑎𝑟𝑡 𝑣à 𝑒𝑛𝑑 có thể chọn khác với trong bài miễn là có = 270nm.
(10) Phương pháp chuẩn ngoại: là phương pháp so sánh chất thử và chất chuẩn.
Áp dụng trong trường hợp với những chất không thể ịnh lượng trực tiếp mà phải
ịnh lượng gián tiếp qua một chất khác.
(11) Ở giai oạn ịnh lượng dung dịch có nồng ộ chưa biết bằng phương pháp
chuẩn ngoại, sau khi bổ sung nước cất vừa ủ thì phải chờ thời gian bằng tmax vừa
xác ịnh ể phản ứng xảy ra hoàn toàn khi o mới chính xác và không sai số.
(12) Đèn của nguồn o UV và Vis trong máy o quang phổ UV-Vis: Xenon.
BÀI 2B: ĐỊNH DANH MỘT SỐ HỢP CHẤT TINH KHIẾT BẰNG QUANG
PHỔ HỒNG NGOẠI (IR) 1. Cơ sở lý thuyết: -
Năng lượng quay và năng lượng dao ộng của phân tử chủ yếu do các liên kết
khung như C-H, C-C và các liên kết của nhóm chức như C=O, C-O, C=C, OH,
NH,… khi phân tử hấp thu ánh sáng trong vùng hồng ngoại. Do ó phổ IR còn gọi là phổ dao ộng - quay. -
Phổ hồng ngoại là phương pháp chuẩn xác ể ịnh tính vì mỗi một chất chỉ cho
một vùng “ iểm chỉ” của phổ không trùng lặp với phổ của các chất khác. Những ặc
tính của phổ hồng ngoại có thể ược dùng như là phép thử hàng ầu ể ịnh tính. 222
THường thì phép thử phổ hồng ngoại tự nó ã ủ tin cậy và không cần thêm phép thử nào khác (DĐVN IV). -
Trong các thao tác o phổ IR, việc chuẩn bị mẫu rất quan trọng. Chuẩn bị
mẫu là thao ặt mẫu o vào cốc o thích hợp không hấp thu trong vùng ánh sáng hồng
ngoại. Mẫu o trong phổ IR có thể ở dạng rắn, lỏng hay khí. Mỗi dạng mẫu o cần
một loại cốc o (cuvet) riêng và sự chuẩn bị mẫu thích hợp. Trong bài này chỉ
hướng dẫn các thao tác chuẩn bị mẫu ở dạng rắn bằng kỹ thuật tạo viên nén KBr. -
Trộn ều mẫu o với KBr theo tỉ lệ khoảng 1/100 (tính theo mg) trên cối á mã
não ( á agate, có màu xanh rêu, thành phần chính là SiO2, ộ cứng 7). 2. Trả lời câu hỏi: (1)
Phổ IR còn gọi là phổ dao ộng quay vì khi kích thích phân tử dao ộng với
bức xạ trong vùng IR gần và IR cơ bản, phân tử hấp thu trong vùng này cho phổ dao ộng quay. (2)
Mục ích thực hiện phổ IR: ể ịnh tính, vì mỗi chất chỉ cho một vùng iểm chỉ
của phổ không trùng lặp với phổ những chất khác, hoặc có thể dùng ể ịnh lượng. (3)
Các chất có thể dùng làm cốc o trong phổ IR: tấm NaCl, tấm KBr, viên nén
KBr, cốc o bằng KBr. Sử dụng những chất này vì không hấp thu trong vùng IR. (4)
Tỉ lệ chất khảo sát và KBr ể ép viên o phổ IR là 1/100 (tính theo mg) (5)
Nếu chất khảo sát quá ẩm thì không sử dép viên nén KBr vì trong môi
trường nước sẽ có nhóm OH- sẽ hấp thu trong vùng IR làm phổ có ỉnh OH như vậy
sẽ gây nhầm lẫn với các chất khác. (6)
Không sử dụng nước ể rửa cốc o vì KBr tan trong nước nếu dùng nước rửa cốc thì cốc sẽ hư. (7)
Các bộ phận chủ yếu của máy ó FT – IR: Đèn nguồn, giao thoa kế
Michelson, mẫu, detector, máy tính, máy ghi và máy in. (8)
Vùng dấu vân tay có số sóng trong khoảng 1300 – 910 cm-1. (9)
Vùng có số sóng lớn hơn 1500 cm-1 là vùng nhóm chức (4000 – 1300 cm-1)
(10) Đèn nguồn quang phổ IR: Nernst, Globar, Ni-Cr.
(11) Để chuẩn hóa bước sóng máy ó quang phổ IR người ta dùng màng film polystyrene. 222
(12) Chỉ cần phổ IR ã ủ ể ịnh danh chắc chắn 100% chất khảo sát. Dược iển các
nước thêm các dữ kiện: ộ chảy, góc quay cực (tùy thuộc vào iều kiện và tính chất
của chất khảo sát), nếu một sản phẩm là muối thì phải thử thêm ion ặc hiệu.
(13) Một chất có thể có nhiều loại phổ như UV-Vis. Vì chất ó có thể có cấu trúc
tạo vòng thơm hoặc nối ôi liên hợp và có nhóm trợ màu thì sẽ cho cả phổ UV-Vis lẫn phổ IR.
(14) Một chất có cấu trúc ối xứng như H2, N2 thì không có phổ IR vì dao ộng co
dãn của chúng ối xứng không làm thay ổi momen lưỡng cực của phân tử do ó
không bị kích thích bởi ánh sáng vùng IR nên không hấp thu trong vùng IR.
(15) Chuẩn bị mẫu dạng lỏng: Cốc o là 2 tấm KBr làm cửa sổ với các vòng ệm là
nhựa Teflon bền trong dung môi. Mẫu lỏng ược nạp vào cốc o như 1 lớp phim
mỏng ược kẹp ở giữa có bề dày khoảng 0,05mm. Có thể hòa tan mẫu lỏng thành
dung dịch loãng với dung môi tuyệt ối khan nước và không hấp thu trong vùng khảo sát (như CCl4, CS2).
(16) Phổ IR có thể dùng ể biện giải cấu trúc của chất khí.
Mô tả: Dùng cốc o bằng KBr có bộ phận hút chân không với chiều dài chứa lớp khí
là 10cm cùng các gương phản chiếu bên trong cốc o ể phản xạ nhiều lần ánh sáng
IR i qua mẫu (với mục ích gia tăng ường i của ánh sáng IR qua mẫu khí vì nồng ộ
các phân tử ở dạng khí rất loãng).
(17) Trong phổ IR, có nhóm chức –OH, -C=O chỉ xuất hiện ỉnh tại một vùng dấu
vân tay hoặc có thể thêm ỉnh ở các vùng khác như vùng nhóm chức.
(18) Các chất kết tinh trong các dung môi khác nhau sẽ cho phổ IR khác nhau vì
nếu kết tinh trong nước phổ sẽ có ỉnh hấp thu OH, hấp thu trong các dung môi
không phân cực sẽ cho các ỉnh hấp thu khác. Cần phải bay hết dung môi thì phổ mới giống nhau.
(19) Các kiểu dao ộng cơ bản của quang phổ IR: ối xứng, bất ối xứng, cắt kéo, rock, vẫy, twist.
BÀI 3: ĐỊNH LƯỢNG ĐỒNG THỜI 2 CHẤT MÀU ( PHƯƠNG PHÁP QUANG PHỔ UV_VIS)
1) Cho biết công thức ể tính ộ hấp thu trong trường hợp hỗn hợp có nhiều thành phần 222
Trong trường hợp hỗn hợp có 2 thành phần: ộ hấp thu ược tính theo công thức: A1 1X.C lX. Y Y1.C l. 2 2 A2 X.C lX. Y Y.C l. Trong ó:
A1 và A2: ộ hấp thu lần lượt của các hỗn hợp o ược ở 2 bước sóng λ 1 và λ2
λ 1 và λ2: bước sóng hấp thu cực ại của dung dịch chất X và dung dịch chất Y 1 1
X và Y : hệ số tắt mol của các chất X và Y ở λ 1 ( ược tính theo ộ hấp thu
mol của dung dịch chuẩn có nồng ộ ã biết) 2 2
X và Y : hệ số tắt mol của các chất X và Y ở λ2 ( ược tính theo ộ hấp thu
mol của dung dịch chuẩn có nồng ộ ã biết) CX và CY:
nồng ộ của các chất X và Y trong hỗn hợp.
L: bề dày của lớp dung dịch mà ánh sang i qua
Nếu hỗn hợp có nhiều hơn 2 thành phần có thể áp dụng công thức tương tự.
2) Nêu các iều kiện ể áp dụng ược luật cộng tính ộ hấp thu Các
chất màu trong dung dịch phải áp ứng những yêu cầu sau:
• Phổ hấp thu của 2 chất màu X và Y chỉ chồng lên nhau 1 phần
• Bước sóng ược chọn lựa ể ịnh lượng phải trùng với cực ại hấp thu của mỗi chất
• Sự hấp thu của mỗi chất riêng biệt phải tuân theo ịnh luật Lambert-Beer
Không có những tương tác hóa học giữa 2 chất X và Y
3) Trong bài thực tập trên, vì sao phải o ộ hấp thu của dung dịch 3 ( là dung
dịch chứa hỗn hợp ồng thể tích của dung dịch 1 và dung dịch 2)? Phải o ộ
hấp thụ của dung dịch 3 ể kiểm chứng ịnh luật công tính.
4) Có thể ịnh lượng 2 chất màu trong bài thực tập trên trong môi trường kiềm
không? Tại sao?
Không nên ịnh lượng 2 chất màu trong bài thực tập trên trong môi trường kiềm vì:
Mn+7 + 3e → Mn+4 (MnO2 màu en) hoặc Mn+7 + 1e → Mn+6 (K2MnO4 màu xanh lục)
Cr+6 + 3e → Cr+3 (Cr2O3 màu ỏ)
Những hợp chất mới tạo ra ều có màu nên sẽ làm sai số kết quả ịnh lượng. 222
5) Một cách tổng quát, có thể sử dụng luật công tính ể áp dụng hỗn hợp có 3-
5 thành phần không?
Có thể sử dụng ịnh luật công tính ể áp dụng hỗn hợp có 3-5 thành phần
nhưng càng nhiều thành phần, kết quả ịnh lượng sai số càng lớn.
6) Ngoài việc xác ịnh từng thành phần trong hỗn hợp theo luật công tính của
phép o quang phổ UV-Vis còn có thể áp dụng phương pháp nào ể ịnh
lượng riêng lẻ từng thành phần.
Có thể sử dụng phương pháp quét và chồng phổ hoặc phương pháp HPLC ể
ịnh lượng riêng lẻ từng thành phần
BÀI 4: KHẢO SÁT ẢNH HƯỞNG CỦA PH LÊN QUÁ TRÌNH CHIẾT OXIN
1) Nhận xét sự thay ổi hiệu suất chiết của oxin trong các dung dịch có pH
khác nhau trong môi trường acid và base. Có kết luận gì về ảnh hưởng của
môi trường acid và môi trường base, pH của từng môi trường ối với hiệu suất chiết oxin.
• Trong môi trường acid: pH càng giảm thì hiệu suất chiết oxin càng tăng.
• Trong môi trường base: pH càng tăng thì hiệu suất chiết oxin càng tăng.
• Hiệu suất chiết oxin trong môi trường acid cao hơn môi trường base suy ra
chiết oxin trong môi trường acid hiệu quả hơn trong môi trường base. pH
càng acid trong môi trường acid và pH càng kiềm trong môi trường kiềm thì
hiệu suất chiết oxin càng cao.
2) Mục tiêu của bước 1 là gì? Tại sao phải tính hệ số hấp thu mol trung bình
từ 3 dung dịch pha loãng? Chỉ sử dụng một trong ba hệ số hấp thu mol
của ba dung dịch này ược không?
• Mục tiêu của bước 1 là xác ịnh hệ số hấp thu mol của dung dịch oxinat.
• Phải tính hệ số hấp thu mol trung bình của 3 dung dịch vì: trong quá trình
thao tác có thể mắc sai số, giá trị giữa các lần o không lặp lại vì vậy phải o 3
lần rồi lấy giá trị trung bình ể giảm bớt sai số.
• Có thể chỉ sử dụng một trong 3 hệ số hấp thu mol của 3 dung dịch nhưng sẽ
mắc sai số lớn hơn dùng hệ số hấp thu mol trung bình. 222
Bài 5a: Định lượng hỗn hợp acid H2SO4+ H3PO4 bằng phương pháp chuẩn ộ iện thế
Các máy sử dụng trong bài: máy o pH (jenway 3510), máy khuấy từ arec (velpscientifica) Nguyên tắc:
-H2SO4 là một acid mạnh có hai nấc phân ly. Khi dùng NaOH ể chuẩn ộ, các phản ứng xảy ra như sau: H2SO4 + NaOH →NaHSO4 H2O
-NaHSO4 phân ly không hoàn toàn nên khó xác ịnh iểm tương ương của nấc này mà
phản ứng thường i thẳng qua nấc phân ly thứ 2:
NaHSO4 + NaOH →Na2SO4 +H2O (2)
-Phản ứng (2) có bước nhảy ở 4-10
-H3PO4 là một acid trung bình có 3 nấc phân ly và các phản ứng với NaOH xảy ra như sau:
H3PO4 +NaOH →Na2HPO4 + H2O (3)
-pH kết thúc phản ứng (3) từ 4.1-5.2 (chỉ thị bromocresol, methyl da cam, ỏ methyl)
NaH2PO4 +NaOH →Na2HPO4 +H2O (4)
-pH kết thúc phản ứng (4) từ 9.2-10 (chỉ thị phenolphtalein)
Na2HPO4 +NaOH →Na3PO4 +H2O (5)
-Phản ứng (5) không có bước nhảy trong môi trường nước vì HPO -4 là một acid rất
yếu không thể hiện tính acid trong môi trường nước.
-Khi chuẩn ộ một hỗn hợp acid như H2SO4+ H3PO4 bằng dung dịch chuẩn NaOH 0.1
N nếu nhìn bằng mắt thường rất khó thấy chính xác sự chuyển màu của chỉ thị ở iểm
tương ương của từng nấc ở cả 2 acid. Do vậy, người ta dùng máy o iện thế ể theo dõi
sự biến ổi thế (hay biến ổi pH) và ghi nhận từng nấc phân ly của 2 acid này.
-Dùng iện cực kép gồm iện cực chỉ thị là iện cực thủy tinh (có thế thay ổi phụ thuộc
vào nồng ộ) và iện cực so sánh (có thế không thay ổi) là iện cực Calomel 222
-Điểm tương ương ược xác ịnh bằng iểm uốn của ường cong chuẩn ộ pH theo V(ml)
NaOH ã nhỏ xuống hoặc iểm cực ại ường ạo hàm bậc nhất ∆pH/∆V theo V(ml) p.s: chỉnh Tiến hành:
Cho cá từ vào becher cạnh thành bình, không ược chạm vào iện cực, chỉnh tốc ộ
khuấy sao cho không ược tạo bọt Tính toán
Hàm lượng g/l của các acid trong hỗn hợp ược tính theo công thức 𝑔
(2𝑉1 − 𝑉2)𝑥𝑁𝑁𝑎𝑂𝐻𝑥𝐸𝐻2𝑆𝑂4 𝑃 𝐻2𝑆𝑂4 𝑙 𝑉ℎỗ𝑛 ℎợ𝑝 𝑔
3(𝑉2 − 𝑉1)𝑥𝑁𝑁𝑎𝑂𝐻𝑥𝐸𝐻3𝑃𝑂4 𝑃 𝐻3𝑃𝑂4 = 𝑙 𝑉ℎỗ𝑛 ℎợ𝑝 Trong ó: E H2SO4=49 E H3PO4= 32.7
V1: thể tích NaOH nhỏ xuống phản ứng với toàn bộ H2SO4 và 1/3 lượng H3PO4
(ứng với iểm uốn thứ nhất)
V2: thể tích NaOH nhỏ xuống phản ứng với toàn bộ H2SO4 và 2/3 lượng H3PO4
(ứng với iểm uốn thứ 2)
𝐻2𝑆𝑂4 + 2𝑁𝑎𝑂𝐻 → 𝑁𝑎2𝑆𝑂4 + 2𝐻2𝑂 1 2
𝐻3𝑃𝑂4 + 3𝑁𝑎𝑂𝐻 → 𝑁𝑎3𝑃𝑂4 + 3𝐻2𝑂 1 3
Gọi Va là thể tích NaOH nhỏ xuống phản ứng với 𝐻2𝑆𝑂4 222
Gọi Vb là thể tích NaOH nhỏ xuống phản ứng với 𝐻3𝑃𝑂4 2𝑉1 = 2𝑉𝑎 +𝑉𝑏 3 2 3
Ta có: {𝑉1 = 𝑉𝑎 + 2 𝑉
𝑏 → { 𝑉2 = 𝑉𝑎 + 𝑉𝑏
→ { 2𝑉1 − 𝑉2 = 𝑉𝑎 𝑉2 = 𝑉𝑎
+𝑉𝑏 { 3𝑉1 = 3𝑉𝑎 + 𝑉𝑏 3(𝑉2 − 𝑉1) = 𝑉𝑏
{ 3𝑉2 = 3𝑉𝑎 + 2𝑉𝑏 𝑛𝑁𝑎𝑂𝐻 𝑚𝐻 𝑆𝑂 = 𝑛𝐻 𝑆𝑂𝑀𝑁𝑎𝑂𝐻 𝑎 𝐻 𝑆𝑂 𝑁𝑎𝑂𝐻 𝑔 2𝑉 𝑁𝑎𝑂𝐻 𝐻 𝑆𝑂 𝑝 𝑙 𝑉ℎỗ𝑛 ℎợ𝑝 𝑛𝑁𝑎𝑂𝐻 𝑚𝐻 𝑃𝑂 = 𝑛𝐻 𝑃𝑂𝑀𝑁𝑎𝑂𝐻 𝑏 𝐻 𝑃𝑂 𝑁𝑎𝑂𝐻 𝑔 (𝑉 𝑁𝑎𝑂𝐻 𝐻 𝑃𝑂 𝑝 𝑙 𝑉ℎỗ𝑛 ℎợ𝑝 Câu hỏi:
1. Có những iểm gì khác biệt khi xác ịnh iểm tương ương của chuẩn ộ thể tích
bằng mắt thường và bằng máy o bước nhảy của pH? Nêu các ưu và khuyết
iểm của hai phương pháp
Khi xác ịnh iểm tương ương ối với chuẩn ộ bằng mắt thường phải có chất chỉ thị mới
có thể xác ịnh ược iểm tương ương, còn ối với chuẩn ộ bằng máy o pH có thể không
dùng chỉ thị vẫn có thể xác ịnh ược iểm tương ương do dựa vào sự thay ổi thế.
• Chuẩn ộ bằng mắt thường 222
-Quá trình xác ịnh bằng mắt
-Hạn chế ối với dung dịch có màu -Ngưỡng sai số lớn
-Chỉ áp dụng khi hàm lượng chất là lớn
-Chịu ảnh hưởng môi trường xung quanh
• Chuẩn ộ bằng máy o bước nhảy của pH -Ưu:
+Độ nhạy cao có thể lên tới vài ppm
+Chuẩn ộ ược những dung dịch có màu, ục
+Chuẩn ộ ược những trường hợp không có chất chỉ thị
+Có thể chuẩn ộ riêng phần các hỗn hợp nhiều thành phần
+Tránh ược sai số chủ quan và có thể tự ộng hóa +An toàn -Nhược: +Khá tốn kém
2. Nhận xét gì khi ến bước nhảy pH:
-Khi ến bước nhảy pH thì ộ biến thiên của thế thay ổi một cách ột ngột tại thời iểm
sát trước và sát sau iểm tương ương nhờ ó mà biết ược thể tích chuẩn ộ.
-Không thể xác ịnh ược iểm tương ương khi vẽ ường biểu diễn pH theo thể tích chuẩn
ộ (V) mà phải theo ường biểu diễn ∆pH/∆V theo 𝑉
Bài 5b: Định lượng methionin trong môi trường khan bằng phương pháp
chuẩn ộ iện thế
Các máy sử dụng trong bài: máy chuẩn ộ iện thế (Mettler toledo g20) Nguyên tắc
Methionin là một base rất yếu và có thể ịnh lượng ược trong môi trường acid acetic
bằng dung dịch acid perclorid 0.1 N trong acid acetic băng. 222
Phát hiện iểm tương ương bằng bước nhảy thế hoặc sử dụng chỉ thị tím tinh thể
Xử lý iện cực: các iện cực thủy tinh ( iện cực chỉ thị) và iện cực calomel ( iện cực
so sánh) luôn ược nhúng chìm vào nước cất khi không sử dụng lau chúng thật khô
trước khi ặt vào môi trường khan.
Chú ý: không ngâm iện cực trong môi trường acid acetic băng lâu hơn 20’ mỗi lần
Thực hiện chuẩn ộ trong môi trường khan càng nhanh càng tốt. Sau mỗi lần chuẩn
ộ, rửa iện cực bằng nước cất, nhúng chìm trong nước cất và cho cá từ quay ít nhất
20’ trước khi chuẩn ộ tiếp trong môi trường khan.
Nguyên tắc chuẩn ộ bằng phép o iện thế: dựa trên việc o sự biến thiên của thế
trong quá trình chuẩn ộ.
Điểm kết thúc ược xác ịnh bằng sự thay ổi ột ngột về iện thế của hỗn hợp dung dịch
chuẩn ộ nhờ ó mà biết ược thể tích chuẩn ộ.
Cần chọn iện cực thích hợp với phản ứng chuẩn ộ.
Tiêu chuẩn của một phản ứng chuẩn ộ có thể áp dụng chuẩn ộ thế:
-Có tốc ộ ủ lớn và không có phản ứng phụ
Phản ứng xảy ra hợp thức theo một chiều xác ịnh
-Có iện cực chỉ thị thích hợp (có phản ứng iện hóa với một trong những cấu tử có
trong phản ứng chuẩn ộ)
-Chuẩn ộ o thế có 2 loại chuẩn ộ o thế không dòng (i=0) và chuẩn ộ thế có dòng
không ổi (i≠0 và i=const)
Nguyên tắc chuẩn ộ trong môi trường khan: chuẩn ộ trong môi trường khan dựa
trên phản ứng trung hòa giữa acid và base. Phương pháo này chủ yếu dùng ể ịnh
lượng acid, base yếu. Sử dụng dung môi khan hay còn gọi là dung môi không nước
Tại sao không ngâm iện cực trong môi trường acid acetic băng lâu hơn 20’ mỗi lần?
Tại sao phải thực hiện trong môi trường khan càng nhanh càng tốt? Câu hỏi:
1. Dung dịch chứa iện cực là LiCl2/Ethanol
2. Khi một chất là acid yếu hay base yếu thì cần ịnh lượng trong môi trường khan 222
3. Cách xử lý iện cực calomel-thủy tinh khi chuẩn ộ trong môi trường khan:
các iện cực thủy tinh ( iện cực chỉ thị) và iện cực calomel ( iện cực so sánh)
luôn ược nhúng chìm vào nước cất khi không sử dụng, lau chúng thật khô
trước khi ặt vào môi trường khan.
Khác so với iện cực trong môi trường nước là: iện cực phải ược lau thật khô
trước khi ặt vào môi trường khan.
4. Acid thường ược sử dụng làm chất chuẩn ộ trong môi trường khan là acid
percloric, ể tăng tính base người ta dùng dung môi ể pha là acid acetic băng.
5. Base thường ược sử dụng làm chất chuẩn ộ trong môi trường khan là KOH
trong alcol( thường dùng methanol), dung môi thường chọn dung môi có tính
base ể tăng tính acid của chất phân tích như pyridin, dimetylformamid (DMFA)
Công thức tính hàm lượng methionin:
Ta có: 1ml dung dịch acid percloric 0.1 N tương ương với 14,92 mg methionin (C15H11NO2S)
V ml dung dịch acid perclorid 0.1N tương ương với 𝑉𝑥14,92 mg methionin 1
Bài 6a: Xác ịnh ộ phân giải và hiệu lực bản mỏng trong sắc ký lớp mỏng
Sử dụng bản mỏng Silicagel F254(Merck) 5cm x10 cm Cơ sở lý thuyết:
Sắc ký lớp mỏng là một phương pháp sắc ký dùng chất hấp phụ làm pha tĩnh trải
thành lớp mỏng trên tấm kính, nhựa hay kim loại. Quá trình tách các hợp chất xảy ra
khi cho pha ộng là dung môi di chuyển qua pha rắn. Do ó SKLM thuộc loại sắc ký
lỏng-rắn theo cơ thế hấp phụ và phân bố. Nhờ tốc ộ di chuyển khác nhau trên pha
tĩnh rắn, các thành phần của mẫu sẽ tách riêng biệt thành từng dải, làm cơ sở phân
tích ịnh tính và ịnh lượng.
Về mặt lý thuyết và ứng dụng, SKLM và sắc ký lỏng trên cột khá giống nhau. Vì thế
SKLM có thể dùng ể tìm các iều kiện tối ưu cho sự tách bằng sắc ký lỏng trên cột. Lý thuyết TLC:
Sắc ký lớp mỏng thuộc sắc ký lỏng 222
Chất làm pha tĩnh cần có ặc tính nở rộng theo cả chiều dọc và chiều ngang
Silicagel: tính hấp phụ của silicagel do các nhóm OH trên bề mặt quyết ịnh Triển khai sắc ký
Đặt bản mỏng vào bình khai triển, những vết chấm phải nằm trên mức dung môi
trong bình. Đậy bình lại và triển khai khi dung môi i ến vạch tiền tuyến (cách mép
trên 0.5 or 0.2 cm), lấy bản mỏng ra khỏi bình và ánh dấu ngay ường dung môi. Làm
khô bản mỏng ở nhiệt ộ phòng trong tủ Hood.
Dùng bút chì khoanh viền vết của mỗi dung dịch trên sắc ký ồ
Khi chấm dung dịch, ống mao quản cầm thẳng ứng, chạm nhẹ, lấy ra ngay, tay
không ược chạm vào bản mỏng.
Tính toán kết quả:
Với mỗi vết sắc ký (Rf: hệ số lưu giữ: retardation factor) 0≤Rf ≤1 𝑑𝑟 ⌀ 𝑅𝑓 = W= 𝑑𝑚 𝑑𝑚
Dr,dm: quãng ường di chuyển lần lượt của chất cần tách và của dung môi
⌀: ường kính của vết
Độ phân giải (resolution) Rs 2|𝑅𝑓2 − 𝑅𝑓1| 2|𝑑𝑟2 − 𝑑𝑟1| 𝑑𝑚 2|𝑑𝑟2 − 𝑑𝑟1| 𝑅𝑠 = = 𝑥 = 𝑊2 + 𝑊1 𝑑𝑚 ⌀2 + ⌀1 ⌀2 + ⌀1
Rs=0.75: 2 pic không tách tốt, còn xen phủ nhau nhiều
Rs=1.0 : 2 pic tách khá tốt, còn xen phủ nhau 4%
Rs≥1.5: 2 pic tách nhau hoàn toàn
Số ĩa lý thuyết (number of theoretical plate): 𝑅𝑓 2 𝑑𝑟 2 𝑁𝑒𝑓𝑓 = 16 ( ) = 16 ( ) 𝑊 ⌀ 222
Chiều cao tương ương của ĩa lý thuyết (height equivalent to a theoretical plate): HETP= 𝑑𝑚 𝑁𝑒𝑓𝑓
Trả lời câu hỏi:
1. Các yếu tố ảnh hưởng ến Rf
-Chất lượng và hoạt tính của chất hấp phụ
-Chiều dày của lớp mỏng, quãng ường sắc ký, lượng chất chấm
-Vị trí và số lượng chất cần tách trên bản mỏng
-Thành phần và ộ tinh khiết của pha ộng
-Phương pháp khai triển sắc ký
-Độ bão hòa của dung môi trong bình sắc ký
-Ảnh hưởng của các cấu tử khác có trong thành phần hỗn hợp cần tách -Độ ẩm, nhiệt ộ và pH
2. Khi tách một hỗn hợp từ 2 chất trở lên bằng TLC, cần phải xác ịnh thông số Rs ( ộ phân giải)
3. Các yếu tố ảnh huởng ến hiệu lực của bản mỏng -Số ĩa lý thuyết -Chiều cao ĩa lý thuyết
Bài 6b: ĐỊNH LƯỢNG NA+ VÀ CL- BẰNG PHƯƠNG PHÁP SẮC KÝ CỘT TRAO ĐỔI ION Nguyên tắc:
Định lượng cation Na+ trong dung dịch NaCl
Ion Natri ược trao ổi trên nhựa cationit theo phản ứng: RH + Na+ →RNa +H+
Các proton H+ ược phóng thích sau khi trao ổi sẽ ược rửa giải và ược ịnh lượng
bằng dung dịch chuẩn ộ NaOH 0.1 N với chỉ thị là phenolphtalein.




