















Preview text:
lOMoAR cPSD| 47207194 lOMoAR cPSD| 47207194
NỘI DUNG CÁC BÀI THỰC TẬP
BÀI 1: KEO VÀ NHŨ DỊCH: ĐIỀU CHẾ, KHẢO SÁT TÍNH
CHẤT HỆ KEO VÀ NHŨ DỊCH
BÀI 2: ĐIỆN HÓA HỌC: ĐO pH VÀ ĐỘ DẪN ĐIỆN CỦA MỘT SỐ DUNG DỊCH
BÀI 3: SỰ HÒA TAN HẠN CHẾ CỦA CHẤT LỎNG
BÀI 4: PHẢN ỨNG BẬC NHẤT: THỦY PHÂN ACETAT
ETHYL TRONG MÔI TRƯỜNG ACID
BÀI 5: PHẢN ỨNG BẬC HAI: PHẢN ỨNG XÀ PHÒNG HÓA ACETAT ETHYL
BÀI 6: SỰ HẤP PHỤ CỦA ACID ACETIC TRÊN THAN HOẠT
BÀI 7: SẮC KÝ GIẤY VÀ SẮC KÝ TRAO ĐỔI ION lOMoAR cPSD| 47207194 lOMoAR cPSD| 47207194 lOMoAR cPSD| 47207194 Đại cương
- Keo thân dịch: tiểu phân keo liên kết chặt chẽ với môi trường
phân tán nhờ lớp vỏ solvat, khi làm đông tụ dung dịch keo này
ta thu được một khối đặc gọi là gel.
- Keo sơ dịch: tiểu phân keo không tạo được lớp vỏ solvat với
môi trường phân tán nên không gắn chặt với môi trường. Khi
làm đông tụ, keo này sẽ kết tủa và tách khỏi môi trường phân
tán dưới dạng bột. Ví dụ: Keo hydroxyd, oxyd kim loại.
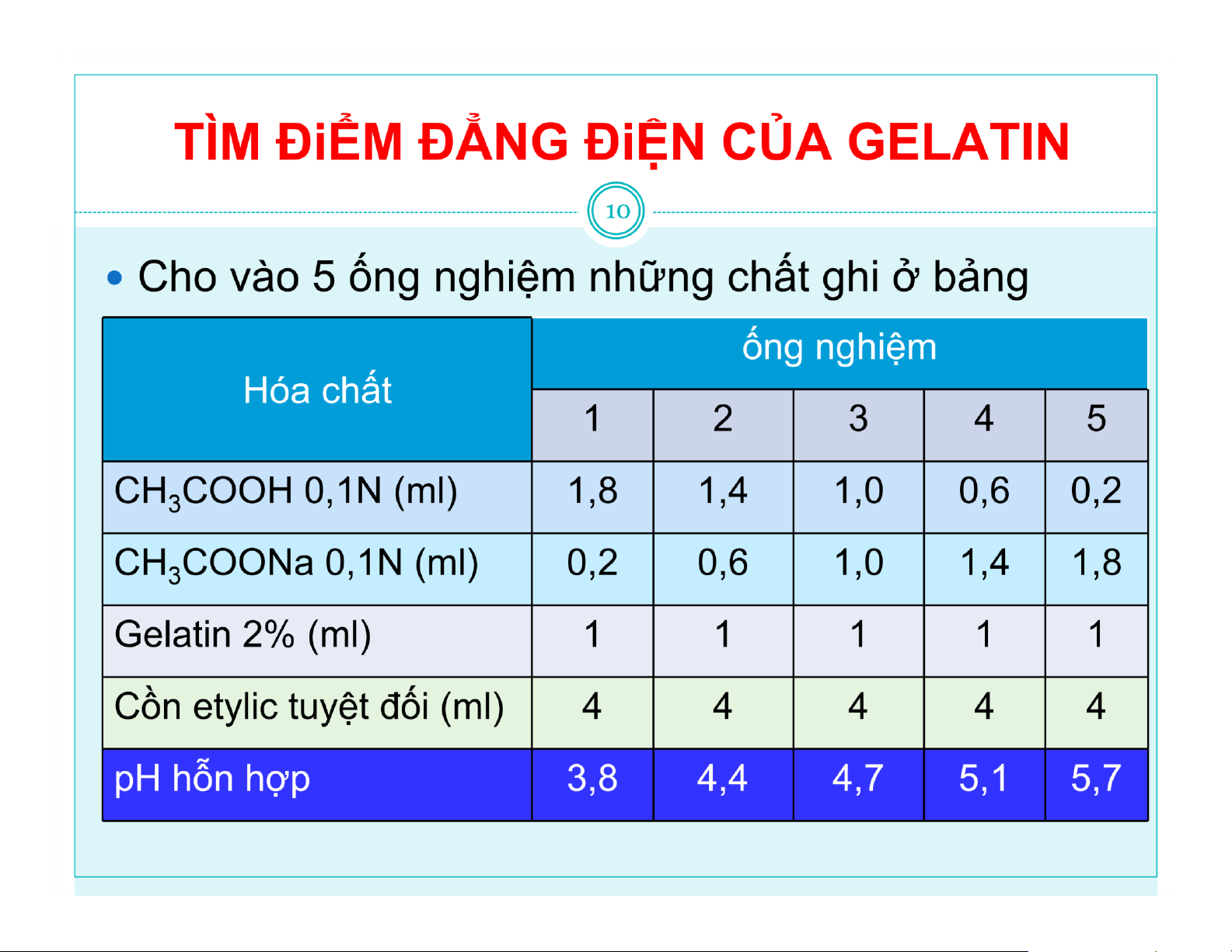
- Điểm đẳng điện: pH mà tại đó protein trung hòa về điện.
- Ứng dụng của việc xác định điểm đđ: biết được pH mà tại
đó protein tủa để gây tủa protein trong tinh chế, hoặc để bảo
quản protein (tránh pH đđ). lOMoAR cPSD| 47207194 Đại cương 6
Trong dung dịch keo các tiểu phân mang điện tích cùng
dấu nên đẩy lẫn nhau, nhờ vậy mà keo được bền vững
Khi điện thế zeta (ξ) hạ đến 1 trị số tới hạn thì xảy ra sự đông vón
Ở điểm đẳng điện, ξ = 0 thì keo đông vón rất nhanh (pH
tại điểm đđ : pI Isoelectrics point)
Đối với keo sơ dịch, tác nhân gây đông vón quan trọng
nhất là chất điện giải
Sự đông vón keo thân dịch ngoài việc hạ điện thế zeta,
còn phải phá lớp hydrat (vỏ nước) bằng chất khử nước: cồn, aceton… Đại cương 7 lOMoAR cPSD| 47207194
Gelatin: protein thu được bằng cách thủy phân colagen động vật
Thủy phân /acid gelatin dạng A (pHđđ: 6-9,5)
Thủy phân /kiềm gelatin dạng B (pHđđ: 4,7-5,6) Cấu tạo: NH +
2 – R – COOH NH3 – R – COO-
Dung dịch gelatin là keo thân dịch
Sự tích điện của keo gelatin phụ thuộc pH môi trường
Điểm đẳng điện: gelatin bị trung hòa điện tích (pI)
Có khả năng bảo vệ keo sơ dịch lOMoAR cPSD| 47207194 lOMoAR cPSD| 47207194 lOMoAR cPSD| 47207194 lOMoAR cPSD| 47207194 lOMoAR cPSD| 47207194 lOMoAR cPSD| 47207194
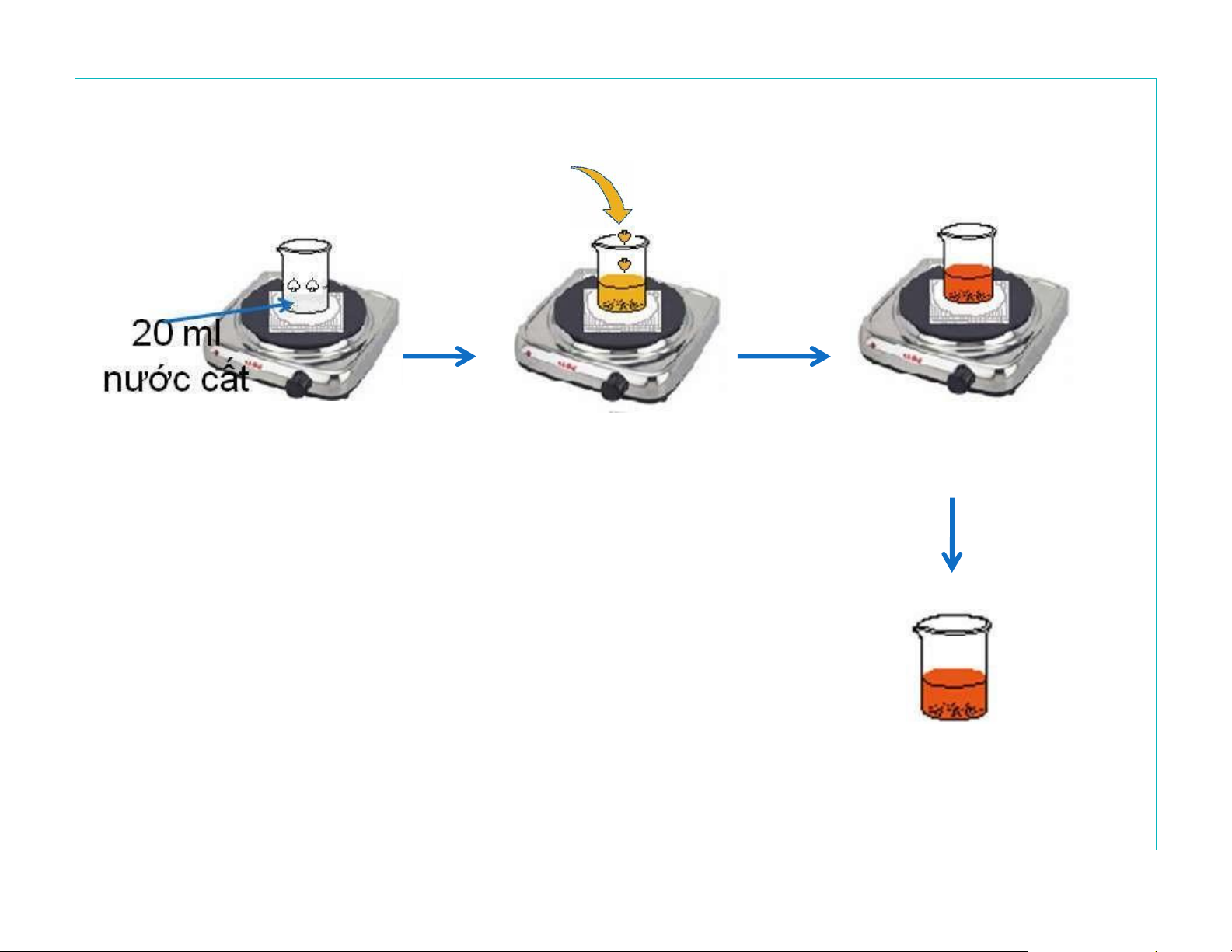
Điều chế dung dịch keo sắt III hydroxyd (Fe(OH)3) Chovàotừtừ 2ml FeCl 2% 3 Đunthêmvài Đunnướcsôi Nướcđangsôi phúttrênbếp Dung dịch keo Fe(OH)3 màu nâu đỏ lOMoAR cPSD| 47207194
Lưu ý về thao tác* 13 lOMoAR cPSD| 47207194 lOMoAR cPSD| 47207194
Điều chế dung dịch keo sắt III hydroxyd (Fe(OH)3) 15
Các phân tử Fe(OH)3 là nhân keo: [Fe(OH)3]m.
Bề mặt nhân keo hấp phụ ion FeO+ tạo thành lớp
quyết định thế hiệu
Nhân hạt keo tích điện dương sẽ hút các ion Clthành
lớp ion bị hấp phụ: [Fe(OH)3]m . nFeO+ + xCl-
→ { [Fe(OH)3]m . nFeO+ .xCl- }(3n - x)+
Các ion Cl- khác ở xa hạt nhân tạo thành lớp ion khuếch tán.
Cấu tạo hạt keo được biểu diễn:
{ [Fe(OH)3]m ; nFeO+ ; xCl- }(3n - x)+ ; (3n - x)Cl- lOMoAR cPSD| 47207194 lOMoAR cPSD| 47207194
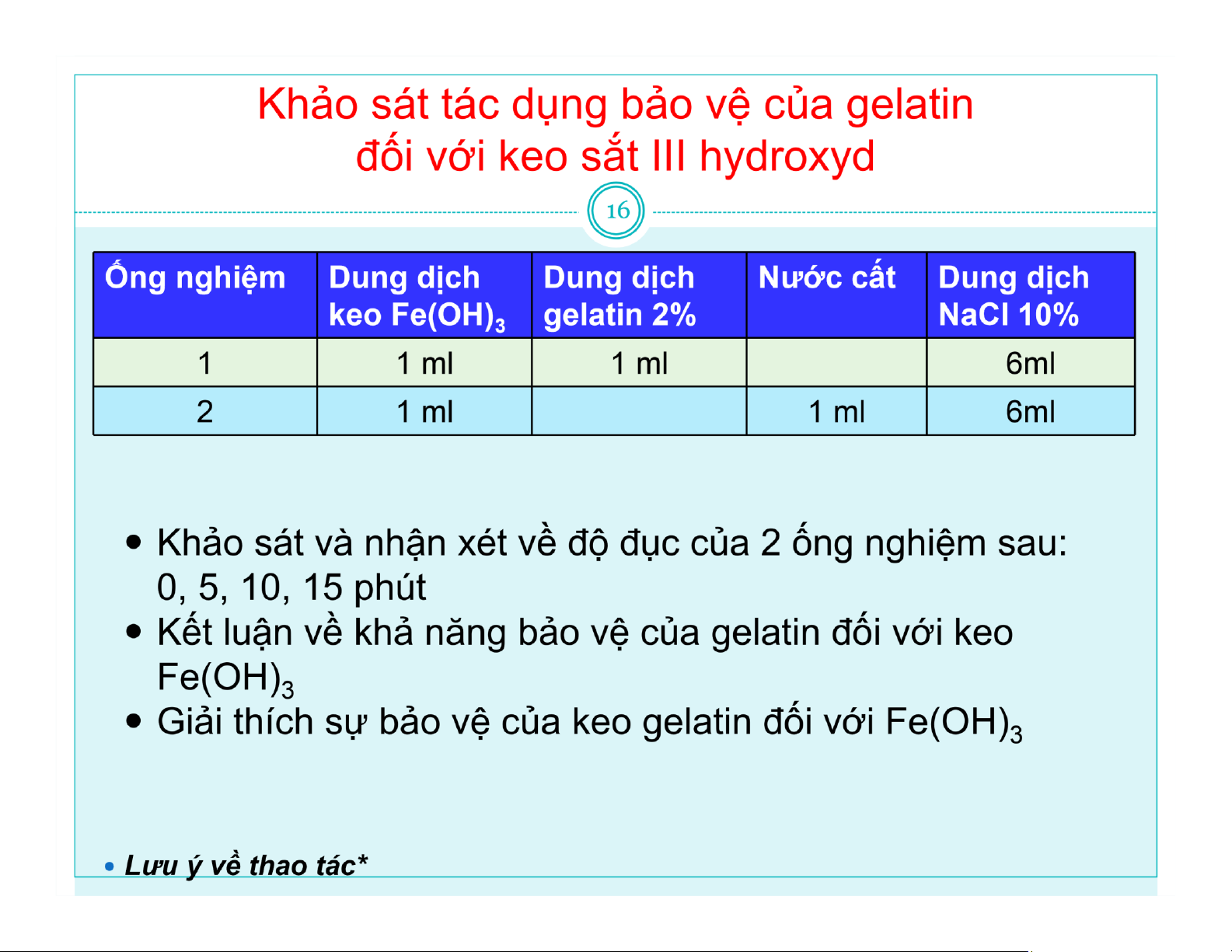
Khảo sát sự đông vón của keo sơ dịch 17
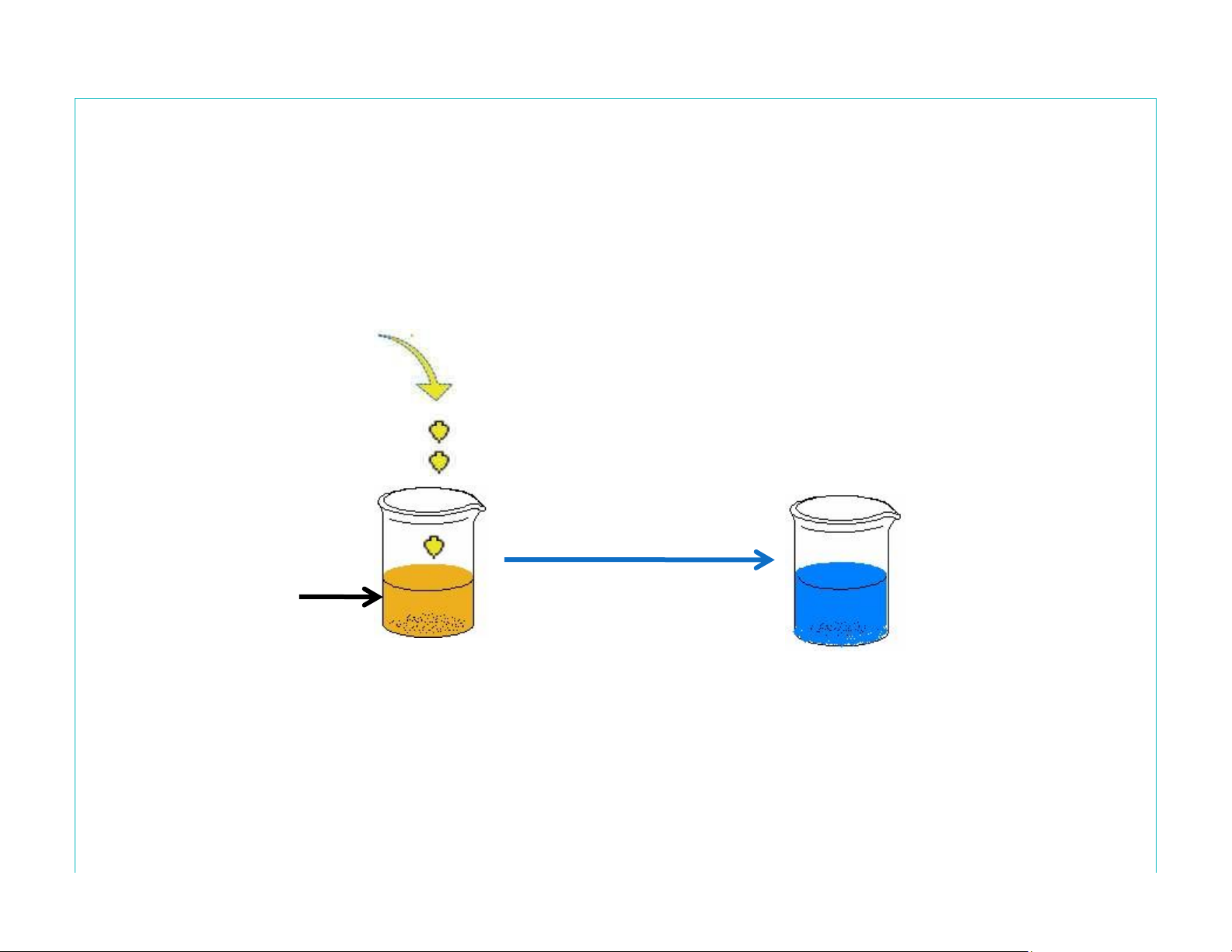
Điều chế keo xanh phổ: Lấy 10 ml dung dịch FeCl3 2%
cho vào becher. Thêm tiếp 2 ml dung dịch kali ferocyanid 10%, khuấy kỹ
Lọc và rửa tủa bằng nước cất đến khi nước rửa không màu
Nhỏ từ từ lên tủa từng giọt acid oxalic 0,1N cho đến khi
thu được 5 ml dung dịch keo xanh phổ
Lấy 5 ml dung dịch keo xanh phổ vừa điều chế pha với
nước cất vừa đủ 100 ml, thực hiện thí nghiệm lOMoAR cPSD| 47207194 Điều chế keo xanh phổ 2ml Kali ferocyanid 10% Khuấykỹ 10 ml FeCl 2% 3 Tủa xanh phổ lOMoAR cPSD| 47207194
Lưu ý về thao tác* 18



