






Preview text:
Những kiến thức cần nhớ cho môn Hóa học ại cương 1. Bộ 4 số lượng tử 1.1. Lý thuyết:
- Số lượng tử chính (n): n = 1 2 3 4 … Ứng với lớp obitan: K L M N …
- Số lượng tử phụ (l):
l nhận một giá trị trong [0,n – 1]. l = 0 1 2 3 …
Ứng với phân lớp obitan: s p d f …
- Số lượng tử từ (ml):
Nhận một giá trị trong [-l,l].
Các ô trong phân lớp ó ược ánh số từ - l ến l.
- Số lượng tử spin (ms): ms nhận 1 trong 2 giá trị ± .
Giá trị (+) thể hiện electron cuối cùng có hướng mũi tên i lên, ngược lại có hướng mũi tên i xuống.
Ví dụ 1: Xác ịnh số thứ tự Z của nguyên tố có electron cuối cùng iền vào cấu hình
electron ứng với bộ 4 số lượng tử như sau:
• n = 2, l = 0, ml = 0, ms = +
Do n = 2, l = 0 nên nguyên tố cần tìm có electron cuối cùng ược iền ở phân lớp 2s.
Hơn nữa ở phân lớp s (ứng với l = 0) chỉ có 1 giá trị ml = 0 do có duy nhất một ô ể iền obitan.
Mà ms = + nên electron cuối cùng ược iền có mũi tên i lên, tức là nguyên tố cần tìm
có cấu hình electron của phân lớp ngoài cùng là 2s1 : ↑ 2s
Vậy nguyên tố cần tìm có cấu hình electron là 1s22s1. Đây là nguyên tố Li có Z = 3. 1 Thỏ Làm Toán
• n = 2, l =1, ml = 0, ms = −
Do n = 2, l = 1 nên nguyên tố cần tìm có electron cuối cùng ược iền ở phân lớp 2p.
Hơn nữa phân lớp p có 3 giá trị ml từ -1 ến 1. Với ô ầu tiên ứng với giá trị -1, ô thứ 2
ứng với giá trị 0, ô cuối cùng ứng với giá trị 1.
Theo ề bài ml = 0 tức electron cuối cùng nằm ở ô thứ 2.
Mà ms = − tức là electron cuối cùng ó ược iền có hướng mũi tên i xuống : ↑↓ ↑↓ ↑ 2p
Vậy nguyên tố cần tìm có cấu hình electron là 1s22s22p5 . Đây là nguyên tố F có Z = 9.
Ví dụ 2: Viết bộ 4 số lượng tử ứng với electron cuối cùng cho các trường hợp sau ây: • N (Z = 7): ↑ ↑ ↑
Cấu hình electron của N là 1s22s22p3 : 2p
Do electron cuối cùng nằm ở phân lớp 2p nên n = 2, l = 1. Mà electron cuối cùng
nằm ở ô cuối cùng ứng với ml = 1 và có hướng mũi tên i lên ứng với ms = + .
Vậy bộ 4 số lượng tử cần tìm là: n = 2, l = 1, ml = 1, ms = + . • Si (Z = 14): ↑ ↑
Cấu hình electron của Si là 1s22s22p6 3s23p2: 3p
Do electron cuối cùng nằm ở phân lớp 3p nên n = 3, l = 1. Mà electron cuối cùng
nằm ở ô thứ 2 ứng với ml = 0 và có hướng mũi tên i lên ứng với ms = + .
Vậy bộ 4 số lượng tử cần tìm là: n = 3, l = 1, ml = 0, ms = + .
2. Tính năng lượng và bước sóng
a. Công thức tính năng lượng 2 Thỏ Làm Toán E = −13,6Z 2 (n12t − n12c)
b. Công thức tính bước sóng hc λ = E
c. Ví dụ: Tính năng lượng cần thiết ể kích thích electron trong ion Li2+ từ mức n = 2
lên mức n = 3. Tính bước sóng (theo nm) của bức xạ iện từ phát ra. 2
(n12 − n12c) = −13,6. 32. (312 − 212) = 17 (eV) E = −13,6Z t λ
= hc 6,625. 10−34. 3. 108 −8(m) =
73,07 (nm) E = 17.1,6. 10−19 = 7,307. 10 d. Lưu ý
• Năng lượng mình luôn lấy là số dương nên khi tính toán thì lấy nt > nc.
• Đối với phân tử H2 chúng ta có thể bỏ qua Z vì nó bằng 1. Nhưng với các ion phân
tử ở trạng thái kích thích gần giống phân tử H2 thì Z ≠ 1.
• Nhớ ọc kỹ ề kỹ ể ưa về các ơn vị mà ề bài yêu cầu. 3. Giản ồ MO
3.1. Phân loại giản ồ MO
a. Phân tử có 2 hạt nhân giống nhau (A1)
- Loại 1: Các phân tử O2, F2, Ne2 và các ion phân tử của nó 3 Thỏ Làm Toán
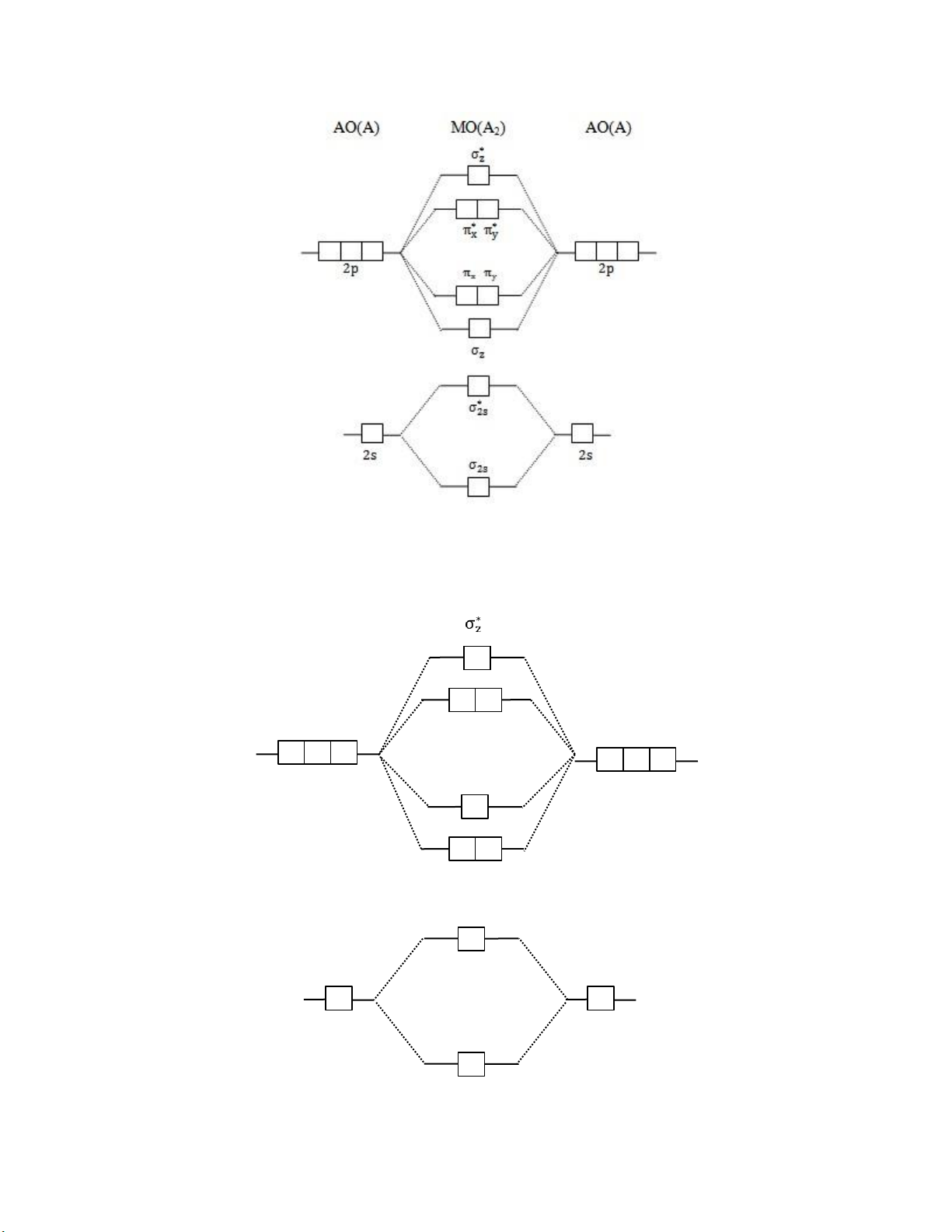
- Loại 2: Các phân tử Li2, Be2, B2, C2, N2 và các ion phân tử của nó AO(A) MO(A2) AO(A) π ∗ ∗ x π y σ 2p z 2 p π x π y σ ∗ 2 s 2 s 2 s σ 2 s 4 Thỏ Làm Toán
b. Phân tử có 2 hạt nhân khác nhau nhau (AB)
- Lưu ý: Giản ồ dạng này B sẽ có ộ âm iện cao hơn A. Đối với các ion phân tử
ABn+ (hoặc ABn−) thì ể biết An+ hay Bn+ (An− hay Bn−) thì ta sẽ ưu tiên ion
phân tử nào khi thêm electron (hoặc bớt electron) thì trở nên bền vững hơn.
- Mẹo: Nếu không hiểu ý trên thì cứ mặc ịnh nếu ộ âm iện A < B thì ABn+ sẽ có
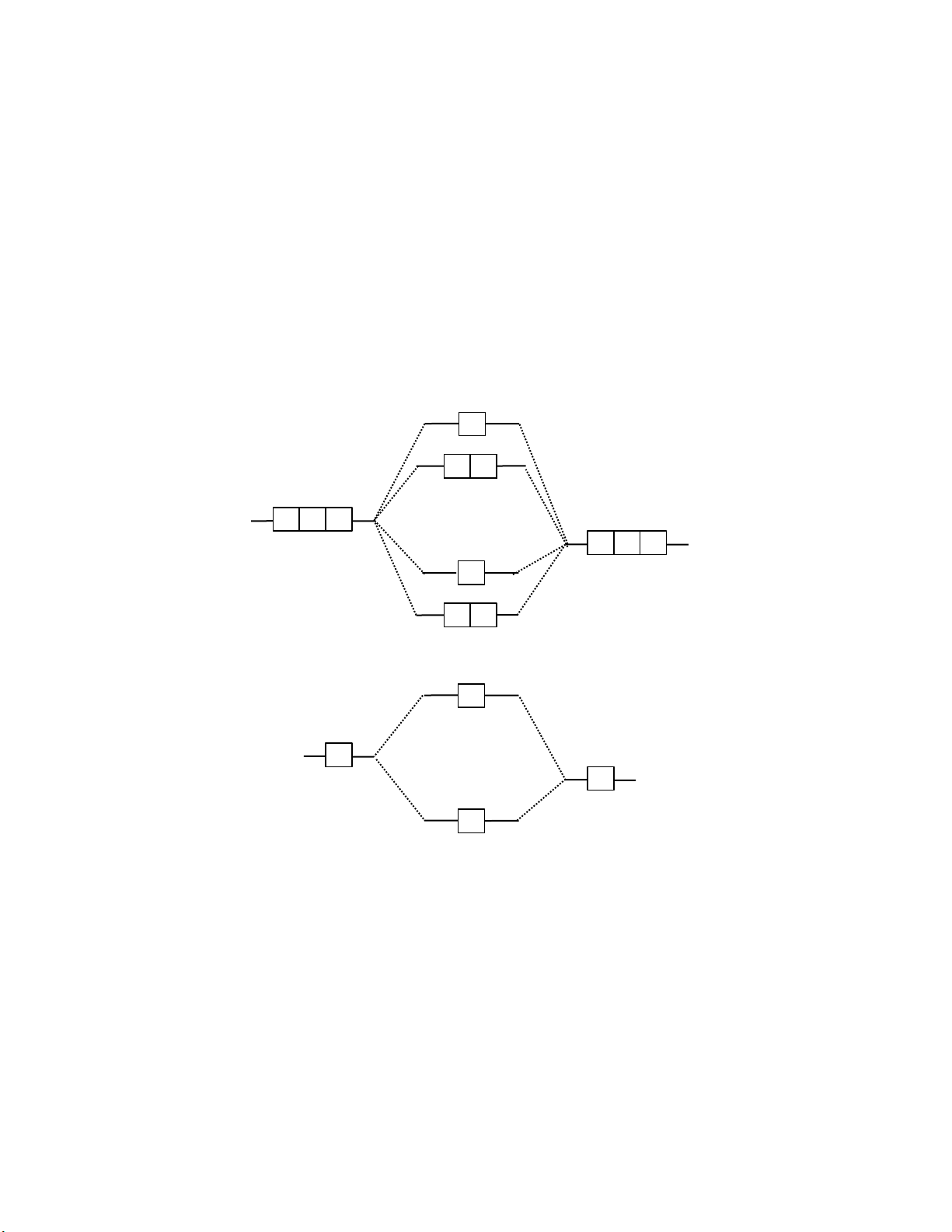
AO(An+) và AO(B) còn ABn− sẽ có AO(A) và AO(Bn−). AO(A) MO(AB) AO(B) σ z ∗ π ∗ ∗ x π y 2p σ z 2 p πx πy σ ∗ 2 s 2 s σ 2 s 2 s
3.2. Các bước ể vẽ giản ồ MO
- Bước 1: Viết cấu hình electron của các phân tử.
- Bước 2: Xác ịnh giản ồ thuộc loại nào và vẽ giản ồ ra.
- Bước 3: Điền các electron vào giản ồ.
- Bước 4: Thực hiện các yêu cầu khác của ề bài sau khi vẽ xong.
3.3. Nguyên tắc iền electron 5 Thỏ Làm Toán
- Nguyên tắc thứ nhất: Điền từng e một (nói dễ hiểu là từng mũi tên một).
- Nguyên tắc thứ hai: Điền e vào các AO ở 2 bên trước sau ó mới iền vào MO nằm
ở giữa. Tổng e của AO 2 bên chính là số e phải iền của MO nằm chính giữa.
- Nguyên tắc thứ ba: Điền từng e một từ dưới lên trên, từ trái sang phải cho ến khi
không còn e nào ể iền nữa. - VD:
+ Đối với phân tử N2: Có 2 AO(N) có cấu hình e là 1s22s22p3 nên 2 AO 2 bên
của phân lớp 2s ều chứa 2 e nên MO có chứa 4 e. Còn phân lớp 2p thì 2 bên ều
có 3 e nên tổng MO ở giữa phải iền là 6 e.
+ Đối với phân tử NO: Có 1 AO(N) và 1 AO(O). AO(N) có cấu hình e là
1s22s22p3 nên phải iền 2 e ở phân lớp 2s và 3 e ở phân lớp 2p. Còn AO(O) có
cấu hình e là 1s22s22p4 nên phải iền 2 e ở phân lớp 2s và 4 e ở phân lớp 2p. Vậy
phần MO nằm ở giữa phải iền tổng cộng 4 e ở phân lớp 2s và 7 e ở phân lớp 2p.
3.4. Viết cấu hình phân tử (ion phân tử) vừa xây dựng
- Từ giản ồ MO chúng ta có thể dễ dàng viết cấu hình của phân tử, ion phân tử ó như sau:
• Đối với giản ồ MO dạng A2 loại 1 và giản ồ MO dạng AB sẽ có chung một kiểu
viết cấu hình là: σ2sσ∗2sσzπxπyπ∗xπ∗yσ∗z.
• Đối với giản ồ MO dạng A2 loại 2 sẽ có cấu hình là: σ2sσ∗2sπxπyσzπ∗xπ∗yσ∗z.
- Lưu ý: Đây chỉ là cấu hình chung. Còn khi xây dựng nó sẽ có thêm chỉ số mũ (1
hoặc 2) trên ầu từng cái tùy thuộc vào ô ó ược iền 1 hay 2 electron hoặc là sẽ bỏ i
nếu ô ó không ược iền e.
- Từ cấu hình e phân tử xây dựng ta có thể xác ịnh ược cấu hình e ion phân tử của
nó và ngược lại hoặc có thể dựa vào giản ồ MO.
3.5. Một số yêu cầu ề bài có thể ra
- Từ tính: Dựa vào giản ồ MO chúng ta có thể xác ịnh ược từ tính của phân tử và
ion phân tử. Nếu trên giản ồ MO mà không còn electron nào ộc thân (tức tất cả
các ô ều chứa ầy ủ 2 mũi tên) thì phân tử, ion phân tử ó mang tính nghịch từ,
ngược lại nếu có 1 electron nào ộc thân (tức xuất hiện một hoặc nhiều ô có chứa 6 Thỏ Làm Toán
1 mũi tên) thì phân tử, ion phân tử ó mang tính thuận từ. Hoặc dựa vào cấu hình
phân tử vừa xây dựng ược ể xác ịnh từ tính. Nếu trên ầu nó có một phần tử nào
không mũ 2 tức mang tính thuận từ, ngược lại tất cả ều mũ 2 thì mang tính nghịch từ. - Bậc liên kết: N = (n − n∗) Trong ó:
n là số electron liên kết (tổng số mũi tên trong giản ổ MO của σ, π)
n∗ là số electron phản liên kết (tổng số mũi tên trong giản ổ MO của σ∗, π∗)
- Độ bền liên kết: Bậc liên kết càng lớn thì ộ bền liên kết càng lớn.
- Độ dài liên kết: Bậc liên kết càng lớn thì ộ dài liên kết càng ngắn. 4. Nhiệt ộng học
a. Các công thức cần nhớ
1) ∆H = ∑ ∆H sản phẩm − ∑ ∆H ban đầu
2) ∆S = ∑ ∆S sản phẩm − ∑ ∆S ban đầu 3) ∆G = ∆H − T∆S b. Ví dụ aA + bB → cC + dD
∆H = c∆HC + d∆Hd − a∆HA + b∆Hb
∆S = c∆SC + d∆Sd − a∆SA + b∆Sb c. Lưu ý
1) ∆H < 0 phản ứng thuận tỏa nhiệt, ∆H > 0 phản ứng thuận thu nhiệt.
2) ∆G < 0 phản ứng tự diễn biến (xảy ra theo chiều thuận), ∆G > 0 phản
ứng không tự diễn biến (xảy ra theo chiều nghịch).
3) Đơn vị của ∆H thường là kJ⁄mol còn ∆S thường là J mol. K⁄ nên chúng
ta cần ổi về kJ hoặc J. 5. Tốc ộ phản ứng 7 Thỏ Làm Toán 5.1. Phản ứng bậc 1 a. Công thức C0 ln = kt Ct b. Thời gian bán hủy ln2 t1 2⁄ = k
Trong đó: C0, Ct lần lượt là nồng độ ban đầu và tại thời điểm t.
k là hằng số tốc ộ phản ứng. 5.2. Phản ứng bậc 2 a. Công thức 1 b(a − x) ln= kt a − b a(b − x) 1 x)
Khi nồng độ 2 chất bằng nhau thì: ln = kt a a − x 1
Lúc này thời gian bán hủy: t1 2⁄ = ak
b. Năng lượng hoạt hóa (Ea) k2 Ea 1 1 ln = ( − ) k1 R T1 T2
Trong đó: R là hằng số khí lý tưởng. Tùy thuộc vào đơn vị các thông số khác mà chọn.
Thường ối với bài toán này R = 8,314 J/mol.K. c. Quy tắc Van’t Hoff: kT + 10
Hệ số nhiệt độ: 𝛾 = kT 6. Dung dịch 8 Thỏ Làm Toán 6.1. Công thức tính pH
- Axit yếu: pH = (pKa − logCa)
- Bazơ yếu: pOH = (pKb − logCb) → pH = 14 − pOH
- Muối của axit yếu, bazơ mạnh: pH = 7 + (pKa − logCa)
- Muối của axit mạnh, bazơ yếu: pH = 7 − (pKb − logCb)
- Muối của axit yếu, bazơ yếu: pH = 7 + (pKa − pKb)
- Dung dịch đệm của axit yếu với muối axit yếu: pH = pKa + log CCma
- Dung dịch đệm của bazơ yếu với muối bazơ yếu: pOH = pKb + log CCmb → pH = 14 − pOH
6.2. Công thức tính tích số tan và ộ tan AmBn ⇔ mAa+ + nBb−
− Tích số tan: TAmBn = [Aa+]m[Bb−]n
− Độ tan: s = a+b√TAmBn (mol L⁄ ) mn
7. Phản ứng oxi – hóa khử và dòng iện
7.1. Phản ứng oxi – hóa khử
Quá trình oxi hóa là quá trình nhường electron.
Quá trình khử là quá trình nhận electron.
Chất oxi hóa là chất nhận electron.
Chất khử là chất nhường electron. - E0 = E(+)0 − E(−)0
- Biến thiên Entanpi tự do: ∆G0 = −nFE0 - Phương trình Nernst: aA + bB → cC
+ dD - Sức điện động: 9 Thỏ Làm Toán RT [C]C[D]d E = E0 − nF log [A]a[B]b 0,0592 [C]C[D]d Ở 250C: E = E0 − n log [A]a[B]b
Trong đó: n là số e trao đổi giữa chất khử và chất oxi hóa.
F là hằng số Faraday, F = 96500 C/mol - Dòng iện: AIt m = nF 8. Cân bằng hóa học
8.1. Biến thiên Entanpi tự do ∆G0 = −RTlnKP
Trong ó: R thường bằng 8,314 J/mol.K.
8.2. Mối liên hệ giữa Kp và Kc KP = KC(RT)∆n Trong ó:
R thường bằng 0,082 L.atm/mol.K.
∆n là ∑ hệ số chất khí sau pứ − ∑ hệ số chất khí trước pứ
8.3. Hệ thức ẳng áp Van’t Hoff: k2 ∆H0 1 1 ln = ( − ) k1 R T1 T2 10 Thỏ Làm Toán




