

















Preview text:
ĐỒ ÁN XỬ LÝ KHÍ THẢI GVHD: ThS. VÕ THỊ THU NHƯ MỤC LỤC CHƯƠNG 1: TỔNG QUAN 4 1.1.
Giới thiệu:.................................................................................................4 1.2.
Tính chất:..................................................................................................4 1.3.
Tác hại:.....................................................................................................5 1.3.1. Đối với con người: 5 1.3.2. Đối với thực vật: 6 1.3.3.
Đối với các công trình kiến trúc: 6 1.4.
Ứng dụng:.................................................................................................7 1.5.
Ý nghĩa môi trường:..................................................................................8 1.6.
Các phương pháp hấp thụ SO2:.................................................................8 1.6.1. Hấp thụ SO bằng nước: 2 8
1.6.2.Hấp thụ bằng đá vôi (CaCO3), vôi nung CaO hoặc vôi sữa (Ca(OH)2): 9 1.6.3. Hấp thụ SO bằng NH 2 3: 11 1.6.4. Hấp thụ SO bằng MgO: 2 12 1.6.5. Hấp thụ SO bằng ZnO: 2 13 1.6.6.
Xử lý SO bằng các chất hấp thụ hữu cơ: 2 14 1.6.7.
Xử lý SO bằng natri cacbonat: 2 14 1.6.8.
Xử lý SO bằng các chất hấp phụ thể rắn: 2 15 1.7.
Các loại thiết bị hấp thụ:.........................................................................17 1.7.1. Tháp rỗng: 17 1.7.2. Tháp đệm: 18
XỬ LÝ KHÍ SO BẰNG NƯỚC 2 1
ĐỒ ÁN XỬ LÝ KHÍ THẢI GVHD: ThS. VÕ THỊ THU NHƯ 1.7.3. Tháp mâm: 20 1.7.4. Tháp màng: 22
CHƯƠNG 2: SƠ ĐỒ CÔNG NGHỆ 25 2.1.
Sơ đồ công nghệ.....................................................................................25 2.2.
Thuyết minh sơ đồ công nghệ:................................................................26
CHƯƠNG 3: TÍNH TOÁN THIẾT KẾ THÁP HẤP THỤ 27 3.1
Nồng độ của SO2:...................................................................................28 3.1.1
Nồng độ đầu vào của SO2 28 3.1.2
Nồng độ đầu ra của SO2 29 3.1.3 Hiệu suất hấp thụ 29 3.2
Lập phương trình đường cân bằng:.........................................................29 3.3
Lập phương trình đường làm việc:..........................................................30 3.4
Tính toán tháp hấp thụ:...........................................................................31 3.4.1
Đường kính tháp hấp thụ: 31 3.4.2 Chiều cao tháp hấp thụ: 33 3.5
Tính toán trở lực:....................................................................................38 3.5.1 Trở lực đệm khô: 38 3.5.2 Trở lực đệm ướt: 38
CHƯƠNG 4: TÍNH TOÁN CƠ KHÍ VÀ CÁC THIẾT BỊ PHỤ TRỢ 40 4.1.
Tính toán các thiết bị phụ trợ:.................................................................40 4.1.1. Ống dẫn khí vào tháp: 40 4.1.2. Ống dẫn khí ra tháp:40 4.1.3.
Ống dẫn dung môi vào tháp: 40
XỬ LÝ KHÍ SO BẰNG NƯỚC 2 2
ĐỒ ÁN XỬ LÝ KHÍ THẢI GVHD: ThS. VÕ THỊ THU NHƯ 4.1.4. Tính toán ống khói: 41 4.1.5. Vòi phun: 42 4.1.6. Bơm: 42 4.1.7. Quạt: 44 4.2.
Tính cơ khí thiết bị:................................................................................44 4.2.1 Tính thân thiết bị: 44 4.2.2
Tính chiều dài đáy và nắp thiết bị (dạng elip có gờ): 46 4.2.3 Mặt bích: 47 4.2.4 Chân đỡ và tai treo: 48
KẾT LUẬN VÀ KIẾN NGHỊ: 51 TÀI LIỆU THAM KHẢO 52
XỬ LÝ KHÍ SO BẰNG NƯỚC 2 3
ĐỒ ÁN XỬ LÝ KHÍ THẢI GVHD: ThS. VÕ THỊ THU NHƯ CHƯƠNG 1: TỔNG QUAN 1.1. Giới thiệu: Sunfua dioxit là một hợp
chất hóa học có công thức SO2. Chất khí
quan trọng này là sản phẩm chính của sự đốt cháy hợp chất lưu huỳnh và nó là một
mối lo môi trường đáng kể. SO thường 2
được mô tả là "mùi hôi của lưu huỳnh bị
đốt cháy". Nó là sản phẩm tạo thành
trong quá trình núi lửa hoạt động và một
số hoạt động công nghiệp khác nhau.
SO2 là loại chất ô nhiễm phổ biến nhất trong sản xuất công nghiệp
cũng như trong sinh hoạt của con người. Nguồn phát thải SO2 chủ yếu là từ Các
trung tâm nhiệt điện, các loại lò nung, lò hơi khi đốt nhiên liệu than, dầu và khí đốt
có chứa lưu huỳnh hoặc các hợp chất lưu huỳnh.
Ngoài ra, một số công đoạn sản xuất trong công nghiệp hóa chất,
luyện kim, cũng thải vào bầu khí quyển một lương SO2 đáng kể. Trên thế giới hàng
năm tiêu thụ gần 2 tỷ tấn than đá các loại và gần 1 tỷ tấn dầu mỏ. Khi thành phần
lưu huỳnh trong nhiên liệu trung bình chiếm 1% thì lượng khí SO 2 thải vào khí
quyển là 60 triệu tấn/năm. Đó là chưa kể lượng SO2 thải ra từ các ngành công nghiệp khác. 1.2. Tính chất:
SO2 là một khí vô cơ không màu, mùi kích thích mạnh, không cháy,
có vị hăng cay dễ hóa lỏng, dể hòa tan trong nước với nồng độ thấp. SO 0 0
2 có nhiệt độ nóng chảy ở –75 C và nhiệt độ sôi ở –10 C.
SO2 rất bền nhiệt (H0tt = - 296,9 kJ/mol).
SO2 oxy hóa chậm trong không khí sạch, do quá trình quang hoá hay
do sự xúc tác khí SO dễ dàng bị oxy hoá 2
biến thành SO trong khí quyển và hòa tan 3
trong nước tạo thành axit H2SO .4
XỬ LÝ KHÍ SO BẰNG NƯỚC 2 4
ĐỒ ÁN XỬ LÝ KHÍ THẢI GVHD: ThS. VÕ THỊ THU NHƯ
Nó có khả năng làm mất màu dung dịch Brom và làm mất màu cánh hoa hồng.
SO2 tan trong nước tạo thành axit yếu SO2 + H O 2 H 2SO3
SO2 là chất khử khi tác dụng một chất oxi hóa mạnh SO2 + Br + 2H 2 O 2 2HBr + H 2SO4 SO2 + 2KMnO + 2H 4
2O K2SO4 + 2MnSO4 + 2 H2SO4
SO2 là chất oxi hóa khi tác dụng với chất khử mạnh hơn SO2 + 2H S 2 3S + 2H 2O SO2 + 2Mg S + 2MgO
SO2 tác dụng với nước tạo thành H SO 2 3 nhưng H SO 2 3 là axit yếu SO2 + H O 2 H 2SO3 1.3. Tác hại:
Khí SO2, SO 3gọi chung là SOx, là những khí thuộc loại độc hại không chỉ
đối với sức khoẻ con người, động thực vật, mà còn tác động lên các vật liệu xây
dựng, các công trình kiến trúc, là một trong những chất gây ô nhiễm môi trường.
Trong khí quyển, khí SO2 khi gặp các chất oxy hóa hay dưới tác động của nhiệt độ,
ánh sáng chúng chuyển thành SO 3nhờ oxy có trong không khí. Khi gặp H2O, SO3
kết hợp với nước tạo thành H2SO4. Đây chính là nguyên nhân tạo ra các cơn mưa
acid mưa axit ăn mòn các công trình, làm cho thực vật, động vật bị chết hoặc chậm
phát triển, biến đất đai thành vùng hoang mạc . Khí SO2 gây ra các bệnh viêm phổi,
mắt, da. Nếu H2SO4 có trong nước mưa với nồng độ cao làm bỏng da người hay làm mục nát quần áo.
1.3.1. Đối với con người:
SO2 và hợp chất của SO 2là những chất có tính kích thích, ở nồng độ
nhất định có thể gây co giật cơ trơn của khí quản. Ở nồng độ lớn hơn sẽ gây tăng
tiết dịch niêm mạc đường khí quản. Khi tiếp xúc với mắt chúng có thể tạo thành axit.
XỬ LÝ KHÍ SO BẰNG NƯỚC 2 5
ĐỒ ÁN XỬ LÝ KHÍ THẢI GVHD: ThS. VÕ THỊ THU NHƯ
SOx có thể xâm nhập vào cơ thể con người qua các cơ quan hô hấp
hoặc các cơ quan tiêu hóa sau khi được hòa tan trong nước bọt. Và cuối cùng chúng
có thể xâm nhập vào hệ tuần hoàn. Khi tiếp xúc với bụi, SOx có thể tạo ra các hạt
axit nhỏ, các hạt này có thể xâm nhập vào các huyết mạch nếu kích thước của chúng nhỏ hơn 2-3 μm.
SO2 có thể xâm nhập vào cơ thể của người qua da và gây ra các
chuyển đổi hóa học, kết quả của nó là hàm lượng kiềm trong máu giảm, amoniac bị
thoát qua đường tiểu và có ảnh hưởng đến tuyến nước bọt. Hầu hết dân cư sống
quanh khu vực nhà máy có nồng độ SO2, SO3 cao đều mắc bệnh đường hô hấp. Nếu
hít phải SO ở nồng độ cao có thể gây tử vong. 2 Độc tính của SO : 2
Theo Henderson – Haggard Triệu chứng mg/m3 ppm
Chết nhanh trong 30’ – 1h 1.300 – 1.000 500 – 400
Nguy hiểm sau khi hít thở 30’ – 1h 260 – 130 100 – 50
Kích ứng đường hô hấp, ho 50 20 Giới hạn độc tính 30 – 20 12 – 8
Giới hạn ngửi thấy mùi 13 – 8 5 – 3
1.3.2. Đối với thực vật:
SOx bị oxy hóa ngoài không khí và phản ứng với nước mưa tạo thành axit
sulfuric là tác nhân chính gây hiện tượng mưa axit, ảnh hưởng xấu đến sự phát triển
thực vật. Khi tiếp xúc với môi trường có chứa hàm lượng SO từ 2 1 - 2ppm trong vài
giờ có thể gây tổn thương lá cây. Đối với các loại thực vật nhạy cảm như nấm, địa
y, hàm lượng 0,15 - 0,30 ppm có thể gây độc tính cấp.
1.3.3. Đối với các công trình kiến trúc: Sự có mặt của SO trong x
không khí ẩm tạo thành axit là tác nhân gây ăn mòn
kim loại, bê-tông và các công trình kiến trúc. SOx làm hư hỏng, làm thay đổi tính
năng vật lý, làm thay đổi màu sắc vật liệu xây dựng như đá vôi, đá hoa, đá cẩm
thạch; phá hoại các tác phẩm điêu khắc, tượng đài. Sắt, thép và các kim loại khác ở
XỬ LÝ KHÍ SO BẰNG NƯỚC 2 6
ĐỒ ÁN XỬ LÝ KHÍ THẢI GVHD: ThS. VÕ THỊ THU NHƯ
trong môi trường khí ẩm, nóng và bị nhiễm SO xthì bị han gỉ rất nhanh. SOx cũng
làm hư hỏng và giảm tuổi thọ các sản phẩm vải, nylon, tơ nhân tạo, đồ bằng da và giấy... 1.4. Ứng dụng: Sản xuất axit sunfuric Làm chất bảo quản: - Khí SO được 2
sử dụng làm chất bảo quản cho hoa quả khô, do đặc
tính kháng khuẩn của nó . Nó duy trì sự tươi sông và ngăn ngừa mục nát, tuy nhiên
sử dụng chất bảo quản này cũng làm cho các loại hoa quả có hương vị khác. -
Khí SO 2được sử dụng trong nghành công nghiệp chế biến rượu
vang. Tuy tỷ lệ rất ít, đóng vai trò như một chất kháng khuẩn và chống oxy hóa.
Tùy từng quốc gia, có thể cho phép nồng độ SO2 trong rượu ở một mức độ nhất
định. Ở Mỹ là 350 ppm, EU là 160 ppm và 210 ppm đối với rượu vang đỏ và trắng,
hồng. Ở nồng độ thấp dưới 50 ppm SO 2 không ảnh hưởng đén mùi vị của rượu,
nhưng nếu nồng độ cao hơn, nó cũng tạo ra một hương vị khác. -
SO2 còn được dùng trong quá trình vệ sinh thiết bị trong các nhà máy sản xuất rượu . - Chống nấm mốc.
Làm tác nhân khử: Điôxít lưu huỳnh cũng là một chất khử Trong
nước, sulfur dioxide có thể làm phai màu. Cho nên nó thường được sử dụng để làm
chất tẩy quần áo, tẩy trắng giấy, bột giấy. Ngoài ra, nó còn được sử dụng để xử lý nước thải.
Làm thuốc thử và dung môi trong các phòng thí nghiệm: Lưu huỳnh
dioxit là một dung môi trơ đa năng đã được sử dụng rộng rãi cho các muối hòa tan
oxy hóa cao. Nó cũng đôi khi được sử dụng như là một nguồn của nhóm sulfonyl trong tổng hợp hữu cơ.
XỬ LÝ KHÍ SO BẰNG NƯỚC 2 7
ĐỒ ÁN XỬ LÝ KHÍ THẢI GVHD: ThS. VÕ THỊ THU NHƯ
1.5. Ý nghĩa môi trường:
Vấn đề ô nhiễm bầu khí quyển bởi khí SO2 từ lâu đã trở thành mối
hiểm họa của nhiều quốc gia, nhất là các nước phát triển trên thế giới. Vì những lý
do nêu trên, công nghệ xử lý khí SO2 trong khí thải công nghiệp đã được nghiên cứu
rất sớm và phát triển mạnh mẽ.
Ngoài tác dụng làm sạch bầu khí quyển, bảo vệ môi trường, xử lý khí
SO2 còn có ý nghĩa kinh tế to lớn của nó bởi vì SO2 thu hồi được từ khí thải là
nguồn cung cấp nguyên liệu cho các nhà máy sản xuất axit Sunfuric (H2SO ) 4 và lưu huỳnh nguyên chất.
1.6. Các phương pháp hấp thụ SO : 2
1.6.1. Hấp thụ SO bằng nước: 2
Hấp thụ SO2 bằng nước là phương pháp đơn giản được áp dụng sớm
nhất để loại bỏ khí SO trong khí thải. 2
Sơ đồ hệ thống xử lý SO2 băng nước bao gồm 2 giai đoạn: •
Hấp thụ SO2 bằng cách phun nước vào dòng khí thải hoặc cho khí
thải đi qua lớp vật liệu đệm (vật liệu rỗng ) có tưới nước – scrubo; •
Giải thoát khí SO2 ra khỏi chất hấp thụ để thu hồi SO2 nếu cần và nước sạch.
Quá trình diễn ra theo phản ứng sau: SO + 3- 2 + H O ↔ H 2 + HSO
Mức độ hòa tan của khí SO2 trong nước giảm khi nhiệt độ nước tăng
cao, do đó nhiệt độ nước cấp vào hệ thống hấp thụ khí SO 2phải đủ thấp. Còn để
giải thoát khí SO2 khỏi nước thì nhiệt độ của nước phải cao. Cụ thể là ở nhiệt độ
1000C thì SO2 bốc ra một cách hoàn toàn và trong không khí thoát ra có lẫn cả hơi
nước. Bằng phương pháp ngưng tụ người ta có thể thu được SO2 với độ đậm đặc
khoảng 100% để dùng vào mục đích sản xuất axit sunfuric.
Để giải hấp cần thụ cần phải đun nóng một lượng nước rất lớn tức
phải có một nguồn cấp nhiệt (hơi nước) công suất lớn. Đó là một khó khăn. Ngoài
ra để sử dụng lại nước cho quá trình hấp thụ phải làm nguội nước xuống gần 100C –
XỬ LÝ KHÍ SO BẰNG NƯỚC 2 8
ĐỒ ÁN XỬ LÝ KHÍ THẢI GVHD: ThS. VÕ THỊ THU NHƯ
tức phải cần đến nguồn cấp lạnh. Đó cũng là vấn đề không đơn giản và khá tốn kém.
Từ những nhược điểm nói trên, phương pháp khí SO 2bằng nước chỉ áp dụng được khi:
- Nồng độ ban đầu của khí SO trong khí thải tương đối cao. 2
- Có sẵn nguồn cấp nhiệt (hơi nước) với giá rẻ.
- Có sẵn nguồn cấp lạnh.
- Có thể xả được nước có ít nhiều axit ra sông ngòi.
Trường hợp khí thải giàu SO 2như trong công đoạn nấu quặng sunfua
kim loại của công nghiệp luyện kim (nồng độ SO2 trong
khí thải có thể đạt 2 ÷
12%). Người ta có thể xử lý bằng nước kết hợp vơi quá trình oxy hóa SO bằng chất 2 xúc tác vanadi (V).
Quá trình cũng được thực hiện thành hai giai đoạn: •
Khí SO2 kết hợp với oxy nhờ sự có mặt của chất xúc tác vanadi để
biến thành anhidrit sunfuric (SO ), phản ứng này có tỏa nhiệt và xảy 3 ra càng mạnh ở
nhiệt độ càng thấp, do đó cần thực hiện quá trình này qua nhiều tầng xúc tác, sau
mỗi tầng đều được làm nguội. •
Dùng nước tưới trong scruber để anhidrit sunfuric kết hợp với
nước tạo thành axit sunfuric (H2SO ). 4
1.6.2. Hấp thụ bằng đá vôi (CaCO3), vôi nung CaO hoặc vôi sữa (Ca(OH) ): 2
Xử lý SO 2bằng vôi là phương pháp được áp dụng rất rộng rãi trong
công nghiệp vì hiệu quả xử lý cao, nguyên liệu rẻ tiền và có sẵn ở mọi nơi.
Các phản ứng hóa học xảy ra trong quá trình xử lý như sau: CaCO3 + SO2 CaCO 3 + CO2 CaO + SO2 CaSO 3 2CaSO3 + O2 2CaSO 4
XỬ LÝ KHÍ SO BẰNG NƯỚC 2 9
ĐỒ ÁN XỬ LÝ KHÍ THẢI GVHD: ThS. VÕ THỊ THU NHƯ
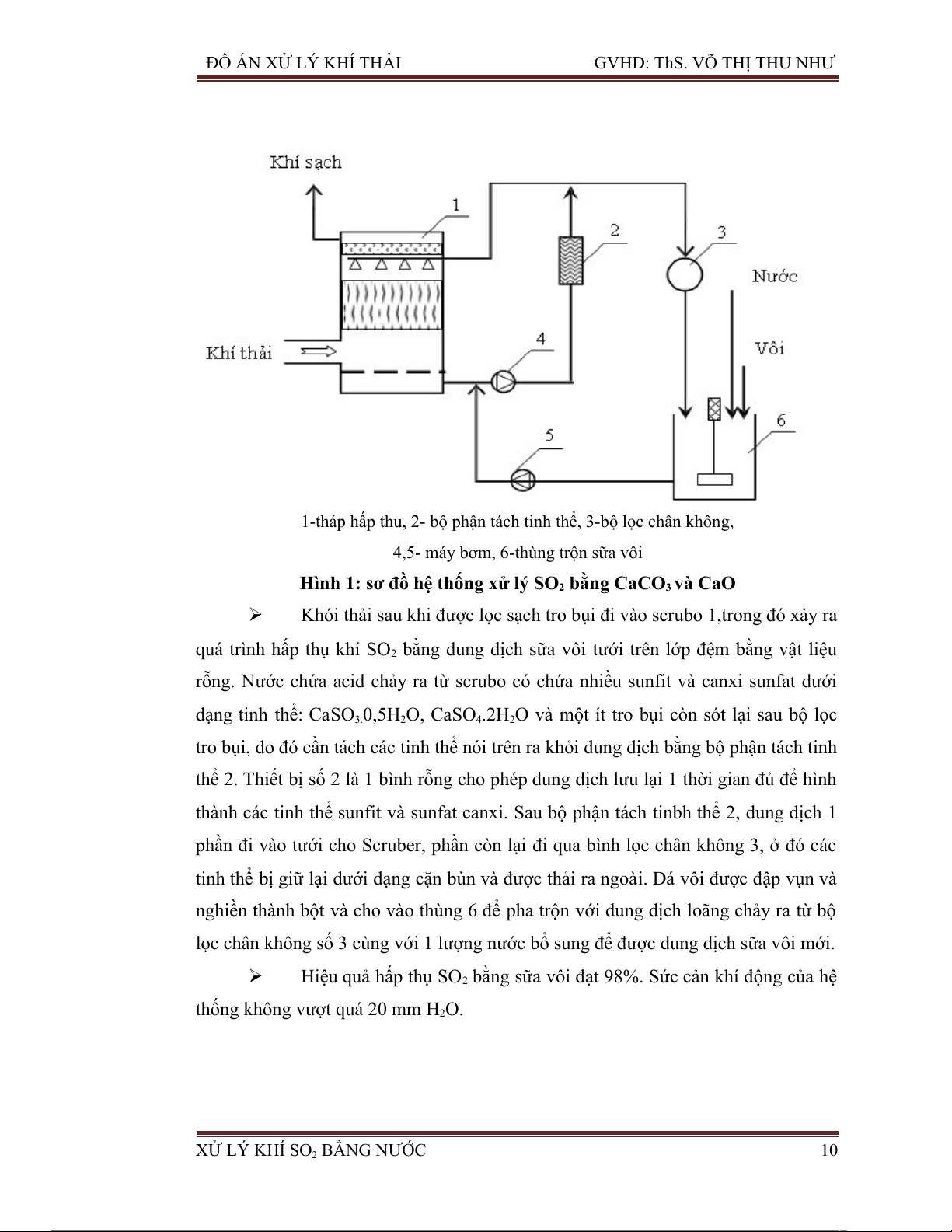
1-tháp hấp thu, 2- bộ phận tách tinh thể, 3-bộ lọc chân không,
4,5- máy bơm, 6-thùng trộn sữa vôi
Hình 1: sơ đồ hệ thống xử lý SO2 bằng CaCO3 và CaO
Khói thải sau khi được lọc sạch tro bụi đi vào scrubo 1,trong đó xảy ra
quá trình hấp thụ khí SO2 bằng dung dịch sữa vôi tưới trên lớp đệm bằng vật liệu
rỗng. Nước chứa acid chảy ra từ scrubo có chứa nhiều sunfit và canxi sunfat dưới
dạng tinh thể: CaSO3.0,5H2O, CaSO4.2H O 2
và một ít tro bụi còn sót lại sau bộ lọc
tro bụi, do đó cần tách các tinh thể nói trên ra khỏi dung dịch bằng bộ phận tách tinh
thể 2. Thiết bị số 2 là 1 bình rỗng cho phép dung dịch lưu lại 1 thời gian đủ để hình
thành các tinh thể sunfit và sunfat canxi. Sau bộ phận tách tinbh thể 2, dung dịch 1
phần đi vào tưới cho Scruber, phần còn lại đi qua bình lọc chân không 3, ở đó các
tinh thể bị giữ lại dưới dạng cặn bùn và được thải ra ngoài. Đá vôi được đập vụn và
nghiền thành bột và cho vào thùng 6 để pha trộn với dung dịch loãng chảy ra từ bộ
lọc chân không số 3 cùng với 1 lượng nước bổ sung để được dung dịch sữa vôi mới.
Hiệu quả hấp thụ SO bằng 2
sữa vôi đạt 98%. Sức cản khí động của hệ
thống không vượt quá 20 mm H2O.
XỬ LÝ KHÍ SO BẰNG NƯỚC 2 10
ĐỒ ÁN XỬ LÝ KHÍ THẢI GVHD: ThS. VÕ THỊ THU NHƯ
Nguyên liệu vôi được sử dụng một cách hoàn toàn, cụ thể là cặn bùn
từ hệ thống xử lý thải ra có thể được sử dụng làm chất kết dính trong xây dựng sau
khi chuyển sunfit thành sunfat trong lò nung.
Ưu điểm: công nghệ đơn giản, chi phí đầu tư ban đầu không lớn, có thể chế
tạo thiết bị bằng vật liệu thông thường, không cần đến vật liệu chống axit và không
chiếm nhiều diện tích xây dựng.
1.6.3. Hấp thụ SO bằng NH 2 3:
Amoniac và khí SO2 trong dung dịch nước có phản ứng với nhau và
tạo ra muối trung gian amoni sunfit, sau đó muối amoni sunfit lại tác dụng tiếp với
SO2 và H2O để tạo ra muối amoni bisunfit theo phản ứng sau: SO2 + 2NH3 + H2O = (NH4)2SO3 (NH4) SO 2 3 + SO + H 2 O = 2NH 2 4HSO3
Lượng bisunfit tích tụ dần trong dung dịch có thể hoàn nguyên bằng
cách nung nóng trong chân không, kết quả thu được amoni sunfit và SO2. Amoni
sunfit này lại có thể sử dụng tiếp để khử SO2 nung nóng
2NH4HSO3 (NH4)2SO3 + SO2↑ + H2O
Ngoài ra trong dung dịch còn có thể xảy ra sự phân hủy sunfit và
bisunfit amoni thành sunfat amoni và lưu huỳnh đơn chất theo phản ứng sau:
2NH4HSO3+ (NH4)2SO3 = 2(NH4)2SO4 + S + H O 2
Lưu huỳnh đơn chất hình thành theo phản ứng trên đến lượt của mình
lại tác dụng với amoni sunfit và tạo ra thiosunfat: (NH4) SO 2 3 + S = (NH4)2S2O3
Sau đó thiosunfat lại kết hợp với amoni bisunfit và tạo ra lưu huỳnh
đơn chất nhiều gấp 2 lần: (NH4)2S2O3+ 2NH HSO 4 3 = 2(NH4)2SO4 + 2S + H O 2
XỬ LÝ KHÍ SO BẰNG NƯỚC 2 11
ĐỒ ÁN XỬ LÝ KHÍ THẢI GVHD: ThS. VÕ THỊ THU NHƯ
Lưu huỳnh đơn chất lại tác dụng với sunfit. Cứ như vậy tốc độ phản
ứng phân hủy dung dịch làm việc tăng dần và dung dịch làm việc sẽ hoàn toàn biến
thành amoni sunfat và lưu huỳnh đơn chất.
Có các phương pháp xử lý sau: -
Hệ thống xử lý SO2 bằng NH theo chu trình. 3 -
Hệ thống xử lý SO2 bằng NH3 có chưng áp. -
Hệ thống xử lý SO2 bằng NH3 và vôi.
1.6.4. Hấp thụ SO bằng MgO: 2
Về khả năng sử dụng sữa MgO để khử SO2 khói thải đã được biết từ
lâu, nhưng nghiên cứu ứng dụng trong công nhgiệp mới được thực hiện gần đây chủ
yếu là do các nhà khoa học – công nghệ của Liên Xô cũ.
SO2 được hấp thụ bởi oxit –hydroxit magiê, tạo thành tinh thể ngậm
nước sunfit magiê. Trong thiết bị hấp thụ xảy ra các phản ứng sau: MgO + SO2 = MgSO3 MgO + H2O = Mg(OH)2 MgSO3 + H O + SO 2 = Mg(HSO 2 3)2
Mg(OH)2 + Mg( HSO3)2 = 2MgSO3 + 2H O 2
Độ hòa tan của sunfit magiê trong nước bị giới hạn, nên lượng dư ở dạng MgSO3.6H O và MgSO 2
3.3H O rơi xuống thành cặn lắng. 2
Tỉ lệ rắn: lỏng trong huyền phù là 1:10.
Độ pH ở đầu vào là 6,8 – 7,5; còn ở đầu ra là 5,5 – 6,0.
Sunfat magiê được hình thành do oxit hóa sunfit magiê. MgSO3 + O2 MgSO 4
Tái sinh oxit magie trong lò nung: Than cốc MgSO3 MgO + S 0 O2 t0=900 C
SO2 thoát ra là 7-15% được làm nguội, tách bụi và sương mù axit
sunfuric dùng để sản xuất axit sunfuric.
XỬ LÝ KHÍ SO BẰNG NƯỚC 2 12
ĐỒ ÁN XỬ LÝ KHÍ THẢI GVHD: ThS. VÕ THỊ THU NHƯ
Có các phương pháp hấp thụ sau: -
Phương pháp magie oxit “kết tinh” theo chu trình. -
Phương pháp magie oxit “không kết tinh”. -
Phương pháp magie oxit “sủi bọt”. -
Phương pháp magie oxit kết hợp với Potas (kali cacbonat). Ưu điểm: -
Có thể làm sạch khí nóng mà không cần làm lạnh sơ bộ. - Thu được axit sunfuric. - Hiệu quả làm sạch cao. Nhược điểm: -
Quy trình công nghệ phức tạp. -
Không phân giải hoàn toàn sulfat khi nung. - Tổn hao MgO khá nhiều.
1.6.5. Hấp thụ SO bằng ZnO: 2
Xử lí khí SO 2bằng kẽm oxit (ZnO) cũng tương tự như phương pháp
oxit magiê tức là dùng phản ứng giữa SO 2với kẽm oxit để thu các muối sunfit và
bisunfit, sau đó dùng nhiệt để phân ly thành SO2 và ZnO.
Trong phương pháp này, chất hấp thụ là kẽm oxit. Phản ứng hấp thụ như sau:
SO2 + ZnO + 2,5H2O ZnSO3.2,5H2O Khi nồng độ SO lớn: 2 2SO2 + ZnO + H2O Zn(HSO 3)2
Sunfit kẽm tạo thành không tan trong nước được tách ra bằng xyclone
ướt và sấy khô.Tái sinh ZnO bằng cách nung sunfit ở 350oC. ZnSO3.2,5H2O SO 2 + ZnO + 2,5H2O
SO2 được chế biến tiếp tục, còn ZnO quay lại hấp thụ.
Có các phương pháp hấp thụ sau: -
Phương pháp kẽm oxit đơn thuần. -
Phương pháp kẽm oxit kết hợp với natri sunfit.
XỬ LÝ KHÍ SO BẰNG NƯỚC 2 13
ĐỒ ÁN XỬ LÝ KHÍ THẢI GVHD: ThS. VÕ THỊ THU NHƯ Ưu điểm: -
Quá trình phân ly kẽm sunfit ZnSO3 thành SO2 và ZnO xảy ra ở
nhiệt độ thấp hơn đáng kể so với quá trình phân ly bằng nhiệt đối với MgSO .3 -
Có khả năng xử kí khí ở nhiệt độ cao (200 – 250oC). Nhược điểm:
Có khả năng hình thành sunfit kẽm (MgSO )
4 làm cho việc tái sinh ZnO bất
lợi về kinh tế nên phải tách chúng ra và bổ sung ZnO.
1.6.6. Xử lý SO2 bằng các chất hấp thụ hữu cơ:
Xử lí khí SO2 trong khí thải bằng các chất hấp thụ hữu cơ được áp
dụng nhiều trong công nghiệp luyện kim màu. Chất hấp thụ khí SO 2được sử dụng
phổ biến là các amin thơm như anilin C6H5NH2, toluđin CH3C6H4NH ,2 xyliđin (CH3)2C6H NH 3 2, và đimety-anilin C6H N(CH 5 3)2.
Quá trình xử lí theo phương pháp trên là: -
Quá trình sunfidin: Quá trình này được các hãng công nghiệp hóa
chất và luyện kim của Đức nghiên cứu và áp dụng ở nhà máy luyện kim Hamburg
để khử SO 2trong khói thải của lò thổi luyện đồng. Nồng độ của khí trong khói thải
dao động trong phạm vi 0,5 ÷ 8%, trung bình là 3,6%.Chất hấp thụ là hỗn hợp
xylidin và nước tỉ lệ ≈ 1:1. -
Quá trình khử SO 2bằng dimetylanilin – Quá trình ASARCO: quá
trình này được nghiên cứu và áp dụng ở nhiều các nhà máy luyện kim.
1.6.7. Xử lý SO2 bằng natri cacbonat: Nguyên tắc: Na2CO3 + SO2 Na 2SO3 + CO2 Na2SO3 + SO + H 2 O 2 2NaHSO 3
Cho ZnO vào dung dịch tạo thành NaHCO3 + ZnO ZnSO3 + NaOH Nung ZnSO để thu khí SO 3 2 và ZnO dùng lại
XỬ LÝ KHÍ SO BẰNG NƯỚC 2 14
ĐỒ ÁN XỬ LÝ KHÍ THẢI GVHD: ThS. VÕ THỊ THU NHƯ Ưu điểm: -
Dùng chất hấp thụ có hoạt độ hấp thụ mạnh. -
Dùng được cho các khí với nồng độ SO2 bất kỳ. Nhược điểm: -
Giá thành cao nên chỉ chỉ thích hợp cho hệ thống nhỏ.
1.6.8. Xử lý SO2 bằng các chất hấp phụ thể rắn:
1.6.8.1. Hấp phụ khí SO bằng than hoạt tính: 2
Khói thải đi vào tháp hấp thụ gồm nhiều tầng, khí SO 2được giữ lại
trong lớp than hoạt tính của các tầng hấp thụ, sau đó khói đi qua cyclone để lọc sạch
tro bụi trước khi thải ra khí quyển.
Than hoạt tính được hoàn nguyên bằng cách nâng nhiệt độ lên 400-
450oC. Khí SO 2 thoát ra từ quá trình hoàn nguyên có nồng độ 40-50% và đạt
khoảng 96-97% lượng khí SO có trong khói thải. 2
Sau khi hoàn nguyên than hoạt tính được sàn chọn lại để loại bỏ phần
than quá vụn nát và bổ sung thêm than mới để đưa lên hấp phụ trở lại.
Khí thoát ra từ quá trình hoàn nguyên ngoài SO 2còn có một số loại
khí khác như: H2S là 2-4%, lưu huỳnh là 0,1-0,3%.
1.6.8.2. Hấp phụ khí SO2 bằng than hoạt tính có tưới nước – quá trình LURGI:
Theo phương pháp này khí thải được làm cho bão hòa hơi nước ở
nhiệt độ dưới 100oC đi qua lớp than hoạt tính có tưới nước làm ẩm trong thiết bị hấp
phụ. Khí SO 2bị giữ lại trong lớp than hoạt tính và oxy hóa thành SO3 nhờ có oxy
trong khí thải. Tiếp theo, SO 3kết hợp với nước biến thành axit sunfuric H2SO 4và
theo nước chảy vào thùng chứa. Axit sunfuric thu được trong thùng chứa với nồng độ 20-25%.
Hệ thống thử nghiệm ban đầu với lưu lượng khỏi thải 1000-1500
m3/h. Nồng độ ban đầu của SO2 trong khói khi đốt nhiên liêu mazut là 0,1-0,15%.
Hiệu quả khử SO2 đạt 98-99%. Chất hấp phụ làm việc trong hơn 3 năm liên tục mà
hoạt tính của nó không hề bị giảm sút.
XỬ LÝ KHÍ SO BẰNG NƯỚC 2 15
ĐỒ ÁN XỬ LÝ KHÍ THẢI GVHD: ThS. VÕ THỊ THU NHƯ
1.6.8.3. Xử lý SO2 bằng nhôm oxit kiềm hóa:
Quá trình xử lý khí SO2 bằng nhôm oxit kiềm hóa được dựa trên tính chất
hấp phụ của hỗn hợp nhôm oxit (Al2O3) và natri oxit (Na2O)với thành phần natri
oxit chiếm 20% khối lượng hỗn hợp. Trong quá trình hấp phụ, khí SO2 bị oxy hóa,
sau đó tác dụng với các oxit kim loại để biến thành sunfat. Chất hấp phụ đã bão hòa
được hoàn nguyên bằng khí trơ ở nhiệt độ 600-650oC.
1.6.8.4. Xử lý SO2 bằng Mangan oxit:
Có 2 phương pháp tiêu biểu của quá trình xử lý SO 2 bằng Mangan
oxit là “quá trình Mangan” được nghiên cứu áp dụng ở Mỹ và “quá trình DAR
Mangan” do hãng Mitsubishi của Nhật Bản đề xuất.
Trong quá trình Mangan của Mỹ, chất hấp phụ được sử dụng là
Mangan oxit (Mn2O3) dạng hạt được làm khô trong không khí và trong chân không ở nhiệt độ 300-400oC.
Quá trình DAR-Mangan của hãng Mitsubishi sử dụng chất hấp phụ là
hỗn hợp của một số oxit được gọi là oxit Mangan hoạt tính. Chất hấp phụ thu được
bằng cách dùng amoniac để xử lý Mangan sunfat và tiếp theo là oxy hóa hydrat
bằng oxy trong không khí và hơi nước: MnSO4 + 2NH OH 4 Mn(OH) 2 + (NH4)2SO4
Mn(OH)2 + 0,5iO2 + n(n-1)H2O MnO1+i.nH O 2
Trong đó: i = 0,5-0,8 và n = 0,1-1,0
1.6.8.5. Xử lý SO2 bằng vôi và dolomit trộn vào than nghiền
Quá trình đốt nhiên liệu than nghiền có trộng bột vôi và dolomit để
khử khí SO 2 mới được áp dụng trong những năm gần đây và hiện nay vẫn đang
được tiếp tục nghiên cứu hoàn thiện.
Phản ứng giữa vôi (CaO) và dolomit (CaCO3.MgCO ) 3 với SO 2 xảy ra như sau: 2CaO + 2 SO +O 2 2 2CaSO4 2CaCO3.MgCO3 + 2SO + O 2 2 2[CaSO4 + MgO] + 4CO2
XỬ LÝ KHÍ SO BẰNG NƯỚC 2 16
ĐỒ ÁN XỬ LÝ KHÍ THẢI GVHD: ThS. VÕ THỊ THU NHƯ
Phản ứng giữa vôi và SO o
2 xảy ra mạnh nhất ở nhiệt độ 760-1040 C,
còn phản ứng giữa dolomit và SO o
2 ở nhiệt độ 600-1200 C.
Phương pháp này là sự kết hợp giữa quá trình cháy với quá trình khử
khí SO2 thành 1 quá trình thống nhất trong buồng đốt của lò mà không đòi hỏi phải
lắp đặt thêm nhiều thiết bị phụ trợ khác.
Trong một số trường hợp khác, người ta còn dùng vôi dưới dạng vữa
(30% chất rắn trong nước theo khối lượng) và phun vào dòng khói thải trong thiết bị
gọi là buồng sấy khô kiểu phun đặt trên đường khói của lò. Khí SO2 trong khói thải
kết hợp với Ca(OH)2 theo phản ứng: SO2 + Ca(OH)2 CaSO + H 3 O 2
CaSO3 bị oxy hóa rất nhanh bằng oxy có mặt trong khói thải và tạo thành CaSO : 4 CaSO3 + ½ O2 CaSO4
Cả canxi sunfit và canxi sunfat đều rất ít hòa tan trong nước. Khi các
giọt vữa được làm khô bằng nhiệt của khói thải, chúng sẽ trở thành những hạt rắn có
nhiều lỗ rỗng và được tách Ra khỏi khói thải trong thiết bị lọc bụi. Người ta gọi đó
là phương pháp rửa khí ướt-khô hỗn hợp bằng đá vôi.
1.7. Các loại thiết bị hấp thụ: 1.7.1. Tháp rỗng:
Là tháp có cơ cấu phun chất
lỏng bằng cơ học hay bằng áp suất
trong đó chất lỏng được phun thành
những giọt nhỏ trong thể tích rỗng
của thiết bị và cho dòng khí đi qua.
Tháp phun đươc sử dụng khi yêu
cầu trở lực bé và khí có chứa hạt rắn.
XỬ LÝ KHÍ SO BẰNG NƯỚC 2 17
ĐỒ ÁN XỬ LÝ KHÍ THẢI GVHD: ThS. VÕ THỊ THU NHƯ 1.7.2. Tháp đệm:
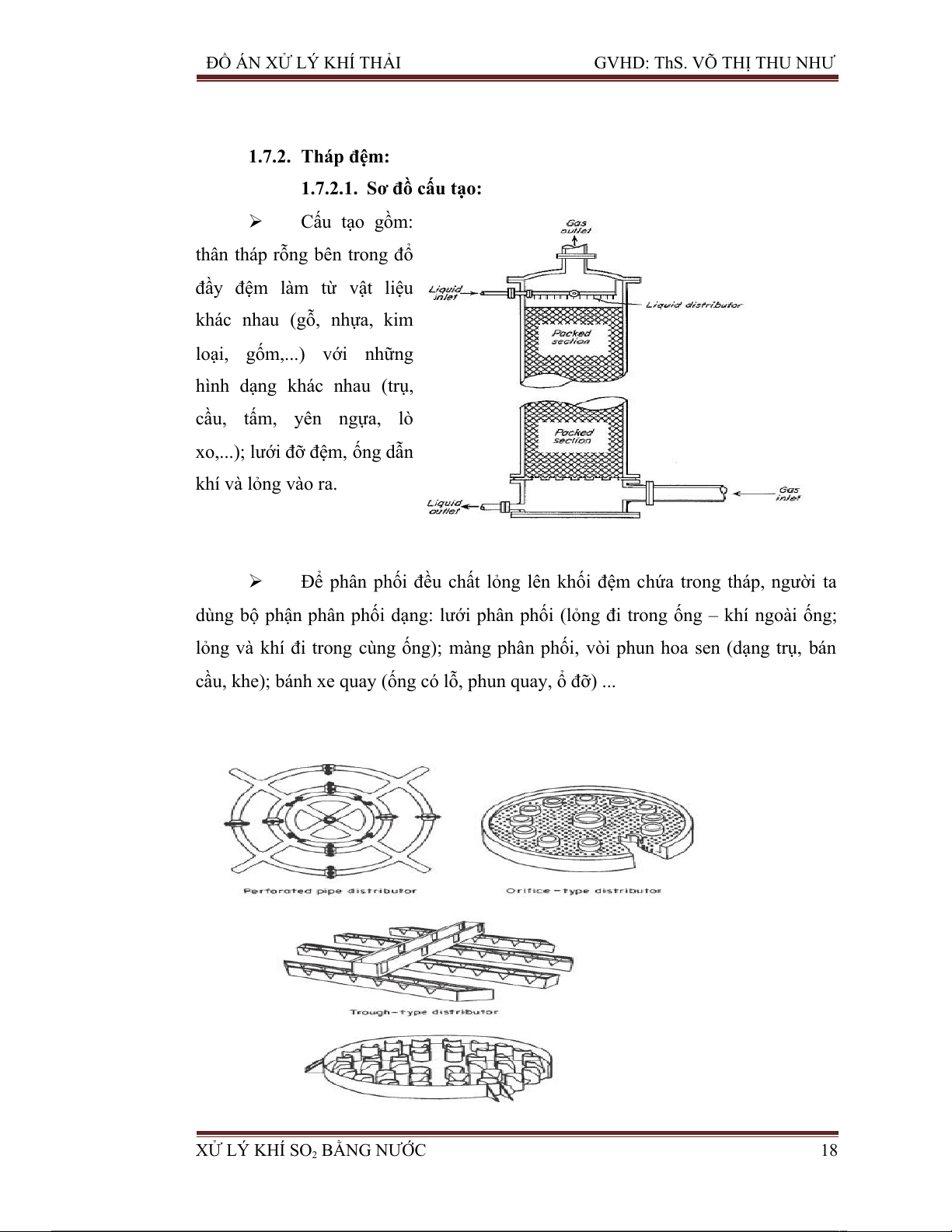
1.7.2.1. Sơ đồ cấu tạo: Cấu tạo gồm:
thân tháp rỗng bên trong đổ
đầy đệm làm từ vật liệu khác nhau (gỗ, nhựa, kim
loại, gốm,...) với những
hình dạng khác nhau (trụ, cầu, tấm, yên ngựa, lò
xo,...); lưới đỡ đệm, ống dẫn khí và lỏng vào ra.
Để phân phối đều chất lỏng lên khối đệm chứa trong tháp, người ta
dùng bộ phận phân phối dạng: lưới phân phối (lỏng đi trong ống – khí ngoài ống;
lỏng và khí đi trong cùng ống); màng phân phối, vòi phun hoa sen (dạng trụ, bán
cầu, khe); bánh xe quay (ống có lỗ, phun quay, ổ đỡ) ...
XỬ LÝ KHÍ SO BẰNG NƯỚC 2 18
ĐỒ ÁN XỬ LÝ KHÍ THẢI GVHD: ThS. VÕ THỊ THU NHƯ
Các phần tử đệm được đặc trưng bằng: đường kính d, chiều cao h, bề
dày δ. Đối với đệm trụ, h = d chứa được nhiều phần tử nhất trong 1 đơn vị thể tích.
Khối đệm được đặc trưng bằng các kích thước: bề mặt riêng a
(m2/m3); thể tích tự do ε (m3/m3); đường kính tương đương d (tđ) = 4r(thủy lực) =
4.S/n = 4 ε/a; tiết diện tự do S (m2/m3) .
Khi chọn đệm cần lưu ý: thấm ướt tốt chất lỏng; trở lực nhỏ, thể tích
tự do và và tiết diện ngang lớn; có thể làm việc với tải trọng lớn của lỏng và khí khi
ε và S lớn; khối lượng riêng nhỏ; phân phối đều lỏng; có tính chịu ăn mòn cao, rẻ
tiền, dễ kiếm... Để làm việc với chất lỏng bẩn nên chọn đệm cầu có khối lượng riêng nhỏ.
1.7.2.2. Nguyên lý hoạt động:
Chất lỏng chảy trong tháp theo đệm dưới dạng màng nên bề mặt tiếp
xúc pha là bề mặt thấm ướt của đệm.
Tháp đệm làm việc ngược chiều có các chế độ thủy động lực sau: •
Chế độ màng OA: khi mật độ tưới không lớn, tốc độ khí nhỏ, chất
lỏng chảy thành màng theo bề mặt đệm, khí đi ở khe giữa các màng. •
Chế độ hãm AB: từ A tăng tốc độ khí sẽ làm tăng ma sát của
dòngkhí với bề mặt lỏng và kìm hãm sự chảy của màng lỏng, lượng lỏng giữ lại trong đệm tăng. •
Khi tăng tốc độ khí làm tăng xoáy đảo màng lỏng trên đệm nên
tăng cường quá trình truyền khối. •
Chế độ nhũ tương BC: Khí-lỏng tạo thành hệ nhũ tương không bền
2 pha liên tục-gián đoạn của khí-lỏng đổi vai trò cho nhau liên tục, làm tăng bề mặt
tiếp xúc pha và cường độ truyền khối lên cực đại, đồng thời trở lực thủy lực cũng
tăng nhanh; chế độ này duy trì rất khó mặc dù cường độ truyền khối lớn. •
Chế độ cuốn theo: quá giới hạn sặc, nếu tăng tốc độ khí, toàn bộ
chất lỏng sẽ bị giữ lại trong tháp và cuốn ngược trở ra theo dòng khí.
XỬ LÝ KHÍ SO BẰNG NƯỚC 2 19
ĐỒ ÁN XỬ LÝ KHÍ THẢI GVHD: ThS. VÕ THỊ THU NHƯ
Hiệu ứng thành thiết bị (channeling effect): Chất lỏng có xu hướng
chảy từ tâm ra thành thiết bị, gây giảm hiệu suất do tiếp xúc pha kém. Khắc phục bằng cách: •
Nếu chiều cao đệm lớn hơn 5 lần đường kính đệm thì chia đệm
thành từng đoạn; giữa các đoạn đệm đặt bộ phận phân phối lại chất lỏng. •
Chọn d/Φ = đường kính đệm/đường kính tháp = 1/15 – 1/8. •
Xếp đệm: nếu d < 50mm: đổ lộn xộn, d > 50mm: xếp thứ tự. •
Tưới lỏng và phun khí ngay từ đầu.
1.7.2.3. Ưu – nhược điểm - ứng dụng:
Ưu điểm: cấu tạo đơn giản; trở lực theo pha khí (hoạt động ở chế độ màng/quá độ) nhỏ.
Nhược điểm: hoạt động kém ổn định, hiệu suất thấp; dễ bị sặc; khó
tách nhiệt, khó thấm ướt. Ứng dụng: •
Dùng trong các trường hợp năng suất thấp: tháp hấp thụ khí, tháp chưng cất,... •
Dùng trong các hệ thống trở lực nhỏ (như hệ thống hút chân không,...) 1.7.3. Tháp mâm:
1.7.3.1. Sơ đồ cấu tạo:
Tháp đĩa thường cấu tạo gồm thân
hình trụ thẳng đứng, bên trong có đặt các tấm
ngăn (đĩa) cách nhau một khoảng nhất định. Trên
mỗi đĩa hai pha chuyển động ngược hoặc chéo
chiều:lỏng từ trên xuống (hoặc đi ngang), khí đi
từ dưới lên hoặc xuyên qua chất lỏng chảy ngang;
ở đây tiếp xúc pha xảy ra theo từng bậc là đĩa.Tùy
thuộc cấu tạo của đĩa chất lỏng trên đĩa có thể là
khuấy lý tưởng hay là dòng chảy qua.
XỬ LÝ KHÍ SO BẰNG NƯỚC 2 20




