












Preview text:
lOMoAR cPSD| 45734214 Chương III KỸ THUẬT PH´N T˝CH THỂ T˝CH (PHƯƠNG PH`P CHUẨN ĐỘ) Ts. Pham Tran Nguyen Nguyen ptnnguyen@hcmus.edu.vn
KỶ THUẬT PH´N T˝CH THỂ T˝CH
(PHƯƠNG PH`P CHUẨN ĐỘ) III.1 Một số khÆi niệm
III.2 Đường cong chuẩn ộ
III.3 Chất chỉ thị trong phương phÆp ph n t ch (PPPT) thể t ch
III.4 CÆc cÆch chuẩn ộ th ng dụng
4.1. Chuẩn ộ trực tiếp 4.2. Chuẩn ộ ngược 4.3. Chuẩn ộ thế 4.4. Chuẩn ộ giÆn tiếp
4.5. Chuẩn ộ liŒn tiếp hay ph n oạn
III.5 CÆch t nh kết quả trong PPPT thể t ch
III.6 Sai số hệ thống trong PPPT thể t ch 2 lOMoAR cPSD| 45734214
III.1 Một số khÆi niệm
PPPT thể t ch: pp ịnh lượng cấu tử X
dựa trŒn phØp o thể t ch
Cấu tử X (Cx ?) + dd chuẩn C (biết CT)
→ sự ịnh ph n hay phØp chuẩn ộ
C + X → A + B : p.ứ chuẩn ộ
Chuẩn ộ acid-base (acid base titrations)
Chuẩn ộ phức (complexometric titrations)
Chuẩn ộ oxy h a khử (redox titrations)
Chuẩn ộ tủa (precipitation titrations) 3
C + X → A + B : p.ứ chuẩn ộ
Điểm tương ương (equivalent point):
→ thời iểm C tÆc dụng vừa hết với X: # mol C = Vt x CT
# mol X = ? Dựa v o hệ số tỉ lượng của pt → # mol X
Dựa v o ịnh luật ương lượng: nC = nX
→ xÆc ịnh iểm tương ương bằng chất chỉ thị
(dd ổi m u, xuất hiện tủa )
Điểm kết thœc chuẩn ộ (endpoint):
→ khi c sự thay ổi của chất chỉ thị
→ sai số trong chuẩn ộ lOMoAR cPSD| 45734214
Điểm tương ương c n ược xÆc ịnh th ng qua phØp o
một số ại lượng h a l : iến thế, ộ dẫn iện, mật ộ d ng : PPPT h a l 4 v + lOMoAR cPSD| 45734214
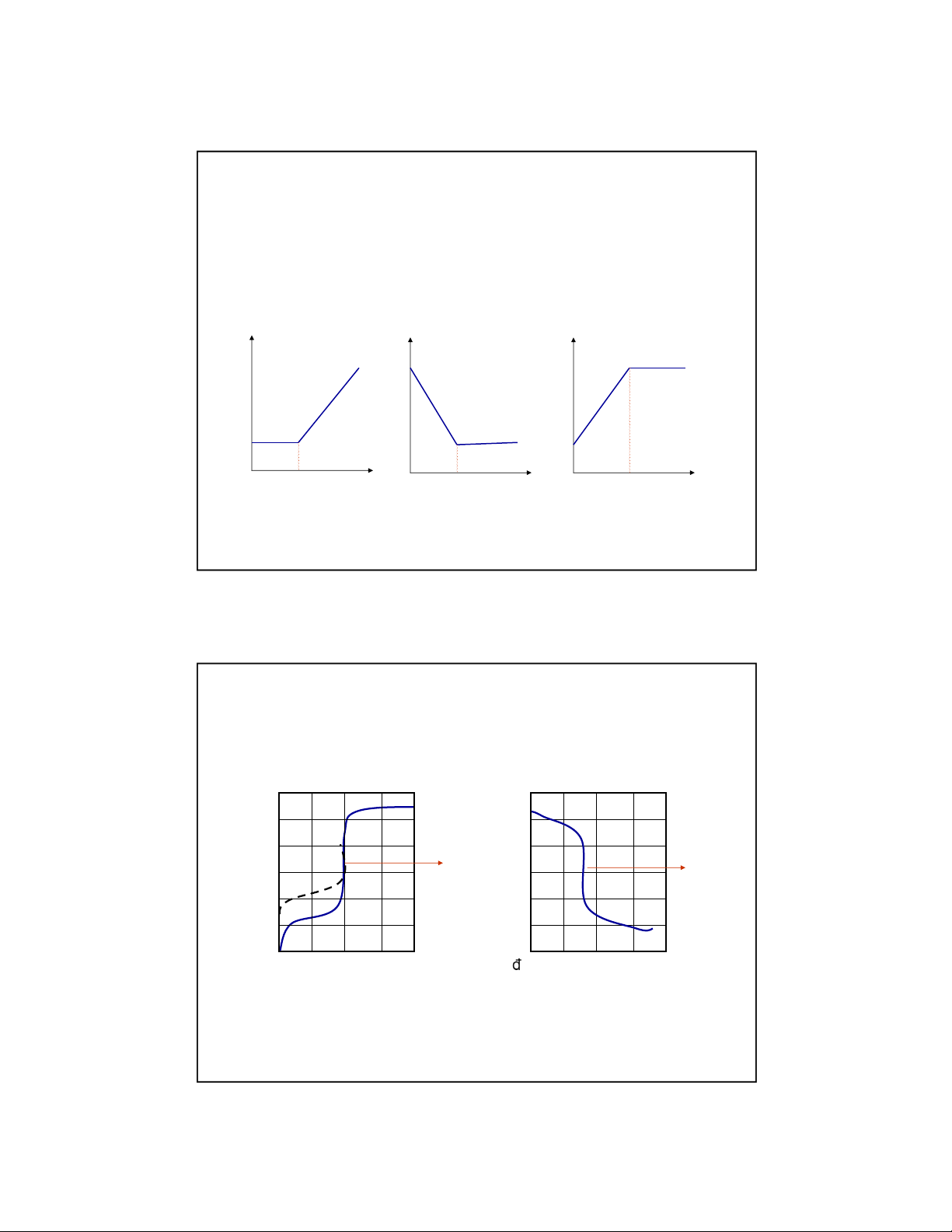
III.2 Đường cong chuẩn ộ (titration curve)
Đường biểu diễn sự biến ổi nồng ộ hay logarit của nồng ộ
một cấu tử n o trong dd của quÆ tr nh chuẩn ộ theo lượng chất chuẩn thŒm v o. C + X → A + B
Biểu diễn sự biến thiŒn của [C], [X], [A] theo lượng chất chuẩn C thŒm v o [C ] [ X ] A [ ] V V td c V V td c V V td c 6
III.2 Đường cong chuẩn ộ (titration curve) C + X → A + B
Biểu diễn sự biến thiŒn của log[C], logX], log[A]
theo lượng chất chuẩn C thŒm v o Log[C] Log[X] K=10 8 K=10 10
ĐiểmĐiểm tươngtương ươngương C (mmol) C (mmol) lOMoAR cPSD| 45734214 7
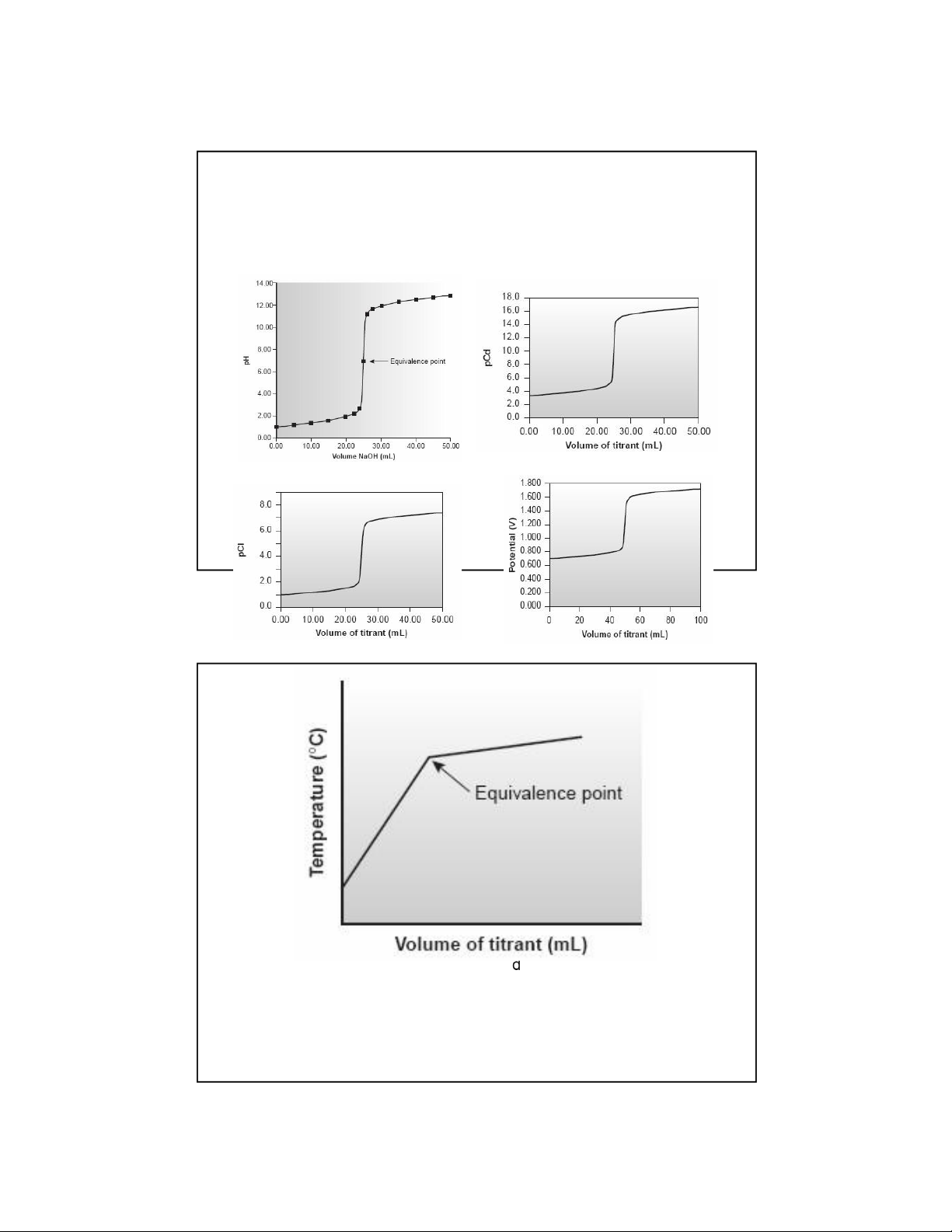
Đườ ngcong chu ẩ n ộ acidbase
Đườ ngcong chu ẩ n ộ ph ứ c
Đường cong chuẩn ộ tủa
Đường cong chuẩn thế oxy h a khử8
Đường cong chuẩn ộ nhiệt cho phản ứng tỏa nhiệt 9 lOMoAR cPSD| 45734214
III.3 Chất chỉ thị trong PPPT thể t ch 3.1 Định nghĩa:
Chất chỉ thị (indicator, Ind) l hợp chất HC hay VC c
cấu trœc thay ổi theo nồng ộ một cấu tử Z n o trong dd. Ind +Z IndZ
Dấu hiệu biến ổi cấu trœc: sự ổi m u của dd, sự xuất hiện
hay biến mất của tủa n o trong dd 3.2 Ph n loại
Chất chỉ thị nồng ộ ion
Chất chỉ thị oxy h a khử (REX-OX)
Chất chỉ thị hấp phụ 10
Chất chỉ thị nồng ộ ion
Đ y l chất chỉ thị c c cấu v t nh chất thay ổi theo nồng ộ ion n o trong dd:
Z l H+ (OH-): Ind l chất chỉ thị acid-baz, ược døng
trong phương phÆp trung h a v o m u ể x pH HInd Ind− +H+
Z l ion Mnn+ v IndZ l kết tủa: Ind l chất chỉ thị tạo tủa Ind + Mn+ MIndn+
Z l ion Mnn+ vIndZ l chất phức: Ind l chất chỉ thị tạo
phức, døng rộng rªi trong phương phÆp chuẩn ộ phức Ind + Mn+ MIndn+ ↓ 11 lOMoAR cPSD| 45734214
Chỉ thị acid-baz hay chỉ thị pH Ind l
acid hay baz yếu, c thể thay ổi m u sắc theo
pH của dd. Ind n y ược døng trong phương phÆp trung h a v o m u ể x pH.
HInd ⇔ Ind− +H+ ki = [
Ind[H−Ind][H]+]⇒[H+]= ki [ [HIndInd−]] [Ind−] pH = pki +lg [HInd]
M u dd ược quyết ịnh tøy thuật v o tỷ số [Ind]/[HInd] v
giÆ trị của tỷ số n y phụ thuộc v o pH của m i trường.
Khi tỷ số [Ind]/[HInd] ạt ến 1/10 hay 10 th dd c sự chuyển m u.
Khoảng chuyển m u: ΔpH = pki – 1 12 13 lOMoAR cPSD| 45734214
Chất chỉ thị oxy h a khử (REX-OX)
M u sắc thay ổi theo khả năng cho nhận iện tử của m i
trường, hay theo sự thay ổi thế oxy h a khử của hệ ược
gọi chất chỉ thị oxy h a khử. Cơ chế: Ind ox( )+nei Ind kh( ) 0.059 [
Ở pH xÆc ịnh: Ei = +Ei0 lg Ind ox()]] [ ni Ind kh() V chỉ thị c
nồng ộ rất nhỏ nŒn thế của dd ược
quyết ịnh bằng cÆc cặp Ox/Kh.
Sự thay ổi của thế l m tỉ lệ Ind(Ox)/Ind(Kh) thay ổi → dd
sẽ c m u của dạng oxy h a hay dạng khử khi nồng ộ
dạng n y hơn nồng ộ của dạng kia 10 lần
Khoảng chuyển m u: Δ = ±E E 0 i 0.059 / ni 14 15 lOMoAR cPSD| 45734214
Chất chỉ thị hấp phụ:
Phẩm nhuộm HC c t nh acid-baz, c khả năng hấp
phụ trŒn bề mặt tủa, l m tủa nhuốm m u ặc trưng.
Chất chỉ ược tạo th nh trong quÆ tr nh chuẩn ộ
Trong quÆ tr nh chuẩn ộ, iểm cuối c n c thể ược x
nhờ v o cÆc dấu hiệu xuất hiện do bản th n của tÆc chất hay sản phẩm
Chuẩn ộ chất khử (kh ng m u) = MnO4-, khi dư
MnO4→ dd cần chuẩn ộ sẽ c m u hồng t m.
Chuẩn ộ chất khử (kh ng m u) = BrO3-, khi dư BrO3-
→ dd cần chuẩn ộ sẽ c m u v ng n u.
Chuẩn ộ chất khử (kh ng m u) = Ce4+, khi dư Ce4+ →
dd cần chuẩn ộ sẽ c m u v ng. 16
III.4 CÆc cÆch chuẩn ộ th ng dụng
4.1 Chuẩn ộ trực tiếp (direct titration)
Dung dịch (dd) chuẩn C ược cho v o dd chứa cấu tử X C + X → A + B
# ương lượng gam C ~ # ương lượng gam X CN = m . 1000 dlg V(ml) 17 lOMoAR cPSD| 45734214
III.4 CÆc cÆch chuẩn ộ th ng dụng
4.2 Chuẩn ộ ngược (back titration)
Cho lượng thừa dd chuẩn C v o dd chứa cấu tử X
Định lượng lượng thừa C bằng dd chuẩn C1 ến iểm cuối C + X → A + B C + C1 → D + E
# ương lượng C ~ ∑ # ương lượng (X + C1)
Døng phương phÆp chuẩn ộ ngược khi:
1. Kh ng c chất chỉ thị th ch hợp cho p.ứ C + X
2. Điều kiện tiến h nh p.ứ C + X ặc biệt:
nhiệt ộ cao, thời gian tiếp xœc d i 18
V dụ: XÆc ịnh nồng ộ của formaldehyde, H2CO bằng I3- H CO( - 2
aq) + 3OH-(aq) + I (3 aq)
HCO (-2 aq) + 3I-(aq) + 2H O 2 ( ) (1)l
Phản ứng chuẩn ộ trực tiếp chậm → døng lượng thừa I3- I ( - 2- 2- 3 aq) + 2S O2
3 (aq) S O (4 6 aq) + 3I-(aq) (2) # ương lượng H2CO = ? # ương lượng I - - -
3 (1) = # ương lượng I3 - # ương lượng I3 (2) lOMoAR cPSD| 45734214
V dụ: XÆc ịnh h m lượng CaCO3 c trong 4g phấn bằng
lượng thừa 200ml dd HCl 0.5N. Biết sau phản ứng, lượng
thừa HCl c n lại phản ứng chuẩn ộ hết với 50 ml dd NaOH 0.5N.
CaCO + 2 HCl3 → CaCl + CO + H O ( ) (1)2 2 2 l
HCl + NaOH → NaCl + H O (2)2 # g lượng CaCO3 = ? = # g lượng HCl (1)
# g lượng HCl (1) = # g lượng HCl - # g lượng HCl (2)
# g lượng HCl = NHCl x VHCl = 0.5 x 0.2 = 0.1
# g lượng HCl (1) = # g lượng NaOH
= NNaOHx VNaOH = 0.5 x 0.05 = 0.025 # g lượng
CaCO3 = 0.1 0.025 = 0.075 khối lượng CaCO3 = # g lượng CaCO3 x dlg(CaCO3) = 3.75g → lẫn 0.25 g tạp chất
4.3 Chuẩn ộ thế (displacement titration)
Cho dd AC1 v o dd chứa cấu tử X, tạo p.ứ thay C1 bằng X
Định lượng lượng thừa C bằng dd chuẩn C1 ến iểm cuối AC1 + X → AX + C1
Lượng C1 ph ng th ch ược chuẩn ộ bằng dd chuẩn C C1 + C → D + E
# g lượng X ~ # g lượng C= # g lượng C1 21 lOMoAR cPSD| 45734214
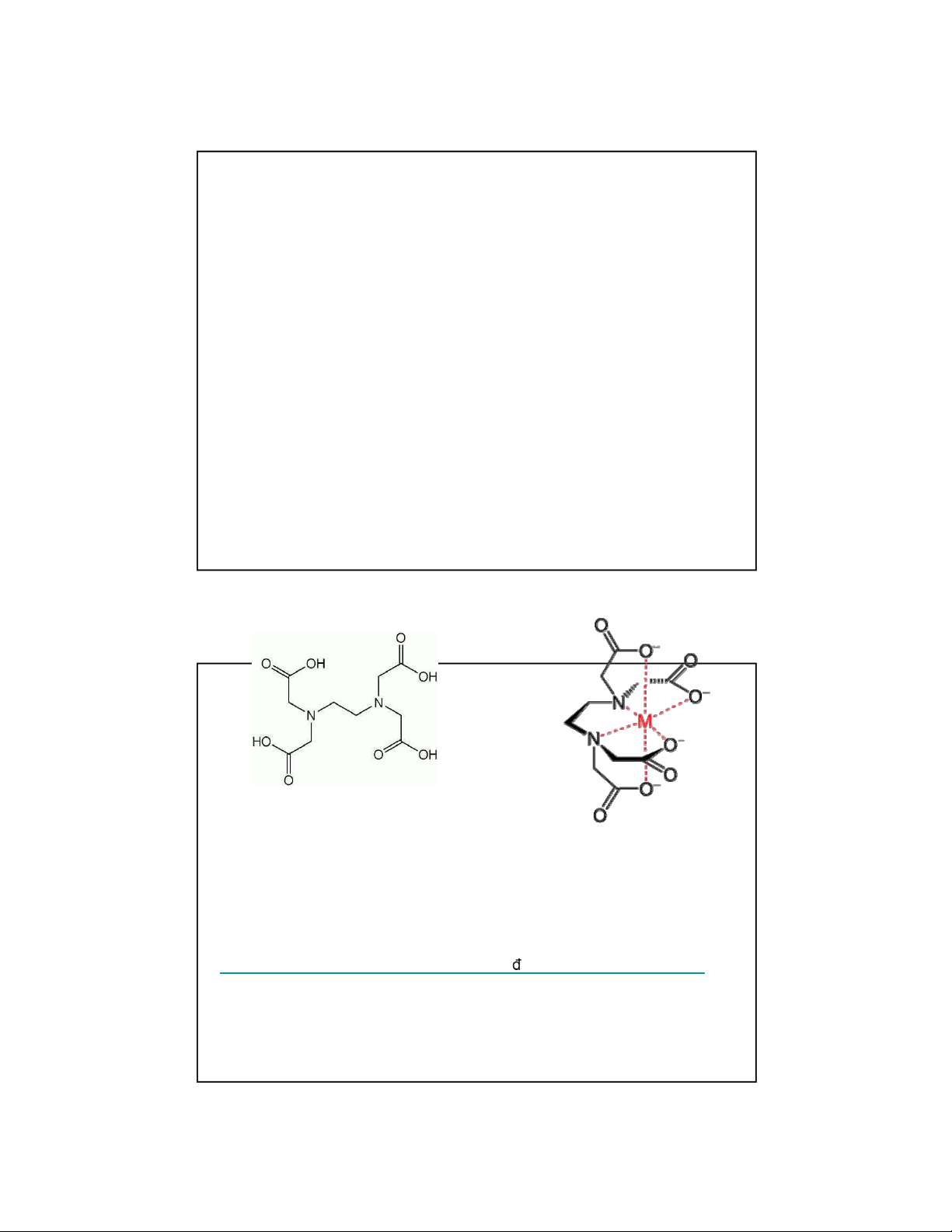
V dụ: XÆc ịnh nồng ộ của Ca2+
Ca2+(aq) + Y4-(aq)
CaY aq2−( ), Y = EDTA4-
→ kh ng c thuốc thử th ch hợp nếu chuẩn ộ trực tiếp →
døng lượng thừa phức Mg2+ với EDTA
Ca2+(aq) + MgY2-(aq) CaY aq2−( ) + Mg2+(aq) → chuẩn ộ Mg2+ ph ng th ch
Mg2+(aq) +Y4-(aq) MgY aq2−( ) 22
EDTA = EtylenDiamineTetraAxetic
C ng nghiệp tẩy rửa : Tạo phức với ion Ca2+, Mg2+, kim loại nặng L m
sạch nước : Tạo phức với ion Ca2+, Mg2+ (giảm ộ cứng của nước).
Trong nhiếp ảnh : sử dụng Fe(III)EDTA như l chất oxih a.
C ng nghiệp dệt : Tạo phức với kim loại nặng, mÆy tẩy trắng vải.
H a học n ng nghiệp : Ph n b n sắt, kẽm v ồng, ặc biệt l ở vøng Æ v i. Kỹ thuật
trồng c y trong nước : Fe(EDTA) ược sử dụng ể h a tan sắt trong giải phÆp dinh dưỡng cho c y trồng.
http://www.h2vn.com/community/index.php?topic=2788.msg26798#ixzz0Ew3cwOvG&A 23 lOMoAR cPSD| 45734214
4.4 Chuẩn ộ giÆn tiếp (indirect titration)
Cấu tử X ược chuyển th nh hợp chất khÆc c CTPT xÆc
ịnh v một th nh phần n o
của ptử c thể chuẩn ộ bằng pp th ch hợp
V dụ: xÆc ịnh lưu huỳnh trong than Æ
S(s) + O ( )2 g → SO ( )2 g
SO ( ) + H O (2 g 2 2 aq) → H SO (2 4 aq) H SO ( 2−
24 aq) + 2OH-(aq) SO4 (aq)+ 2H O (l2 )
4.5 Chuẩn ộ liŒn tiếp hay ph n oạn 24
III.5 CÆch t nh thể t ch trong PPPT thể t ch
5.1 NguyŒn tắc chung:
dựa v o ịnh luật ương lượng C + X → A + B C .V CC = C .V X X
Cc , Cx: nồng ộ ương lượng của chất chuẩn C v cấu tử X
Vc , Vx: thể t ch của 2 dd C v X (ml)
5.2 CÆc biểu thức t nh: Mẫu lỏng Mẫu rắn 25 lOMoAR cPSD| 45734214
5.2 CÆc biểu thức t nh: Mẫu lỏng
a. Lấy Vx (ml) mẫu, chuẩn ộ bằng Vc (ml) dd chuẩn c nồng ộ ương lượng Cc C (X)N= C .V cc ; CM(X) = C (X) N (1) Vx n C(g/l) = C (X)N ×dlg( X) = C (X)N × Mx (2) n
b. Lấy V(ml) mẫu ậm ặc pha loªng th nh V1 (ml) dd loªng;
døng Vx (ml) dd loªng chuẩn ộ bằng Vc (ml) dd chuẩn c nồng ộ ương lượng Cc
C (N dddd) = C .Vcc × V 1 (3) Vx V
C(g/l) = C (X)N×dlg(X) = C (X)N× Mx (4) n 26
5.2 CÆc biểu thức t nh: Mẫu rắn
a. C n a (g) mẫu, h a tan v chuẩn ộ bằng Vc (ml) dd chuẩn
c nồng ộ ương lượng Cc lOMoAR cPSD| 45734214 %X = C .V .10 −3 C C 100×dlg(X) (5) a
b. C n a (g) mẫu, h a tan v ịnh mức th nh V1(ml) dd
loªng; lấy Vx (ml) dd loªng em chuẩn ộ bằng Vc (ml) dd
chuẩn c nồng ộ ương lượng Cc V %X = C .V .10 −3 1 C C 100×dlg(X) (6) VX a
Biểu thức 1-6 ược Æp dụng ể t nh kết quả cho pp
chuẩn ộ trực tiếp v chuẩn ộ thế. 27
Với chuẩn ộ ngược, sử dụng biểu thức C .VCC −C .VC1C1 C .VCC = C .VXX +C .VC ⇒ 1C1 CX = (7) VX Một số
trường hợp, việc t nh kết quả th ng qua ộ chuẩn a. Độ
chuẩn của một chất Tx: số gam hay miligam chất X trong 1 mililit dd:
TCX (g/ml) = m hay T(mg/mL) = m1000 (8) V V
b. Độ chuẩn theo chất xÆc ịnh TC/X: số gam hay miligam
chất X tÆc dụng vừa ủ với 1 mililit dd chuẩn c nồng ộ CC lOMoAR cPSD| 45734214 = C T C CX (g/ml) 1000 dlg(X) (9) CC =1000.TC/X/dlg(X) (10)
TC/X = THCl/NaOH = 0.00401g → 0.00401g NaOH sẽ ược
tÆc dụng vừa ủ với 1 ml dd HCL 0,1 N. 28 V dụ: Một
dd soda (Na2CO3) kỹ thuật chưa biết nồng ộ, ược pha
loªng bằng nước ến vạch mức của b nh ịnh mức c dung t
ch 250 ml. Chuẩn ộ 25ml dd n y khi c mặt methyl da cam
th tốn mất 22.45 ml dd chuẩn acid HCl 0.1095N. T nh tổng
h m lượng Na2CO3 ra gam c trong dd soda ban ầu
V dụ: T nh h m lượng % của Na2B4O7.10 H2O c trong mẫu
borax kỹ thuật, biết rằng chuẩn ộ 0,2298 g borax th tốn mất 10,60 ml dd HCl 0,1060 N
III.6 Sai số hệ thống trong PPPT thể t ch
6.1 Sai số do p.ứng chuẩn ộ c hằng số cb kh ng ủ lớn C + X ⎯⎯→K A + B
Hằng số cb K c ng lớn, mức ộ phản ứng diễn ra c ng ho
n to n → sai số hệ thống Δ% c ng bØ v ngược lại K = 108-109: Δ% ≈ 0.01% lOMoAR cPSD| 45734214 K = 106-107: Δ% ≈ 0.1% K < 105: Δ% > 1%
6.2 Sai số do dụng cụ o thể t ch, do mÆy o hoặc h a
chất 6.3 Sai số chỉ thị
Δ% =Số (mili) ương lượng của X c n lại x 100% Số
(mili) ương lượng của X ban ầu 31
Titrimetry: Any method in which volume is the signal.
Titrant: The reagent added to a solution containing the
analyte and whose volume is the signal. Equivalence point:
The point in a titration where stoichiometrically equivalent
amounts of analyte and titrant react.
End point: The point in a titration where we stop adding titrant.
Indicator: A colored compound whose change in color
signals the end point of a titration.



