













Preview text:
lOMoAR cPSD| 45734214 Chương 5. DUNG DỊCH
5.1. Nồng ộ v ộ tan của dung dịch 5.1.1. Nồng ộ
Để biểu thị th nh phần của một dung dịch, người ta døng nồng ộ dung dịch. Vậy
nồng ộ dung dịch l lượng chất tan c trong một lượng xÆc ịnh dung dịch hoặc dung m i,
lượng chất tan lớn tạo dung dịch ặc, ngược lại l dung dịch loªng. a. Nồng ộ phần trăm khối lượng (%)
Số gam chất tan trong 100 gam dung dịch: mCt C% = ×100 mdd
V dụ: Dung dịch NaOH 20% nghĩa l cứ 100g dung dịch th c 20g NaOH tan trong .
♦ Nồng ộ % theo thể t ch
Biểu thị số ml chất tan c trong 100ml dung dịch.
V dụ: ancol etylic 70o nghĩa l trong 100ml dung dịch rượu n y cần c 70ml
C2H5OH nguyŒn chất v 30ml H2O.
b. Nồng ộ mol
Số mol chất tan c trong 1 l t dung dịch: nct CM = Vdd ( )l
c. Nồng ộ molan (Cm)
Số mol của chất tan c trong 1kg hoặc 1000g dung m i: Cm = nct ×1000 mdm
Với nct l số mol chất tan c trong lượng dung m i l mdm.
V dụ: dung dịch NaCl 0,2 molan: dung dịch chứa 0,2 mol NaCl trong 1000 gam nước.
d. Nồng ộ Ph n mol
L tỉ lệ giữa số mol chất n o với tổng số mol của cÆc chất trong dung dịch. —ối
với dung dịch tạo th nh từ hai chất A, B với số mol tương ứng l nA, nB , ta c biểu thức B ph n mol như sau: nA nB 74 lOMoAR cPSD| 45734214 χA = ;χB = nA +nB nA +nB
* Chœ : Tổng nồng ộ phần mol của cÆc chất c trong dung dịch bằng 1.
e. Nồng ộ ương lượng
Một loại nồng ộ khÆc thường ược sử dụng ể t nh toÆn trong cÆc phương phÆp ph n
t ch thể t ch l nồng ộ ương lượng ược ịnh nghĩa l số ương lượng gam của chất tan trong một l t dung dịch. n’
n : số ương lượng gam chất tan c trong dung dịch. CN = V V: thể t ch (l)
V dụ: dung dịch HCl 2N l dung dịch c chứa 2 ương lượng gam hoặc 2×36,5g HCl nguyŒn chất.
* `p dụng ịnh luật ương lượng cho cÆc phản ứng trong dung dịch.
Giả sử phản ứng : A + B → C Gọi:
NA, NB : N ồng ộ ương lượng gam của 2 dung dịch A v B B
VA VB: Thể t ch của 2 dung dịch A v B phản ứng vừa ủ với nhau Theo ịnh B luật ương lượng ta c : NA .VA = NB .VB B
Đy l biểu thức toÆn học Æp dụng ịnh luật ương lượng cho dung dịch.
f. Mối quan hệ giữa cÆc nồng ộ
* Giữa nồng ộ ph n tử gam v nồng ộ %:
M : khối lượng ph n tử chất tan 10dC%
CM : nồng ộ mol của dung dịch CM = M
d : khối lượng riŒng của dung dịch
C%: nồng ộ % của dung dịch *
Giữa nồng ộ ương lượng v nồng ộ % của dung dịch: CN = 10dC% D: ương lượng gam D * Giữa CM v CN: 75 lOMoAR cPSD| 45734214
n = Số iện t ch m 1 ptg chất trao ổi CN = n.CM
hoặc n = Số e m 1 ptg chất trao ổi
V dụ 1: Ta c dung dịch 0,5M H2SO4. 1 mol H2SO4 ứng với số ương lượng gam l 2. Do CN = 2. 0,5 = 1N.
V dụ 2: Dung dịch sử dụng b nh acqui l dung dịch H2SO4 3,75M, c khối lượng
riŒng l : 1,230 g/ml. T nh nồng ộ %, nồng ộ molan v nồng ộ ương lượng của H2SO4
trong dung dịch trŒn. Giải:
Khối lượng của 1 l t dung dịch: 1000 x 1,230 = 1230g
Khối lượng của H2SO4 trong 1 l t dung dịch: 3,75 x 98 = 368g
Khối lượng của H2O trong 1 l t dung dịch: 1230 - 368 = 862g Do : C% = ×100 = 29,9%
CN = 3,75×2 = 7,5N Cm = = 4,35m
5.1.2. Độ tan v cÆc yếu tố Ænh hưởng ến ộ tan
a. KhÆi niệm về ộ tan
—ộ tan l nồng ộ của chất tan ược v o dung dịch ể tạo ra một dung dịch bảo h a ở một nhiệt ộ xÆc ịnh.
Ở một nhiệt ộ nhất ịnh ộ tan của một chất trong một dung m i ược xÆc ịnh bằng
nồng ộ của dung dịch bªo h a của chất .
Th ng thường ộ tan của chất rắn trong một chất lỏng ược biểu thị bằng số mol
chất tan c trong một l t dung dịch.
Đối với chất kh tan trong chất lỏng th ộ tan ược biểu diễn bằng thể t ch chất kh
bªo h a trong một thể t ch xÆc ịnh của dung m i. Độ tan thường ược k hiệu l S -
Khi dung dịch c nồng ộ nhỏ hơn ộ tan ta c dung dịch chưa bªo h a, chất tan c thể tan thŒm. -
Khi dung dịch c nồng ộ lớn hơn ộ tan ở cøng nhiệt ộ th ta c dung dịch quÆ bªo h a.
CÆc dung dịch quÆ bªo h a kh ng bền, nếu khuấy, lắc hoặc thŒm v o dung dịch
một v i tinh thể chất rắn sẽ c sự kết tinh chất tan từ dung dịch v dung dịch sẽ trở về trạng thÆi bªo h a. T ch số tan
L t ch số nồng ộ của cÆc ion của n trong dung dịch bảo h a chất với số mũ bằng
hệ số tỷ lượng trong ph n thức: 76 lOMoAR cPSD| 45734214 AmBn ⇔ mAn+ + nBm-
Τ =A Bm n [An m+] [Bm n−]
V dụ, t ch số tan BaSO4 l 1,1.10-10 (ở 25oC) Nếu
gọi S l ộ tan của BaSO4, lœc ta c :
[Ba2+ ][SO42−] =SS T. = BaSO4
S = T = 1,1.10−10 =1,05.10−5mol L/
Một chất sẽ kết tủa khi t ch số nồng ộ cÆc ion của n trong dung dịch lớn hơn t ch số
tan v ngược lại.n sẽ c n tan khi t ch số nồng ộ ion của n chưa ạt ến t ch số tan.
b. CÆc yếu tố ảnh hưởng ến ộ tan * Bản chất chất tan v bản chất dung m i
Qui luật kinh nghiệm về ộ tan: < CÆc chất c cøng t nh ph n cực th h a tan tốt v o nhau >.
V dụ: Khi h a tan NaCl v o nước, quÆ tr nh h a tan c thể chia l m 3 bước: -
Bước 1 PhÆ vỡ cấu trœc tinh thể của chất tan ể tạo th nh tiểu ph n riŒng biệt. -
Bước 2 PhÆ vỡ lực liŒn kết liŒn ph n tử giữa cÆc ph n tử dung m i ể tạo ra
cÆc khoảng trống cho cÆc tiểu ph n của cÆc chất tan x m nhập. -
Bước 3 Xảy ra tương tÆc giữa cÆc tiểu ph n của chất tan v cÆc ph n tử của dung m i
ể tạo th nh dung dịch, tức xảy ra quÆ tr nh solvat h a. * Nhiệt ộ -
Độ tan của một chất tăng khi nhiệt ộ tăng, nếu quÆ tr nh h a tan thu nhiệt. V dụ: NH4Cl, KNO3 tan nhiều khi un n ng.
Việc h a tan cÆc chất rắn v o nước, v dụ h a tan ường hay muối v o nước, m ta
gặp hằng ng y c thể i ến kết luận rằng ộ tan của cÆc chất tăng theo nhiệt ộ. Tuy nhiŒn,
iều thực sự kh ng phải như vậy. Khi nhiệt ộ tăng giœp quÆ tr nh h a tan xảy ra nhanh
hơn nhưng lượng chất tan c thể giảm i theo nhiệt ộ. -
Độ tan của chất kh giảm khi nhiệt ộ tăng v quÆ tr nh h a tan của cÆc chất kh phÆt nhiệt.
Ảnh hưởng của nhiệt ộ ối với ộ tan của cÆc chất kh c nghĩa quan trọng về mặt m
i trường. Vấn ề n y ược thấy rı khi một lượng lớn nước ược sử dụng ể l m nguội trong
cÆc qui tr nh c ng nghiệp, sau khi sử dụng sẽ bị n ng lŒn v ược thải trở lại s ng hồ. Do
n ng hơn nŒn nước sẽ chứa t lượng O2 h a tan hơn, iều n y l m phÆ vỡ c n bằng hấp
phụ O2, l m giảm lượng O2 h a tan trong nước v do vậy sẽ ảnh hưởng ến hoạt ộng sống
của cÆc sinh vật sống trong m i trường nước. * `p suất
`p suất ảnh hưởng kh ng Æng kể ến ộ tan của chất rắn hoặc lỏng, nhưng c tÆc ộng lớn
ến ộ tan của chất kh . CÆc loại nước giải khÆt chứa ga khi ng chai phải ở Æp suất CO2
cao nhằm bảo ảm ạt ược một nồng ộ lớn của CO2 trong dung dịch. Khi mở nắp, do Æp 77 lOMoAR cPSD| 45734214
suất của CO2 trong kh quyển bØ nŒn xảy ra sự thoÆt CO2 khỏi dung dịch tạo nŒn sủi bọt vỡ ặc trưng.
Sự gia tăng ộ tan của chất kh trong chất lỏng c thể ược minh họa trong v dụ sau:
giả sử ang xảy ra c n bằng giữa chất kh v chất lỏng, nghĩa l số ph n tử kh thoÆt ra hoặc
tan v o dung dịch với tốc ộ bằng nhau. Nếu ta l m tăng Æp suất th số ph n tử kh trong
một ơn vị thể t ch sẽ gia tăng, kh sẽ tan v o dung dịch với tốc ộ lớn hơn tốc ộ thoÆt ra,
lœc n y nồng ộ kh tan trong dung dịch sẽ tăng cho ến khi một c n bằng mới ược thiết
lập, v dĩ nhiŒn lœc n y dung dịch sẽ chứa một lượng kh tan nhiều hơn.
Định luật Henry về ộ tan của chất kh trong chất lỏng: Độ tan của cÆc chất kh tỉ
lệ với Æp suất riŒng phần của chất kh .
K : hằng số tỉ lệ (ặc trưng cho mỗi loại dung dịch) S = K.Pi
Pi : Æp suất riŒng phần của chất kh
S : ộ tan của chất kh trong chất lỏng ( g/100g dung m i)
V dụ: ộ h a tan của O2 sẽ giảm 25% khi tăng lượng muối h a tan trong nước tới 40 gam.
Bảng 9. Sự phụ thuộc của hằng số Henry (k) v o nhiệt ộ. k Nhiệt ộ (oK)
O2 (× 10-5) CO2 (× 10-5) H2S (× 10-5) 273 67,45 3349,51 6825,24 275 63,48 3000,97 6397,08 277 60,52 2788,34 5998,05 298 38,76 1407,76 3332,03
Chœ l ịnh luật Henry chỉ œng trong trường hợp cÆc chất kh tan kh ng phản ứng
với dung m i, v dụ: œng với trường hợp kh O2 tan trong nước, nhưng kh ng
œng với trường hợp HCl tan trong nước v ở y xảy ra sự ph n ly của HCl.
5.2. T nh chất của dung dịch kh ng iện ly
5.2.1. `p suất hơi bªo h a của dung dịch chứa chất tan kh ng iện li v kh ng bay hơi.
`p suất hơi của một chất lỏng l Æp suất g y nŒn bởi những ph n tử của n trŒn mặt thoÆng chất lỏng.
`p suất hơi bªo h a l Æp suất tạo ra trŒn mặt thoÆng khi quÆ tr nh bay hơi ạt tới trạng thÆi c n bằng.
Giải th ch: do chuyển ộng nhiệt nŒn cÆc ph n tử chất lỏng tinh khiết ựng trong b nh k
n sẽ tÆch khỏi bề mặt chất lỏng v biến th nh hơi. QuÆ tr nh n y gọi l quÆ tr nh h a hơi.
Mặt khÆc, cÆc ph n tử chất lỏng tinh khiết ở trạng thÆi hơi cũng chuyển ộng hỗn loạn,
va v o bề mặt chất lỏng v một số ph n tử c thể ngưng tụ trở lại, quÆ tr nh n y gọi l quÆ
tr nh ngưng tụ. Khi vận tốc hai quÆ tr nh n y bằng nhau th tồn tại c n bằng: 78 lOMoAR cPSD| 45734214 Lỏng ⇔ Hơi ; ΔH > 0
Lœc n y, trạng thÆi hơi nằm c n bằng với trạng thÆi lỏng gọi l hơi bªo h a, n g y nŒn
Æp suất hơi bªo h a của chất nguyŒn chất.
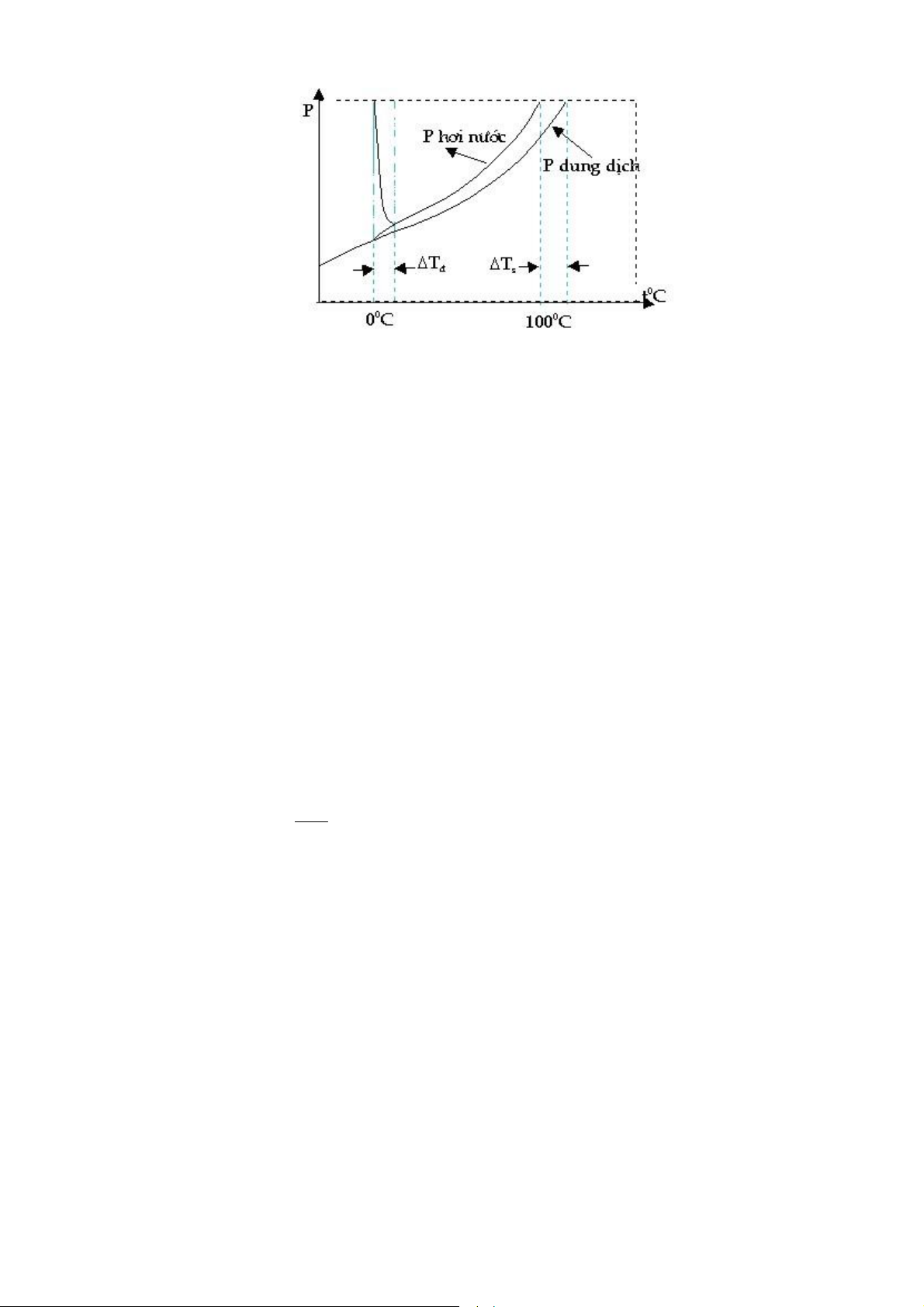
Th nghiệm về Æp suất hơi bªo h a: C hai cốc, một cốc ựng nước nguyŒn chất v một
cốc ựng dung dịch nước ường v ược ặt trong một chậu thủy tinh như h nh 33. Sau một
thời gian th nghiệm ta thấy thể t ch của cốc chứa nước giảm c n thể t ch của cốc chứa
dung dịch nước ường tăng.
—iều n y c thể ược giải th ch khi Æp suất hơi của dung m i nguyŒn chất lớn hơn Æp
suất hơi của dung dịch chứa chất tan kh ng bay hơi, nghĩa l nếu hai b nh ộc lập nhau th
khi c n bằng lỏng hơi ược thiết lập Æp suất hơi tạo ra trŒn bề mặt dung m i nguyŒn
chất phải lớn hơn Æp suất hơi tạo ra trŒn bề mặt dung dịch.
H nh 33. Th nghiệm ảnh hưởng của chất tan ến t nh chất của dung m i
Do trong một hệ k n, sự h a hơi mạnh của dung m i nguyŒn chất l m c n bằng lỏng
hơi của dung dịch bị dịch chuyển theo chiều dung dịch phải hấp thụ hơi ể l m giảm Æp
suất hơi trŒn bề mặt dung dịch. Sự hấp thụ hơi của dung m i trŒn bề mặt dung dịch sẽ
l m giảm Æp suất hơi của dung m i trong hệ. —ể ạt c n bằng lỏng ⇔ hơi trở lại, dung m
i nguyŒn chất phải bốc hơi thŒm, kết quả l xảy ra sự chuyển dung m i nguyŒn chất sang dung dịch.
Sự hiện diện của chất tan trong dung dịch l m giảm số ph n tử dung m i tự do trong
một ơn vị thể t ch, do l m giảm số ph n tử dung m i trŒn bề mặt v do l m giảm khả
năng h a hơi của dung m i.
Khi ho tan một chất tan kh ng iện li v kh ng bay hơi v o một dung m i th cÆc ph
n tử chất tan sẽ ph n bố ều trong to n bộ thể t ch của dung m i. Một số ph n tử dung m
i c trŒn mặt thoÆng ược thay thế bởi cÆc ph n tử chất tan kh ng bay hơi, một số ph n
tử dung m i bay hơi giảm v do Æp suất hơi bªo ho của dung m i trong dung dịch bØ
hơn so với Æp suất hơi bªo ho của dung m i nguyŒn chất. Số ph n tử chất tan c ng tăng
th số ph n tử dung m i thoÆt ra c ng t, do Æp suất hơi bªo ho của dung dịch (P1) lu n lu
n nhỏ hơn Æp suất hơi bªo ho của dung m i nguyŒn chất (P0).
Sự giảm Æp suất hơi bªo ho của dung dịch tu n theo ịnh luật Raoult I.
`p suất hơi bªo h a của dung dịch bằng Æp suất hơi bªo ho của dung m i nguyŒn chất
nh n với phần mol của dung m i trong dung dịch .
Ρ =Ρl 0χdm =Ρ0 ndm ndm +nct
P1 : Æp suất hơi bªo ho của dung dịch; 79 lOMoAR cPSD| 45734214
P0 : Æp suất hơi bªo ho của dung m i nguyŒn chất χdm
: phần mol của dung m i trong dung dịch
Nếu gọi χchất tan l nồng ộ phần mol của chất tan trong dung dịch th : χdm + χct = 1
ΔP : ộ giảm Æp suất hơi bªo ho của dung dịch
ΔP/P0 : ộ giảm tương ối Æp suất hơi bªo ho của dung dịch Ρ0 −Ρ1 ΔΡ χct = = Ρ0 Ρ0
Định luật Raoult I c thể phÆt biểu cÆch khÆc: "Tại một nhiệt ộ xÆc ịnh, ộ giảm
tương ối Æp suất hơi bªo ho của dung dịch chứa chất tan kh ng bay hơi v kh ng iện li
bằng nồng ộ phần mol của chất tan trong dung dịch".
Trong trường hợp dung dịch loªng v l tưởng, ịnh luật Raoult I œng với mọi chất tan kh ng iện li, kh ng bay hơi.
5.2.2. —ộ tăng nhiệt ộ s i
Nhiệt ộ của chất lỏng l nhiệt ộ m tại Æp suất hơi bªo h a của chất lỏng bằng Æp
suất hơi bªo ho của kh quyển.
Do dung dịch c Æp suất hơi bªo h a nhỏ hơn Æp suất hơi bªo ho của dung m i
nguyŒn chất nŒn muốn cho Æp suất hơi bªo h a của dung dịch bằng Æp suất kh quyển
cần phải tăng nhiệt ộ của dung dịch lŒn nŒn nhiệt ộ s i của dung dịch lớn hơn nhiệt ộ
s i của dung m i nguyŒn chất.
Nhiệt ộ s i b nh thường của một chất lỏng ược ịnh nghĩa l nhiệt ộ lœc Æp suất
hơi của chất lỏng ạt ược 1 atm. CÆc chất tan kh ng bay hơi l m giảm Æp suất hơi của
dung dịch, do dung dịch phải ược un n ng ến nhiệt ộ cao hơn nhiệt ộ s i của dung m i
tinh chất mới c thể ạt ược Æp suất 1atm. —iều n y c nghĩa l chất tan kh ng bay hơi l m
tăng nhiệt ộ s i của dung m i. Mức ộ gia tăng nhiệt ộ s i phụ thuộc v o nồng ộ của chất
tan trong dung dịch. —ối với cÆc dung dịch loªng mối quan hệ ược biểu diễn bằng phương tr nh:
ΔΤS =Κ S .Cm
Với: T: ộ tăng nhiệt ộ s i so với dung m i tinh chất. ks :gọi l
hằng số nghiệm s i phụ thuộc v o bản chất dung m i.
Cm: nồng ộ molan của chất tan trong dung dịch.
Dựa v o ộ tăng nhiệt ộ s i so với dung m i nguyŒn chất ta c thể xÆc ịnh ược ph n tử
lượng của chất tan trong dung dịch.
Bảng 10. GiÆ trị KS v K của một số dung m i khÆc nhau
Dung m i Nhiệt ộ s i (C) K 0 s C.Kg/mol Nhiệt ộ K 0C.Kg/mol Nước 100,0 0,51 0 1,86 80 lOMoAR cPSD| 45734214 CCl4 76,5 5,03 -22,99 3,00 CHCl3 61,2 3,63 -63,5 4,70 C6H6 80,1 2,53 5,5 5,12 CS2 46,2 2,34 -111,5 3,83 ˚te etylic 34,5 2,02 -116,2 1,79 Camphor 208,0 5,95 179,8 40
V dụ 1: Một dung dịch ược iều chế bằng cÆch h a tan 18,00g Gluc trong 150,00g
nước. Dung dịch c nhiệt ộ s i l 100,340C. xÆc ịnh ph n tử lượng của Gluc , biết hằng số
nghiệm s i của nước l 0,510C.Kg/mol. Giải:
ΔΤ =ΚS S .Cm ; ΔΤ= 0,340C ; Ks = 0,51 Cm = 0,34 = 0,67 mol/kg = ngluco 0,51 0,1500
Do : ngluco = 0,15. 0,67 = 0,1 mol; M gluco = 18 =180 0,1
5.2.3. —ộ hạ nhiệt ộ ng ặc
Nhiệt ộ ng ặc (kết tinh) của chất lỏng l nhiệt ộ m tại Æp suất hơi bªo ho của
pha lỏng bằng Æp suất hơi bªo ho của pha rắn.
Do Æp suất hơi bªo ho của dung dịch nhỏ hơn Æp suất hơi bªo ho của dung m i
nguyŒn chất nŒn ể cho Æp suất hơi bªo ho trŒn pha rắn bằng Æp suất hơi bªo ho trŒn
pha lỏng (của dung dịch) cần phải hạ nhiệt ộ ng của dung dịch xuống, nghĩa l : nhiệt ộ
ng của dung dịch nhỏ hơn nhiệt ộ ng của dung m i nguyŒn chất.
V dụ: Với nước nguyŒn chất c nhiệt ộ ng ặc l 00C (ch nh xÆc l
0,00990C) ứng với Æp suất hơi bảo h a của nước Æ v nước lỏng l 0,006atm. Việc h a
tan chất tan v o nước sẽ l m cho dung dịch c nhiệt ộ ng ặc thấp hơn nước nguyŒn chất,
bởi v sự hiện diện của chất tan trong nước sẽ l m cho Æp suất hơi của nước trong dung
dịch thấp hơn Æp suất hơi của nước Æ, do tại nhiệt ộ n y dung dịch kh ng thể ng ặc v
kh ng c sự c n bằng của Æp suất hơi giữa pha lỏng v pha rắn. Nếu ta hạ nhiệt ộ, Æp suất
hơi của pha rắn giảm nhanh hơn pha lỏng, kết quả sẽ dẫn ến sự c n bằng Æp suất hơi
của 2 pha lỏng v rắn v lœc n y dung dịch sẽ ng ặc.
Do chất tan l m hạ nhiệt ộ ng ặc của nước, nŒn cÆc chất như NaCl, CaCl2 thường ược
rªi trŒn cÆc vĩa hŁ hoặc ường lộ ể trÆnh sự ng băng trong møa ng ở cÆc nước ở vøng
lạnh giÆ, dĩ nhiŒn với iều kiện nhiệt ộ bŒn ngo i kh ng quÆ thấp. 81 lOMoAR cPSD| 45734214
H nh 34. Giản ồ pha của c n bằng lỏng / hơi v lỏng / rắn của dd nước chứa chất tan kh ng bay hơi
Từ giản ồ ta c thể kết luận: sự hiện diện của chất tan kh ng bay hơi l m mở rộng khoảng
nhiệt ộ m dung dịch tồn tại ở trạng thÆi lỏng. Cũng giống như ộ tăng nhiệt ộ s i, ộ hạ
nhiệt ộ ng ặc của dung dịch so với dung m i nguyŒn chất phụ thuộc v o nồng ộ của chất
tan. Phương tr nh biểu diễn sự liŒn hệ, ối với dung dịch loªng, cũng c dạng tương tự v
cũng ược døng ể xÆc ịnh ph n tử lượng của cÆc chất tan. ΔT = K .Cm
ΔT : ộ hạ nhiệt ộ ng ặc của dung dịch so với dung m i tinh chất.
K : hằng số nghiệm ng phụ thuộc v o bản chất dung m i.
Cm : nồng ộ molan của chất tan.
V dụ: T nh gần œng khối lượng của etylen glycol cần thŒm v o 10 l t nước ể thu
ược một dung dịch c nhiệt ộ ng ặc l 23,30C. Biết MŒtylenglicol = 62,1. Khối lượng riŒng
của nước 1g/ml, hằng số nghiệm ng của nước 1,860C kg/mol. Giải ΔT = K .Cm; 23,3 Cm = =12,5 mol/kg 1,86
Do 10 l t nước c khối lượng 10 Kg, nŒn
Khối lượng etylenglycol cần : 12,5×6,21 10× −3 = 7,8Kg
Dưới Æp suất b nh thường nước c khối lượng riŒng (tỷ trọng) cao nhất l ở 4 C: 1 g/cm‡
l v nước vẫn tiếp tục giªn nở khi nhiệt ộ giảm xuống dưới 4 C. Hiện tượng n y kh ng
ược quan sÆt ở bất kỳ một chất n o khÆc. Điều n y c nghĩa l : Với nhiệt ộ trŒn 4 C,
nước c ặc t nh giống mọi vật khÆc l n ng nở, lạnh co; nhưng với nhiệt ộ dưới 4 C, nước
lại lạnh nở, n ng co. Do h nh thể ặc biệt của ph n tử nước (với g c liŒn kết 104,45 ), khi
bị l m lạnh cÆc ph n tử phải dời xa ra ể tạo liŒn kết tinh thể lục giÆc mở. V vậy m tỉ
trọng của nước Æ nhẹ hơn nước thể lỏng. 82 lOMoAR cPSD| 45734214
H nh 35. CÆc tinh thể nước ở trạng thÆi ng lạnh < 40C
Khi ng lạnh dưới 4 C, cÆc ph n tử nước phải dời xa ra ể tạo liŒn kết tinh thể lục giÆc mở.
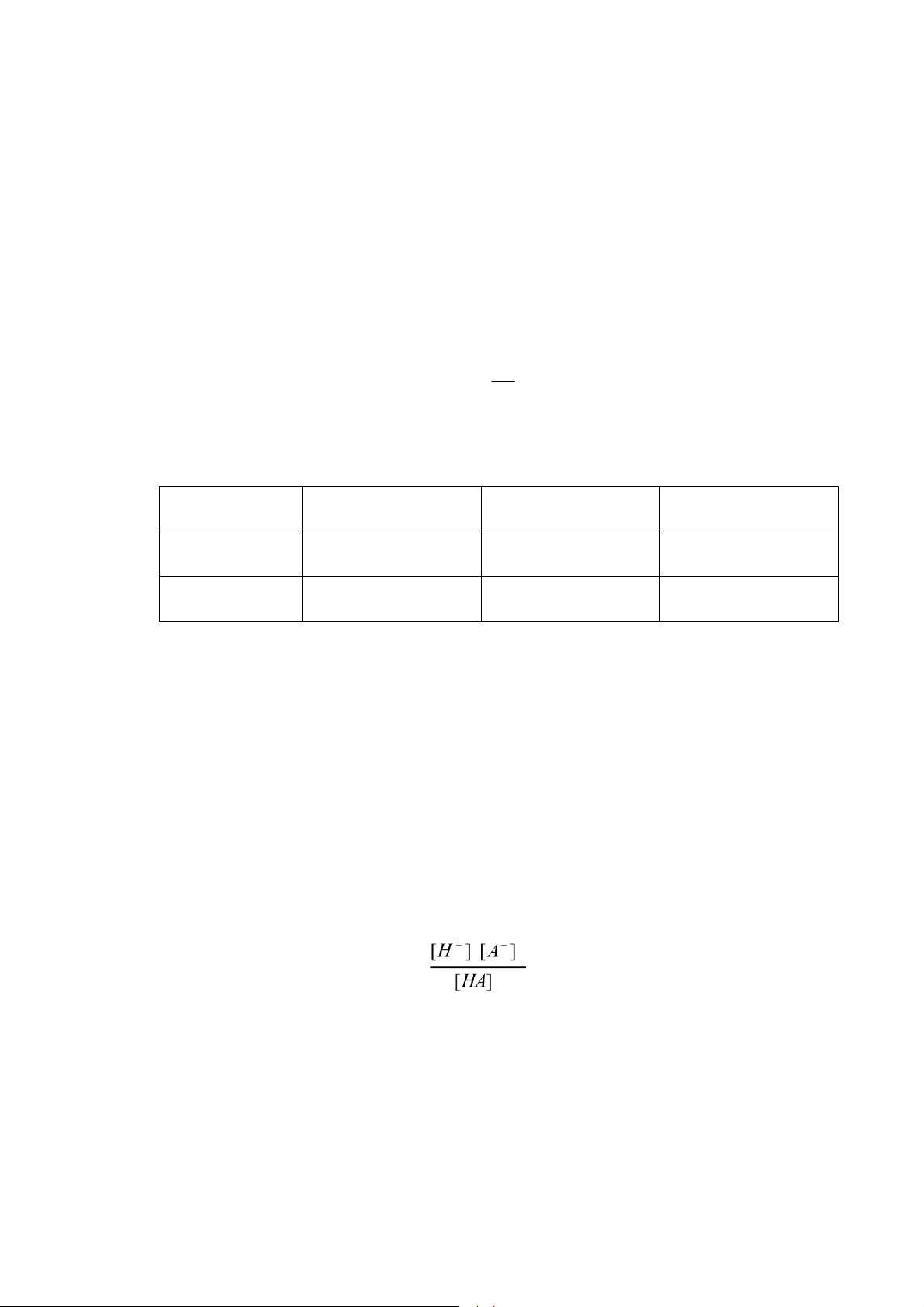
5.2.4. `p suất thẩm thấu của dung dịch
`p suất thẩm thấu l Æp suất cần phải tÆc dụng lŒn một dung dịch ể thế nhiệt
ộng của n lấy lại giÆ trị m n c ối với dung m i tinh khiết.
V dụ 1: Khi thả v o nước tinh khiết, nước th m nhập nhanh ch ng v o dung dịch ường
qua m ng v người thấy nước d ng lŒn trong ống. —ồng thời, nhưng với tốc ộ nhỏ hơn
nhiều, ường cũng khuếch tÆn v o trong nước tinh khiết. Cuối cøng nồng ộ hai bŒn m
ng c n bằng nhau, cÆc mực cũng vậy, cÆc hiện tượng khuếch tÆn t nhiều c t nh chọn
lọc qua cÆc m ng gọi l sự thẩm thấu. CÆch ph n t ch một hỗn hợp nhờ sử dụng cÆc
hiện tượng thẩm thấu gọi l phØp thẩm tÆch.
V dụ 2: Một ống thủy tinh ược ngăn cÆch bởi một m ng bÆn thấm ở giữa (m ng
bÆn thẩm c t nh chất ặc biệt l chỉ cho cÆc ph n tử dung m i thấm qua nhưng kh ng cho
cÆc ph n tử chất tan thấm qua). Cho v o hai bŒn ống cøng thể t ch dung m i nguyŒn
chất v dung dịch chứa chất tan. Sau một thời gian thể t ch của dung dịch tăng c n thể t
ch của dung m i nguyŒn chất giảm. QuÆ tr nh di chuyển dung m i nguyŒn chất sang
dung dịch th ng qua m ng bÆn thấm ược gọi sự thẩm thấu. —ến một lœc n o mực chất
lỏng bŒn phần ống ựng dung dịch kh ng d ng cao lŒn nữa, quÆ tr nh thẩm thấu ạt ến
c n bằng. Kết quả l mực chất lỏng trong ống ựng dung dịch cao hơn trong phần ống ựng
dung m i nguyŒn chất, iều n y c nghĩa l Æp suất tĩnh của dung dịch lớn hơn của dung
m i tinh chất. Phần Æp suất chŒnh lệch ược gọi l Æp suất thẩm thấu.
H nh 36. Th nghiệm xÆc ịnh Æp suất thẩm thấu 83 lOMoAR cPSD| 45734214
`p suất thẩm thấu cũng ược sử dụng ể xÆc ịnh ph n tử lượng của chất tan v ược døng
nhiều hơn cÆc phương phÆp khÆc bởi v chỉ cần một nồng ộ nhỏ của chất tan cũng tạo
nŒn ược một Æp suất thẩm thấu c giÆ trị Æng kể.
Lực cần tÆc dụng lŒn một ơn vị diện t ch của m ng bÆn thấm ể l m triệt tiŒu
hiện tượng thẩm thấu gọi l Æp suất thẩm thấu (k hiệu π). `p suất n y bằng Æp suất thủy
tĩnh của cột chất lỏng c chiều cao h g y ra.
♦ Định luật Van t Hoff về Æp suất thẩm thấu
Năm 1887 Van’t Hoff xÆc ịnh Æp suất thẩm thấu của dung dịch lỏng chứa chất
tan kh ng iện li thỏa mªn phương tr nh: π = CRT C:
nồng ộ mol của dung dịch R: hằng số kh
T: nhiệt ộ tuyệt ối (0K) π: `p suất thẩm
thấu của dung dịch (atm) Thay C = =n m V MV ta ược: πV = m RT M
V: thể t ch dung dịch (l t) chứa m gam chất tan.
M: Khối lượng ph n tử của chất tan
`p suất thẩm thấu của dung dịch bằng Æp suất g y bởi chất tan, nếu như ở cøng
nhiệt ộ chất tan nằm ở trạng thÆi kh v chiếm một thể t ch bằng thể t ch dung dịch.
Định luật n y chỉ Æp dụng cho dung dịch loªng chứa chất tan kh ng bay hơi v khi
kh ng c sự tương tÆc giữa cÆc chất. `p suất thẩm thấu chỉ phụ thuộc v o nhiệt ộ v nồng ộ chất tan.
Việc o Æp suất thẩm thấu cũng ược sử dụng ể xÆc ịnh khối lượng ph n tử chất tan.
V dụ 3: H a tan 1. 10-3g một protein v o nước v chỉnh ến thể t ch 1ml. Dung
dịch thu ược c Æp suất thẩm thấu l 1,12mmHg ở 250C. T nh khối lượng ph n tử của protein. Giải: π=1,12× =1,47 10× −3atm;
R = 0,082atm K mol/0 . ; T= +25 273 298= 0K 1,47 10× −3 84 lOMoAR cPSD| 45734214 C =
= 6,02 10× −5mol l/ ; 0,082×298 1,00 10× −3 Khối lượng ph n tử = 6,02 10× −5 =1,66 10× 4 ♦ Ứng dụng:
Hiện tượng thẩm thấu c nghĩa sinh học rất quan trọng v m ng của cÆc tế b o l m
ng thẩm thấu. Thẩm thấu l nguyŒn nh n trực tiếp của quÆ tr nh hœt nước từ m i trường
v quÆ tr nh vận chuyển nước trong cơ thể sinh vật. Tuy nhiŒn, Mỗi sinh vật chỉ phÆt
triển b nh thường trong m i trường c Æp suất thẩm thấu th ch hợp. Do nếu b n ph n với
nồng ộ quÆ lớn c thể l m c y chết v mất nước.
Dịch tế b o của mỗi cơ thể sống c nồng ộ cÆc chất dinh dưỡng xÆc ịnh nŒn c
Æp suất thẩm thấu xÆc dịnh. Khi Æp suất thẩm thấu của dịch tế b o lớn hơn của m i
trường sẽ g y ra sự thẩm thấu nước ở m i trường v o tế b o v l m cho nước di chuyển từ
tế b o nọ sang tế b o kia.
QuÆ tr nh thẩm thấu ược nghiŒn cứu ở th nghiệm sau: Khi c y hØo ặt trong nước th
tươi lại. Khi nước thấm v o tế b o, n sẽ tạo ra Æp suất dư trong Æp suất n y c ng tăng
nhẹ ở vỏ tế b o v giữ n ở trạng thÆi căng. Nếu cắt ứt c y, do nước bay hơi nŒn thể t ch
của chất lượng bŒn trong giảm xuống v vỏ tế b o xẹp i, c y sẽ hØo. Nếu như ặt c y vừa
mới hØo v o nước th sự thẩm thấu lại bắt ầu, tế b o lại căng ra v c y tươi lại.
Một trong những ứng dụng quan trọng của sự thẩm thấu l tạo ra mÆy lọc mÆu cho
những bệnh nh n bị bệnh thận. MÆu ược cho chảy qua một ống l m bằng cellophane,
ng vai tr m ng bÆn thẩm, ống ược ặt trong dung dịch rửa (dialyzing). Dung dịch n y
chứa cÆc ion cũng như chứa cÆc chất tan c nồng ộ bằng nồng ộ của chœng trong mÆu,
do sự thẩm thấu cÆc chất n y sẽ thấm qua m ng i v o dung dịch v do mÆu ược lọc sạch.
Dung dịch c Æp suất thẩm thấu như nhau gọi l dung dịch ẳng trương. CÆc chất lỏng
bơm v o mÆu phải ẳng trương với chất lỏng trong mÆu.
B y giờ nếu chœng ta cho nước nguyŒn chất tiếp xœc với dung dịch nước muối th ng
qua một m ng bÆn thẩm v tÆc ộng lŒn dung dịch nước muối một Æp suất lớn hơn Æp
suất thẩm thấu của dung dịch nước muối th sẽ xảy ra quÆ tr nh thẩm thấu ngược nghĩa
l nước sẽ chuyển từ dung dịch v o nước nguyŒn chất. Ứng dụng n y c nghĩa thực tiễn
lớn. CÆc mÆy khử muối xÆch tay ứng dụng nguyŒn tắc trŒn cho phØp lọc ược 5 l t
nước từ nước biển trong 1 giờ. 5.3. Dung dịch iện ly
5.3.1. Thuyết iện ly a. Thuyết Arrhenius
Ax t l hợp chất chứa hi ro khi tan trong nước ph n li ra cation H+.
Bazơ l hợp chất chứa OH khi tan trong nước ph n li ra anion OH-. b.
Thuyết Bronsted Lowry 85 lOMoAR cPSD| 45734214
Ax t l tiểu ph n (ph n tử, ion) c khả năng nhường proton (H+).
Bazơ l tiểu ph n (ph n tử, ion) c khả năng nhận proton.
V dụ, khi ho tan NaCl v o nước:
NaCl + (x + y)H2O → Na+.xH2O + Cl-.yH2O
CÆc chất khÆc nhau c mức ộ ph n li khÆc nhau nŒn ta c chất iện li mạnh v
chất iện li yếu. c. Độ iện li:
Độ iện li α của một chất iện li l tỉ số số ph n tử ph n li ra ion (n) v tổng số ph n tử ho tan (n0). α= n no
Vậy ộ iện li của chất iện li mạnh α = 0; của chất iện li yếu: 0 < α < 1.
Để ph n biệt mức ộ mạnh - yếu của chất iện li, người ta qui ước: Chất iện li Yếu Trung b nh Mạnh Độ iện li 0 < α ≤ 0,03 0,03 < α < 0,3 0,3 < α ≤ 1 Sự ph n li ion rất t Một phần Gần ho n to n
d. Ph n loại chất iện li: Chất iện li mạnh, chất iện li yếu, chất kh ng iện li.
Chất iện li mạnh: l chất c khả năng chất iện li ho n to n th nh cÆc ion nghĩa l
trong dung dịch kh ng c n ph n tử chưa iện li; gồm: axit mạnh, bazơ mạnh v muối của chœng.
Chất iện li yếu: l chất chỉ iện li một phần th nh ion (hoặc chỉ c một số ph n tử
iện li ra ion); gồm: axit yếu, bazơ yếu, muối của bazơ yếu v axit yếu. 5.3.2. C n bằng
trong dung dịch chất iện li yếu
a. Hằng số iện li
Sự iện li của chất iện li yếu l một quÆ tr nh thuận nghịch nŒn ta c thể Æp dụng
ịnh luật tÆc dụng khối lượng.
Giả sử c c n bằng: HA → H+ + A- Ta c : Κ= [H+], [A-]: nồng ộ mol
Hằng số c n bằng K gọi l hằng số iện li hoặc hằng số ion hoÆ, ặc trưng cho
khả năng iện li của một chất K; c ng lớn th sự iện li c ng mạnh, chất iện li ph n li ra
cÆc ion c ng nhiều v ngược lại. K phụ thuộc bản chất của chất iện li, dung m i v nhiệt ộ.
b. Mối liŒn hệ giữa hằng số iện li v ộ iện li
Định luật pha loªng Otswald 86 lOMoAR cPSD| 45734214 AB ⇔ A+ + B- Nồng ộ ban ầu: C 0 0
Nồng ộ c n bằng: C - Cα Cα Cα Κ= C Cα. α ⇒ Κ= α2 C C C− α 1−α
Đy l biểu thức ịnh luật pha loªng OstWald.
Nếu α ≤ 0,05 c thể coi 1- α ≈ 1. Từ : α= Κ C
Biểu thức n y cho thấy: ộ iện li tỷ lệ nghịch với căn bậc 2 của nồng ộ chất iện li. Đ l
nội dụng của ịnh luật pha loªng Ostwald. Khi nồng ộ giảm nghĩa l khi
pha loªng th ộ iện li của dung dịch tăng lŒn. 5.3.3.
Đặc iểm iện li của axit v bazơ
a. Axit v sự iện li
- Axit l chất trong dung dịch iện li ra ion H+ (H3O+) v anion gốc axit. HnA → nH+ + AnV dụ: ΗΝΟ − 3 → Η+ + ΝΟ3 T nh
axit của dung dịch l do t nh chất của ion H+
quyết ịnh, chất n o iện li cho c ng nhiều ion H+ th t nh axit c ng mạnh.
- Axit mạnh l ax t iện li gần như ho n to n, axit yếu iện li kh ng ho n to n. - Đối với axit yếu: HA ⇔ H+ + A- Κ =A
KA gọi l hằng số c n bằng axit (hằng số iện li), cÆc axit a chức yếu sẽ iện li th
nh nhiều nấc, mỗi nấc c một hằng số axit riŒng. Hằng số axit chung của to n bộ ph n tử
bằng t ch cÆc hằng số axit riŒng.
Bảng 11. Hằng số iện li (Ka) v pKa của một số axit yếu TŒn axit C ng thức ph n tử Ka pKa A. Oxalic HOOC-COOH 7,5.10-2 1,27 5,4.10-5 4,27 87 lOMoAR cPSD| 45734214 A. Photphoric H3PO4 7,5.10-3 2,13 6,2.10-8 7,21 2,2.10-2 11,66 A. Xucxinic HOOC(CH2)2-COOH 6,3.10-5 4,20 2,4.10-6 5,63 A. Acrilic CH2=CH-COOH 5,5.10-5 4,26 A. Fomic HCOOH 1,8.10-4 3,74 A. Axetic CH3-COOH 1,8.10-5 4,76 A. Lactic CH3CH(OH)-COOH 1,4.10-4 3,86 A. Benzoic C6H5-COOH 6,5.10-5 4,19 A. Malonic HOOC-CH2-COOH 1,5.10-3 2,83 2,0.10-6 5,70
b. Bazơ v sự iện li
Bazơ l chất trong dung dịch iện li ra anion OH- v cation kim loại (hoặc ΝΗ+4 ) M(OH)n → Mn+ + nOH-
T nh bazơ do ion OH- quyết ịnh, chất iện li c ng nhiều ion OH- th t nh bazơ c ng mạnh.
Bazơ mạnh l bazơ iện li ho n to n, bazơ yếu iện li kh ng ho n to n.
Đối với bazơ yếu: quÆ tr nh iện li thuận nghịch; hằng số c n bằng iện li của bazơ gọi l hằng số bazơ. NH + 4OH ⇔ NH4 + OH- Κ =Β
CÆc bazơ a chức yếu sẽ iện li th nh nhiều nấc, mỗi nấc c một hằng số bazơ
riŒng. Hằng số bazơ chung của to n bộ ph n tử bằng t ch cÆc hằng số bazơ riŒng.
Bảng 12. Hằng số iện li (Kb) v pKb của một số bazơ yếu TŒn bazơ C ng thức ph n tử Kb pKb Dietylamin (C2H5)2NH 9,6.10-4 3,00 88 lOMoAR cPSD| 45734214 Etylamin CH3NH2 5,6.10-4 2,13 Amoniac NH3 1,8.10-5 4,74 Hidroxilamin NH2OH 1,1.10-8 7,97 Anilin C6H5NH2 3,8.10-10 9,42 UrŒ (NH2)2CO 1,5.10-14 13,82
5.3.4. T ch số ion của nước - ộ pH của một số dung dịch
a. T ch số ion của nước
Nước nguyŒn chất tuy với mức ộ rất nhỏ, cũng c khả năng dẫn iện, trong nước tồn tại c n bằng: H2O ⇔ H+ + OH-
Vậy nước l chất iện li yếu: H2O + H2O ⇔ H3O+ + OH-
T ch số nồng ộ cÆc ion H+ v OH- trong nước nguyŒn chất hoặc trong dung dịch kh ng
quÆ ặc ở mỗi nhiệt ộ l một hằng số gọi l t ch số ion của nước, k hiệu Kw: Kw = [H+][OH-]
Ở 250C ta c Kw =[H+][OH-] = 10-14
M i trường ax t: [H+] > [OH-] v [H+] > 10-7 M i
trường bazơ: [H+] < [OH-] v [H+] < 10-7 b. Độ pH
Để ặc trưng cho ộ axit, bazơ hay trung t nh của một dung dịch, người ta sử dụng
một ại lượng gọi l pH. pH = - lg[H+].
pH ược gọi l chỉ số hy r hay ộ pH.
Dung dịch c pH c ng nhỏ → [H+] c ng lớn → dung dịch c t nh ax t c ng mạnh.
Dung dịch c pH c ng lớn → [H+] c ng nhỏ → [OH-] c ng lớn → dung dịch c t nh
ax t c ng yếu (t nh bazơ c ng mạnh). c. Chất chỉ thị về pH
Nhiều phản ứng chỉ xảy ra ở một ộ pH xÆc ịnh. Để biết ộ pH sơ bộ của dung
dịch nghiŒn cứu, người ta thường døng cÆc chất chỉ thị m u hay chất chỉ thị về pH.
♦ Định nghĩa
Chất chỉ thị về pH l những chất c m u sắc thay ổi phụ thuộc v o pH, chœng thường
l axit hay bazơ hữu cơ yếu m dạng ph n tử v dạng ion c m u khÆc nhau. V dụ: Một
chất chỉ thị pH l axit th trong dung dịch tồn tại c n bằng ph n li: HInd ⇔ H+ + Ind- Dạng axit Dạng bazơ 89 lOMoAR cPSD| 45734214 -
Nếu m i trường axit th c n bằng chuyển dịch theo chiều nghịch, cho ến khi
th dung dịch c m u dạng axit. -
Nếu m i trường bazơ th c n bằng chuyển dịch theo chiều thuận, cho ến khi
th dung dịch c m u dạng bazơ.
♦ Khoảng ổi m u của chất chỉ thị
L khoảng pH từ khi chỉ thị bắt ầu chuyển m u ến chuyển m u ho n to n.
Bảng 13. Khoảng ổi m u của một số chất chỉ thị Chất chỉ thị Khoảng ổi m u M u dạng axit M u dạng bazơ Metyl da cam 3,1 - 4,4 Đỏ cam V ng Metyl ỏ 4,4 - 6,2 Đỏ V ng Qu t m 5 - 8 Hồng Xanh Phenolftalein 8 - 10 Kh ng m u Hồng Timolftalein 9,4 - 10,6 Kh ng m u Xanh
Ngo i ra người ta c n døng chất chỉ thị vạn năng l hỗn hợp gồm nhiều chất chỉ
thị khÆc nhau (phenolftalein, metyl ỏ, metyl v ng, timolftalein,...).
Đại lượng ặc trưng ối với mỗi chất chỉ thị pH l khoảng ổi m u của chất chỉ thị. Đ
l khoảng pH m chất chỉ thị bắt ầu chuyển từ một m u n y sang ho n to n một m u khÆc.
d. Độ pH của một số dung dịch * pH của dung dịch ax t mạnh một nấc
Ax t một nấc l ax t m một ph n tử ( hoặc một ion ) chỉ c thể nhường một H+ pH = - lgCa
* pH của dung dịch bazơ mạnh một nấc
Bazơ một nấc l ax t m một ph n tử ( hoặc một ion ) chỉ c thể nhận một H+ pH = 14 + lgCb
* pH của dung dịch ax t yếu một nấc
XØt dung dịch ax t yếu CH3COOH nồng ộ Ca mol/l:
CH3COOH + H2O ⇔ CH3COO- + H3O+ nồng ộ ban ầu Ca 0 0 nồng ộ c n bằng Ca x x x Κ =a
x x. → +Κ −Κx2 a x aCa = 0 Ca −x 90 lOMoAR cPSD| 45734214
Khi biết Ka, Ca sẽ t m ược x = [H3O+] với 0 < x < Ca.
Nếu x quÆ nhỏ so với Ca ( x ≤ 5%Ca ) th c thể coi Ca - x ≈ Ca. Từ ta c : x = K Ca a
* pH của dung dịch bazơ yếu một nấc
XØt dung dịch bazơ yếu NH3 nồng ộ Cb mol/l : NH + 3 + H2O ⇔ NH4 + OH- nồng ộ ban ầu Cb 0 0 nồng ộ c n bằng Cb x x x Κ = x x. b
→ +Κ −Κx2 bx bCb = 0 với 0 < x < Cb. Cb −x
Nếu x quÆ nhỏ so với Cb ( x ≤ 5%Cb ) th c thể coi Cb - x ≈ Cb. Từ ta c : x = K Cb b
5.3.5. Sự thủy ph n của muối
Định nghĩa: Phản ứng thuỷ ph n l phản ứng trao ổi cÆc ion của muối với cÆc ion của nước tạo ax t v bazơ.
Điều kiện xảy ra: Phản ứng thuỷ ph n xảy ra khi c sự tạo th nh ax t yếu hoặc bazơ yếu.,
do ộ pH của muối sẽ phụ thuộc v o t nh chất của ax t hoặc bazơ tạo th nh.
Đặc iểm của phản ứng thủy ph n muối
+ C t nh chất thuận nghịch nŒn c thể Æp dụng nguyŒn l chuyển dịch c n bằng.
+ Chỉ c gốc ax t yếu v bazơ yếu trong muối mới bị thủy ph n. Ax t c ng yếu, bazơ c ng
yếu th gốc của n trong muối mới bị thuỷ ph n c ng mạnh.
+ Khi tăng nhiệt ộ th ộ thuỷ ph n c ng mạnh.
+ Nếu ho tan một muối c gốc ax t yếu v một muối c p gốc bazơ yếu v o cøng một dung
dịch th sự thủy ph n muối tăng cường lẫn nhau v c thể bị thủy ph n ho n to n.
CÆc loại muối thủy ph n
- Muối của bazơ yếu với ax t mạnh: Thuỷ ph n tạo bazơ yếu v pH < 7.
pH = −7 (pKb + lgCm )
- Muối của bazơ mạnh với ax t yếu: Thuỷ ph n tạo ax t yếu v pH > 7.
pH = +7 (pKa + lgCm )
- Muối của bazơ yếu với ax t yếu: Thuỷ ph n tạo ax t yếu v bazơ yếu. 91 lOMoAR cPSD| 45734214 Một số nhận xØt -
Nếu ion của muối l những cation trung t nh th quÆ tr nh ph n li chỉ dừng lại ở
cÆc ion bị hi rÆt hoÆ v c pH của dung dịch kh ng thay ổi (pH = 7). -
Nếu ion của những anion v cation ax t , bazơ hoặc lưỡng t nh th chœng sẽ tương
tÆc với dung m i nước ể tạo ra sản phẩm c chứa chất kết tủa, bay hơi hoặc iện li yếu.
QuÆ tr nh n y gọi l sự thủy ph n của muối. Trong cÆc trường hợp n y pH của dung dịch sẽ thay ổi 5.4. Dung dịch keo
5.4.1. KhÆi quÆt v ph n loại a. KhÆi quÆt
Trạng thÆi keo của vật chất l trạng thÆi ph n tÆn dị thể, trong từng hạt riŒng lẻ kh
ng phải l một ph n tử m l một tập hợp nhiều ph n tử. Cơ thể ộng vật v thực vật gồm
những dung dịch v gel của cÆc chất cao ph n tử. V thế sinh hoÆ học gắn liền với hoÆ học chất keo.
CÆc hạt c k ch thước hơn ph n tử v ion nhưng kh ng ủ lớn ể c thể quan sÆt ược bằng
k nh hiển vi quang học ược gọi l cÆc hạt keo.
Hạt keo l một hệ phức tạp tạo nŒn bởi một số lượng lớn khoảng từ 103 - 105 nguyŒn
tử, c khối lượng khoảng 104 - 109 ơn vị nguyŒn tử, với k ch thước từ 10-5 ến 10-7 cm.
Cấu tạo hạt keo: Trung t m của hạt keo c thể l tinh thể ion rất nhỏ, hoặc c thể l một nh
m ph n tử, hoặc chỉ c thể l một ph n tử k ch thước lớn. Chœng hấp thụ một lớp ion c
cøng iện t ch từ m i trường, lớp ion n y ến lượt n lại hấp thụ một lớp ion c iện t ch trÆi
dấu bao quanh, kết quả dẫn ến cÆc hạt keo phần bŒn ngo i ều c cøng iện t ch.
H nh 37. Cấu tạo hạt keo
Do c cøng iện t ch nŒn cÆc hạt keo sẽ ẩy nhau, kh ng thể kết hợp lại ược th nh
hạt c k ch thước lớn tÆch ra khỏi hệ. Ch nh lực ẩy tĩnh iện n y l m cho hệ keo bền trong
một khoảng thời gian d i.
Hệ keo bao gồm: Nh n, lớp hấp phụ, lớp ion ối tạo th nh hạt. Hạt mang dấu iện t ch của lớp hấp phụ. -
Nh n: Trung h a về iện, gồm một số lớn nguyŒn tử hay kết ph n tử hợp lại. -
Lớp hấp phụ (hay lớp ion cøng dấu bị hập phụ): nh n l một tập hợp ph n tử c bề
mặt lớn nŒn c khả năng hấp phụ một loại ion của dung dịch c trong th nh phần của nh
n v trở th nh bề mặt mang iện, cÆc ion n y ph n bố quanh nh n tạo th nh lớp hấp phụ. -
Lớp ion ối (hay lớp ion bị hấp phụ): lớp hấp phụ c khả năng hœt một số ion
ngược dấu với n . CÆc ion n y ph n bố gần nh n tạo lớp ion ối. 92 lOMoAR cPSD| 45734214 -
Lớp khuyếch tÆn (hay lớp ion khuếch tÆn): một số ion ối c n lại trong m i
trường ph n tÆn tạo lớp khuyếch tÆn. Lớp n y bị hạt keo hœt yếu nŒn chuyển ộng tương ối tự do.
Hạt + lớp khuyếch tÆn = mixen
Mixen trung ho về iện. Dươ tÆc dụng của iện trường, hạt chuyển về một iện cực,
c n lớp khuyếch tÆn chuyển về iện cực kia. Nếu lớp hấp phụ mang iện (+) ta c keo (+)
v ngược lại. b. Ph n loại
C hai cÆch ph n loại hệ keo: CÆch 1: -
Keo th n dịch: tiểu ph n keo liŒn kết chặt chẽ với m i trường ph n tÆn nhờ lớp
vỏ solvat, khi l m ng tụ dung dịch keo n y ta thu ược một khối ặc gọi l gel. V dụ: Keo protein -
Keo sơ dịch: tiểu ph n keo kh ng tạo ược lớp vỏ solvat với m i trường ph n tÆn
nŒn kh ng gắn chặt với m i trường. Khi l m ng tụ, keo n y sẽ kết tủa v tÆch khỏi m i
trường ph n tÆn dưới dạng bột.
V dụ: Keo hydroxit, oxit kim loại.
Khi m i trường ph n tÆn l H2O, ta c keo th n nước v keo sơ nước, keo th n dịch
bền hơn keo sơ dịch. T nh chất th n dịch hoặc sơ dịch của keo c n phụ thuộc m i trường ph n tÆn.
V dụ: Keo Ca3(PO4)2 CÆch
2: Keo dương v keo m. -
Keo dương gồm: Hi roxit kim loại, phẩm nhuộm hữu cơ, hŒm grobin, -
Keo m gồm: Keo lưu huỳnh, keo sunfua, gốm Ả rập,
♦ Keo dương Fe(OH)3 -
Thủy ph n FeCl3 trong nước s i ta ược dung dịch keo sắt (III) hi rox t: FeCl3 = Fe3+ + 3ClSau : Fe3+ + H + 2O ⇔ Fe(OH)2 + H+ Fe(OH)2+ + H + 2O ⇔ Fe(OH)2 + H+ Fe(OH) + 2 + H2O ⇔ Fe(OH)3 + H+ Fe3+ + 3H2O ⇔ Fe(OH)3 + 3H+
Tổng quÆt: FeCl3 + 3H2O ⇔ Fe(OH)3 + 3H+ + 3Cl- -
CÆc ph n tử Fe(OH)3 tạo th nh d nh kết lại th nh tập hợp: [Fe(OH)3]m. - Bề mặt
của tập hợp hấp thụ ion Fe3+ tạo th nh nh n hạt keo: 93



