















Preview text:
lOMoAR cPSD| 47207194 HÓA PHÂN TÍCH (Analytical Chemistry)
Ts. Phạm Trần Nguyên Nguyên ptnnguyen@hcmus.edu.vn
(Dành cho sinh viên Khoa Hóa , Đại Học Lạc Hồng) Năm học 2008-2009 Học Kỳ 2
THÔNG TIN TỔNG QUÁT • Thời lượng: 48 tiết • Giờ dạy: tiết 1-4 (7:30 – 11:00) • Địa điểm: ĐH Lạc Hồng • Ngày: Thứ Năm, thứ Bảy 23/04 – 30/05 • Bài giảng:
Tài liệu bài giảng PowerPoint chỉ gồm những điểm chính của bài học
SINH VIÊN CẦN TỰ GHI CHÉP THÊM CHO MÌNH 2 lOMoAR cPSD| 47207194
TÀI LIỆU THAM KHẢO
• Cơ sở hóa học phân tích
A.P.kreskov, nhà xuất bản đại học và giáo dục chuyên
nghiệp Hà Nội, 1990.
• Phân tích định lượng
Nguyễn thị Thu Vân, nhà xuất bản ĐH Quốc Gia Tp. HCM, 2004. 3 MỤC TIÊU
Cung cấp kiến thức cơ bản, cơ sở lý thuyết về:
phân tích định tính phân tích định
lượng nồng độ dung dịch điện ly sự
cân bằng trong dung dịch điện ly kỹ
thuật phân tích thể tích kỹ thuật phân tích trọng lượng 4 NỘI DUNG MÔN HỌC
Chương 1: Nhập môn hóa phân tích
Chương 2: Cân bằng hóa học
Chương 3: Kỷ thuật phân tích thể tích (pp chuẩn độ) lOMoAR cPSD| 47207194
Chương 4: Cân bằng acid – base và chuẩn độ
Chương 5: Phản ứng tạo phức & chuẩn độ
Chương 6: Phân tích trọng lượng & cân bằng tủa
Chương 7: Phản ứng tạo tủa & chuẩn độ
Chương 8: Pin điện hóa & thế điện cực
Chương 9: Phản ứng Oxy hóa khử & chuẩn độ điện thế Analytical Chemistry PTNNguyen-HCMUS 5 Chương 1
NHẬP MÔN HÓA PHÂN TÍCH I.1 Hoá phân tích?
I.2 Phân tích định tính? Phân tích định lượng?
I.3 Các giai đoạn trong phân tích hóa học
I.4 Một số kiến thức cơ bản cần cho hóa phân tích
A. Chữ số - đơn vị trong hóa học phân tích
B. Dụng cụ đo lường cơ bản trong hóa phân tích
C. Một số phản ứng hóa học dùng trong hóa phân tích
D. Dung dịch-nồng độ dung dịch E. Pha chế dung dịch 1.5 Bài tập
Analytical Chemistry/ I. Introduction PTNNguyen-HCMUS 6 lOMoAR cPSD| 47207194
I.1 H ó a phân t í ch ? Hóa h ọ c?
khoa h ọ c kh ả o s á t :
Các tính ch ấ t, thành
ph ầ n, c ấ u trúc c ủ a v ậ t ch ấ t.
Các bi ế n đổ i v ề tính
ch ấ t, thành ph ầ n, c ấ u
trúc c ủ a v ậ t ch ấ t cùng các thay đổ i n ă ng
“ Every aspect of our world today .. l ượ ng kèm theo các
even politics and international relations .. bi ế n đổ i ấ y. Is affected by chemistry ” - Linus Pauling - 7 Cácngànhhóah ọ c? H ó a sinh H ữ u c ơ ( Biochemical ) ( Organic ) C Phân ơ kim t í ch sinh h ọ c ( ( Organometallic ) Bioanalytical )
Hóah ọ c (Ch emis ) try Phân t í ch Vô c ơ ( Analytical ) I ( norganic) H ó a lý (P hysical ) 8 lOMoAR cPSD| 47207194 Analytical Chemistry?
“Science of Chemical Measurements”
“Everything is made of chemicals. Analytical chemists determine
WHAT and HOW MUCH ” • D ượ c ph ẩ m • Th ự c ph ẩ m • Môi tr ườ ng • Nông nghi ệ p • Công nghi ệ p • … • …. 9
• Hàm lượng chất X trong mẫu là bao nhiêu?
• Mẫu chứa chất X không?
• Nhận danh cấu trúc của X?
• Làm cách nào tách được X ra khỏi mẫu? Hóa phân tích?
Hóa phân tích là bộ môn của ngành hóa học nghiên
cứu về thành phần cấu tạo và hàm lượng các thành
phần của những mẫu khảo sát.
• Hóa phân tích định tính (qualitative analysis)
• Hóa phân tích định lượng (quantitative analysis) lOMoAR cPSD| 47207194 10 Qualitative analysis is what.
Quantitative analysis is how much. 11 lOMoAR cPSD| 47207194 12
I. 2a Phân tích định tính
(Qualitative analysis - What)
Nhận danh cation, anion, hợp chất trong mẫu bằng sự lụa
chọn phản ứng hóa học hay sử dụng thiết bị
Phản ứng tạo tủa Nhóm I: Ag+, Hg22+, Pb2+ → tạo tủa với Cl-, I-
Nhóm II: Bi3+,Cd2+, Cu2+, Hg2+, Sn4+ ….
→ tạo tủa với H2S ở pH=0.5
Nhóm III: Al3+,Co2+, Cr3+, Fe2+,Fe3+, Mn2+, Ni2+, Zn2+
→ tạo tủa với H2S ở pH=9 13
I. 2a Phân tích định tính lOMoAR cPSD| 47207194
(Qualitative analysis - What)
Thử nghiệm ngọn lủa Li + Na + K + Cu ++
Na: lửa vàng ; K: lửa tím; Ca: lửa đỏ gach …. 14
Phản ứng tạo màu đặc trưng
Phân biệt alkan hay alken: dd Br2
soi tinh thể dưới kính hiểm vi
Tinh thể của các hợp chất khác nhau có cấu trúc tinh thể
khác nhau, đặc trưng → dùng kính hiểm vi để phân biệt
SrCrO4 với BaCrO4 ; CuSO4 với BaSO4
điều chế ngọc borax hay phosphate
Một số oxyt kim loại tạo hợp chất với borax hay
phosphate có màu đặc trưng dưới ngọn lửa
Cu-borax: dạng ngọc màu xanh đậm
Mn-borax: dạng ngọc màu tím 15
I. 2b Phân tích định tính lOMoAR cPSD| 47207194
(Quantitative analysis – How much)
Thành phần mẫu phân tích đã biết
Phân tính trọng lượng (gravimetric)
Phân tích thể tích (volumetric)
Phân tích điện hóa (electroanalytical)
Phân tích phổ nghiệm (spectroscopic) Phân
tích sắc ký (chromatographic)
Phân tích bằng các pp vật lý, hóa lý … √ √ √ 17 lOMoAR cPSD| 47207194 18
I. 3 Các bước trong phân tích hóa học
• Xác định vấn đề
thông tin cần phân tích, mức độ cần chính xác?,
kinh phí? Thời gian? Điều kiện về dụng cụ, thiết bị
cho phép của phòng thí nghiệm?
• Chọn lựa kỹ thuật và phương pháp Lấy mẫu (sampling) Xử lý mẫu Phân tích định tính
Phân tích định lượng
• Diễn giải và trình bày kết quả thu được lOMoAR cPSD| 47207194
I.4 Kiến thức cơ bản cần cho hóa phân tích
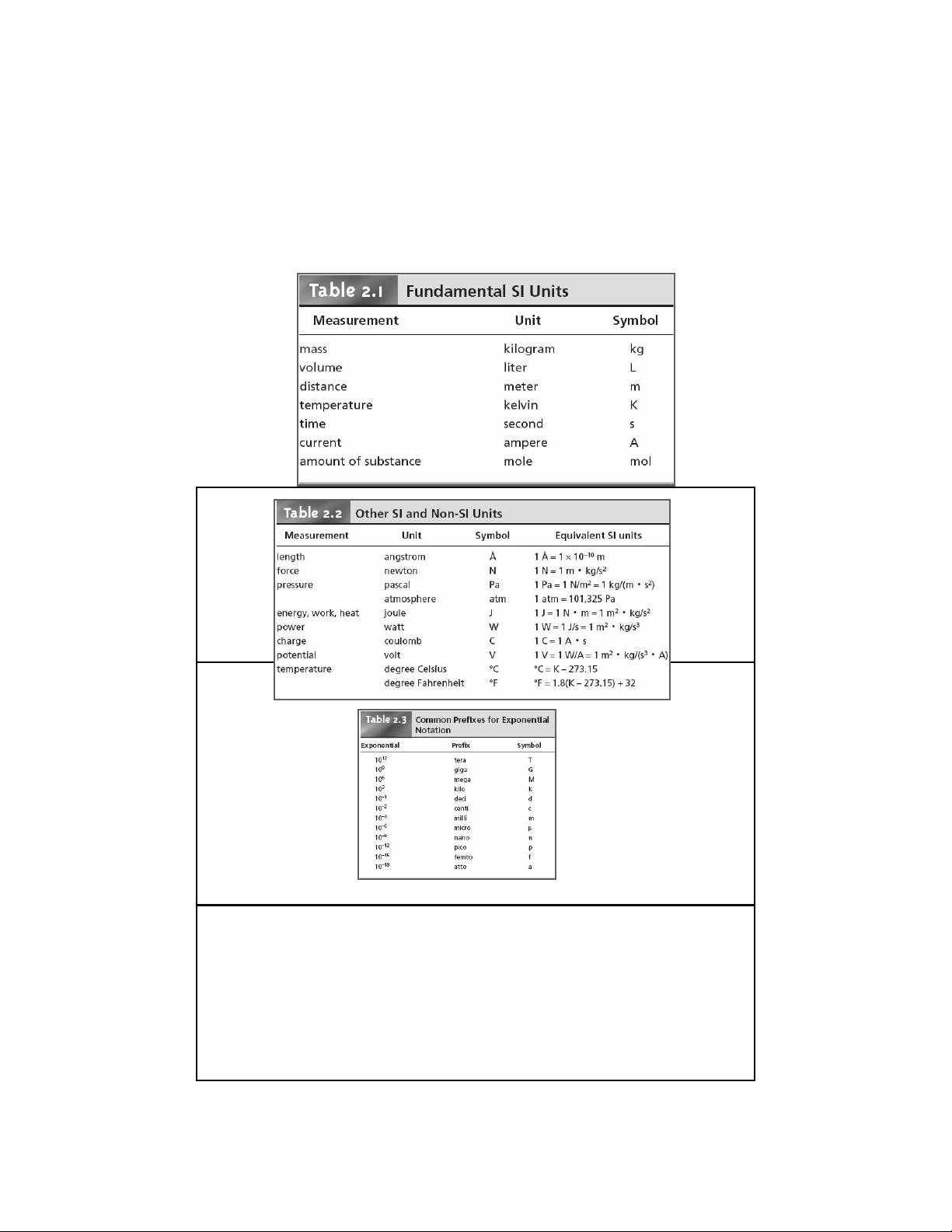
A. Chữ số - đơn vị đo lường trong hóa phân tích
Đơn vị đo lường 21 lOMoAR cPSD| 47207194 22
Chữ số có nghĩa (CSCN)
Là con số có ý nghĩa của 1 đại lượng đã đo hay tính được.
Khi CSCN được kể thì chữ số cuối cùng được hiểu là không tin cậy
• Chữ số khác zero đều là CSCN
- Một mẫu cân nặng 1.759 gram → có 4 CSCN
không tin cậy (1.759 ± 0.001g) • Chữ số chứa zero - 25,508: 5 CSCN
- 0,06 L: 1 CSCN; 0,00093 L: 2 CSCN
- 3,0 g: 2 CSCN; 2,06 ml: 3 CSCN; 4,060 m: 4CSCN 23
• Với con số chính xác: hệ số tỉ lệ trong công thức hóa
học, p.ứ hay hệ số chuyển đổi đơn vị: có vô số CSCN lOMoAR cPSD| 47207194
1 mol CaCl2 có chính xác: 1 mol Canxi và 2 mol Clo 1000 ml = 1L
• Số liệu đo lường thể hiện sự không tin cậy của dụng cụ
hay pp đo → cần ghi đúng CSCN
- Cân mẫu trên cân có độ chính xác ± 0.1 mg
kết quả trình bày: 1.57g 1.570g 1.5700g √
- Dùng buret có vạch chia nhỏ nhất 0,1 ml kết quả
trình bày: 12.26 ml 12.260 ml√ 24
• Một phép đo ~ 100, ~ 10
Trình bày ở dạng khoa học: 1 x 102 :1CSCN 0.1 x 102 : 2 CSCN
• Phép đo dùng hàm logarithm: pH pH = 3.45 → 2 CSCN
• CSCN trong phép cộng và trừ
45,667 + 1,2 = 46,867 làm tròn → 46,9
24,175 – 0,58 = 24,095 làm tròn → 24,10
24,165 – 0,58 = 24,085 làm tròn → 24,08
• CSCN trong phép nhân và chia
45,667 x 1,2 = 54,8004 làm tròn → 55
45,667 : 1,2 = 38,055833 làm tròn → 38 25
1. Indicate how many significant figures are in each of the following numbers. a) 903 b) 0.903 c) 1.0903 d) 0.0903 e) 0.09030 f) 9.03 x102 lOMoAR cPSD| 47207194
2. Round each of the following to three significant figures. a) 0.89377 b) 0.89328 c) 0.89350 d) 0.8997 e) 0.08907 26
3. Report results for the following calculations to the
correct number of significant figures. a. 4.591 + 0.2309 + 67.1 = b. 313 – 273.15 = c. 712 x 8.6 = d. 1.43/0.026 = e. (8.314 x 298)/96485 = f. log(6.53 x10–5) = g. 10–7.14 =
h. (6.51 x 10–5) (8.14 x 10–9) = 27
B Dụng cụ đo lường cơ bản trong hóa phân tích lOMoAR cPSD| 47207194 Kh ố il ượ ng 28 Th ể tích 29 lOMoAR cPSD| 47207194 30
C Một số phản ứng hóa học dùng trong hóa phân tích
Phản ứng oxy hóa khử
Phản ứng trao đổi điện tử giữa cặp oxy hóa / khử, thường
được dùng trong hóa phân tích để: 1. Định tính: 2Fe + 2 I 3+ - → 2Fe2++ I2
→ I2 làm giấy tẩm tinh bột hóa xanh 2. Định lượng:
MnO-4 + 5Fe2+ +8H+ → Mn2++ 5Fe3+ +4H O2 3. Hòa tan:
3Cu + HNO3 →3Cu(NO ) + 2NO3 2 +4H O2 2NO + O2 → NO2
Phản ứng trao đổi tiểu phân lOMoAR cPSD| 47207194
Phản ứng acid-baz
1. Định tính: Đo pH → xác định tính acid, baz
2. Định lượng: Chuẩn độ acid/baz HCl+ NaOH → NaCl+H O2 3. Hòa tan:
CaCO3 + 2HCl → CaCl2 +CO + H O2 2
Phản ứng tạo tủa 1. Định tính: Ag+ + I- → AgI (vàng) 2. Tách nhóm: Ag ,Pb , Hg+ 2+ 2+ 2 + HCl → AgCl, PbCl , Hg Cl2 2 2 3. Định lượng: SO24− + Ba2+ → BaSO4
Phản ứng tạo phức 1. Định tính: lOMoAR cPSD| 47207194
Fe3+ + nSCN- →⎡⎣Fe SCN( )n⎤⎦(3−n)+ (màu đỏ) 2. Hòa tan: + - AgCl + 2NH OH )
4 →⎡⎣Ag NH(3 2 ⎤⎦ + Cl + 2H O2 3. Định lượng:
Ca2++ H Y2 2− → CaY2- +2H+
D Dung dịch (dd) và nồng độ dung dịch lượng chất tan (solute)
Nồng độ của dd = -----------------------------lượng dung dịch (solution)
- dd loãng: lượng chất tan chiếm tỉ lệ nhỏ
- dd đậm đặc: lượng chất tan chiếm tỉ lệ lớn
- dd bão hòa: dd chứa chất tan tối đa (ở T, P xác định)
- dd quá bão hòa: lượng chất tan dư dễ dang tách ra khỏi dd Độ tan(q: khối m lượng dd) S= .100 q m Nồng độ khối lượng hay nồng C = độ g/l: .1000 V
Nồng độ phần trăm (part per hundred, %): m
% (khối lượng/khối lượng) C% KL/KL( )= m .100 % m+q (khối C% KL/TT( )= .100 V lượng/thể tích) lOMoAR cPSD| 47207194 V
% (thể tích/thể tích) C% TT/TT( )= x .100 V
• Nồng độ phần ngàn (part per thousand, ‰):
• Nồng độ phần mười ngàn (part per ten thousand, ‰o): 36
• Nồng độ phần triệu (parts-per-million, ppm) m C ppm( )= .106 m+q
1 ppm = 1 g chất tan / 106 g hay 1000 kg mẫu
= 1 mg chất tan / 106 mg hay 1 kg mẫu ( hay 1L, d =1)
ppb = nồng độ phần tỉ (parts-per-billion, 109) ppt =
nồng độ phần ngàn của tỉ (parts-per-trillion, 1012 ) 37 Nồng độ mol: Nồng độ molan: lOMoAR cPSD| 47207194 m (g) 1000 m (g) 1000 CM = . Cm = . M V(ml) n M q (g) Ni = i Nồng độ phân mol: N m 1000
Nồng độ đương lượng: CN = . dlg V
Đương lượng của một M
nguyên tố X: n là hóa trị của X trong hợp dlg = X n chất
N2O: đương lượng của N = 14 NO: “ 14/2 N2O3 : “ 14/3 N2O5 “ 14/5 38
Đương lượng của một hợp chất AB M n là số dlg = AB
đlg tham gia p.ứ, thay đổi tùy theo p.ứ AB n tham gia
1. AB là chất oxy hóa - khử → n số điện tử trao đổi ứng với 1 mol
MnO-4 +5e → Mn2+ dlg(KMnO )4 = MKMnO 5,dlg(MnO 4 2 ) = MMnO2 5
Cr O272- +6e → 2Cr3+ dlg(K CrO )2 7 = MK Cr O2 2 7 6,dlg(CrCl3) = MCrCl33
2. AB là acid hay baz → n số ion H+ hay OH- trong 1 mol chất
HCl → H + Cl dlg(HCl)+ - =M 1HCl H PO → 3 4 3H + PO dlg(H PO+ 3-4 3 4 ) = M 4 H PO33 1 NaOH → Na + OH dlg(NaOH)+ - = MNaOH Ca OH( ) → 2 Ca2+ + 2OH dlg(Ca OH- ( )2 ) =MCa OH( )2 2 39



