


Preview text:
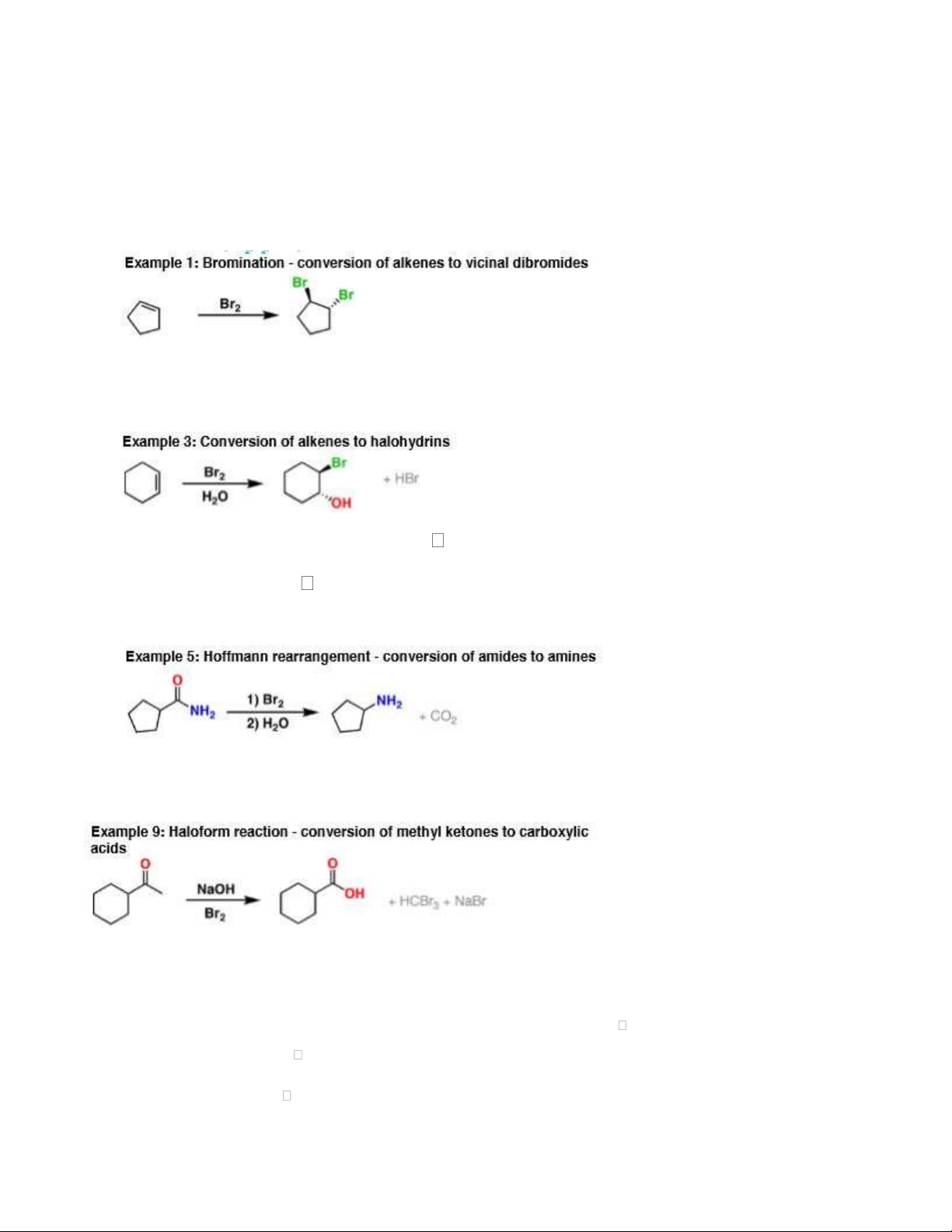
TÁC NHÂN PHẢN ỨNG 1. Brom: 1.1. Br2/CCl4
- Cộng vào nối đôi/ba; tùy theo tỷ lệ sẽ ra sản phẩm khác nhau. Vd: Br2 + HC CH (1:1) và (1:2) 1.2. Br2/H2O:
- Cộng vào nối đôi của anken tạo thành halohydrin:
- Chuyển andehid thành acid : RCHO RCOOH C2H5CHO + Br2/H2O
- Thế nhân thơm phenol (tribromo phenol) -
Thoái phân amid tạo thành amin: - 1.3. Br2/NaOH
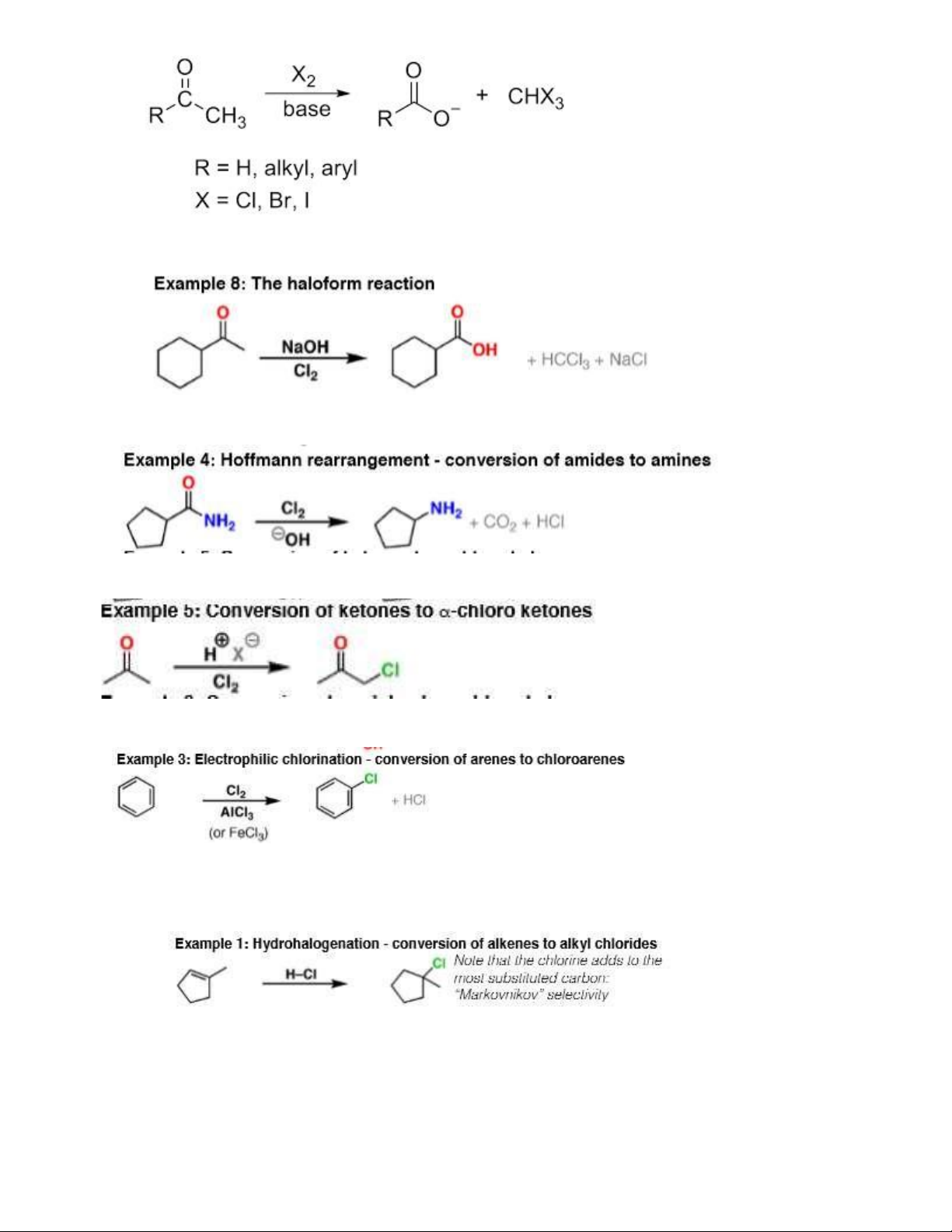
- Chuyển methyl ceton thành acid
Tương tự: Cl2/NaOH và I2/NaOH (I2/OH- CH3-CO-R’ / CH3-CH(OH)-R’)
- Thoái phân amid tạo thành amin: CH3CONH2 + Br2/OH- CH3NH2
1.4. Br2/CS2 + phenol monobromo phenol
1.5. Br2 + RCOOAg R-Br + CO2 + Ag 1
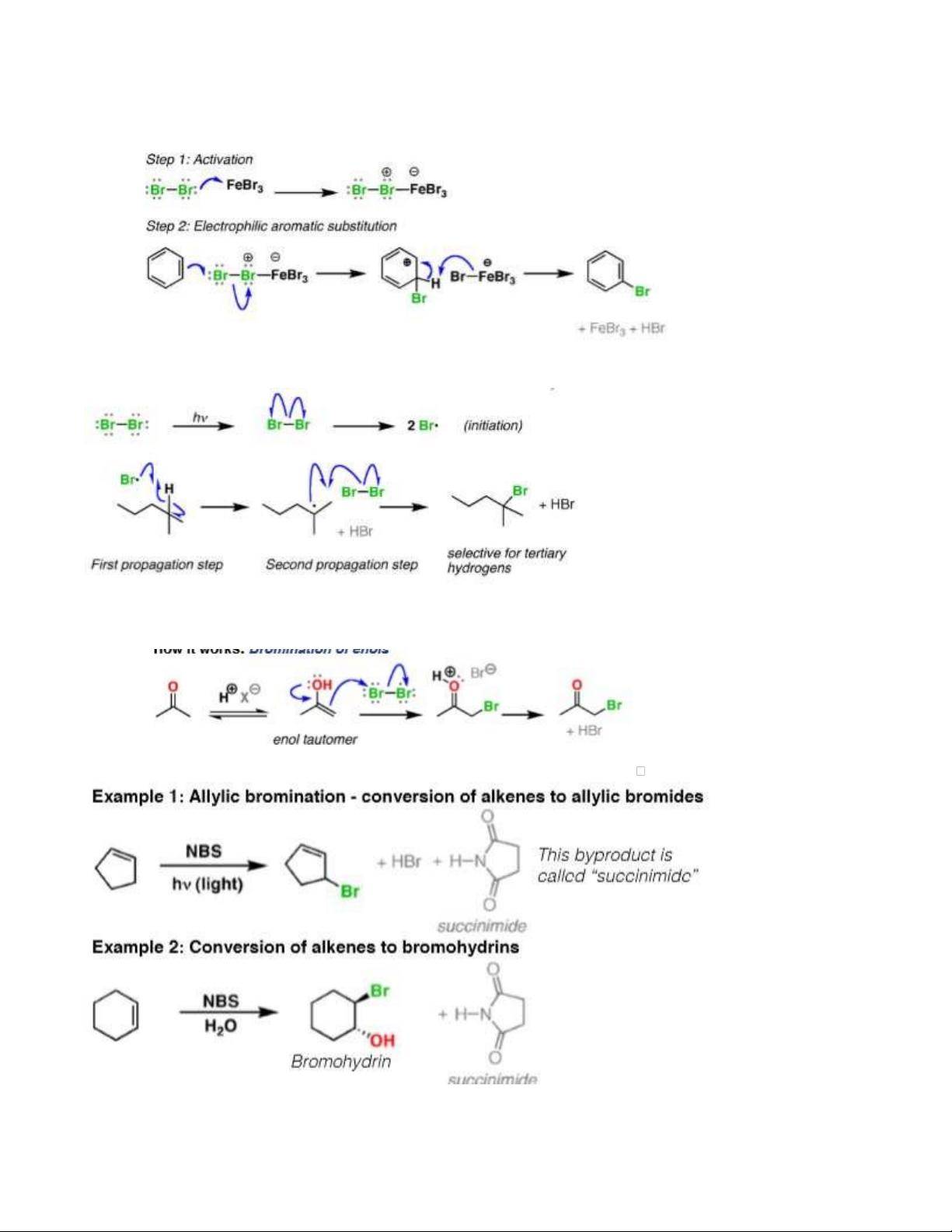
1.6. Br2/Fe (t0) xúc tác cho phản ứng thế vào nhân thơm.
1.7. Br2 (hv/askt/t0) xúc tác cho p.ư thế ưu tiên vào C bậc cao
1.8. Br2/HX: chuyển ceton thành α-bromoceton
1.9. NBS/(hv or t0) : thế Br vào Cα vd: CH2=CH-CH3 + NBS 2 1.10. HBr
- Cộng vào nối đôi của anken bất đối xứng theo Maccopnhicop, HBr + but-2-en HBr + but-1-en
- Khi có mặt peroxide sẽ xảy ra ngược quy tắc này.
HBr (peroxide) + but-1-en HX (peroxide) + but-1-en
- Khi có nhóm hút điện tử mạnh đính trực tiếp vào nối bội:
HBr + CH2=CH-COOH HBr (peroxide) + CH2=CH-COOH
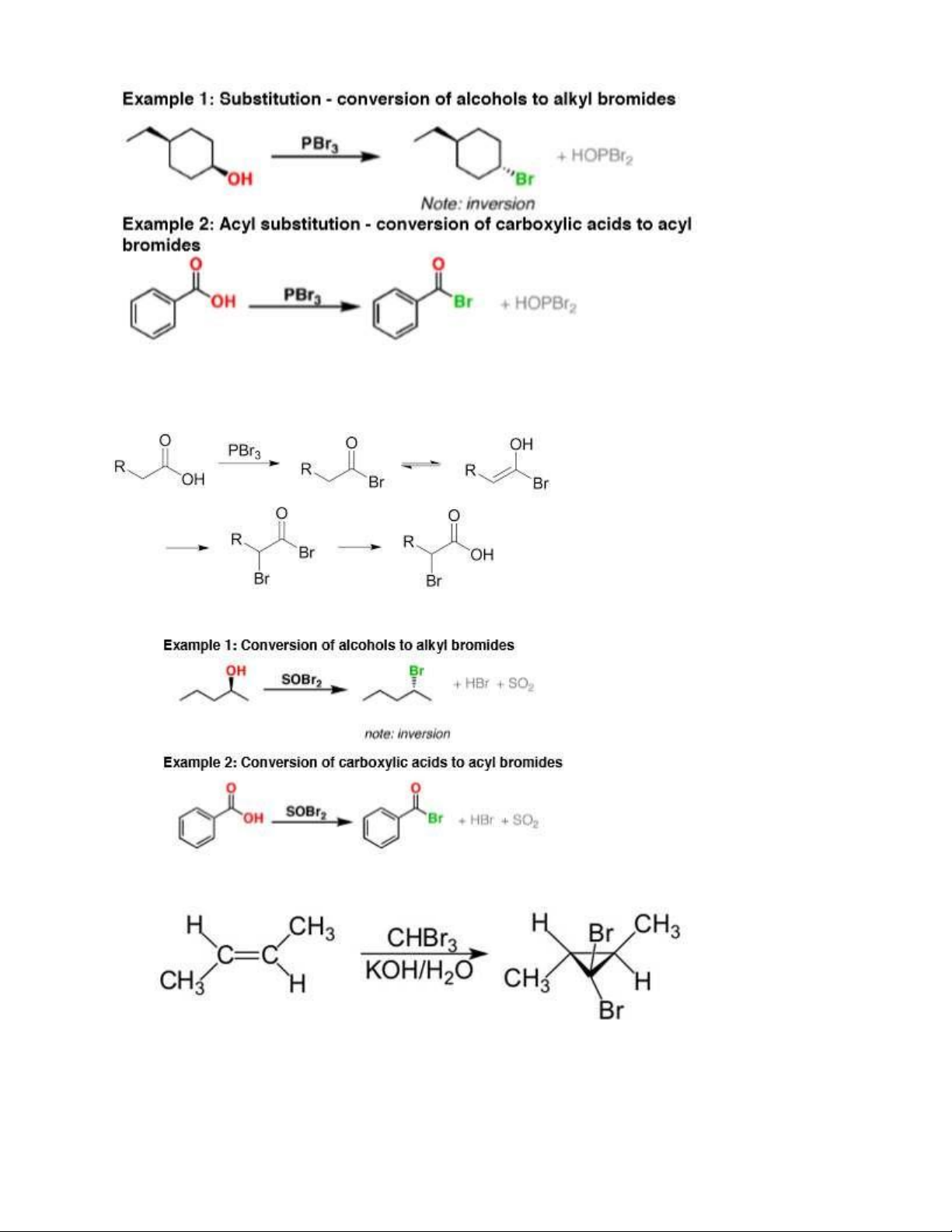
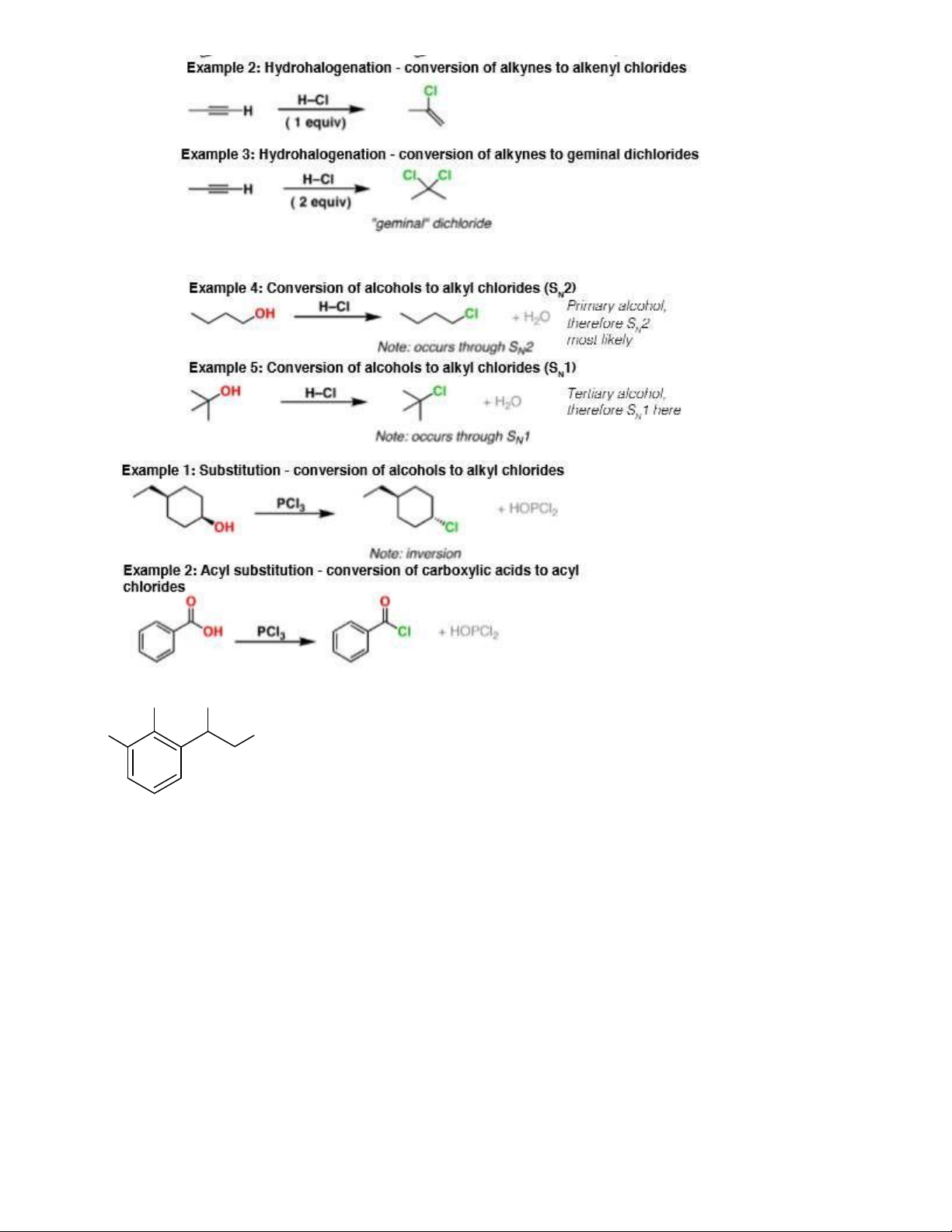
- Tác dụng với alcol: HBr + ROH R-X + H2O (thường chỉ dùng vs bậc 3) 3
1.11. PBr3 thế nhóm OH của acid, ancol
Lưu ý phản ứng thế carbon anpha của acid: khi cho acid no tác dụng với halogen Clo
hoặc Brom có mặt của Phospho đỏ. 1.12. SOBr2 1.13. CHBr3/KOH, H2O 2. Clo 2.1. Cl2 4
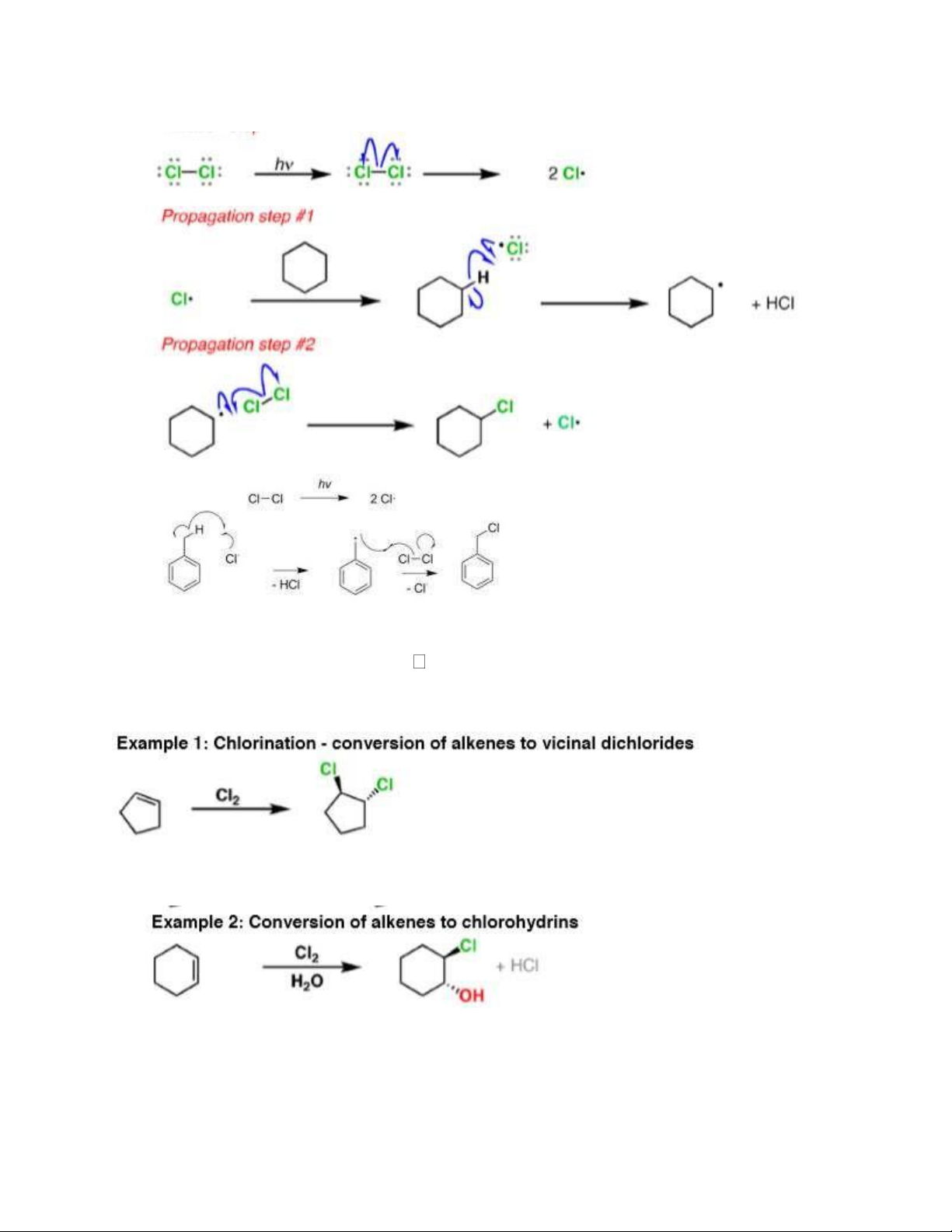
- Trong điều kiện askt tham gia p.ưng thế vào hydrocarbon no ưu tiên C bậc cao hoặc
nhánh của hydrocarbon thơm,
- Thế vào Cβ của acid carboxylic (trong điều kiện thiếu ánh sáng tử ngoại hoặc đun nóng
300-4000C): acid n-butanoic + Cl2 acid 3-cloro butanoic -
Cộng vào liên kết bội:
2.2. Cl2/H2O hoặc HClO xúc tác p.ư cộng va tuân theo các quy tắc Maccopnhicop 2.3. Cl2/OH-
- Chuyển α-methyl ceton thành acid carboxylic 5
- Thoái phân amid tạo thành amin -
2.4. Cl2/HX chuyển ceton thành α-cloro ceton
2.5. Cl2/FeCl or Cl2/AlCl3 (có mặt nhiệt độ) thế clo vào nhân thơm. 2.6. HCl
- Tham gia p.ư cộng vào anken bất đối xứng theo quy tắc Maccopnhicop 6
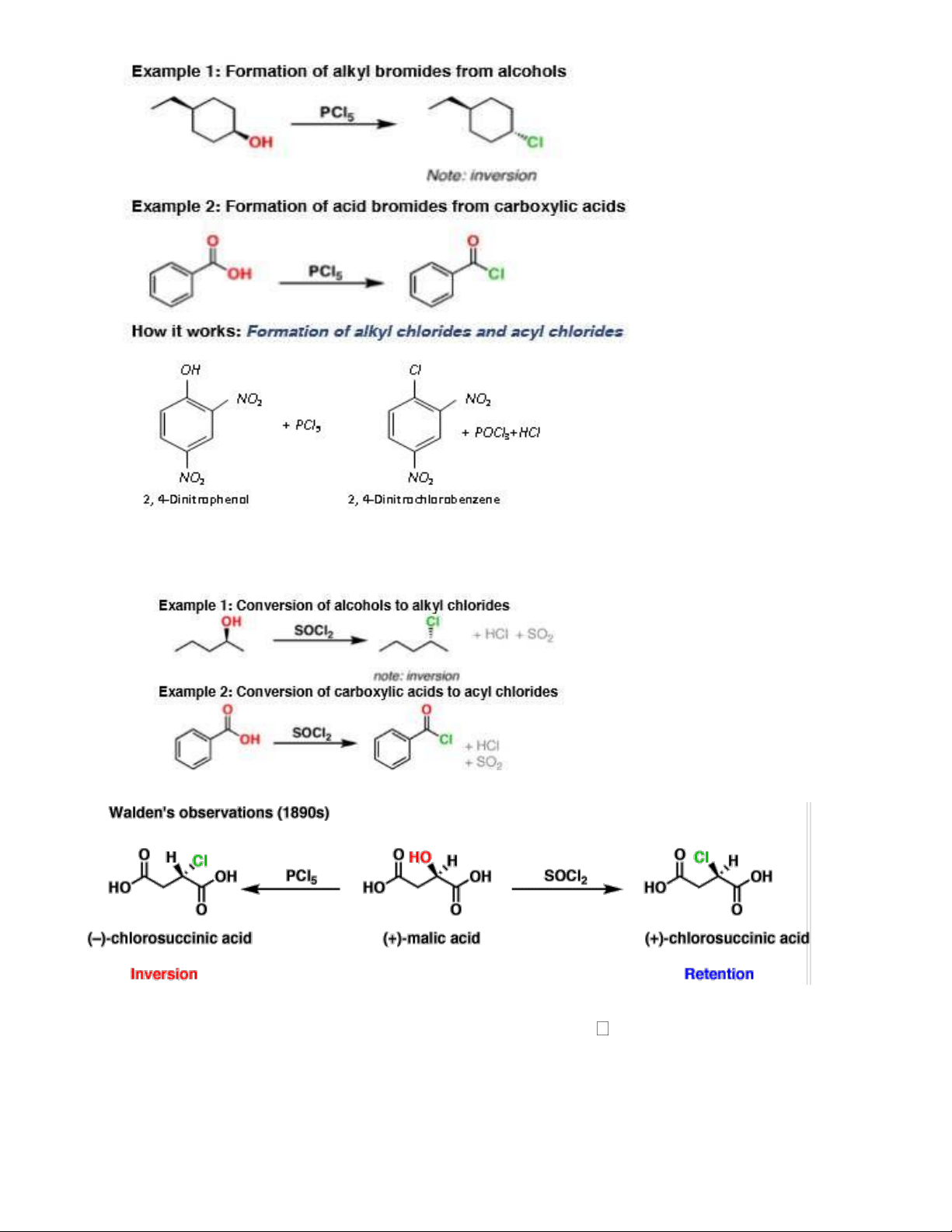
- Tác dụng vs alcol tạo dẫn halogen 2.7. PCl3 thay thế nhóm OH của ancol, acid nhưng không thay được nhóm OH phenol + PCl3 2.8. PCl5 thay thế nhóm OH của ancol, acid, phenol
(khi có nhóm thế hút điện tử mạnh) OH OH HO CH 3 7 2.9. SOCl2
- Thay thế nhóm OH của alcol (chỉ bậc 1 và 2) và Carboxylic bằng Cl -
- Chuyển muối thành halogenid acid: RCOONa + SOCl2 RCOCl
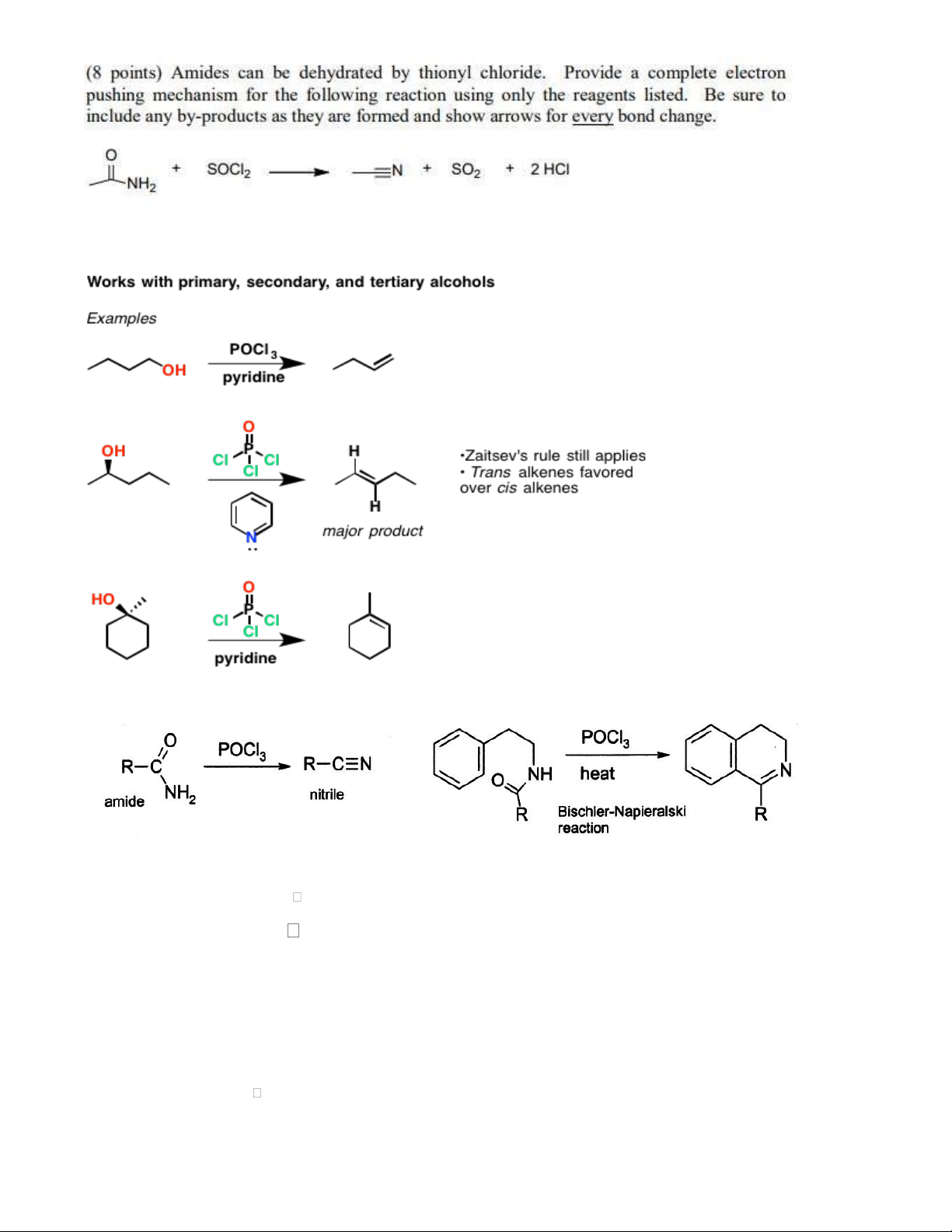
- Tách nước chuyển amid thành nitril 8 2.10. POCl3 tách
2.11. CO + HCl/ AlCl3 đính CHO vào nhân thơm
2.12. CHCl3/KOH (t0) đính CHO vào nhân thơm tại vị trí ortho so với nhóm OH 2.13.
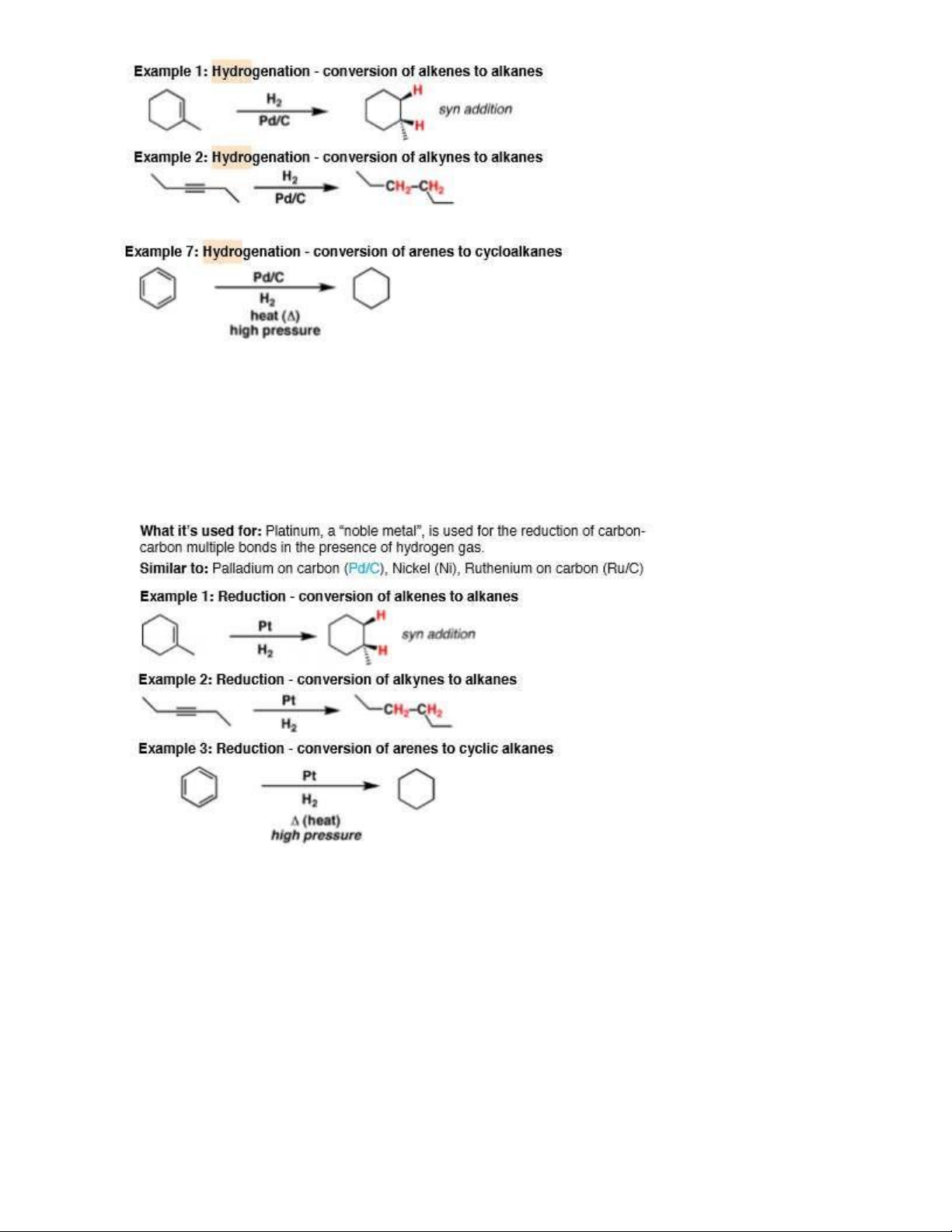
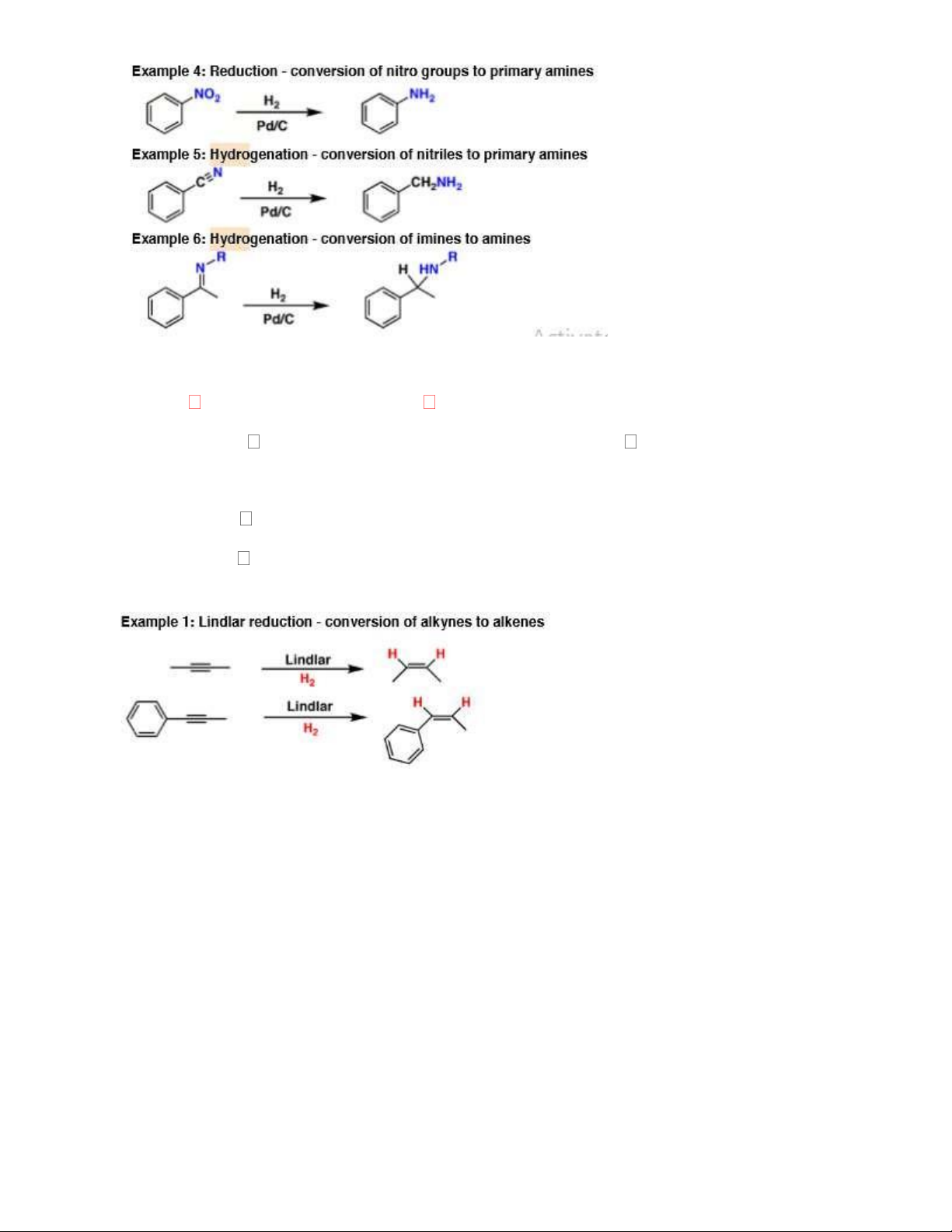
COCl2/AlCl3 gắn COCl vào nhân thơm 3. Hydro 3.1. H2, (Ni/Pd/Pt) - Khử nối đôi, ba đơn 9
- Chuyển Nitro; imin; Nitril, amid thành amin 10
- Chuyển Halogenid; andehid; ceton; ester thành alcol RCOCl RCH=O ; RCH=O RCH2OH
R-CO-R' R-CH(OH)-R' R-COO-R' RCH2OH + R'OH
- Chuyển dẫn chất halogen thành hydrocarbon RX RH R-CO-NHR' RCH2NHR'
3.2. H2/ Pd-BaCO3-PbO2… (xúc tác Lindlar): khử lựa chọn liên kết ba về liên kết đôi.
3.3. H2/ [(C6H5)3P]3RhCl: khử lựa chọn liên kết đôi C=C chỉ chứa 1 hoặc 2 nhóm thế.
3.4. NaNH2/NH3 thế nguyên tử H của liên kết ba; Na/NH3 chuyển nối 3 thành nối đôi 11
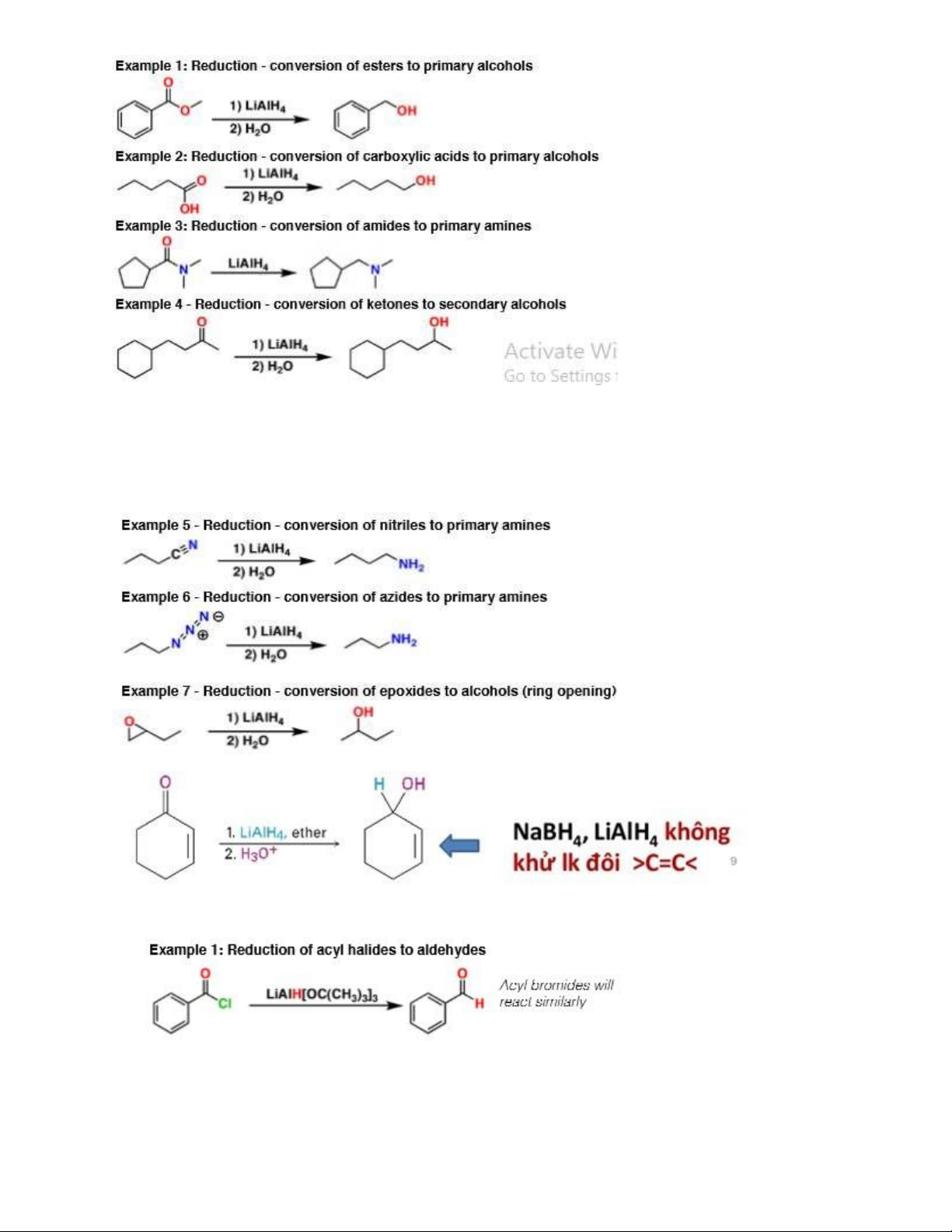
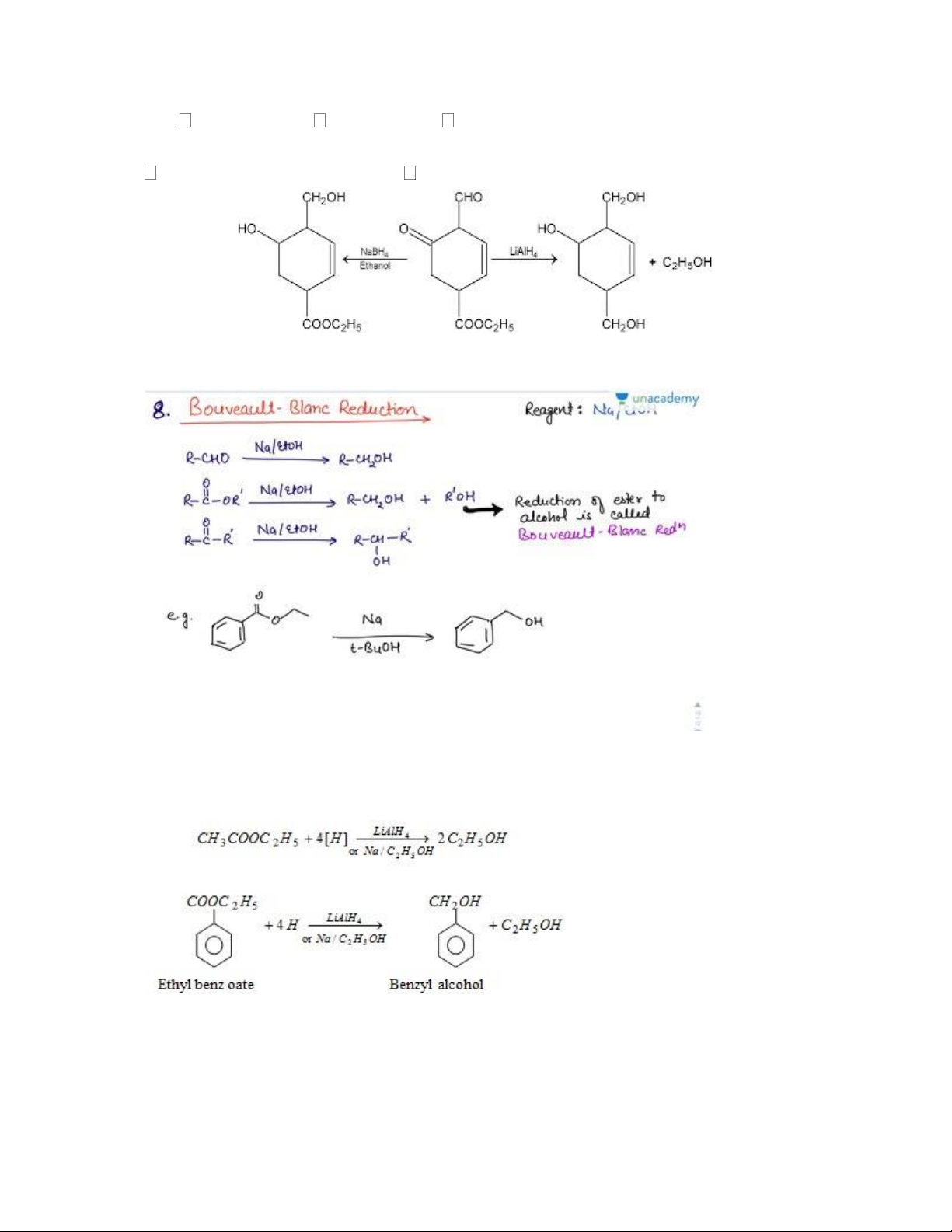
3.5. Tác nhân khử: LiAlH4 (Khử hóa chọn lọc)
- Chuyển ester, acid carboxylic, ceton, epoxit thành alcol (không khử liên kết bội) - Chuyển Nitril; amid Amin 12 -
3.6. LiAlH(Ot-Bu)3 Lithium tri tert-butoxy aluminum hydride
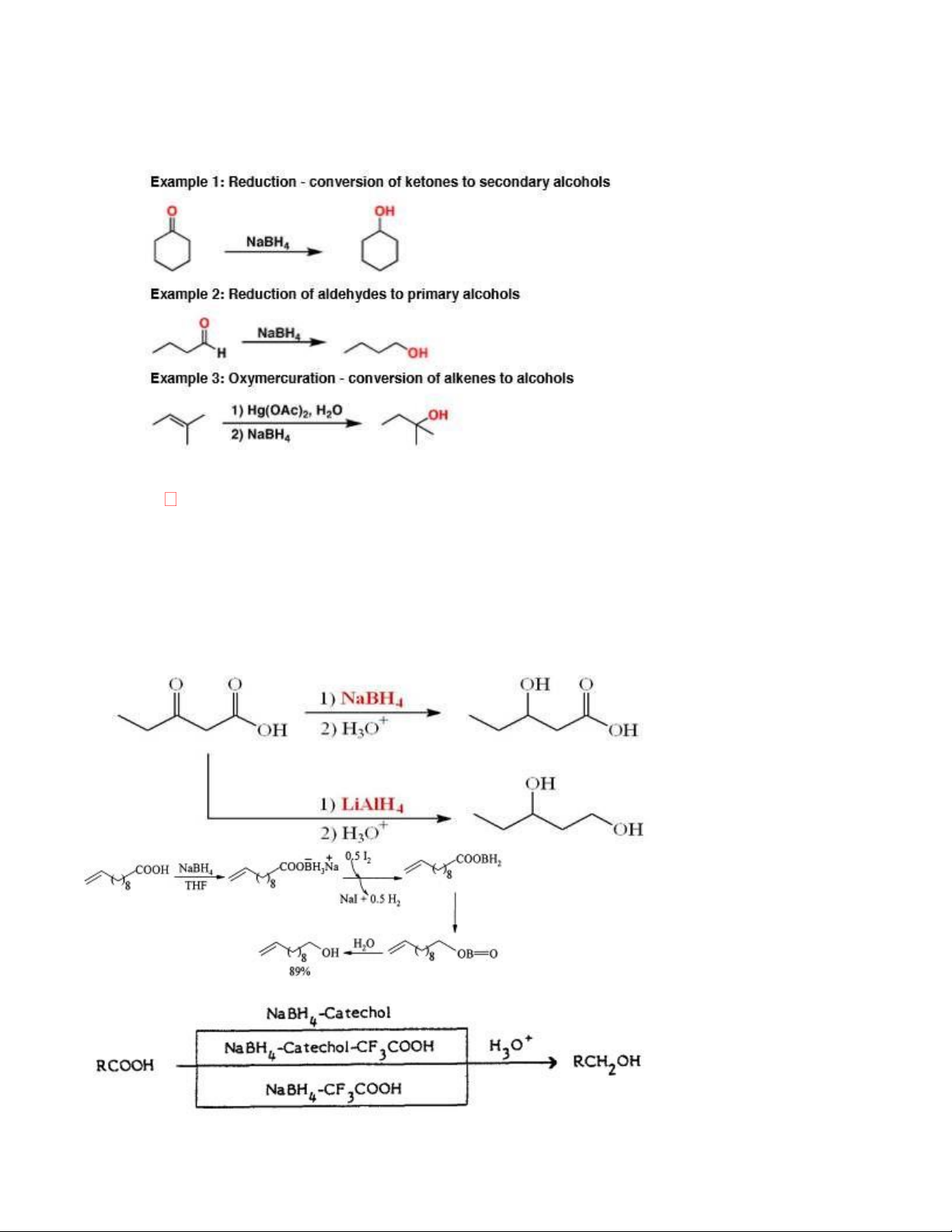
3.7. NaBH4 (Sodium borohydride) 13
- Khử ceton, andehid về ancol (không khử liên kết bội)
- NaBH4 được sử dụng để phá vỡ liên kết carbon-thủy ngân và thay thế nó bằng hydro (bước thứ hai) RCOOH RCH2OH
- NaBH4 khử hóa chọn lọc hơn so với LiAlH4
- Tùy từng dung môi mà NaBH4 mới thể hiện tính khử khác nhau 14
Không khử được bằng NaBH4
Epoxit 1,2-điol; RX RH; RNO2 RNH2 ;
R-CN R-CH2NH2 ; R-CO-NHR' RCH2NHR' 3.8. Na/ C2H5OH: - Khử Nitril tạo amin 15 3.9. NaH
Thay thế H trong ankyl và alcol
3.10. Các tác nhân khử Nitro 3.11. Zn 16 3.12. Sn, Fe/HCl
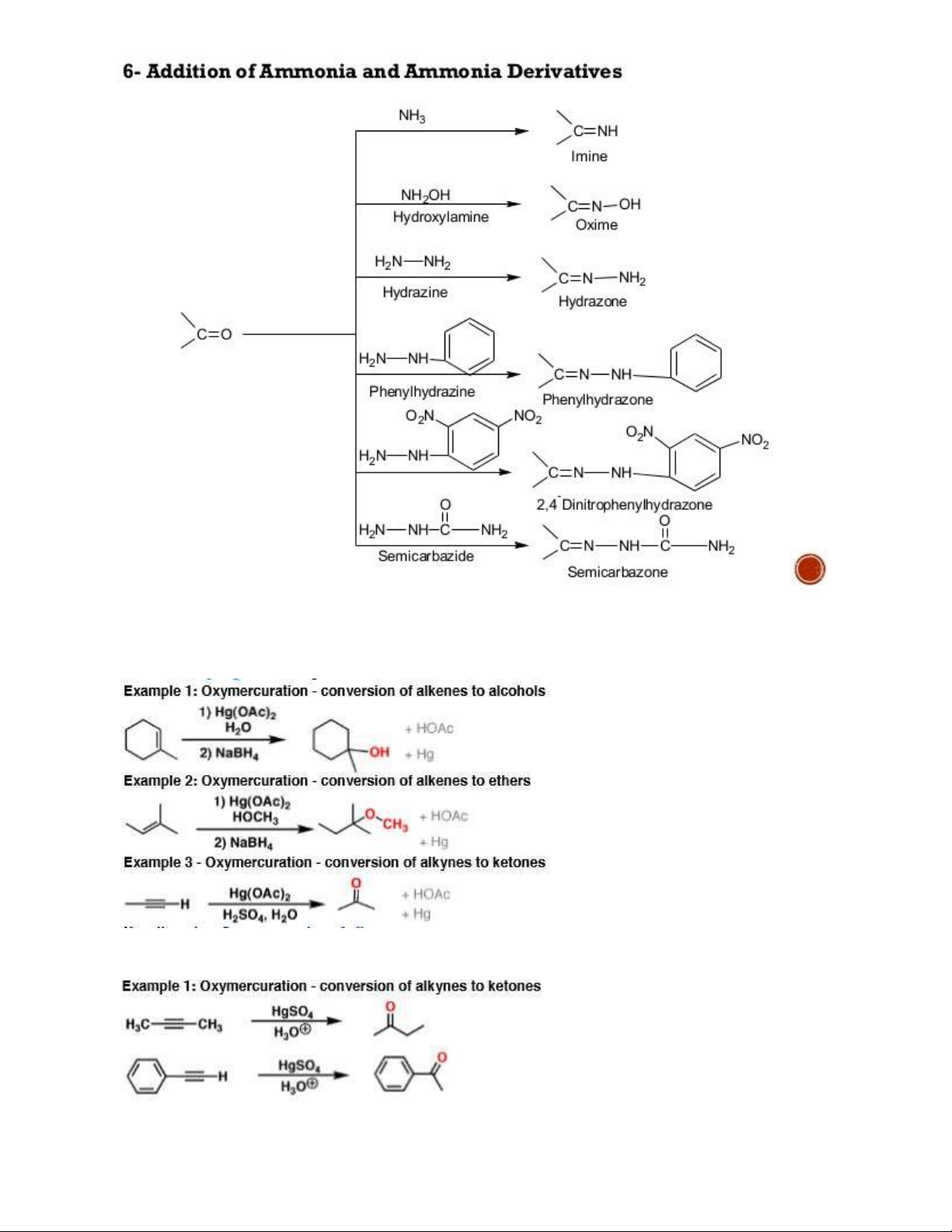
3.13. NH2-NH2/OH khử C=O CH2
Chú ý phân biệt với R-NH2/R-NH-NH2/NH2-NH-CO-NH2 là p.ư ngưng tụ 17 18 4. Thủy ngân 4.1. Hg(OAc)2 4.2. HgSO4 19 5. Iod 5.1 HI 5.2 HIO4 5.3 NaIO4 5. Tác nhân oxy hóa 5.1. Oxi-Ozon (O3) - O3 tạo vòng ozonid 20




