















Preview text:
ĐỒ ÁN MÔN HỌC GVHD: Ths. PHAN XUÂN THẠNH CHƯƠNG I: TỔNG QUAN I. KHÁI QUÁT
- Lò hơi là nguồn cung cấp nhiệt khá phổ biến trong nhiều loại hình công
nghệ, thường gặp trong các công đoạn sấy, gia nhiệt định hình, gia nhiệt
cho các phản ứng hóa học, làm chín thực phẩm, khử trùng…Trong
nhiều ngành sản xuất, lò hơi là thiết bị không thể không có.
- Lò hơi có thể được cấp nhiệt từ nhiều nguồn khác nhau. Ở các lò hơi
công suất nhỏ thường cấp nhiệt bằng điện, một số lò hiện đại dùng
nhiên liệu là khí đốt hóa lỏng (gas-LPG) kèm theo là hệ thống điều
chỉnh tự động. Với các lò hơi “sạch” như trên thường không có vấn đề
về mặt khói bụi thải. Tuy nhiên, thường gặp trong các cơ sở tiểu thủ
công nghiệp tại Thành phố Hồ Chí Minh là các lò hơi dùng nhiên liệu
đốt lò chính là gỗ củi, than đá hoặc dầu F.O. Các sản phẩm cháy do việc
đốt các nhiên liệu trên thải vào không khí thường là nguyên nhân dẫn
đến tình trạng ô nhiễm môi trường. II.
ĐẶC ĐIỂM KHÓI THẢI TỪ LÒ HƠI
- Đặc điểm khói thải của các loại lò hơi khác nhau, tùy theo loại nhiên liệu sử dụng.
- SO2 chủ yếu sinh ra trong quá trình đốt nhiên liệu bằng than đá hoặc dầu F.O.
Đặc điểm khói thải lò hơi đốt bằng than đá
- Khí thải của lò hơi đốt than chủ yếu mang bụi, CO2, CO, SO2, SO3,
NOx…do thành phần hóa chất có trong than kết hợp với ôxy trong quá trình cháy tạo nên.
- Hàm lượng lưu huỳnh trong than khoảng 0,5% nên trong khí thải có
SO2 với nồng độ khoảng 1333mg/m3.
SVTH: TRỊNH THỊ MINH CHÂU 5
ĐỒ ÁN MÔN HỌC GVHD: Ths. PHAN XUÂN THẠNH
Đặc điểm khói thải lò hơi đốt bằng dầu F.O
- Khí thải của lò hơi đốt dầu F.O thường có các chất sau: CO2, CO, SO2, SO3, NOx, hơi nước…
- Ngoài ra còn có một hàm lượng nhỏ tro và các hạt tro rất nhỏ trộn lẫn
với dầu cháy không hết tồn tại dưới dạng sol khí mà ta thường gọi là mồ hóng.
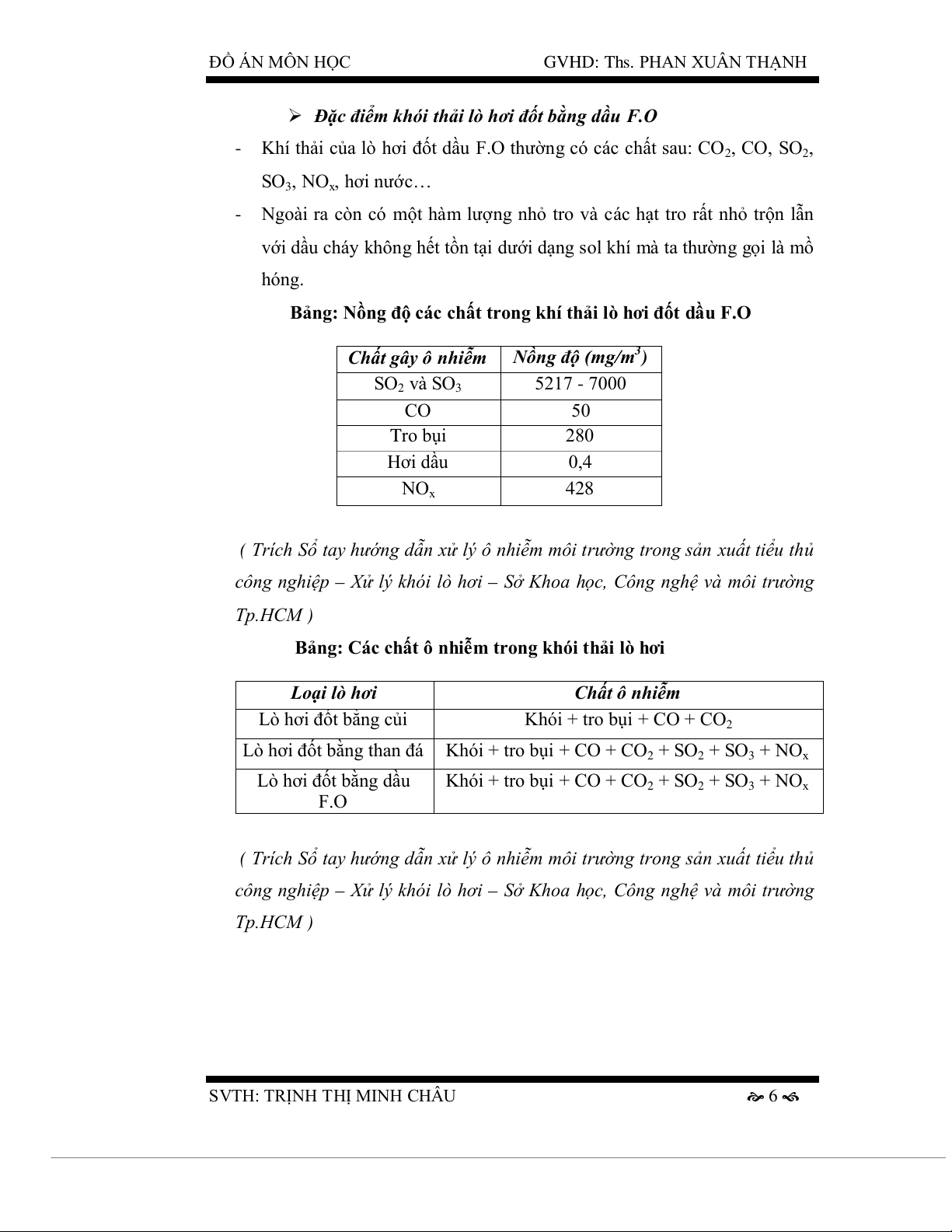
Bảng: Nồng độ các chất trong khí thải lò hơi đốt dầu F.O Chất gây ô nhiễm
Nồng độ (mg/m3) SO2 và SO3 5217 - 7000 CO 50 Tro bụi 280 Hơi dầu 0,4 NOx 428
( Trích Sổ tay hướng dẫn xử lý ô nhiễm môi trường trong sản xuất tiểu thủ
công nghiệp – Xử lý khói lò hơi – Sở Khoa học, Công nghệ và môi trường Tp.HCM )
Bảng: Các chất ô nhiễm trong khói thải lò hơi Loại lò hơi Chất ô nhiễm Lò hơi đốt bằng củi Khói + tro bụi + CO + CO2
Lò hơi đốt bằng than đá Khói + tro bụi + CO + CO2 + SO2 + SO3 + NOx Lò hơi đốt bằng dầu
Khói + tro bụi + CO + CO2 + SO2 + SO3 + NOx F.O
( Trích Sổ tay hướng dẫn xử lý ô nhiễm môi trường trong sản xuất tiểu thủ
công nghiệp – Xử lý khói lò hơi – Sở Khoa học, Công nghệ và môi trường Tp.HCM )
SVTH: TRỊNH THỊ MINH CHÂU 6
ĐỒ ÁN MÔN HỌC GVHD: Ths. PHAN XUÂN THẠNH
III. TÁC HẠI CỦA KHÍ SO2
- Khí SO2 là loại khí không màu, không cháy, có vị hăng cay. Do quá
trình quang hóa hay do sự xúc tác, khí SO2 dễ dàng bị oxy hóa và biến
thành SO3 trong khí quyển.
- Khí SO2 là loại khí độc hại không chỉ đối với sức khỏe con người, động
thực vật mà còn ảnh hưởng nghiêm trọng đến môi trường.
Đối với sức khỏe con người
- SO2 là chất có tính kích thích, ở nồng độ nhất định có thể gây co giật ở
cơ trơn của khí quản. Ở nồng độ lớn hơn sẽ gây tăng tiết dịch niêm mạc
đường khí quản. Khi tiếp xúc với mắt, chúng có thể tạo thành axit.
Bảng: Liều lượng gây độc
mg SO2/m3 Tác hại 20 - 30
Giới hạn gây độc tính 50
Kích thích đường hô hấp, ho 130 - 260
Liều nguy hiểm sau khi hít thở (30 - 60 phút) 1000 - 1300
Liều gây chết nhanh (30 - 60 phút)
- SO2 có thể xâm nhập vào cơ thể con người qua các cơ quan hô hấp hoặc
các cơ quan tiêu hóa sau khi được hòa tan trong nước bọt. Cuối cùng,
chúng có thể xâm nhập vào hệ tuần hoàn.
- Khi tiếp xúc với bụi, SO2 có thể tạo ra các hạt axit nhỏ có khả năng xâm
nhập vào các huyết mạch nếu kích thước của chúng nhỏ hơn 2-3 μm.
- SO2 có thể xâm nhập vào cơ thể qua da và gây ra các chuyển đổi hóa
học. Kết quả là hàm lượng kiềm trong máu giảm, ammoniac bị thoát
qua đường tiểu và có ảnh hưởng đến tuyến nước bọt.
- Trong máu, SO2 tham gia nhiều phản ứng hóa học, gây rối loạn chuyển
hóa đường và protein, gây thiếu vitamin B và C, ức chế enzyme
oxydaza, tạo ra methemoglobine để chuyển Fe2+ (hòa tan) thành Fe3+
SVTH: TRỊNH THỊ MINH CHÂU 7
ĐỒ ÁN MÔN HỌC GVHD: Ths. PHAN XUÂN THẠNH
(kết tủa) gây tắc nghẽn mạch máu cũng như làm giảm khả năng vận
chuyển oxy của hồng cầu, gây co hẹp dây thanh quản, khó thở. Đối với thực vật
- Các loài thực vật nhạy cảm với khí SO2 là rêu và địa y.
Bảng: Nồng độ gây độc Nồng độ (ppm) Tác hại 0,03
Ảnh hưởng đến sinh trưởng của rau quả 0,15 – 0,3 Gây độc kinh niên 1 – 2
Chấn thương lá cây sau vài giờ tiếp xúc
Đối với môi trường
- SO2 bị oxy hóa ngoài không khí và phản ứng với nước mưa tạo thành
axit sulfuric hay các muối sulfate gây hiện tượng mưa axit, ảnh hưởng xấu đến môi trường.
Quá trình hình thành mưa axit của SO2
- Phản ứng hoá hợp giữa lưu huỳnh điôxít và các hợp chất gốc hiđrôxyl: SO2 + OH· → HOSO2·
- Phản ứng giữa hợp chất gốc HOSO2· và O2 sẽ cho ra hợp chất gốc HO2· và SO3 : HOSO2· + O2 → HO2· + SO3
- Lưu huỳnh triôxít SO3 sẽ phản ứng với nước và tạo ra H2SO4. Đây
chính là thành phần chủ yếu của mưa axít. SO3(k) + H2O(l) → H2SO4(l)
Các tác hại của mưa axit
- Nước hồ bị axit hóa: mưa axit rơi trên mặt đất sẽ rửa trôi các chất dinh
dưỡng trên mặt đất và mang các kim loại độc hại xuống ao hồ, gây ô
nhiễm nguồn nước trong hồ, phá hỏng các loại thức ăn, uy hiếp sự sinh
tồn của các loài cá và các sinh vật khác trong nước.
SVTH: TRỊNH THỊ MINH CHÂU 8
ĐỒ ÁN MÔN HỌC GVHD: Ths. PHAN XUÂN THẠNH
Bảng: Các ảnh hưởng của pH đến hệ thủy sinh vật
pH<6,0 Các sinh vật bậc thấp của chuỗi thức ăn bị chết (phù du…),
đây là nguồn thức ăn quan trọng của cá.
pH<5,5 Cá không thể sinh sản được. Cá con khó sống sót. Cá lớn bị
dị dạng do thiếu dinh dưỡng. Cá bị chết do ngạt.
pH<5,0 Quần thể cá bị chết.
pH<4,0 Xuất hiện các sinh vật mới khác với các sinh vật ban đầu.
- Rừng bị hủy diệt và sản lượng nông nghiệp bị giảm: mưa axit làm tổn
thương lá cây, gây trở ngại quá trình quang hợp, làm cho lá cây bị vàng
và rơi rụng, làm giảm độ màu mỡ của đất và cản trở sự sinh trưởng của cây cối.
- Làm tổn hại sức khỏe con người: các hạt sulfate, nitrate tạo thành trong
khí quyển làm hạn chế tầm nhìn. Hơn nữa, do hiện tượng tích tụ sinh
học, khi con người ăn các loại cá có chứa độc tố, các độc tố này sẽ tích
tụ trong cơ thể và gây nguy hiểm đối với sức khỏe con người.
- Gây ăn mòn vật liệu và phá hủy các công trình kiến trúc.
IV. CÁC PHƯƠNG PHÁP XỬ LÝ SO2
Hấp thụ khí SO2 bằng nước
- Là phương pháp đơn giản được áp dụng sớm nhất để loại bỏ khí SO2
trong khí thải, nhất là trong khói từ các lò công nghiệp.
- Ưu điểm: rẻ tiền, dễ tìm, hoàn nguyên được. SO - 2 + H2O H+ + HSO3
- Nhược điểm: do độ hòa tan của khí SO2 trng nước quá thấp nên thường
phải dùng một lượng nước rất lớn và thiết bị hấp thụ phải có thể tích rất
SVTH: TRỊNH THỊ MINH CHÂU 9
ĐỒ ÁN MÔN HỌC GVHD: Ths. PHAN XUÂN THẠNH
lớn, cồng kềnh. Để tách SO2 khỏi dung dịch phải nung nóng lên đến
1000C nên tốn rất nhiều năng lượng, chi phí nhiệt lớn.
( Trang 93 – Ô nhiễm không khí và xử lý khí thải, tập 3 – Trần Ngọc Chấn )
Hấp thụ khí SO2 bằng dung dịch sữa vôi
- Là phương pháp được áp dụng rất rộng rãi trong công nghiệp vì hiệu
quả xử lý cao, nguyên liệu rẻ tiền và sẵn có ở mọi nơi. CaCO3 + SO2 CaSO3 + CO2 CaO + SO2 CaSO3 2CaSO3 + O2 2CaSO4
- Ưu điểm: công nghệ đơn giản, chi phí đầu tư ban đầu không lớn, chi phí
vận hành thấp, chất hấp thụ rẻ, dễ tìm, làm sạch khí mà không cần phải
làm lạnh và tách bụi sơ bộ, có thể chế tạo thiết bị bằng vật liệu thông
thường, không cần đến vật liệu chống axit và không chiếm nhiều diện tích xây dựng.
- Nhược điểm: đóng cặn ở thiết bị do tạo thành CaSO4 và CaSO3, gây tắc
nghẽn các đường ống và ăn mòn thiết bị.
SVTH: TRỊNH THỊ MINH CHÂU 10
ĐỒ ÁN MÔN HỌC GVHD: Ths. PHAN XUÂN THẠNH
( Trang 95 – Ô nhiễm không khí và xử lý khí thải, tập 3 – Trần Ngọc Chấn )
Xử lý khí khí SO2 bằng ammoniac
- Phương pháp này hấp thụ khí SO2 bằng dung dịch ammoniac tạo muối
amoni sunfit và amoni bisunfit theo phản ứng sau:
SO2 + 2NH3 + H2O (NH4)2SO3
(NH4)2SO3 + SO2 + H2O 2NH4HSO3
- Ưu điểm: hiệu quả rất cao, chất hấp thụ dễ kiếm và thu được muối
amoni sunfit và amoni bisunfit là các sản phẩm cần thiết.
- Nhược điểm: rất tốn kém, chi phí đầu tư và vận hành rất cao.
(Trang 100 – Ô nhiễm không khí và xử lý khí thải, tập 3 – Tr n Ngọ ầ c Chấn)
SVTH: TRỊNH THỊ MINH CHÂU 11
ĐỒ ÁN MÔN HỌC GVHD: Ths. PHAN XUÂN THẠNH
Xử lý khí SO2 bằng magie oxit
- Các phản ứng xảy ra như sau: MgO + SO2 MgSO3
MgSO3 + SO2 + H2O Mg(HSO3)2
Mg(HSO3)2 + MgO 2MgSO3 + H2O
- Ưu điểm: có thể làm sạch khí nóng mà không cần làm lạnh sơ bộ, thu
được axit sunfuric như là sản phẩm của sự thu hồi, hiệu quả xử lý cao, MgO dễ kiếm và rẻ.
- Nhược điểm: quy trình công nghệ phức tạp, vận hành khó, chi phí cao, tổn hao MgO khá nhiều.
(Trang 105 – Ô nhiễm không khí và xử lý khí thải, tập 3 – Trần Ngọc Chấn)
(Trang 106 – Ô nhiễm không khí và xử lý khí thải, tập 3 – Trần Ngọc Chấn)
SVTH: TRỊNH THỊ MINH CHÂU 12
ĐỒ ÁN MÔN HỌC GVHD: Ths. PHAN XUÂN THẠNH
Xử lý khí SO2 bằng kẽm oxit
- Phương pháp này dựa theo các phản ứng sau:
SO2 + ZnO + 2,5 H2O ZnSO3 . 2,5H2O
ZnSO3 . 2,5H2O => ZnO + SO2 + 2,5H2O
- Ưu điểm: có thể làm sạch khí ở nhiệt độ khá cao (200 - 2500C).
- Nhược điểm: có thể hình thành ZnSO4 làm cho việc tái sinh ZnO bất lợi
về kinh tế nên phải thường xuyên tách chúng ra và bổ sung lượng ZnO tương đương.
Xử lý SO2 bằng kẽm oxit kết hợp natri sunfit
- Phương pháp này dựa theo các phản ứng sau:
Na2CO3 + SO2 Na2SO3 + CO2 Na2SO3 + SO2+H2O 2NaHSO3
2NaHSO3 + ZnO ZnSO3 + Na2SO3 + H2O
- Ưu điểm: không đòi hỏi làm nguội sơ bộ khói thải, hiệu quả xử lý cao.
- Nhược điểm: hệ thống xử lý khá phức tạp và tiêu hao nhiều muối natri.
(Trang 110 – Ô nhiễm không khí và xử lý khí thải, tập 3 – Trần Ngọc Chấn)
SVTH: TRỊNH THỊ MINH CHÂU 13
ĐỒ ÁN MÔN HỌC GVHD: Ths. PHAN XUÂN THẠNH
Xử lý khí SO2 bằng các chất hấp thụ hữu cơ
- Phương pháp này được áp dụng nhiều trong xử lý khí thải từ các nhà máy luyện kim màu.
- Chất hấp thụ chủ yếu được dùng là xyliđin và đimetylanilin. Quá trình sunfiđin
- Chất hấp thụ được sử dụng là hỗn hợp xyliđin và nước theo tỉ lệ 1:1
2C6H3(CH3)2NH2 + SO2 2C6H3(CH3)2NH2 . SO2
- Nếu khí thải có nồng độ SO2 thấp thì quy trình này không kinh tế vì tổn hao xyliđin.
(Trang 112 – Ô nhiễm không khí và xử lý khí thải, tập 3 – Trần Ngọc Chấn)
Quá trình khử SO2 bằng đimetylanilin
- Với khí thải có trên 35% (thể tích) khí SO2 thì dùng đimetylanilin làm
chất hấp thụ sẽ có hiệu quả hơn dùng xyliđin.
(Trang 113 – Ô nhiễm không khí và xử lý khí thải, tập 3 – Trần Ngọc Chấn)
SVTH: TRỊNH THỊ MINH CHÂU 14
ĐỒ ÁN MÔN HỌC GVHD: Ths. PHAN XUÂN THẠNH
Hấp phụ khí SO2 bằng than hoạt tính
- Phương pháp này có thể áp dụng rất tốt để xử lý khói thải từ các nhà
máy nhiệt điện, nhà máy luyện kim và sản xuất axit sunfuric với hiệu quả kinh tế đáng kể.
- Ưu điểm: sơ đồ hệ thống đơn giản và vạn năng, có thể áp dụng được
cho mọi quá trình công nghệ có thải khí SO2 một cách liên tục hay gián
đoạn, cho phép làm việc được với khí thải có nhiệt độ cao (trên 1000C).
- Nhược điểm: tùy thuộc vào quá trình hoàn nguyên có thể là tiêu hao
nhiều vật liệu hấp phụ hoặc sản phẩm thu hồi được có lẫn nhiều axit
sunfuric và tận dụng khó khăn, phải xử lý tiếp mới sử dụng được.
(Trang 116 – Ô nhiễm không khí và xử lý khí thải, tập 3 – Trần Ngọc Chấn)
Hấp phụ khí SO2 bằng vôi, đá vôi, đolomit
- Ưu điểm: hiệu suất hấp phụ cao.
- Nhược điểm: cần chi phí đầu tư lớn do vật liệu chế tạo thiết bị đắt (thiết
bị làm việc trong môi trường ăn mòn mạnh và nhiệt độ cao).
SVTH: TRỊNH THỊ MINH CHÂU 15
ĐỒ ÁN MÔN HỌC GVHD: Ths. PHAN XUÂN THẠNH
CHƯƠNG II: ĐỀ XUẤT VÀ THUYẾT MINH QUY TRÌNH CÔNG NGHỆ
Yêu cầu: Thiết kế hệ thống xử lí khí thải SO2 từ lò hơi bằng thiết bị tháp hấp thụ (tháp đệm).
Nguồn khói thải từ lò hơi có các thông số sau
- Lưu lượng khí: 12000 m3/h
- Nồng độ SO2: 8000 mg/m3
- Nhiệt độ khói thải: 2500C
- Nồng độ bụi: 300 mg/m3 - Áp suất: 1atm Quy chuẩn
- Theo QCVN 19: 2009/BTNMT, nồng độ tối đa cho phép của bụi và SO2
được tính theo công thức sau: Cmax = C . Kp . Kv Trong đó:
- Cmax là nồng độ tối đa cho phép của bụi và SO2 ( mg/Nm3)
- C là nồng độ của SO2 quy định tại mục 2.2 (mg/Nm3)
- Kp là hệ số lưu lượng nguồn thải quy định tại mục 2.3
- Kv là hệ số vùng, khu vực quy định tại mục 2.4
Theo mục 2.2 QCVN 19: 2009/BTNMT – cột B, ta có: Cbụi = 200 mg/Nm3 CSO2 = 500 mg/Nm3
Theo mục 2.3 QCVN 19: 2009/BTNMT, ta có lưu lượng nguồn thải là
12000 m3/h < 20000 m3/h nên hệ số Kp = 1
Theo mục 2.4 QCVN 19: 2009/BTNMT, ta chọn hệ số Kv = 1,0
SVTH: TRỊNH THỊ MINH CHÂU 16
ĐỒ ÁN MÔN HỌC GVHD: Ths. PHAN XUÂN THẠNH Ta có:
- Nồng độ tối đa cho phép của bụi và SO2:
Cbụi= 200 . 1 . 1 = 200 mg/Nm3
CSO2=500 . 1 . 1 = 500 mg/Nm3
- Vì thế, ta áp dụng QCVN 19: 2009/BTNMT cho đầu ra của HTXL.
Hiệu suất của quá trình xử lý bằng hấp thụ
E = 8000 − 500 1.00%=93 7,5% 8000
Lựa chọn dung dịch hấp thụ
- Các dung dịch thường dùng để hấp thụ khí SO2 có thể là nước, huyền
phù sữa vôi (FGD), dung dịch soda Na2CO3, dung dịch NaOH…
- Nồng độ SO2 trong khói thải lò hơi theo đề bài là 8000 mg/m3.
Chuyển sang nồng độ Cppm 8000. 2 ,24 .(273+ 5 )5 Cppm = = 336 (4 pp ) m 64 . 273
- Ta thấy, nồng độ SO2 ban đầu là rất lớn (3364 ppm > 2000 ppm) nên
không áp dụng phương pháp hấp thụ SO2 bằng huyền phù sữa vôi được.
- Đối với nồng độ cao, ta có thể áp dụng phương pháp hấp thụ SO2 bằng
nước hoặc bằng các dung dịch hấp thụ có chứa Natri như NaOH và Na2CO3.
- Tuy nhiên, khí SO2 có độ hòa tan trong nước khá thấp nên thường phải
dùng một lượng nước rất lớn và thiết bị hấp thụ phải có thể tích rất lớn,
cồng kềnh. Mặt khác, để tách SO2 khỏi dung dịch phải nung nóng lên
đến 1000C nên tốn rất nhiều năng lượng, chi phí nhiệt lớn.
- NaOH và Na2CO3 là các chất hấp thụ có hoạt độ hấp thụ mạnh, có thể
xử lý SO2 ở bất kỳ nồng độ nào. Do đó, dung dịch hấp thụ lựa chọn cho
quy trình công nghệ là dung dịch NaOH (pha loãng với nước).
SVTH: TRỊNH THỊ MINH CHÂU 17
ĐỒ ÁN MÔN HỌC GVHD: Ths. PHAN XUÂN THẠNH
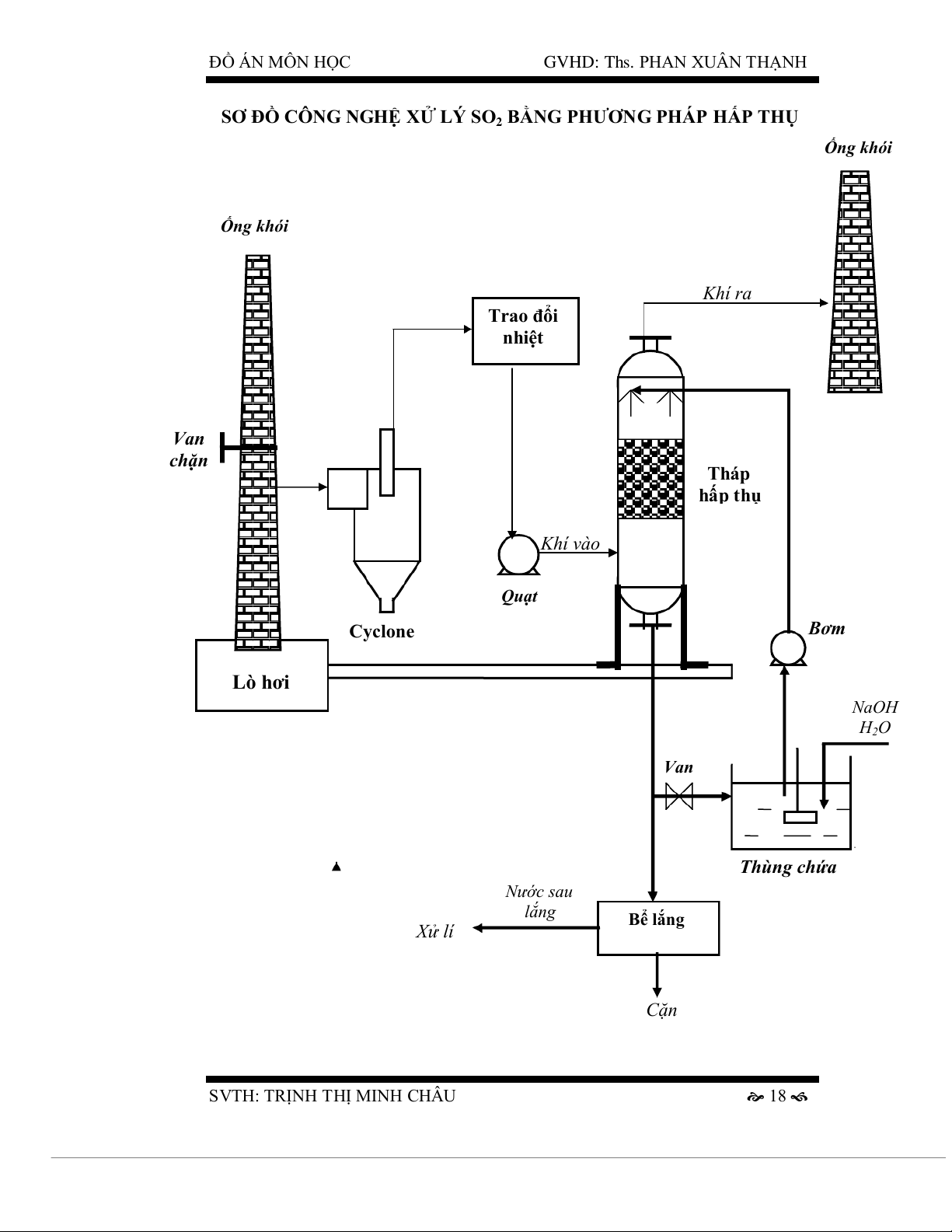
SƠ ĐỒ CÔNG NGHỆ XỬ LÝ SO2 BẰNG PHƯƠNG PHÁP HẤP THỤ Ống khói Ống khói Khí ra Trao đổi nhiệt Van chặn Tháp hấp thụ Khí vào Quạt Cyclone Bơm Lò hơi NaOH H2O Van Thùng chứa Nước sau lắng Bể lắng Xử lí Cặn
SVTH: TRỊNH THỊ MINH CHÂU 18
ĐỒ ÁN MÔN HỌC GVHD: Ths. PHAN XUÂN THẠNH
Thuyết minh sơ đồ công nghệ
- Vì nồng độ bụi tương đối cao hơn so với nồng độ cho phép (300 mg/m3
> 200 mg/m3) nên ta phải xử lý bụi. Cho dòng khí thải có chứa bụi đi
qua Cyclone để thu hồi bụi.
- Do nhiệt độ dòng khí thải cao (2500C) nên sau khi qua Cyclone, dòng
khí được dẫn qua thiết bị trao đổi nhiệt để giảm nhiệt độ xuống thích
hợp cho quá trình hấp thụ xảy ra hiệu quả.
- Dùng quạt thổi khí vào tháp đệm từ dưới lên. Dung dịch hấp thụ NaOH
được bơm từ thùng chứa lên tháp và tưới trên lớp vật liệu đệm theo
chiều ngược với chiều của dòng khí đi trong tháp.
- Các phản ứng xảy ra trong tháp SO2 + 2NaOH Na2SO3 + H2O
Na2SO3 + SO2 + H2O 2NaHSO3
SO2 + NaHSO3 + Na2SO3 + H2O 3NaHSO3
- Khí sạch đi vào ống khói và thải ra môi trường có nồng độ SO2 đạt tiêu
chuẩn cho phép Cmax ( Theo QCVN 19: 2009/BTNMT).
- Dung dịch sau khi hấp thụ có chứa nhiều natri sunfit, natri bisunfit và
khói bụi. Một phần dung dịch được bơm trở lại thùng chứa qua van điều
chỉnh lưu lượng và tiếp tục được bơm lên tháp tưới cho vật liệu đệm nếu
lượng dung dịch NaOH còn dư nhiều. Phần dung dịch còn lại được đưa
đến bể lắng để lắng các cặn bẩn. Cặn sau lắng được đem chôn lấp còn
nước sau lắng được đưa đi xử lí rồi mới thải ra môi trường.
SVTH: TRỊNH THỊ MINH CHÂU 19
ĐỒ ÁN MÔN HỌC GVHD: Ths. PHAN XUÂN THẠNH
CHƯƠNG III: TÍNH TOÁN QUÁ TRÌNH HẤP THỤ I. CÂN BẰNG VẬT CHẤT
- Lưu lượng khí: 12000 m3/h
- Nồng độ SO2 đầu vào: 8000 mg/m3
- Nhiệt độ khí vào tháp: 550C
- Nồng độ bụi: 300 mg/m3
- Áp suất: Pt = 1atm = 760 mmHg = 1,0133.105 Pa. - Nồng độ đầu ra: C c SO2 = 500 mg/m3
- Nhiệt độ của dung dịch NaOH: 250C
- Chọn điều kiện làm việc của tháp là nhiệt độ trung bình của dòng khí
vào và dòng lỏng vào, t0 = 400C. Hỗn hợp khí xử lý xem như gồm SO2 và không khí. 1. Đầu vào
- Suất lượng mole của hh khí đi vào tháp: G PV .112000 1= = = 4461,6 (3kmol / h) RT ,0082.(273+ 5 ) 5
- Suất lượng mole của SO2: đ G đ C .V 12000 . 8000 SO 2 A = = = 1500(mol /h) = ( 5, 1 kmol /h) M 64 S 2 O
- Suất lượng mole của cấu tử trơ: G đ đ B =G − G = − = kmol h 1 A 446 1 , 63 5, 1 44 ,466 (3 / )
- Nồng độ phân mole của SO2 trong hỗn hợp khí: GđA 5, 1 y đ −3 A = = = 3, 3 62 1.0 (mol SO /mol hhkhí) G 4461,63 2 1 - Tỉ số mol: đ − 3 Yđ yA 3, 3 62. = 10 −3 = = 3 , 3 73 1.0 − 3 1 − đ y 1− 3 , 3 62 1.0 A
SVTH: TRỊNH THỊ MINH CHÂU 20
ĐỒ ÁN MÔN HỌC GVHD: Ths. PHAN XUÂN THẠNH
- Khối lượng riêng của pha khí ở 00C và 1atm: đ đ −3 −3 1 y 1− y − A A 3, 3 6 .210 1 3, 3 6 .210 = + = + = ,0771 ( 9 kg / 3 m ) ρhh ρ ρ đ SO 2 kk 9, 2 3 ,1293 => ρ = ,1 hhđ 29 (5kg / 3 m )
- Khối lượng riêng của pha khí ở 550C và 1atm: đ đ P T 1 273 ρ = ρ = = hh kg m 0 . . 0 ,1295. . 0 , 1 7 ( 8 / 3 ) P T 1 273 + 0 55 2. Đầu ra
- Suất lượng mole của SO2 được hấp thụ:
M = 9,0375.Gđ = ,09375 = A 5,1 . ,14062 (5kmol/ )h
- Suất lượng mole của SO2 còn lại trong hỗn hợp khí ở đầu ra: G c A = Gđ − M = − = A
5,1 ,140625 ,00937 (5kmol/h)
- Suất lượng mole của khí ở đầu ra: G c đ c B =G + G = + = B A 444 6
, 63 ,009375 444 7,57(kmol/h)
- Nồng độ phân mole của SO2 trong hỗn hợp khí đầu ra: c G ,009375 y c A − 3 A = = = ,0211 1.0 (mol SO 2 / mol hhkhí) G cB 44 ,4757 - Tỉ số mol: c 3 − Yc y , 0 211 1 A . 0 = −3 = = , 0 211 1 . 0 3 1 − c y 1− , 0 211 1 A . 0−
- Khối lượng riêng của pha khí ở 00C và 1atm: c c − 3 −3 1 y 1 − y − A A , 0 21 .110 1 , 0 21 .110 = + = + = ,0773 ( 3 kg / 3 m ) ρhhc ρ ρ SO 2 kk 9, 2 3 ,1293 => ρ = ,129 (3kg / 3 m ) hhc
- Khối lượng riêng của pha khí ở 400Cvà 1atm (ta xem như nhiệt độ dòng
khí ra bằng với nhiệt độ làm việc là 400C): c c P T 1 273 ρ = ρ = = kg m hh 0 . . 0 ,1293. . 1 , 1 2 ( 8 / 3 ) P T 1 273 + 40 0
SVTH: TRỊNH THỊ MINH CHÂU 21
ĐỒ ÁN MÔN HỌC GVHD: Ths. PHAN XUÂN THẠNH II.
XÁC ĐỊNH PHƯƠNG TRÌNH CÂN BẰNG
- Xác định đường cân bằng thông qua các dữ kiện về độ hòa tan của SO2 trong nước.
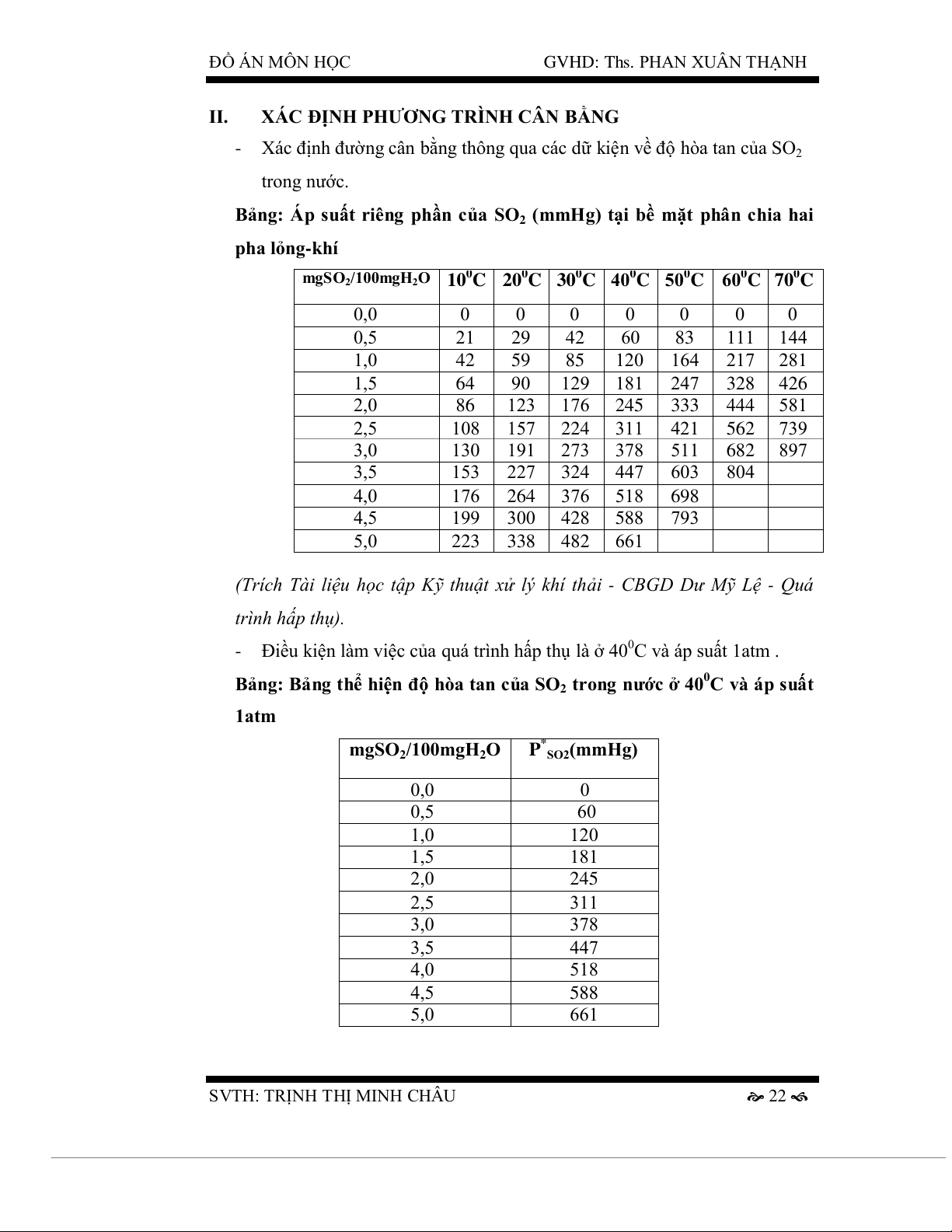
Bảng: Áp suất riêng phần của SO2 (mmHg) tại bề mặt phân chia hai pha lỏng-kh í
mgSO2/100mgH2O 100C 200C 300C 400C 500C 600C 700C 0,0 0 0 0 0 0 0 0 0,5 21 29 42 60 83 111 144 1,0 42 59 85 120 164 217 281 1,5 64 90 129 181 247 328 426 2,0 86 123 176 245 333 444 581 2,5 108 157 224 311 421 562 739 3,0 130 191 273 378 511 682 897 3,5 153 227 324 447 603 804 4,0 176 264 376 518 698 4,5 199 300 428 588 793 5,0 223 338 482 661
(Trích Tài liệu học tập Kỹ thuật xử lý khí thải - CBGD Dư Mỹ Lệ - Quá trình hấp thụ).
- Điều kiện làm việc của quá trình hấp thụ là ở 400C và áp suất 1atm .
Bảng: Bảng thể hiện độ hòa tan của SO 0
2 trong nước ở 40 C và áp suất 1atm
mgSO2/100mgH2O P*SO2(mmHg) 0,0 0 0,5 60 1,0 120 1,5 181 2,0 245 2,5 311 3,0 378 3,5 447 4,0 518 4,5 588 5,0 661
SVTH: TRỊNH THỊ MINH CHÂU 22
ĐỒ ÁN MÔN HỌC GVHD: Ths. PHAN XUÂN THẠNH
1. Tính toán cho cặp giá trị p*SO2 = 60mmHg và CSO2 = 0,5gSO2/100gH2O Pha khí
- Nồng độ phần mole SO2 trong pha khí: * p 60 * SO2 y = = = 07895 ,0 P 760 t - Tỉ số mol: y ,007895 Y = = = ,008572 1 −y 1 − ,007895 Pha lỏng
- Nồng độ phần mole SO2 trong pha lỏng: 0 5 , mol SO trong dung dich 2 64 x = = = , 0 0014
mol SO trong dung dich +mol H O 0 5 , 100 2 2 + 64 18 - Tỉ số mol: x ,00014 X = = = ,00014 1−x 1− ,00014 2. Kết quả CSO2 P*SO2 y* x gSO2/100gH2O (mmHg) 0,0 0 0 0 0,5 60 0,07895 0,0014 1,0 120 0,15789 0,0028 1,5 181 0,23816 0,0042 2,0 245 0,32237 0,00559 2,5 311 0,40921 0,00698 3,0 378 0,49737 0,00837 3,5 447 0,58816 0,00975 4,0 518 0,68158 0,01112 4,5 588 0,77368 0,0125 5,0 661 0,86974 0,01387
SVTH: TRỊNH THỊ MINH CHÂU 23
ĐỒ ÁN MÔN HỌC GVHD: Ths. PHAN XUÂN THẠNH
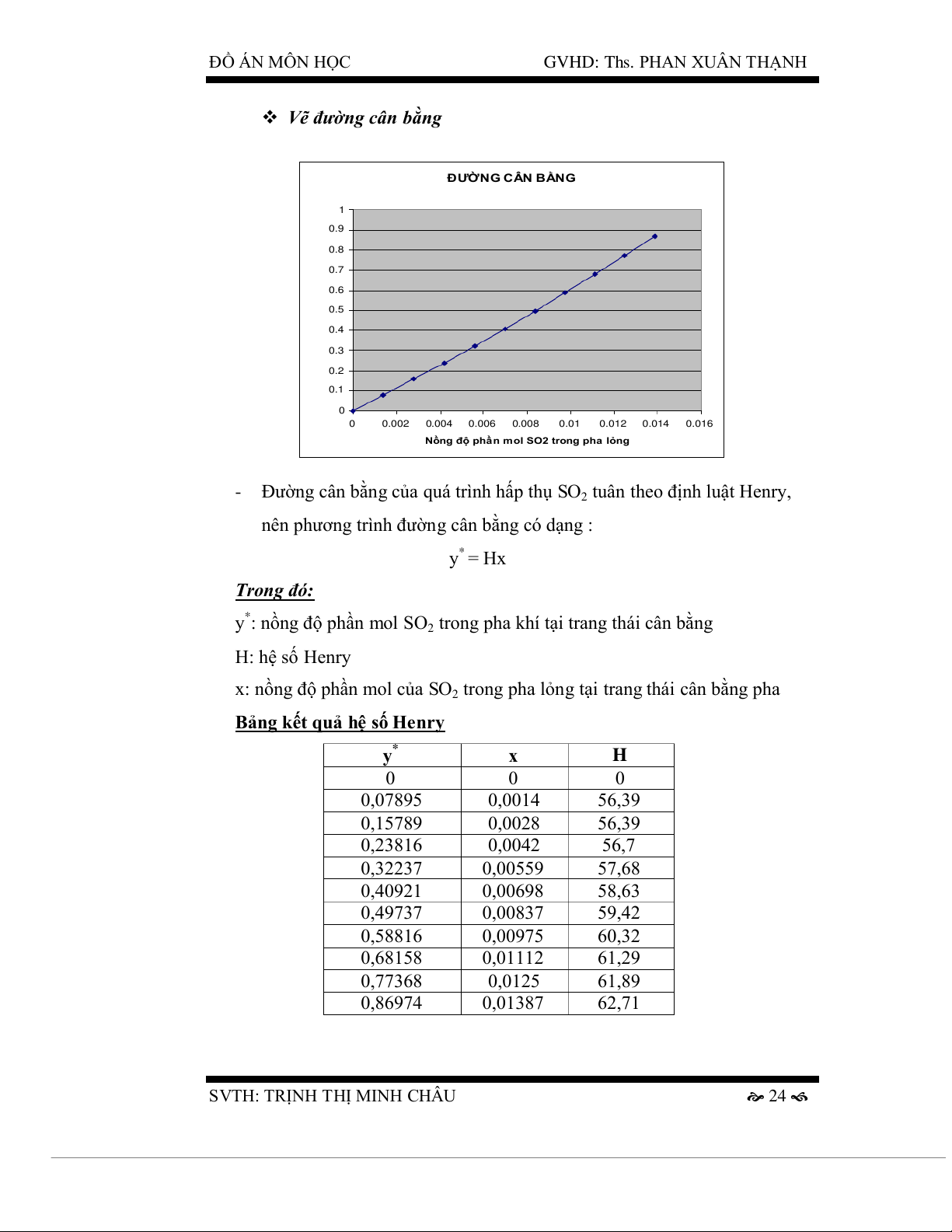
Vẽ đường cân bằng ĐƯỜNG CÂN BẰNG 1 0.9 0.8 0.7 2 trong pha khí 0.6 O 0.5 ol S 0.4 0.3 0.2 ồng độ phần m N 0.1 0 0 0.002 0.004 0.006 0.008 0.01 0.012 0.014 0.016
Nồng độ phần mol SO2 trong pha lỏng
- Đường cân bằng của quá trình hấp thụ SO2 tuân theo định luật Henry,
nên phương trình đường cân bằng có dạng : y* = Hx Trong đó:
y*: nồng độ phần mol SO2 trong pha khí tại trang thái cân bằng H: hệ số Henry
x: nồng độ phần mol của SO2 trong pha lỏng tại trang thái cân bằng pha
Bảng kết quả hệ số Henry y* x H 0 0 0 0,07895 0,0014 56,39 0,15789 0,0028 56,39 0,23816 0,0042 56,7 0,32237 0,00559 57,68 0,40921 0,00698 58,63 0,49737 0,00837 59,42 0,58816 0,00975 60,32 0,68158 0,01112 61,29 0,77368 0,0125 61,89 0,86974 0,01387 62,71
SVTH: TRỊNH THỊ MINH CHÂU 24




