


















Preview text:
lOMoAR cPSD| 45740153
Hoá phân tích 2 – thực hành.
Bài 2:............................................................................................................................. .................................................2
Bài 3:............................................................................................................................. .................................................5
Bài 4:..............................................................................................................................................................................8
Bài 5:............................................................................................................................................................................11
Bài 7:............................................................................................................................................................................13
Bài 8:............................................................................................................................................................................14
Soạn đề ôn kiểm tra đợt 2 (bài 3 + 4 + 5 + 7 +8)......................................................................................................16
Đề 1:....................................................................................................................................................................16
Đề 2:....................................................................................................................................................................17
Đề 3:....................................................................................................................................................................17
Đề 4:....................................................................................................................................................................18
Đề 5:....................................................................................................................................................................18
Đề 6:....................................................................................................................................................................19
Đề 7:....................................................................................................................................................................20
Đề 8:....................................................................................................................................................................21 1 lOMoAR cPSD| 45740153
Bài 2: Định lượng ion sắt (II) trong nước bằng phương pháp quang phổ uv-vis.
1. Nguyên tắc định lượng?
- Ion Fe2+ có khả năng tạo phức với 1,10 phenatrolin (o-phen) tạo phức màu đỏ cam
bền trong môi trường đệm acetat và phức màu này có khả năng hấp thụ quang phổ
trong vùng ánh sáng khả kiến (có cực đại hấp thu tại bước sóng 510 nm 3 và có
hệ số hấp thu mol bằng 11.100 mol.l-1.cm-1). Lập phương trình hồi quy và tính
toán kết quả nồng độ Fe2+ trong mẫu. Fe2+ + O-phen = [Fe(O-phen)3]2+.
2. Mẫu chuẩn? Mẫu thử? Mẫu trắng?
- Mẫu chuẩn: Dung dịch chuẩn sắt Fe2+: 1000 mg/l, dung dịch đệm actetat 1 g/l,
nước cất, 1-10 phenatrolin.
- Mẫu thử: Dung dịch mẫu thử sắt Fe2+, dung dịch đệm acetat, nước cất, 1,10phenatrolin.
- Mẫu trắng: Dung dịch đệm acetat, nước cất, 1,10 phenatrolin.
3. Dung dịch chuẩn được pha loãng bao nhiêu lần? 100 lần.
4. Độ pha loãng của mẫu thử trước phản ứng? 20 lần.
5. Mẫu thử được pha loãng sau phản ứng bao nhiêu lần? 200 lần.
6. Cách pha dung dịch chuẩn?
- Dùng pipet bầu 5ml hút chính xác 5ml dung dịch chuẩn Fe2+ có nồng độ 1000 ug/ml
rồi cho vào bình định mức 500 ml. Thêm nước cất đến vạch rồi trộn đều, ta được
dung dịch chuẩn Fe2+ mới có nồng độ bằng 10 ug/ml.
C1V1 = C2V2 5.1000=500.C2 C2 = 10 (ug/ml).
7. Cách pha dung dịch mẫu thử?
- Dùng pipet bầu 5ml hút chính xác 5 ml mẫu thử rồi cho vào bình định mức 100 ml.
Dùng nước cất định mức tới vạch rồi trộn đều, ta được 100 ml mẫu thử T đã pha loãng 20 lần.
8. Thành phần của hệ đệm acetat? CH3COOH/CH3COONa.
9. Vai trò của phenatrolin 1,10? Tạo phức màu đỏ cam với Fe2+ bền trong môi trường đệm
acetat để đo quang phổ UV – VIS.
10. Bước sóng của bài này là bao nhiêu? 510 3 nm.
11. Ứng dụng của các kiểu đo Photometry? Kinetic? Spectrum?
- Photometry: Đo độ hấp thụ của 5 dd chuẩn và dd cần định lượng Ct vừa pha tại
tương quan λmax (biến thiên theo nồng độ).
- Kinetic: Đo độ hấp thụ tương quan với thời gian phản ứng (đo Tmax).
- Spectrum: Quét phổ hấp thụ của dung dịch chuẩn 3 từ bước sóng 400-650 nm để tìm λmax.
12. Trình bày đơn giản các bước chuẩn bị xây dựng 5 điểm tuyến tính? -
Pha dãy dung dịch chuẩn có nồng độ C , C , C , C , C , đo độ hấp thu tương 1 2 3 4 5
ứng A , A , A , A , A . Vẽ đồ thị A theo C. 1 2 3 4 5 2 lOMoAR cPSD| 45740153 - 2
- Yêu cầu: A = f (C) và r > 0,99.
Đo mật độ quang của dung dịch cần xác định C được độ hấp thu A tương ứng. T T
- Dựa vào đường chuẩn xác định C . T
13. Có thể thay thế đệm Acetat (pH=5) thành đệm Amoni (pH=10) hay không? Vì sao?
- 4 yêu cầu của định luật Lambert khi đo quang: mẫu phải bền trong MT dung dịch,
môi trường phải trong suốt, chỉ hấp thụ chùm tia đơn sắc, nồng độ mẫu thử phải
nằm trong khoảng tuyến tính.
- Không. Vì ta định lượng ion Fe2+ trong nước bằng cách đo quang phổ phức đỏ cam
Fe2+ với 1,10 phenatrolin – phức này bền trong môi trường đệm acetat (pH < 7).
Nếu thay thế đệm acetat (pH= 5) thành đệm Amoni (pH = 10) thì phức kém bền
(không đáp ứng đủ yêu cầu định luật Lambert).
14. Dùng dụng cụ gì để lấy 5ml dung dịch đệm Acetat?
- Dùng pipet thẳng/cốc có mỏ vì dung dịch đệm actetat không phải chất chuẩn nên
không cần lấy thể tích chính xác.
15. Lấy mẫu chuẩn và mẫu thử dùng dụng cụ đo nào?
- Thử: BĐM 100ml và pipet bầu 5ml, chuẩn: BDM 500ml và pipet bầu 5ml vì pha
loãng dung dịch chuẩn/dung dịch có nồng độ chính xác nên cần dụng cụ đo chính xác.
16. Cho dung dịch chuẩn 10mg/ml lấy 5ml cho vào bình định mức 100ml và định mức
đến vạch, tính nồng độ? C1V 1 5.10 - C1V1 = C2V2 C2 = = =0,5(mg/ml). V 2 100
17. Liệt kê cuvet được xài trong bài? Giải thích?
- Cuvet: nhựa, thuỷ tinh, thạch anh.
- Giải thích: Vì phức hấp thụ trong vùng khả kiến (380-760 nm) mà nhựa/thuỷ
tinh/thạch anh không bị hấp thụ trong vùng này nên ánh sáng đo quang có thể truyền thẳng qua mẫu cuvet.
18. Vai trò của 1,10 phenatrolin, nước cất, ion sắt và đệm actetat?
- 1,10 phenatrolin: tạo phức màu đỏ cam bền với ion Fe2+ để định lượng bằng
phương pháp đo quang phổ UV-VIS.
- Nước cất: dung môi pha loãng nồng độ dung dịch.
- Ion Fe2+: chất chuẩn Fe2+ 1000 ugm/l dùng để định lượng. - Đệm actetat:
ổn định pH môi trường dung dịch.
19. Mục đích của việc lập 5 điểm chuẩn?
- Để hình thành sơ đồ hồi quy tuyến tính (xây dựng đường chuẩn).
20. Vì sao trong bài thực hành phải pha loãng mẫu 200 lần?
- Pha loãng dung dịch chuẩn giúp giảm nồng độ ion sắt (II), tạo điều kiện cho: 3 lOMoAR cPSD| 45740153
• Phản ứng tạo phức chất diễn ra hoàn toàn hơn, từ đó tăng độ chính xác của kết quả phân tích.
• Nồng độ ion sắt (II) nằm trong phạm vi tuyến tính của đường chuẩn, đảm
bảo độ chính xác của phép đo quang phổ.
Đáp ứng được các yêu cầu về mẫu đo của định luật Lambert (mẫu bền, loãng, dung
dịch trong suốt, nồng độ dung dịch nằm trong khoảng tuyến tính).
21. Vẽ phương trình hồi quy y = a + bx. Trong đó, y tương ứng với Abs, x tương ứng với C (ug/ml).
22. Tại sao phải ủ 15p?
- Để đệm pH ổn định pH môi trường và các phản ứng xảy ra hoàn toàn để kết quả đo
quang được chính xác.
23. Fe3+ có thể tạo phức với O-phen bằng phương pháp trực tiếp được không? Vì sao?
- Fe3+ có thể tạo phức với O-phen nhưng không dùng phương pháp này để đo trực
tiếp được vì phức này kém bền, phải chuyển Fe3+ thành Fe2+ rồi mới thực hiện phản ứng.
24. Trình bày thứ tự pha chế thuốc thử? Đổi thứ tư có được không? Tại sao?
- Thứ tự pha chế thuốc: Pha dung dịch chuẩn Pha loãng mẫu thử Pha 5 bình mẫu
chuẩn, 1 bình mẫu thử và 1 bình chất nền để đo độ hấp thu. •
Pha dung dịch chuẩn trung gian S1: Hút chính xác 5 ml dung dịch chuẩn
1000 ug/ml cho vào bình định mức 500 ml. Thêm nước cất đến vạch mức
rồi trộn đều, ta có dung dịch chuẩn S1 có nồng độ 10 ug/ml. •
Pha loãng mẫu thử: Hút chính xác 5 ml mẫu thử (PTN đã cung cấp) cho
vào bình định mức 100 ml, thêm nước cất đến vạch mức rồi trộn đều, ta có
mẫu thử đã pha loãng 20 lần. •
Pha 5 bình mẫu chuẩn, 1 bình mẫu thử và 1 bình chất nền để đo độ hấp thu. •
Chuẩn bị 7 bình định mức 100 ml và pha dung dịch để đo độ hấp thụ A.
- Thứ tự pha chế thuốc thử trong bài thực tập thay đổi được nhưng không được cho
dung dịch đệm acetat vào sao cùng vì đệm này giúp tạo môi trường pH ổn định cho phản ứng.
25. Phức có màu gì trong vùng ánh sáng nào? PTPU?
- Phức có màu đỏ cam trong vùng ánh sáng khả kiến (380-760 nm). PTPU: Fe2+ + O-phen = [Fe(O-phen)3]2+.
26. Trình bày cấu tạo máy đo quang phổ?
- Nguồn sáng => hệ tán sắc => cuvet => đầu dò.
27. Vì sao phải pha loãng dung dịch chuẩn 1-5?
- Có thể đo mật độ quang khác nhau để xác định đường chuẩn, từ đó xác định nồng
độ chất cần định lượng.
28. Phương pháp định tính là phương pháp điểm danh các chất dựa vào λmaxcủamẫuthử sovớimẫuchuẩn.
29. Đường biểu diễn nồng độ hấp thu của mỗi phép đo biến thiên theo thông số gì?
- Biến thiên theo nồng độ Fe2+ tính theo (ug/ml). 4 lOMoAR cPSD| 45740153 -
30. Kể tên 3 ứng dụng của phương pháp đo quang phổ UV – Vis? - Phân tích hàm lượng
kim loại trong thực phẩm.
- Phân tích hàm lượng kim loại nặng, ion vô cơ trong nước và nước thải. - Phân
tích hàm lượng nhôm, phenol…trong vacxin và sinh phẩm.
31. Tại sao phải chọn MT acid mà không ưu tiên MT trung tính và base?
- Vì không đáp ứng đủ điều kiện của định luật Lambert: Ánh sáng phải đơn sắc;
• Dung dịch phải trong suốt (không tán xạ);
• Dung dịch loãng nằm trong khoảng nồng độ tuyến tính giữa A – C;
Chất đo bền trong MT dung dịch.
32. Khi định lượng mẫu bằng phương pháp đường chuẩn thì nồng độ mẫu thử so với dãy
chuẩn phải như thế nào? Giải thích?
Nồng độ mẫu thử phải nằm trong khoảng nồng độ tuyến tính của dãy chuẩn vì
nếu nằm ngoài khoảng nồng độ dãy chuẩn thì phương pháp đo quang sẽ không
cho kết quả chính xác do không đáp ứng đủ điều kiện của định luật Lambert.
33. Nêu khoảng pH của dd đệm acetat? Biết pKa của CH3COOH là 4,75. -
Khoảng pH của dd đệm acetat: 4,5-5.
34. Nêu ngắn gọn cách pha (chuẩn bị) dãy chuẩn gồm 5 điểm chuẩn khi định lượng Fe
(II) bằng phương pháp đo quang phổ UV – VIS?
- Dùng buret hút chính xác 5, 10, 20, 25, 50 ml lần lượt vào 5 bình 1 => 5.
- Dùng pipet khắc vạch hút 5 ml dung dịch đệm cho lần lượt vào 5 bình 1 => 5.
- Dùng pipet khắc vạch hút 10 ml dung dịch 1,10 phenantrolin lần lượt vào 5 bình 1 => 5.
- Rồi sau đó dùng nước cất định mức tới vạch bình định mức 100 ml.
35. Tính Fe2+ bằng phương pháp nào? Phương pháp xây dựng đường chuẩn và lập phương trình hồi quy.
36. Trong tính toán, Fe2+ dùng nồng độ nào? ug/ml.
37. Khi định lượng ion Fe2+ trong nước bằng chuẩn độ UV-Vis dùng kiểu đo nào? Photometry.
38. Tính toán tìm C từ công thức nào? - A = 𝜀. 𝑙. 𝐶
• l: Chiều dày của lớp chất hấp thụ (cm).
• A: độ hấp thụ (không đơn vị).
• C: Nồng độ của chất hấp thụ (mol/lít). e: Hệ số hấp thụ mol (l.mol- 1.cm-1).
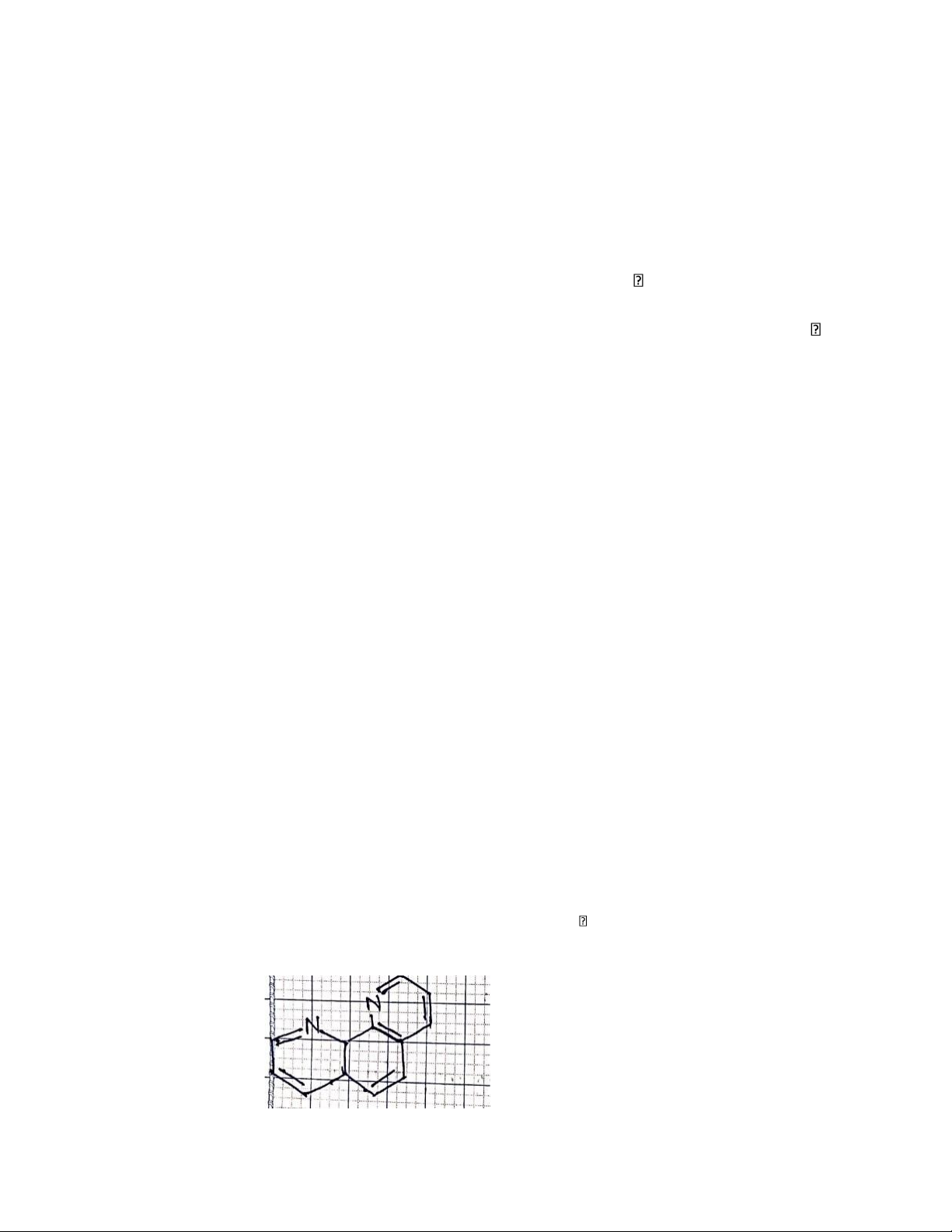
39. Cấu tạo của 1,10 phenatrolin? 5 lOMoAR cPSD| 45740153
40. Làm cách nào để nhận biết ion Fe2+?
- Dựa vào khả năng tạo phức bền với 1,10 phenatrolin trong MT đệm acetat hấp thu trong vùng VIS.
Bài 3: Định lượng nitrit bằng phương pháp đo quang phổ tử ngoại.
1. Nguyên tắc của phép đo quang bằng quang phổ UV?
- Nitrit trong môi trường acid HCl (hoặc acid nitro) có khả năng tạo với acid sulfanilic
thành một diazoic có thể hấp thụ quang phổ tử ngoại nên có thể định lượng acid
nitric bằng phương pháp đo quang phổ UV-VIS. Tính toán nồng độ mẫu đo theo độ hấp thu A.
2. Đổi đơn vị: 1 g/l = 10^3 ug/ml.
3. Nêu ứng dụng của phương pháp định lượng nitrit?
- Dùng cho các chuẩn độ acid-base, oxy hoá khử, tạo phức, tạo tủa.
4. Trình bày thứ tự pha chế dung dịch thuốc thử?
- Dùng pipet bầu 5 ml hút chính xác 5 ml dung dịch mẫu thử NaNO2 cần định lượng
cho vào bình định mức 100 ml.
- Dùng pipet thẳng hút 2 ml dung dịch acid sulfalinic 0,6 g/l cho vào bình định mức.
- Thêm nước cất gần tới vạch định mức.
- Dùng pipet thẳng hút 2 ml dung dịch acid HCl 4 N vào bình định mức. Dùng nước
cất định mức đến vạch rồi trộn đều.
5. Trình bày thứ tự pha chế 5 mẫu dung dịch chuẩn?
- Dùng buret hút chính xác 2, 5, 10, 15, 20 ml dung dịch chuẩn trung gian S1 NaNO2
2 ug/ml lần lượt vào 5 bình định mức 1 5.
- Dùng pipet thẳng hút 2 ml dung dịch acid sulfalinic 0,6 g/l cho lần lượt vào từng bình định mức.
- Thêm nước cất gần tới vạch định mức.
- Dùng pipet thẳng hút 2 ml dung dịch acid HCl 4 N cho lần lượt vào từng bình định mức.
Dùng nước cất định mức đến vạch rồi trộn đều.
6. Trình bày các bước pha dung dịch chuẩn S1? 6 lOMoAR cPSD| 45740153 -
- Dùng pipet bầu 10 ml hút chính xác 10 ml dung dịch chuẩn NaNO2 0,2 g/l cho vào
bình định mức 100 ml, thêm nước cất tới vạch định mức rồi trộn đều, ta được 100
ml dung dịch chuẩn S1 có nồng độ 0,02 g/l tương ứng. C1V 1 0,2.10 C1V1 = C2V2 C2 = = =0,02(g/l). V 2 100
7. Ứng dụng của các kiểu đo Photometry? Kinetic? Spectrum?
- Photometry: Đo độ hấp thụ của 5 dd chuẩn và dd cần định lượng Ct vừa pha tại
tương quan λmax (biến thiên theo nồng độ).
- Kinetic: Đo độ hấp thụ tương quan với thời gian phản ứng (đo Tmax) (tìm thời gian
để phản ứng xảy ra hoàn toàn và phản ứng đạt trạng thái cân bằng) (biến thiên theo thời gian).
- Spectrum: Quét phổ hấp thụ của dung dịch chuẩn từ bước sóng 250-400 nm để tìm
λmax (biến thiên theo bước sóng).
8. Vì sao phải dùng = 270 nm để khảo sát động học phản ứng (kinetic)?
Vì bước sóng này gần với độ hấp thụ của nhóm chức -N=N (diazo).
9. Thứ tự thực hiện phản ứng diazo? Thay đổi thứ tự phản ứng được không? Vì sao?
- Thứ tự thực hiện phản ứng diazo: Pha dung dịch chuẩn trung gian S1 Pha 5 bình
mẫu chuẩn, 1 bình mẫu thử và 1 bình chất nền để đo độ hấp thụ.
- Không thể thay đổi thứ tự pha chế thuốc thử vì nếu HCl đươc cho vào trước acid
sulfanilic thì một phần nitrit có thể bị oxy hóa thành nitrat và do đó sẽ không định lương được.
10. Trong phần khảo sát động học của phản ứng theo thời gian nếu không đo ngay lập
tức thì độ hấp thu của dung dịch sẽ bị ảnh hưởng?
- Trong phần khảo sát động học của phản ứng theo thời gian nếu không đo ngay lập
tức thì độ hấp thu của dung dịch sẽ bị ảnh hưởng vì phương pháp đo động học phụ
thuộc vào thời gian.
11. Sản phẩm diazoic đo trong vùng nào? Màu gì? Dùng cuvet nào phù hợp?
- Vùng tử ngoại (UV gần, 200-400 nm), sản phẩm không màu.
- Cuvet phù hợp: thạch anh.
- Giải thích: Vì sản phẩm hấp thụ trong vùng tử ngoại (200-400 nm) mà thạch anh
không bị hấp thụ trong vùng này nên ánh sáng đo quang có thể truyền thẳng qua mẫu cuvet.
12. Nêu các hoá chất được chuẩn bị?
- Mẫu chuẩn: dung dịch chuẩn NaNO2 0,2 g/l, dung dịch acid sulfalinic 0,6 g/l, nước cất 2 lần, acid HCl 4N.
- Mẫu thử: dung dịch mẫu thử NaNO2 cần định lượng, dung dịch acid sulfalinic 0,6
g/l, nước cất 2 lần, acid HCl 4N.
- Chất nền: dung dịch acid sulfalinic 0,6 g/l, nước cất 2 lần, acid HCl 4N.
13. Vai trò của dung dịch NaNO2 0,2 g/l, acid sulfalinic 0,6 g/l, nước cất, acid HCl 4N? 7 lOMoAR cPSD| 45740153
- Acid sulfalinic 0,6 g/l: Tạo với nitrit trong môi trường acid HCl thành diazo để đo quang phổ UV-VIS.
- Nước cất 2 lần: dung môi pha loãng dung dịch.
- HCl 4N: tạo môi trường pH acid cho dung dịch và tham gia phản ứng tạo phức với nitric.
- Dung dịch NaNO2 0,2 g/l: dung dịch có nồng độ chính xác dùng để pha mẫu chuẩn. V 2 100
14. Độ pha loãng dung dịch mẫu thử bài này là nhiêu lần? 20 lần ( = =20lần¿. V 1 5
15. Vì sao phải pha loãng dung dịch chuẩn 1-5?
- Có thể đo mật độ quang khác nhau để xác định đường chuẩn, từ đó xác định nồng
độ chất cần định lượng.
- Pha loãng chuẩn để nồng độ mẫu chuẩn có thể nằm trong khoảng tuyến tính nòng
độ của dãy chuẩn (đáp ứng điều kiện của định luật lambert: mẫu phải loãng, trong
suốt, nằm trong khoảng tuyến tính, bền).
16. Tại sao phải đợi 30p trước khi đo?
- Để đệm pH ổn định pH môi trường và các phản ứng xảy ra hoàn toàn để kết quả đo
quang được chính xác.
17. Điều kiện định luật Lambert?
- Ánh sáng phải đơn sắc;
- Dung dịch phải trong suốt (không tán xạ);
- Dung dịch loãng nằm trong khoảng nồng độ tuyến tính giữa A –C; - Chất đo bền trong MT dung dịch.
18. Nêu phương pháp tính kết quả hàm lượng nitrit trong mẫu thử bằng phương pháp đo UV-VIS? - 3 cách tính
• Từ độ hấp thu At thông qua đồ thị đường chuẩn.
• Từ độ hấp thu At thông qua phương trình hồi quy.
• Từ hệ số hấp thu mol thông qua biểu thức định luật Lambert-beer: A=e.l.C.
19. Lấy dung dịch acid sulfalinic 0,6 g/l bằng dụng cụ gì? Giải thích?
- Lấy bằng dụng cụ pipet thẳng. Vì Acid sulfalinic 0,6 g/l tạo với nitrit trong môi
trường acid HCl thành diazo để đo quang phổ UV-VIS định lượng nitrit, và nitrit là
dung dịch cần đo quang định lượng chính chứ không phải acid sulfalinic nên có thể
lấy dư hoặc đủ lượng tác chất acid sulfalinic để tạo sản phẩm đo quang diazoic.
20. Định lượng nitrit bằng phương pháp UV-VIS, để xây dựng phương trình hồi quy
tuyến tính, người ta sử dụng bao nhiêu dung dịch chuẩn? Giải thích?
- 5 dung dịch chuẩn. Vì 5 dung dịch chuẩn mới đủ dữ liệu để xét tính tuyến tính
(phương pháp xây dựng đường chuẩn) và số liệu 5 dung dịch chuẩn để tạo giao
điểm của nồng độ với độ hấp thu A, từ đó lập phương trình hồi quy tuyến tính.
21. λmax thựcnghiệm?270nm.
22. Sau khi có bước sóng hấp thụ cực đại thì chọn kiểu đo nào để có được độ hấp thu
chính xác tại vùng lamda để định lượng?
- Photometry để đo chính xác tại 1 bước sóng. 8 lOMoAR cPSD| 45740153 -
23. Ứng dụng của phương pháp đo quang phổ UV-VIS? Định tính, định lượng, kiểm tra
chất lượng, nghiên cứu khoa học.
24. Tại sao phải chọn khoảng bước sóng từ 200-400nm để quét bước sóng khi định lượng
Nitrit bằng pp quang phổ UV-VIS?
- Vì sản phẩm đo quang diazoic của nitric và acid sulfalinic bị hấp thụ trong vùng
UV tử ngoại (200-400 nm) nên ta cần chọn khoảng bước sóng từ 200-400nm để
quét bước sóng khi định lượng Nitrit.
25. Giá trị nào để biết phản ứng xảy ra hoàn toàn?
- Tmax: thời gian tối thiểu phản ứng xảy ra hoàn toàn & đạt trạng thái cân bằng.
26. Cho bảng số liệu, phương trình có dạng gì?
- Phương trình hồi quy tuyến tính, dạng đường thẳng.
Bài 4: Định lượng hỗn hợp acid H2SO4 và H3PO4 bằng
phương pháp chuẩn độ điện thế.
1. Nguyên tắc chuẩn độ hỗn hợp đa acid bằng phương pháp chuẩn độ điện thế?
- H2SO4 là một acid mạnh có 2 nấc phân ly và H3PO4 là một acid trung bình có 3
nấc phân ly nên có thể dùng một base mạnh như NaOH để chuẩn độ. Sử dụng máy
đo điện thế để theo dõi sự biến đổi thế E (hoặc dùng máy đo pH để xác dịnh pH
phản ứng) theo Vml chất chuẩn độ NaOH 0,10 N. Sau đó dùng phần mềm 9 lOMoAR cPSD| 45740153
excel xử lý kết quả đo, tìm ra thể tích chất chuẩn độ đã phản ứng tương đương và
áp dụng biểu thức định luật đương lượng để tính kết quả.
- Các phản ứng chuẩn độ:
H2SO4 + NaOH → NaHSO4 + H2O (1).
NaHSO4+ NaOH → Na2SO4 + H2O (2).
Phản ứng (1; 2) có khoảng bước nhảy ở pH = 4 → 10.
H3PO4+ NaOH → NaH2PO4 + H2O (3) pKa1 = 2,1
o Phản ứng (3) có khoảng bước nhảy ở pH = 4,1 - 5,2.
NaH2P04+ NaOH → Na2HPO4 + H2O (4) pKa2 =7,21 o
Phản ứng (4) có khoảng bước nhảy ở pH = 9,2 – 10.
NaHPO4 + NaOH → Na3PO4 + H2O (5) рКаз = 12,71
2. Các phản ứng trong bài đa acid? Theo thứ tự?
1. H2SO4 + NaOH = NaHSO4 + H2O.
2. NaHSO4 + NaOH = Na2SO4 + H2O.
3. H3PO4 + NaOH = NaH2PO4 + H2O.
4. NaH2PO4 + NaOH = Na2HPO4 + H2O.
5. Na2HPO4 + NaOH = Na3PO4 + H2O.
3. Điện cực bài hỗn hợp đa acid?
- Điện cực hỗn hợp bài đa acid là điện cực kép gồm điện cực chỉ thị màng thuỷ tinh
và điện cực so sánh là Ag/AgCl.
4. Các bước tiến hành của bài đo hỗn hợp đa acid? - Chuẩn bị buret:
Nạp dung dịch chuẩn NaOH 0,10 N lên cây Buret. - Chuẩn bị mẫu đo:
• Cho chính xác 10 ml dung dịch mẫu cần định lượng vào cốc có mỏ 100
ml (dung dịch X), cho cá từ vào cốc, rồi đặt cốc lên máy khuấy từ của hệ thống.
• Nhúng điện cực kép vào dung dịch X (lưu ý: đầu của điện cực ngập trong
dung dịch đo, nếu cần có thể dùng thêm nước cất).
- Tiến hành định lượng:
• Để máy ở chế độ đo pH.
• Nhỏ NaOH 0,10 N từ buret xuống. Ghi nhận số đo pH tương ứng với số
ml NaOH 0,10 N tiêu tốn. Khi qua điểm tương đương thứ hai (pH >10) thì
nhỏ thêm 1 - 2 ml NaOH rồi ngừng lại.
5. Xác định điểm tương đương của bài đa acid/Fe (II)?
- Đường cực đại đạo hàm bậc 1. Fe (II): ΔE/ ΔV. Đa acid: ΔpH/ ΔV.
6. Công thức tính P (g/l) H3PO4? - P (g/l) = CM x M = CM x 98.
- P (g/l) = CN x E = CN x 98/3.
7. Có thể thay thế NaOH bằng NH4OH được không? Vì sao? 10 lOMoAR cPSD| 45740153
- Không. Vì NaOH là base mạnh, NH4OH là base yếu mà ta cần chuẩn độ hỗn hợp
acid gồm acid mạnh H2SO4 và acid trung bình 3 nấc là H3PO4 nên ta cần dùng
chất chuẩn độ là dung dịch base mạnh, vì nếu dùng base yếu thì ta không trung
hoà được dung dịch cần định lượng (điểm tương đương) khó xảy ra bước nhảy
pH khó xác định điểm tương đương hơn.
8. Phương pháp điện thế được áp dụng cho phép đo nào?
- Áp dụng cho phép đo thay đổi đột ngột về mặt điện thế. - Ứng dụng: đo acid-
base, tạo phức, tạo tủa, oxh-khử.
9. Acid tham gia phản ứng mỗi nấc phân ly?
- 2 nấc H2SO4 + 1/3 nấc H3PO4 tại điểm tương đương V1 (bao gồm 3 phương trình: 1, 2, 3 pH= 4,1 5,2).
- 2 nấc H2SO4 + 2/3 nấc H3PO4 tại điểm tương đương V2 (bao gồm 2 phương trình: 4, 5 pH= 9,2 10).
10. V NaOH tiêu tốn?
- H3PO4 (3V2 – V1). - H2SO4 (2V1-V2).
11. Các nấc phân li có dễ dàng xác định không?
- Việc xác định các nấc không dễ dàng vì nahso4 không phân li hoàn toàn nên phản
ứng (1) này khó xác định điểm tương đương của lúc này mà phản ứng đi thẳng qua nấc phân li thứ hai.
- Phản ứng (5) thì không rõ trong môi trường nước với PO43- là một acid rất yếu nó
không thể hiện tính acid trong nước.
12. Trong bài hỗn hợp đa acid có khoảng pH nào nên thực hiện chậm không? Có,
khoảng pH = 4, 1 - 5,2 và pH = 9,2 - 10.
13. Nêu phương pháp chuẩn độ bài hỗn hợp đa acid? Viết phương trình tại điểm tương đương?
- Phương pháp chuẩn độ acid – base.
- Phương trình tại điểm tương đương V1: Vtd1 = VH2SO4 + 1/3 VH3PO4.
o H2SO4 + NaOH = NaHSO4 + H2O (1)
o NaHSO4 + NaOH = Na2SO4 + H2O (2)
o H3PO4 + NaOH = NaH2PO4 + H2O(3)
- Phương trình tại điểm tương đương V2: Vtd2 = VH2SO4 + 2/3 VH3PO4.
o H2SO4 + NaOH = NaHSO4 + H2O (1)
o NaHSO4 + NaOH = Na2SO4 + H2O (2)
o H3PO4 + NaOH = NaH2PO4 + H2O(3)
o NaH2P04+ NaOH → Na2HP04 + H2O (4).
14. H2SO4 và H3PO4 có bao nhiêu nấc phân ly?
- H2SO4: n = 2 có 2 nấc phân ly HSO4 (pKa=-3) và SO42- (pKa=2) → pKa 1 < 4
Chuẩn độ 1 lần (HSO4 không phân li hoàn toàn nên khó xác định) pH 4 - 10. 11 lOMoAR cPSD| 45740153
- H3PO4: n = 3 có 3 nấc phân ly H2PO4- (pKa=2,1); HPO42- (pKa=7,21);
PO43(pKa=12,71) → pKa = 22.02 > 4 Chuẩn độ 2 nấc do nấc 3 có pKa rất lớn không hiện tính acid.
- Nấc (I): pH 4,1 - 5,2; Nấc (2): pH 9,2 - 10; Nấc (3) không có pH rõ ràng.
15. Sau khi thực hành cần tìm đường đồ thị dạng gì? Cách xác định điểm tương đương?
- Đồ thị đường đạo hàm bậc 1 của ΔpH/ΔV theo Vtb của NaOH đã dùng.
- Xác định điểm tương đương dựa vào điểm cực đại của đường đồ thị đạo hàm bậc 1.
- Lưu ý ở bài này có 2 điểm cực đại vì có 2 chất.
• Điểm cực đại thứ 1 (pH=4,6) là khi chuẩn độ được 2 nấc H2SO4 và nấc 1 của H3PO4.
• Điểm cực đại thứ 2 (pH=9,6) là khi chuẩn độ được 2 nấc H2SO4 và nấc 2 của H3PO4.
16. Cách nhỏ NaOH từ buret như thế nào? Lúc đầu cho từng ml vào, gần điểm tương
đương thì cho từng 0,05 hoặc 0,1 ml. Sau khi qua điểm tương đương thứ 2 thì nhỏ thêm 1-2ml.
17. Ưu điểm của PP chuẩn độ điện thế so với PP hóa học:
- Độ nhạy cao, có thể đến 10-5M.
- Chuẩn độ được những dung dịch có màu, trường hợp không có chất CT màu, đđ chứa nhiều cấu tử.
18. Đơn vị dùng trong bài hỗn hợp đa acid? P (g/l).
19. Định lượng hỗn hợp đa acid H2SO4 và H3PO4 bằng pp chuẩn độ điện thế, người ta dùng:
- Dùng dd chuẩn độ: NaOH 0,10 N.
- Dùng cặp điện cực kép: điện cực chỉ thị màng thuỷ tinh và điện cực so sánh là Ag/AgCl.
- Cách xác định điểm tương đương: Xác định điểm tương đương dựa vào điểm cực
đại của đường đồ thị đạo hàm bậc 1.
Bài 5: Định lượng nguyên liệu sắt (II) sunfat bằng phương
pháp chuẩn độ điện thế.
1. Nguyên tắc chuẩn độ sắt (II) sunfat bằng phương pháp chuẩn độ điện thế?
- Sắt (II) sunfat là chất có tính khử nên có thể dùng các chất chuẩn độ có tính oxi hoá
như K2Cr2O7 để chuẩn độ. Sử dụng máy đo điện thế để theo dõi sự biến đổi E (V)
của phản ứng theo thể tích V (ml) chất chuẩn độ K2Cr2O7 0,10N thêm vào. Sau đó
dùng phần mềm excel để xử lý kết quả đo điện thế để tìm ra thể tích chất chuẩn độ
K2Cr2O7 0,10N đã phản ứng tương đương và áp dụng biểu thức định luật đương
lượng để tính hàm lượng Fe2+. - Phản ứng chuẩn độ:
6Fe2+ + Cr2O72- + 14H+ = 6Fe3+ + 2Cr3+ + 7H2O.
2. Vai trò từng chất trong phản ứng chuẩn độ? - Fe2+: Chất khử – mẫu thử. 12 lOMoAR cPSD| 45740153
- Cr2O72- 0,10N: Chất oxi hoá – chất chuẩn độ.
- H2SO4 20%: môi trường phản ứng.
3. Điện cực sử dụng trong phép đo sắt (II) sunfat bằng phương pháp chuẩn độ điện thế?
- Điện cực kép gồm điện cực chỉ thị là Pt và điện cực so sánh là Ag/AgCl.
4. Các bước tiến hành phép đo sắt (II) sunfat bằng phương pháp chuẩn độ điện thế?
- Cân chính xác khoảng 0,5 gam sắt (II) Sunfat vào trong cốc có mỏ, hòa tan hoàn
toàn hỗn hợp gồm khoảng 10 ml acid sunfuric 20% và khoảng 80 ml nước cất;
- Cho tất cả từ từ vào cốc rồi đặt cốc lên máy khuấy từ trong hệ thống;
- Rửa sạch điện cực kép bằng nước cất rồi ráp điện cực vào hệ thống giá đỡ (lưu ý:
đầu điện cực được nhúng ngập trong dung dịch đo và nếu cần thì dùng thêm nước cất);
- Chuẩn độ bằng dung dịch K2Cr2O7 0,10 N và theo dõi sự thay đổi thế điện cực.
5. Có thể thay H2SO4 bằng NaOH được không? Vì sao?
- Không. Vì OH- sẽ phản ứng với ion Fe2+ tạo Fe(OH)2, vì chất này kém bền nên
nhanh chóng chuyển thành dạng Fe(OH)3 – kết tủa sai số chuẩn độ.
6. Trong phương pháp chuẩn độ oxy hóa khử trên có thể thay thế dung dịch chuẩn
trên bằng các dung dịch nào? Cho ví dụ và viết phương trình phản ứng?
- Trong phương pháp chuẩn độ oxy hóa khử trên có thể thay thế dung dịch chuẩn trên
bằng các dung dịch KMnO4.
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + H2O + K2SO4 + MnSO4.
7. Có thể thêm vào phản ứng một chất khử khác được không? Vì sao?
- Không. Vì chất khử thêm vào sẽ phản ứng với chất chuẩn độ có tính oxi hoá mạnh
là K2Cr2O7 0,10 N, gây giảm một lượng chất chuẩn độ không xác định được nên
dễ gây sai số phép đo điện thế [phép đo điện thế E (mV) theo V (ml) của K2Cr2O7 0,10 N].
8. Đương lượng gam của Fe2+? K2Cr2O7? M M - E (Fe2+) = = . n 1 M M - E (K2Cr2O7) = = . n 6
9. Sau khi thực hành cần tìm đường đồ thị dạng gì? Cách xác định điểm tương đương?
- Đồ thị đường đạo hàm bậc 1 của ΔE/ΔV theo Vtb dd chuân độ K2Cr207 đã dùng.
- Xác định điểm tương đương: Dựa vào cực đại của đường đạo hàm bậc 1 để tìm thể
tích K2Cr2O7 0,10 N tương đương.
10. Nêu một phương pháp khác để định lượng sắt (II) sulfat?
- Phương pháp khác để định lượng sắt (II) sulfat: phương pháp permanganat.
11. Cách bảo quản điện cực sau sử dụng? - Rửa sạch điện cực bằng nước cất.
- Lau khô điện cực bằng khăn giấy.
- Gắn nắp bảo vệ có chứa dd KCl vào điện cực cho đầu dò ngập trong dd. 13 lOMoAR cPSD| 45740153
12. So sánh sự khác nhau giữa 2 phương pháp đo chuẩn độ điện thế và phương pháp
Chuẩn độ điện thế
Chuẩn độ thể tích - Độ chính xác cao, tìm
được điểm tương đương. - Phương pháp đơn giản.
Ưu điểm - Không cần dùng chất chỉ thị. - Dụng cụ rẻ tiền. - Thao tác đơn giản.
- Chỉ xác định được điểm kết thúc. Nhược
- Phải thực hiện nhiều lần với 1 điểm - Thiết bị mắc tiền. phép thử.
- Thời gian khảo sát lâu.
- Cần tìm chỉ thị màu phù hợp.
chuẩn độ thể tích?
13. Ứng dụng của phương pháp chuẩn độ đo điện thế?
- Dùng để đo pH, chuẩn độ acid-base, định lượng các ion KL trong nước, thực phẩm, dược phẩm.
14. Viết công thức tính %Fe2+? (C.V
)K 2Cr2O7 - % FeSO4 = mcân x M FeSO4.
15. Vai trò KCl bão hoà ? Máy đo pH?
- KCl bão hòa dùng để bảo vệ điện cực.
- Máy đo pH là máy chuẩn độ điện thế để theo dõi sự biến đổi của pH.
16. K2Cr2O7 có mấy điểm tương đương? Giải thích?
- Có 1 điểm tương đương vì mẫu chỉ có Fe2+.
17. Ứng dụng của điện cực so sánh?
- Tiêu chuẩn xác định thế điện cực khác.
- Đo điện thế trên bề mặt các điện cực.
- Đo pH bằng phương pháp điện hoá.
- Dùng để xác định thế của những điện cực khác (hiệu chuẩn) - điện cực hydro chuẩn.
- Dùng trong chuẩn độ điện thế - điện cực calomel, Bạc Clorua.
18. Có thể thay H2SO4 thành HCl hoặc HNO3 được không? Vì sao?
- Thay HCl? Không, vì ion Cl- có tính khử (Cl-1 có thể tăng số oxi hoá) khi tác dụng
với K2Cr2O7, nó thể cạnh tranh phản ứng với Fe2+ (mẫu có tính khử) gây sai số thiếu. 14 lOMoAR cPSD| 45740153
- Thay HNO3? Không, vì HNO3 có tính oxi hoá mạnh, vì nó sẽ tác dụng với Fe2+
gây phản ứng phụ (gây sai số đo do mất mẫu, Fe2+ bị khử lên Fe3+). Ngoài ra,
HNO3 phản ứng với Fe2+ sẽ bị trung hoà dần môi trường kiềm hoá nên Fe2+ sẽ
phản ứng với OH- môi trường tạo tủa Fe(OH)3 gây sai số đo.
Bài 7: Tách và định tính các cyclin bằng phương pháp sắc ký lớp mỏng.
1. Nguyên tắc bài tách và định tính các cyclin?
- Sắc ký lớp mỏng (SKLM) là một phương pháp phân tích cho phép tách và định tính
những lượng nhỏ các hợp chất hữu cơ. Việc tách những sản phẩm được thực hiện
dựa vào sự khác biệt về tốc độ rửa giải của một dung môi thích hợp (pha động: chất
rửa giải/hệ dung môi) trên một giá mang chất hấp phụ rắn (pha tĩnh) đối với các
thành phần của một hỗn hợp.
2. Vai trò của cột sắc ký?
- Tách các chất pha động ra khỏi cột sắc ký tuỳ thuộc vào tính phân cực từng chất.
3. Các lưu ý khi chuẩn bị pha động?
- Tất cả dung dịch trước khi đưa vào máy sắc ký đều phải lọc qua màng lọc 0,45 um.
- Pha động cần khử khí bằng siêu âm trước khi tiến hành.
6. Siêu âm có vai trò: loại bỏ bọt khí, khử khí trong pha động
7. Bước sóng phát hiện trong bài tách và định tính các cyclin là: 274 nm.
8. Trong định lượng, thay pha tĩnh bằng một chất phân cực được không? Giải thích?
- Được. Sử dụng sắc ký phân bố pha thuận để tách các chất cần phân tích. 9. Rf là gì?
- Là hệ số di chuyển, đại lượng đặc trưng cho mức độ di chuyển của chất phân tích.
10. Ứng dụng của SKLM?
- Định tính và thử độ tinh khiết.
- Định lượng và bán định lượng.
11. Cách phát hiện lớp sắc ký trong bài thực hành cyclin? Phạm vi áp dụng?
- Cách phát hiện: Soi dưới đèn UV 254 nm.
- Phạm vi áp dụng: Chất khảo sát hoàn toàn là chất lỏng, tách nhau hoàn toàn và phát
quang được (hợp chất có nối đôi, nhân thơm, dị vòng).
12. Các bước thực hiện định tính bằng phương pháp SKLM?
- Chuẩn bị vật liệu: bản mỏng silicagel, bình khai triển, mao quản, giấy bão hoà SK. -
Chuẩn bị dung môi khai triển. - Chiết cyclin.
- Chấm mẫu thử lên bản mỏng.
- Triển khai sắc ký. - Phát hiện kết quả.
13. Thành phần của Silicagel dùng trong SKLM? Nó có được sử dụng trong sắc ký cột không?
- Thành phần của Silicagel dùng trong SKLM là silicagel của acid salycilic, nó có
được sử dụng trong sắc ký cột.
14. Cơ chế chính trong sắc ký lớp mỏng? - Sắc ký hấp phụ. 15 lOMoAR cPSD| 45740153
Bài 8: Định lượng đồng thời Paractemol và cafein trong chế
phẩm bằng phương pháp sắc ký lỏng hiệu năng cao.
1. Nguyên tắc bài định lượng đồng thời Paractemol và cafein?
- Paracetamol và cafein có các nối đôi liên hợp và các nhóm mang màu nên sau khi
chiết khỏi dược phẩm có thể được tách và định lượng bằng phương pháp HPLC với
cột pha đảo và đầu dò dãy diod quang (PDA).
2. Hãy cho biết thành phần pha động trong định lượng Paractemol và cafein trong
chế phẩm bằng phương pháp sắc ký lỏng hiệu năng cao? Cần lưu ý điều gì? -
Thành phần pha động: 345 ml nước + 140 ml methanol + 15 ml acid acetic băng. -
Cần lưu ý: o Lọc dưới áp suất qua màng lọc giảm 0,45 um. o
Khử khí pha động bằng siêu âm trong 10 phút.
2. Vai trò của methanol trong định lượng Paractemol và cafein trong chế phẩm
bằng phương pháp sắc ký lỏng hiệu năng cao?
- Rửa cột sắc ký, dung môi pha động, bảo quản cột, cân bằng cột SK
3. Cách để định tính bài Paractemol và cafein? Định lượng?
- Định tính: thời gian lưu.
- Định lượng: chiều cao và diện tích peak.
4. Nạp mẫu Paractemol và cafein vào máy bằng? Tiêm mẫu tự động. 5.
Đầu dò PDA bước sóng phát hiện: 273 nm.
6. Để đánh giá độ tương thích của hệ thống thì mẫu phải tiêm lặp bao nhiêu lần?
Nêu ý nghĩa của độ sai số tương đối (%RSD)? - Ít nhất 2 lần. -
Dùng để biểu diễn độ sai lặp dữ liệu, dùng trong quy trình thẩm định
7. Nếu không dùng dung môi là Methanol, acid acetic băng thì có thể thay bằng
CHCl3 được không? Giải thích? -
Không, vì CHCl3 là dung môi phân cực trung bình( ít phân cực) mà SKPB pha đảo,
pha động luôn có tính phân cực. Pha động và pha tĩnh phải ngược pha với nhau.
8. So sánh đầu dò PDA và UV-VIS? - Khác: Đầu dò UV-VIS Đầu dò PDA -
Rẻ, hệ tán sắc phía trước. -
Đắt hơn, hệ tán sắc phía sau. -
Chỉ phân tích được 1 bước -
Phát hiện chất phân tích ở sóng
nhiều bước sóng khác nhau. -
Giống: Đều dùng cho các h/c có vùng hấp thụ UV-VIS và đều dùng nguồn đèn UV- VIS -
Độ tin cậy cao, sử dụng được trong chạy gradient, không phá huỷ mẫu thử, tương
đối nhạy và đặc hiệu.
9. Định lượng paracetamol dung môi là pha nào? Dung môi hoà tan là gì? -
Định lượng paracetamol dung môi dùng pha động - Dung môi hoà tan: methanol. 16 lOMoAR cPSD| 45740153
10. HPLC dùng để? Định tính, thử độ tinh khiết, tách, định lượng từng phần trong hỗn hợp.
11. Lí do phương pháp HPLC được sử dụng rộng rãi và phổ biến? -
Độ nhạy cao, khả năng định lượng tốt, có khả năng tách các chất khó bay hơi hoặc dễ phân huỷ nhiệt.
12. Trong hệ thống HPLC vai trò của: -
Bơm: bơm pha động vào cột tách, điều khiển tốc độ dòng, áp suất của pha động -
Cột sắc ký: Tách các chất pha động ra khỏi cột sắc ký tuỳ thuộc vào tính phân cực từng chất. -
Pha tĩnh: giữ chất phân tích, tách chất phân tích. -
Pha động: kéo chất phân tích đi. -
Đầu dò PDA: phát hiện các chất đi qua cột sắc kí (ưu điểm: phát hiện được nhiều chất cùng lúc).
13. Mục đích của việc dùng hỗn hợp dung môi pha động? -
Tăng khả năng tách của hỗn hợp nhiều chất, tăng sức rửa giải, tăng cường độ phân
cực, giúp cho việc tách chất phân tích rõ ràng hơn.
14. Ngoài phát hiện vết sắc ký bằng cách soi đèn, ta còn những phương pháp nào?
Nêu ưu nhược điểm? -
Phun thuốc thử hiện màu:
o Ưu điểm: Dễ thực hiện, đặc hiệu với một số chất.
o Nhược điểm: phạm vi áp dụng nhỏ và không thể phát hiện những hợp chất
không hiện màu với thuốc thử. -
Dùng máy đo mật độ quang:
o Ưu điểm: Độ chính xác cao, thuận tiện. o Nhược điểm: Tốn kém, kĩ thuật cao.
15. Có thể định tính paracetamol bằng cách khác không? VD? -
Có: phương pháp đo quang phổ, phương pháp hoá
16. Kiểu rửa giải trong HPLC?học . Đẳng dòng( Isocratic)
17. Điều kiện sắc ký? -
Pha động: nước - methanol - acid acetic băng (69:28:3). -
Cột sắc ký: Cột pha đảo C18. -
Đầu đò PDA: Bước sóng phát hiện 273 nm. -
Tốc độ dòng: 1 ml/phút. -
Thể tích tiêm mẫu: 10 ul. -
Nhiệt độ cột: 45 1°C.
18. Ý nghĩa C18, (4,6x150) mm, 5 um?
- 4.6 mm: đường kính cột sắc ký.
- 150 mm: chiều dài cột sắc ký.
- 5 microm: kích thước hạt nhồi.
19. Sắc ký paracetamol sử dụng ở pha thuận hay pha đảo? Vì sao?
- Pha đảo: vì cột sắc ký C18 kém phân cực còn hỗn hợp pha động phân cực cao.
20. Vẽ sơ đồ khối máy HPLC? 17 lOMoAR cPSD| 45740153
- Bình chứa pha động bộ phận khử khí bơm bộ phận tiêm mẫu cột sắc ký
đầu dò bộ phận ghi dữ liệu và xử lý tín hiệu.
21. Trong mẫu có para không? Giải thích? b = 8 , at = 3 , ac = 2,9? - Rft = 3/8 = 0.375. - Rfc = 2,9/8 = 0.3625.
- Trong mẫu có paracetamol vì Rfc và Rft gần nhau, sai số thấp hơn 0.2 nên có paracetamol trong mẫu.
22. Trong HPLC, có thể xác định được sự hiện diện của một hợp chất bằng những cách nào?
- Dựa vào thời gian lưu tR.
23. Tốc độ dòng 1 ml/p có ý nghĩa ?
Trong 1 phút thì 1 ml bơm qua cột.
24. Biểu thức tính hàm lượng paracetamol? ST P
- X = x x độ phaloãngxC. SC m
o ST: diện tích peak trung bình của hoạt chất trong dung dịch mẫu thử. o
Sc: diện tích peak trung bình của hoạt chất trong dung dịch mẫu chuẩn. o
P: khối lượng trung bình của viên (mg). o m: khối lượng bột thuốc cân
(mg). o C: nồng độ hoạt chất trong dung dịch mẫu chuẩn (µg/ml).
Soạn đề ôn kiểm tra đợt 2 (bài 3 + 4 + 5 + 7 +8). Đề 1:
1. Sơ đồ HPLC?
- Bình chứa pha động bộ phận khử khí bơm bộ phận tiêm mẫu cột sắc ký
đầu dò bộ phận ghi dữ liệu và xử lý
Bộ phận có tốc độ dòng 1ml/phút ? Bơm. tín hiệu. 2.
3. Điện cực so sánh trong bài oxy hoá khử là gì? - Điện cực so sánh: Pt.
4. Chuẩn độ điện thế có thể chuẩn độ được dd có màu không? Giải thích?
- Được. Vì chuẩn độ điện thế theo dõi sự biến đổi điện thế E của chất phân tích,
màu sắc không ảnh hưởng quá trình chuẩn độ.
5. Công thức liên hệ Cm với Cn? 18 lOMoAR cPSD| 45740153 C N = C M .n
6. Trong bài nitrit để tính hàm lượng ngoài phương pháp đường chuẩn còn phương pháp nào ?
PP trực tiếp( đo tuyệt dối) PP so sánh( 1 chuẩn)
7. Viết phương trình acid nitro và acid sulfanilic? Sản phẩm diazoic tạo ra có màu ? gì Sản phẩm không màu.
1. Phương pháp nhận biết vết của sắc ký lớp mỏng?
- Soi dưới đèn UV 254 nm.
2. Điện cực đc bảo vệ bằng: dung dịch KCl bão hòa
3. Trong bài 5 Fe 2+ phản ứng điện thế có thể thay thế bằng chất khử mạnh được không? Tại sao? -
Không. Vì nó sẽ cạnh tranh phản ứng với mẫu thử fe2+ cũng có tính khử sai số thiếu.
4. Ngoài đường chuẩn có thể dùng phương pháp nào để tính hàm lượng mẫu? -
Từ độ hấp thu At thông qua phương trình hồi quy. -
Từ hệ số hấp thu mol thông qua biểu thức định luật Lambert-beer: A=e.l.C
5. Các xác định điểm tương đương bài 5, mấy điểm tương đương? -
Dựa vào điểm cực đại của đường đạo hàm bậc 1 theo Vtb của dung dịch chuẩn
độ K2Cr2O7 0,10 N thêm vào dựa trên ΔE/ΔV. -
Có 1 điểm tương đương vì mẫu thử có 1 chất. Đề 3:
1. Điền kiện sắc ký? -
Pha động: nước - methanol - acid acetic băng (69:28:3). -
Cột sắc ký: Cột pha đảo C18. -
Đầu đò PDA: Bước sóng phát hiện 273 nm. -
Tốc độ dòng: 1 ml/phút. -
Thể tích tiêm mẫu: 10 ul. -
Nhiệt độ cột: 45 1°C.
2. Ý nghĩa C18, (4,6x150) mm, 5 um?
- 4.6 mm: đường kính cột sắc ký.
- 150 mm: chiều dài cột sắc ký.
- 5 microm: kích thước hạt nhồi.
3. Đa acid có bao nhiêu acid tham gia phản ứng? Viết ptpu? 19 lOMoAR cPSD| 45740153
- Có 2 acid tham gia phản ứng: H2SO4 và H3PO4.
- H2SO4 + NaOH = NaHSO4 + H2O.
- NaHSO4 + NaOH = Na2SO4 + H2O.
- H3PO4 + NaOH = NaH2PO4 + H2O.
- NaH2PO4 + NaOH = Na2HPO4 + H2O. - Na2HPO4 + NaOH = Na3PO4 + H2O.
4. Cách xác định điểm tương đương của bài đa acid?
- Dựa vào điểm cực đại của đường đồ thị đạo hàm bậc 1 theo Vtb dung dịch chuẩn
độ NaOH 0,10 N thêm vào dựa trên ΔpH/ΔV.
5. Viết công thức P(g/l) của H2SO4?
- P (g/l) = CM x M = CN x E = CN x 98/2.
6. Trong mẫu có para không? Giải thích? b = 8 , at = 3 , ac = 2,9? - Rft = 3/8 = 0.375. - Rfc = 2,9/8 = 0.3625.
- Trong mẫu có paracetamol vì Rfc và Rft gần nhau, sai số thấp hơn 0.2 nên có paracetamol trong mẫu.
7. Ứng dụng của các kiểu đo Photometry? Kinetic? Spectrum?
- Photometry: Đo độ hấp thụ của 5 dd chuẩn và dd cần định lượng Ct vừa pha tại
tương quan λmax (biến thiên theo nồng độ).
- Kinetic: Đo độ hấp thụ tương quan với thời gian phản ứng (đo Tmax) (tìm thời gian
để phản ứng xảy ra hoàn toàn và phản ứng đạt trạng thái cân bằng) (biến thiên theo thời gian).
- Spectrum: Quét phổ hấp thụ của dung dịch chuẩn từ bước sóng cho trướcđể tìm
λmax (biến thiên theo bước sóng).
8. Vai trò methanol?
- Rửa cột, bảo quản cột, dung môi pha động. Đề 4:
2. Kiểu rửa giải paracetamol: Đẳng dòng.
3. Có thể đổi K2Cr2O7 thành chất khác được không? Tại sao?
- Được, có thể thay K2Cr2O7 thành một chất chuẩn độ khác có tính oxi hoá tương
đương như KMnO4 vì để chuẩn độ mẫu thử Fe2+ có tính khử, ta cần dung dịch
chuẩn độ có tính oxi hoá mạnh.
4. Ptpu điểm tương đương đầu tiên của đa acid? - H2SO4 + NaOH = NaHSO4 + H2O.
- NaHSO4 + NaOH = Na2SO4 + H2O.
- H3PO4 + NaOH = NaH2PO4 + H2O.
4. Dụng cụ thể tích để lấy dung dịch mẫu?
- Vì mẫu cần định lượng (xác định lại nồng độ) nên cần sử dụng dụng cụ lấy thể tích
chính xác như: pipet bầu, buret….
5. Ứng dụng của biến đổi thế e?
- Dùng để chuẩn độ acid-base, oxi hoá khử, tạo phức, tạo tủa, định lượng ion KL
trong dược phẩm, thức ăn.
6. Liệt kê các cốc( cuvet) dùng trong vùng khả kiến vis? 20




