


Preview text:
CÂN BẰNG LỎNG HƠI HỆ 2 CL
HOÀN TOÀN KHÔNG TAN Tính chất hệ
ü Thành phần pha lỏng: xA=xB=1
ü Áp suất hơi của hệ: phụ thuộc T A B 0 0 0 0
P = P .x + P .x = P + P = f(T) A A B B A B Pha B ü Thành phần pha hơi y P Po B = B = A = f(T) Pha A y P o P A A B
ü Nhiệt độ sôi của hỗn hợp cũng không phụ thuộc vào thành phần pha lỏng
Ts,hh < Ts,A và Ts,hh < Ts, B
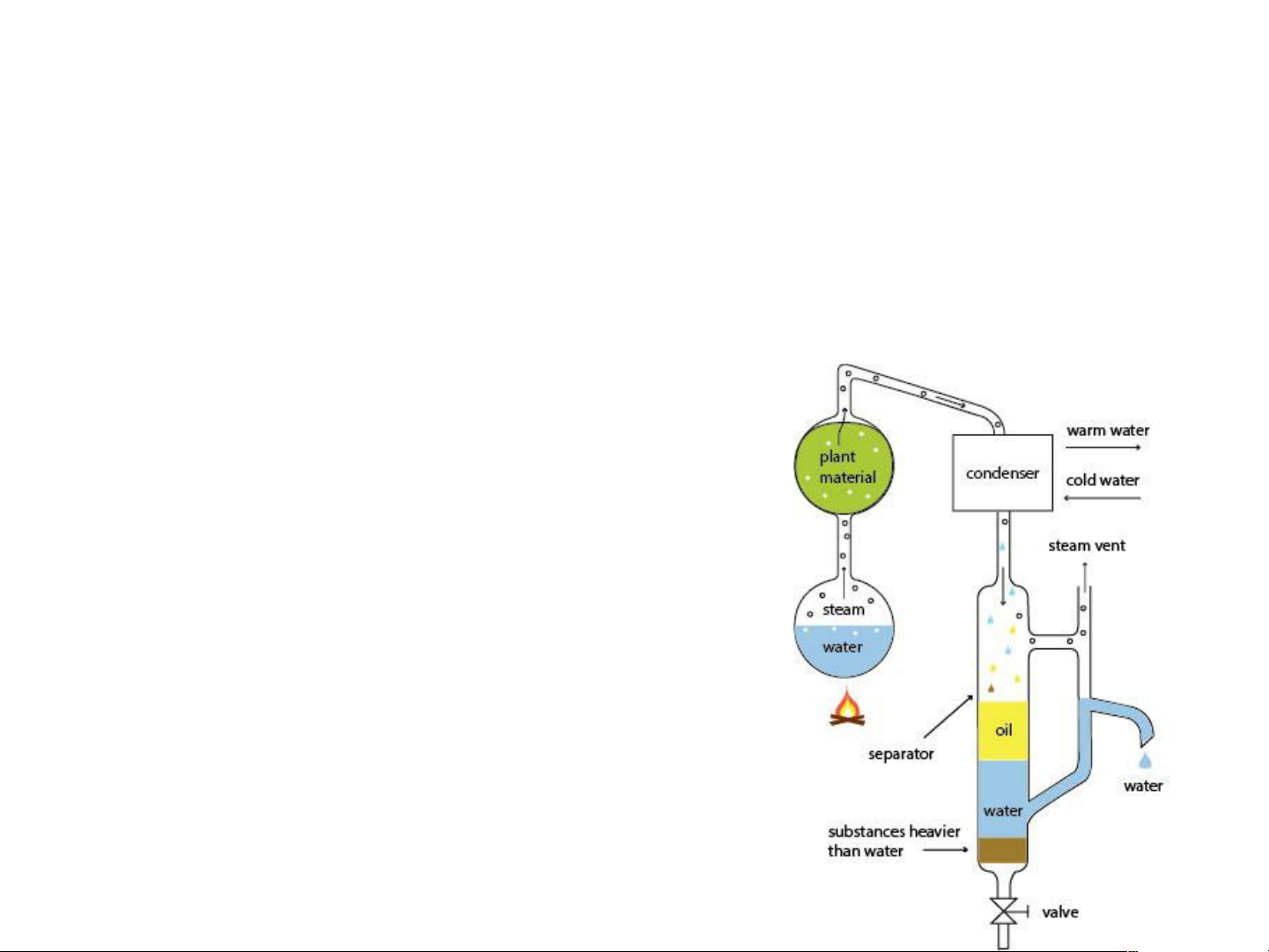
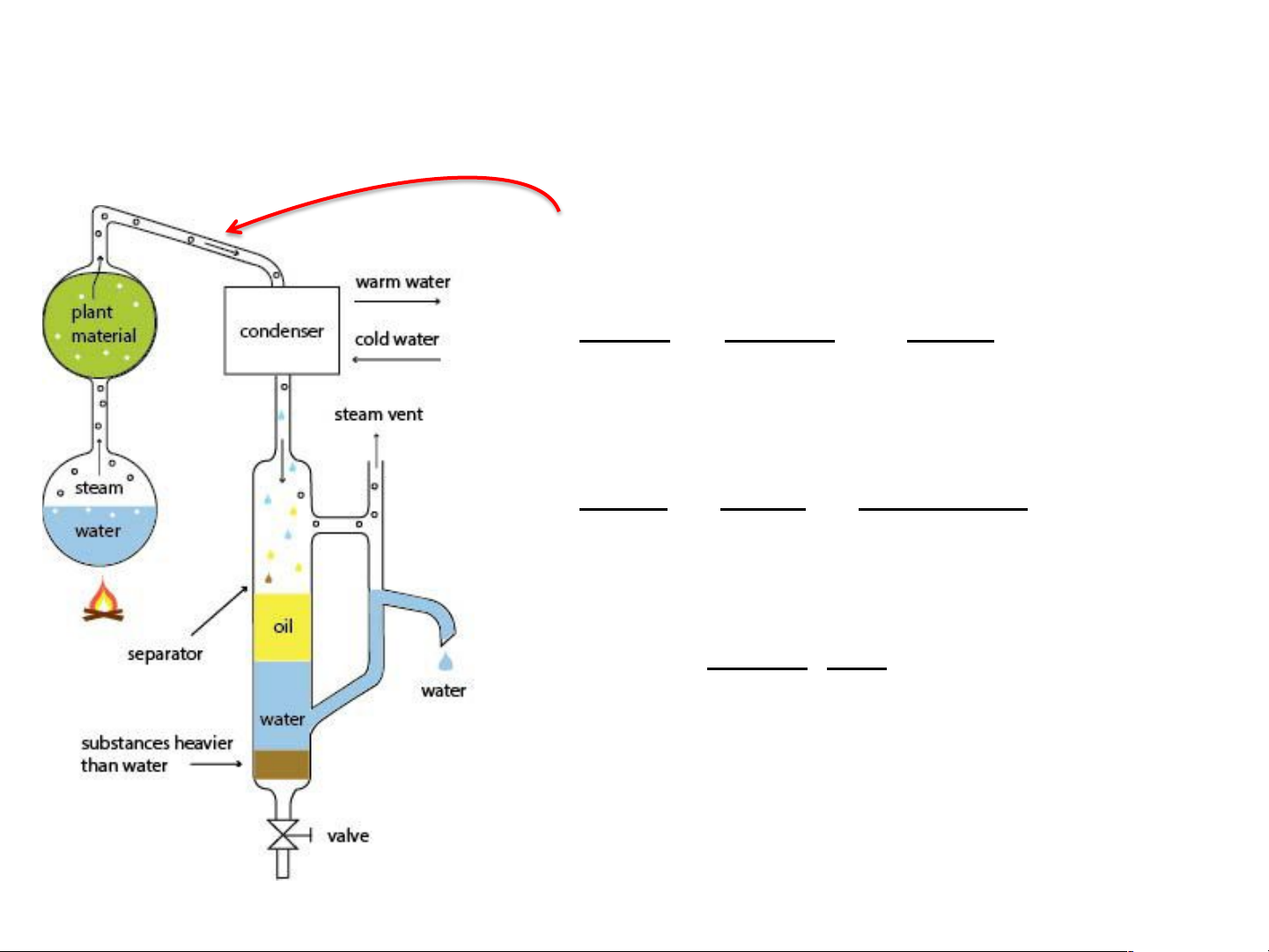
Chưng cuốn theo hơi nước
- Là pp dùng hơi để lôi kéo một cấu tử không tan
trong nước ra khỏi hh của nó
- Phạm vi: để tách các chất dễ bị phân hủy ở T< Ts. 3 1 Sơ đồ chưng cuốn 1- Bình chưng 2 4 2- Nguồn hơi nước 3- Ngưng tụ 4- Thu hồi
Tính lượng dung môi cần dùng
Để chưng cuốn đc 1 lượng xác định chất
Pha hơi: hơi A và hơi nước x P0 y H O H O H O 2 = 2 (= 2 ) x y P0 A A A x n g / 18 H O H O H O 2 = 2 = 2 x n 1/ M A A A P0 18 g = H O 2 . (kg) H O 2 M P0A A P0 0
là áp suất hơi của chất A ở H O PA 2
nhiệt độ sôi của hỗn hợp
Định luật phân bố Nernst
Sự phân bố 1 chất tan trong 2 dung môi ko tan lẫn
Ở một T xác định, chất tan X được phân bố trong 2
dung môi A, B tại trạng thái cân bằng, đặc trưng bởi hằng số phân bố: X(A) ! X(B) X/A x C m X/A = X/A = X/A = K X/B x C m X/B X/B X/B
Chú ý: Nếu trong dung môi A, chất tan nằm dưới dạng
phân tử liên hợp thì viết định luật phân bố dưới dạng: CnX/A = K C X/B
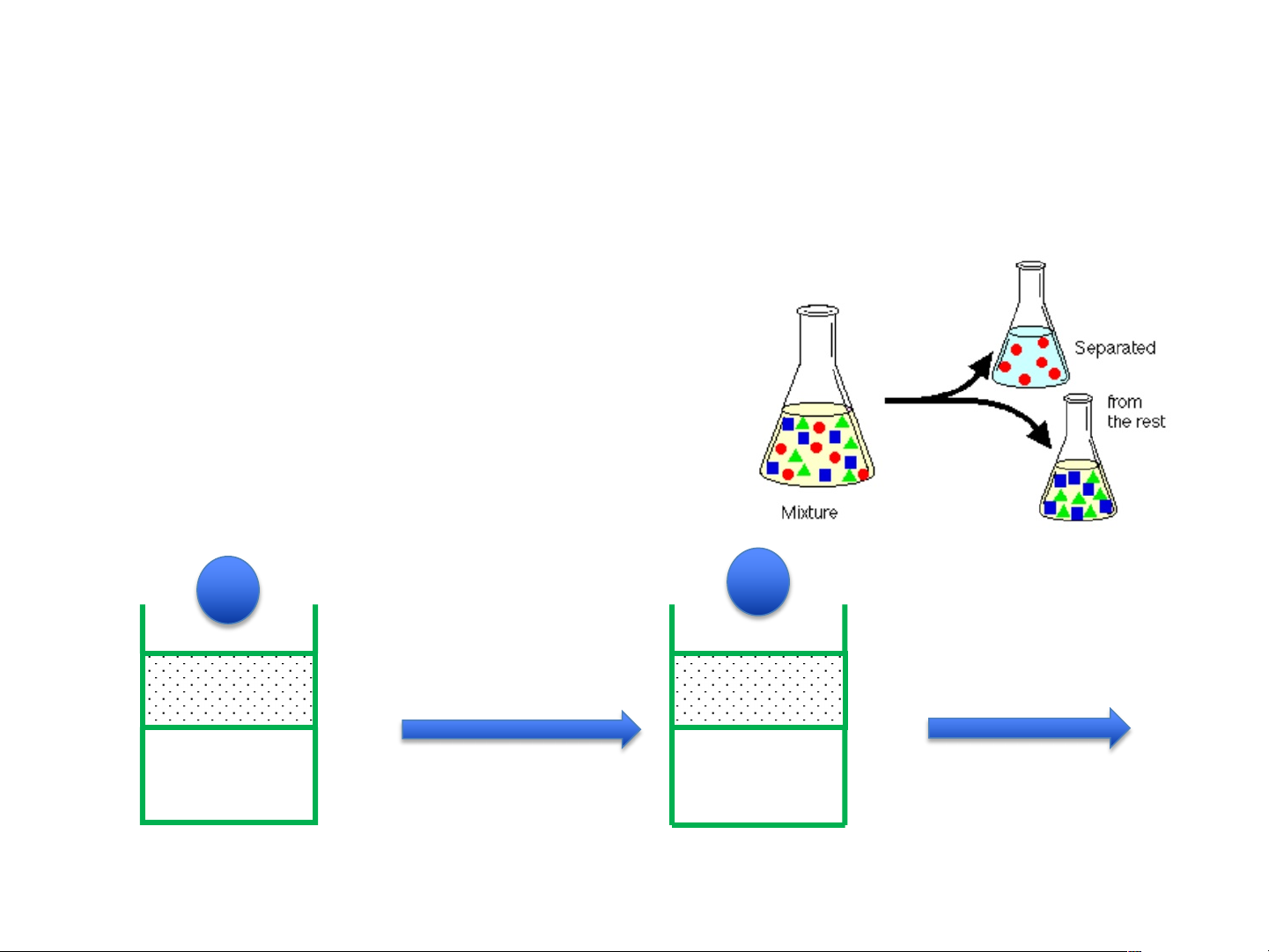
Ứng dụng của ĐL phân bố Nernst
Chiết: là quá trình tách các chất ra khỏi nhau dựa vào
khả năng tan trong các dung môi khác nhau
Nếu chất X tan tốt trong dung môi
A hơn dung môi B, có thể dùng dm
A tách X ra khỏi hỗn hợp với B, với
đk A và B không tan lẫn với nhau 1 2 Lắc đều, để Tách lớp cân bằng V dung môi C VC a mol V0 x V0 1 mol Cho dung môi
Ứng dụng của định luật phân bố Nernst Sau lần chiết 1: a − x1 C V V V X/A = K = C x = a. 0 C C x 1 V + K.V V X/B 1 0 C 0 V0 Sau lần chiết 2: x − x 1 2 V K = C V 2 C x ⎛ ⎞ 2 V V V 0 0 0 x = x . = a. V 2 1 0 V + K.V ⎝⎜ V + K.V ⎠⎟ 0 C 0 C Sau lần chiết n; ⎛ n V ⎞
Nhận xét: hiệu quả chiết xn <<< x = a. 0 + K càng lớn càng tốt n ⎝⎜ V + K.V ⎠⎟ 0 C + n càng lớn càng tốt
TÍNH CHẤT NỒNG ĐỘ CỦA DUNG DỊCH
Tính chất nồng độ của dung dịch
(dd loãng chứa chất tan không bay hơi) Ví dụ:
a)Dung dịch đường glucôzơ trong nước
b)Dung dịch urê trong nước - Dung môi bay hơi - Chất tan không bay hơi - Chất tan không phân ly, liên hợp trong dung dịch
3 tính chất nồng độ:
+ Sự giảm áp suất hơi bão hòa (của dung dịch so với dung môi nguyên chất)
+ Sự tăng nhiệt độ sôi và sự giảm nhiệt độ kết tinh.
+ Sự hình thành áp suất thẩm thấu
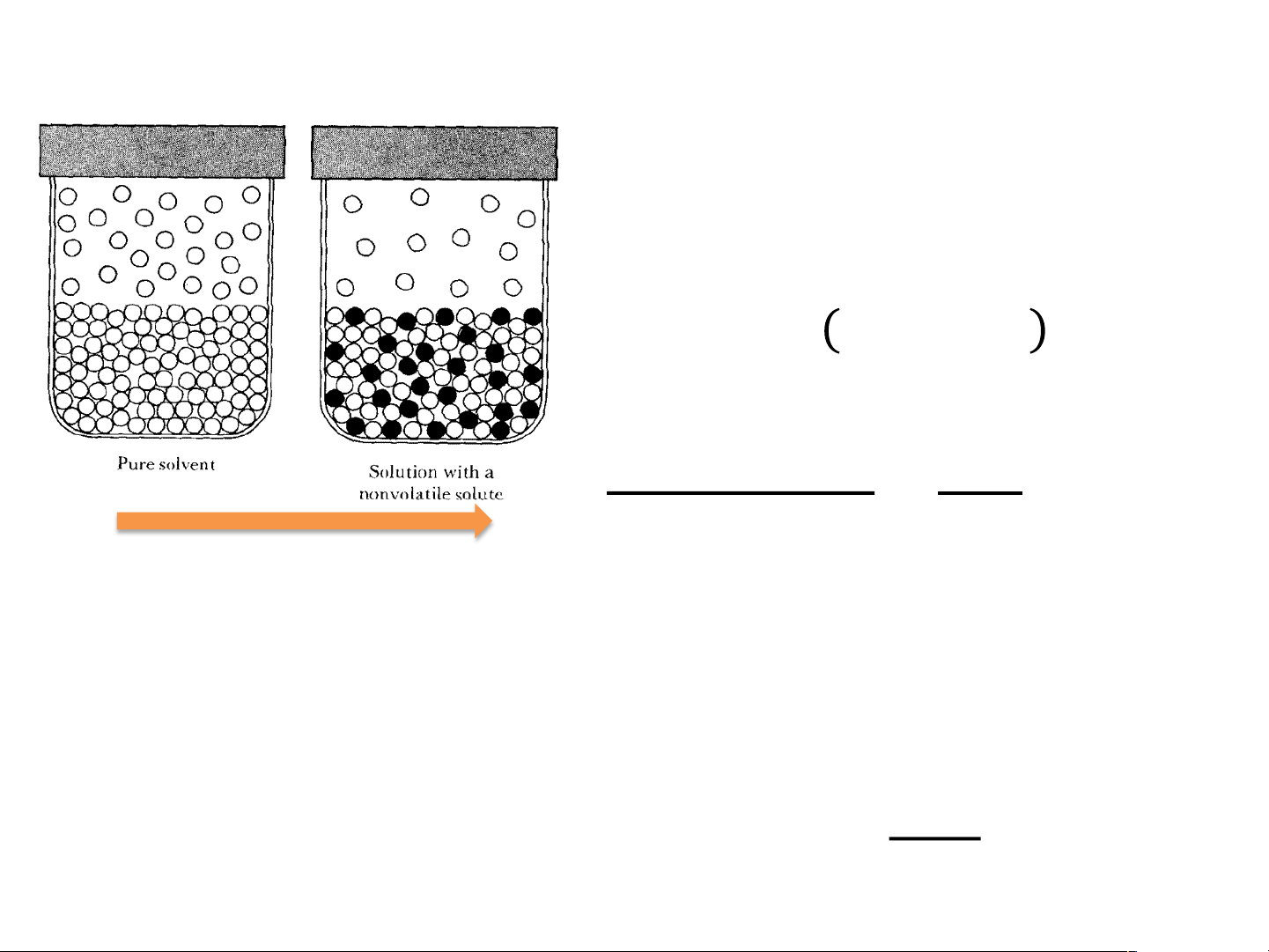
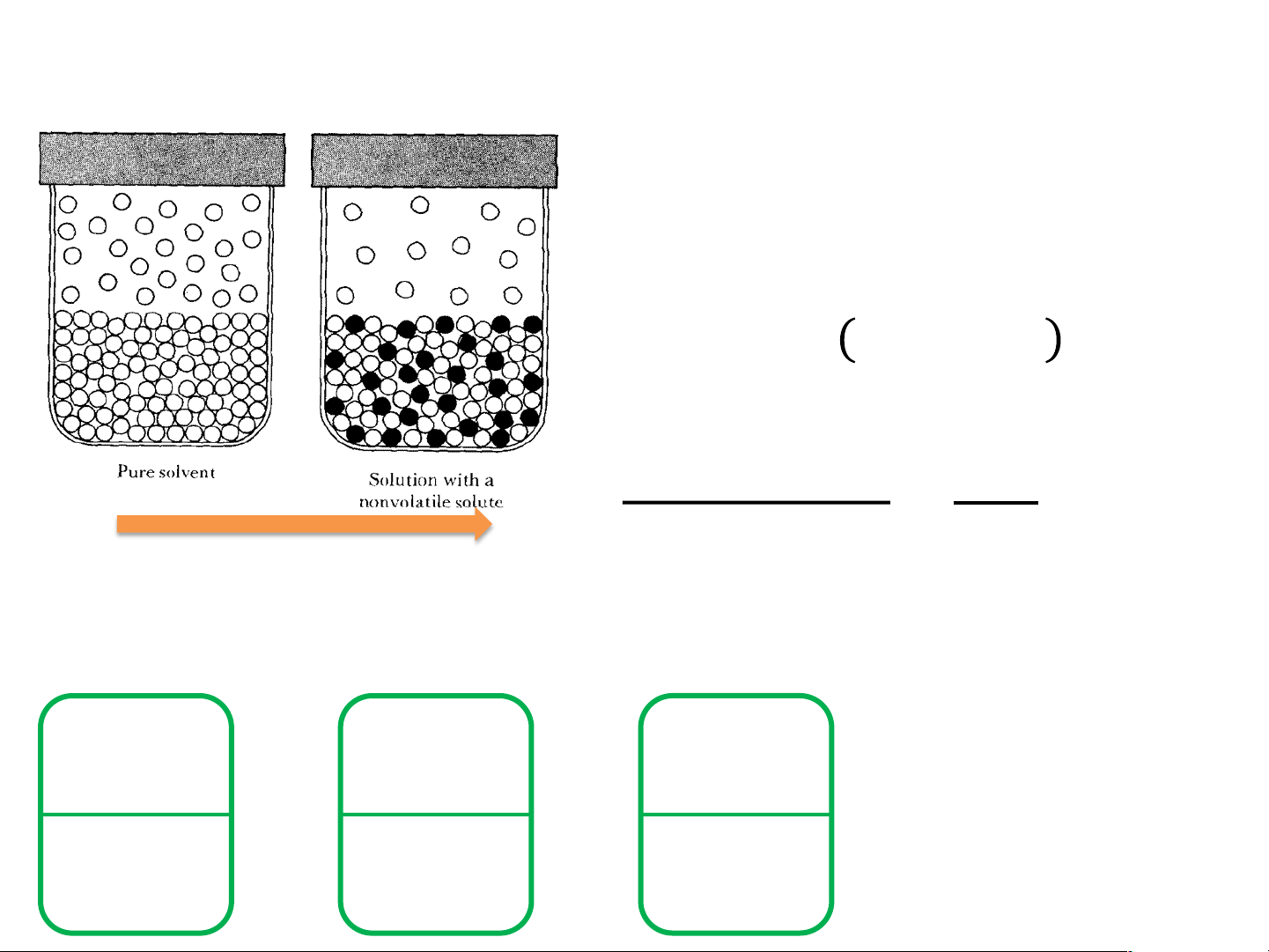
Độ giảm áp suất hơi 𝑃 # #
!! = 𝑃!" . 𝑥!" + 𝑃$%&' . 𝑥$%&' 𝑃 # #
!! = 𝑃!" 1 − 𝑥()*+ < 𝑃!" 𝑃# # !" − 𝑃$%&' ∆𝑃 = = 𝑥 𝑃# # $%&' !" 𝑃!" Khi hình thành dung dịch, áp suất pha hơi giảm đi
Nếu dung dịch chứa nhiều chất tan ∆𝑃 = Σ𝑥
(vẫn thoả mãn là dung dịch loãng) 𝑃# $%&' !"
Độ giảm áp suất hơi 𝑃 # #
!! = 𝑃!" . 𝑥!" + 𝑃$%&' . 𝑥$%&' 𝑃 # #
!! = 𝑃!" 1 − 𝑥()*+ < 𝑃!" 𝑃# # !" − 𝑃$%&' ∆𝑃 = = 𝑥 𝑃# # $%&' !" 𝑃!" P0 = 12.78 mmHg,100C H O 2 Phơi=? Cốc nước nào 0.5g ure ? glucozo cạn nhanh hơn? 25 ml H2O 25 ml H2O 25 ml H2O
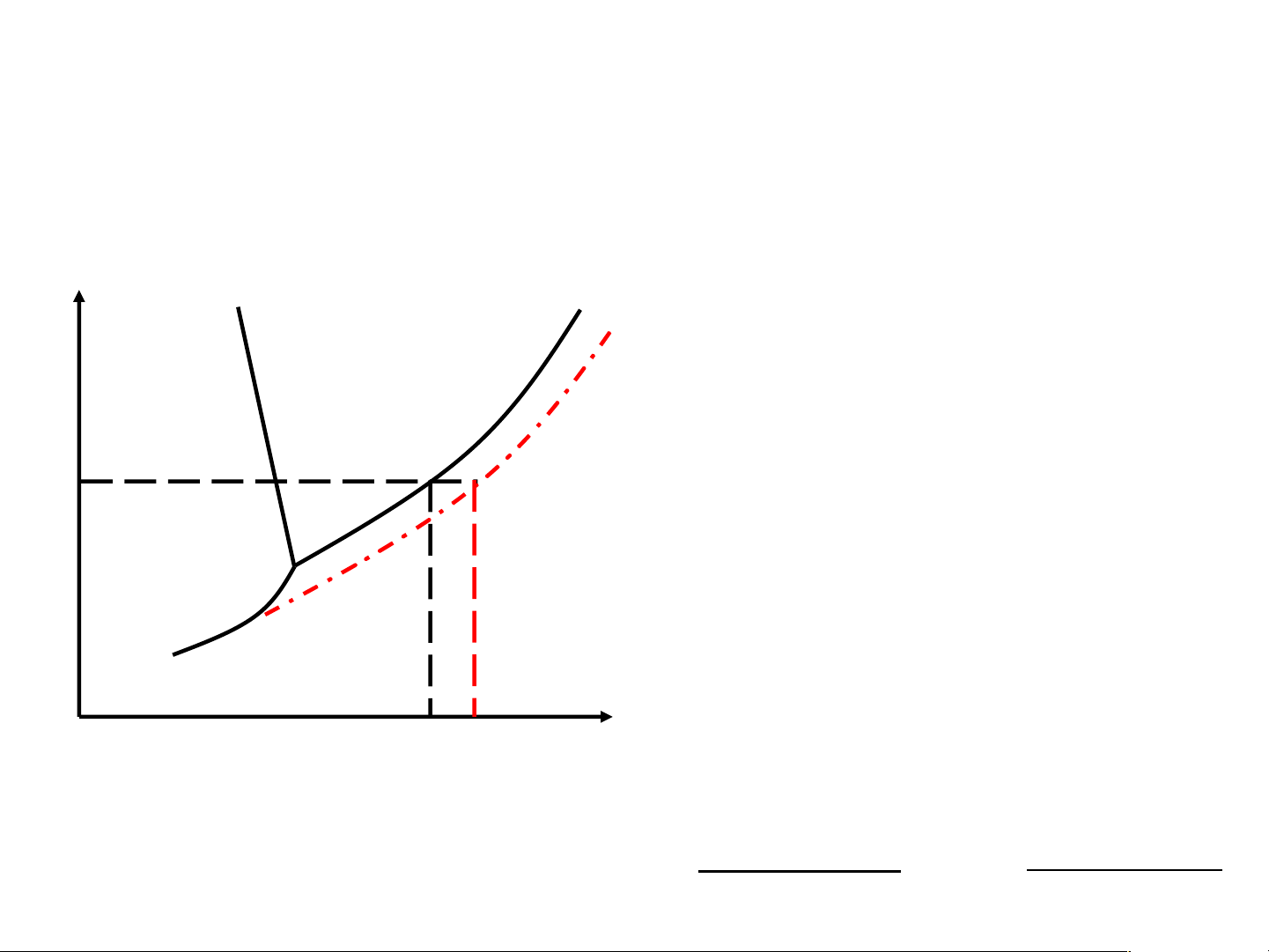
Độ tăng điểm sôi, độ hạ điểm kết tinh Thực nghiệm T0 > T0 ; T0 < T0 s,dd s,dm kt,dd kt,dm P, atm Trong quá trình sôi hoặc B C
kết tinh à nồng độ dung dịch tăng à Ts tăng và Tkt giảm dần. O ΔT = T0 − T0 = k .m s s,dd s,kt s 2 A ΔT = T0 − T0 = k .m kt kt,dm kt,dd L 2 T T s,dmTs,dd RT2 .M RT2 .M
ks là hằng số nghiệm sôi k = kt,dm dm k = s,dm dm ℓ s k 1000
l là hằng số nghiệm lạnh ΔH 1000ΔH nc hh
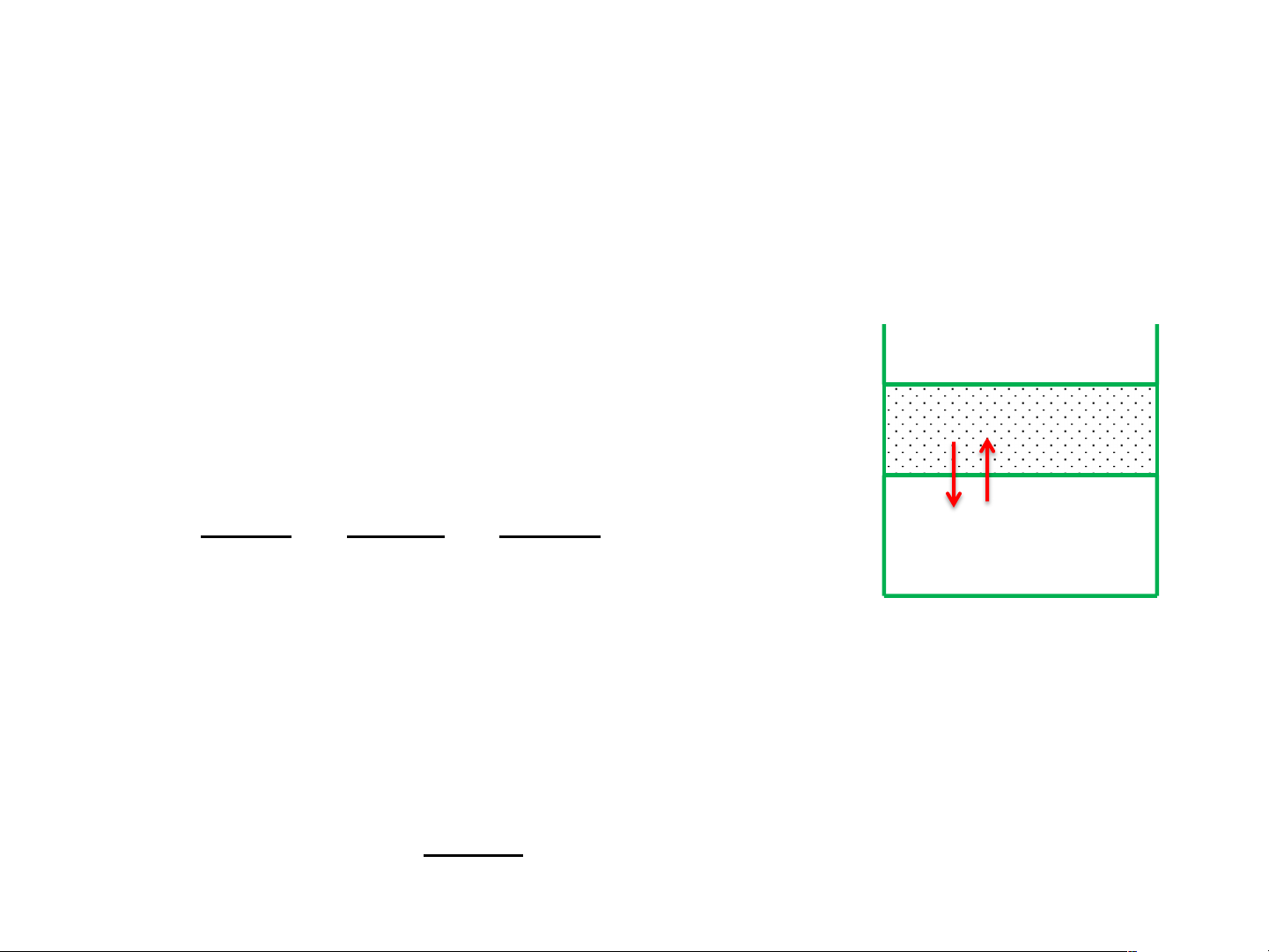
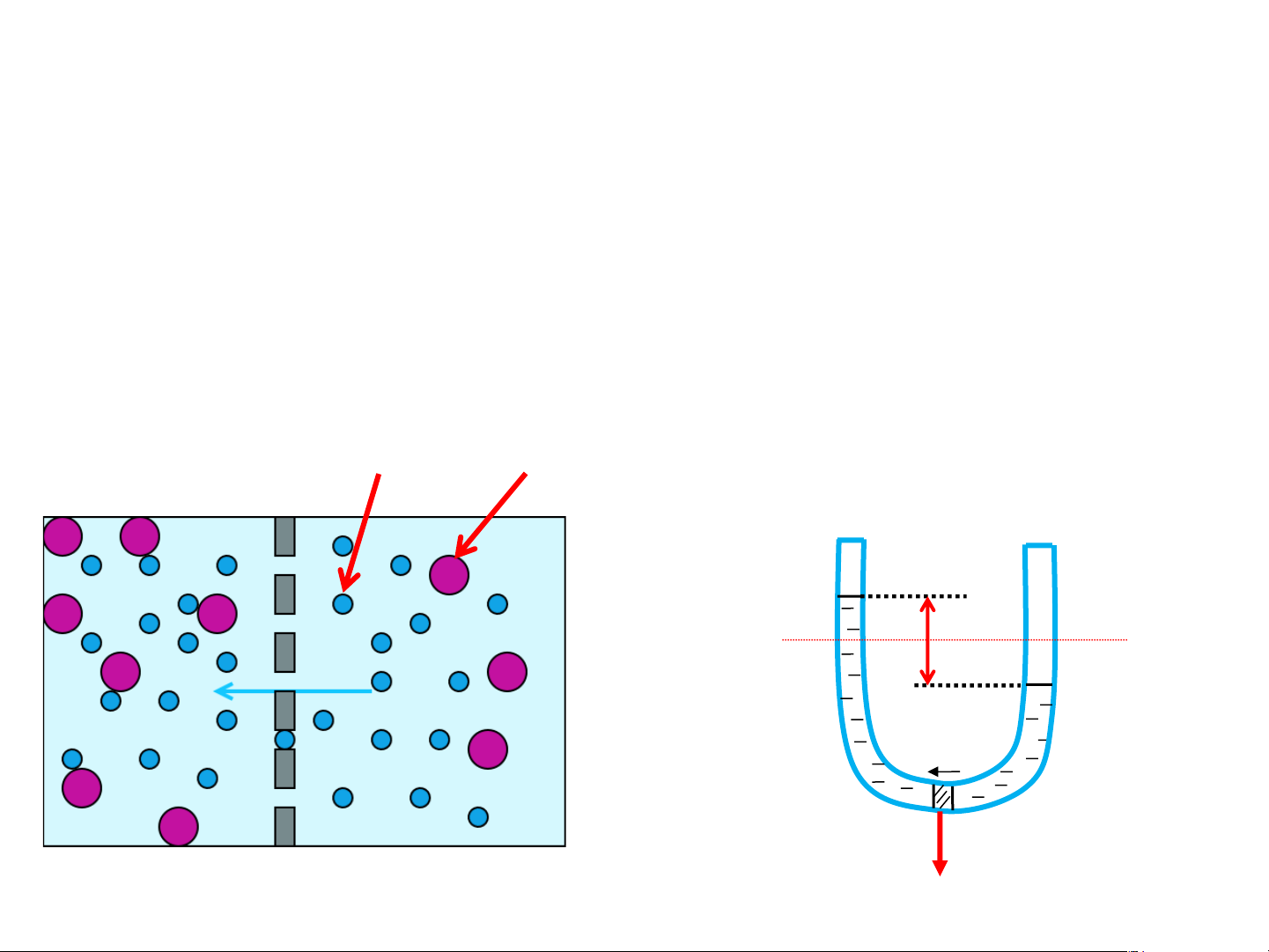
Áp suất thẩm thấu
Thí nghiệm: Nhánh chữ U , ở giữa ngăn bởi 1 màng bán thấm. Một
bên đổ dung dịch chứa chất tan,1 bên đổ dung môi của chính dung
dịch đó. Lúc đầu 2 mức chất lỏng bằng nhau. Do mật độ phân tử dung
môi ở nhánh A lớn hơn nhánh B nên dung môi sẽ chuyển qua màng
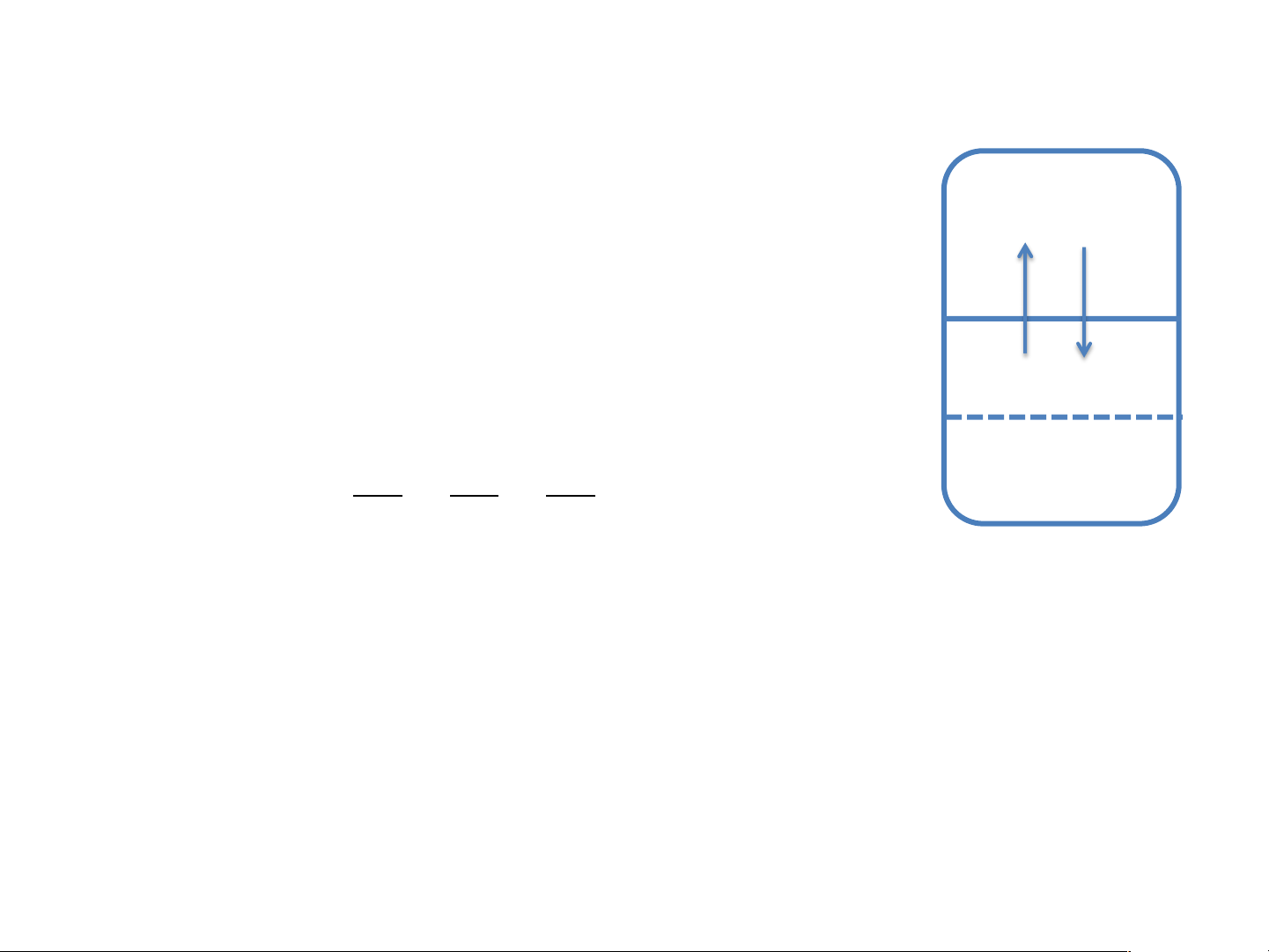
bán thấm từ nhánh A sang nhánh B Dung môi Chất tan Nhánh B Nhánh A Dung dịch Dung môi h dmôi Màng bán thấm Màng bán thấm
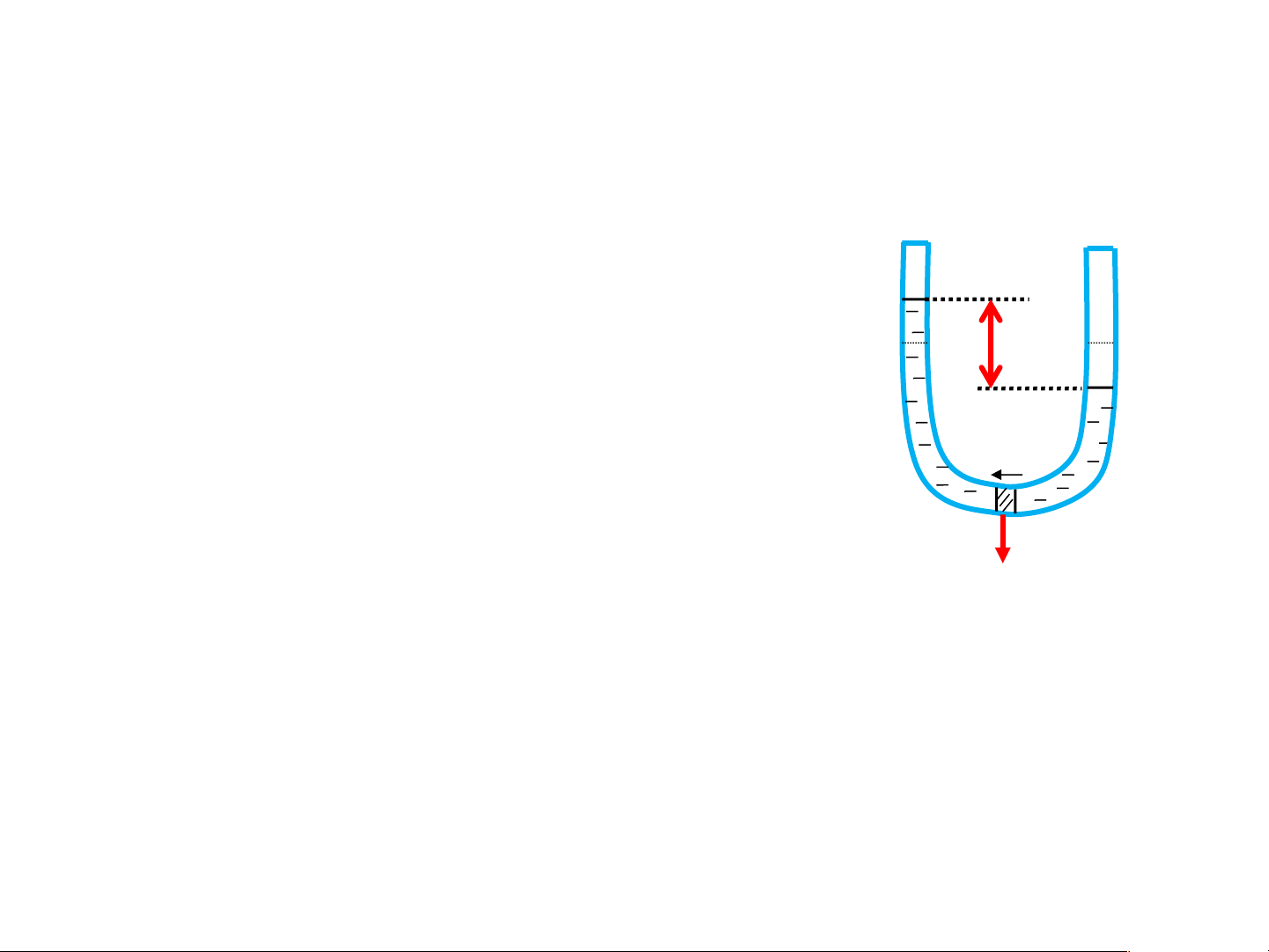
Áp suất thẩm thấu Định nghĩa Nhánh B Nhánh A
Áp suất thẩm thấu: của 1 dung dịch Dung dịch Dung môi
có nồng độ xác định là áp suất phải
tác động lên màng bán thấm nằm h
phân cách giữa dung dịch và dung
môi để dung dịch này có thể nằm dmôi
cân bằng thủy tĩnh với dung môi qua màng bán thấm. Màng bán thấm
Năm 1886, Van’t Hoff đã chứng minh được: “Đối với
các dung dịch loãng, áp suất thẩm thấu của một dung
dịch tỷ lệ thuận với nồng độ dung dịch” Π = C RT 2




